γ-谷维素对过氧化氢诱导氧化损伤L02细胞的增殖和保护作用
蒋维维,易金娥,2,,谭柱良,
(1.湖南农业大学动物医学院,湖南 长沙 410128;2.湖南畜禽安全生产协同创新中心,湖南 长沙 410128)
γ-谷维素对过氧化氢诱导氧化损伤L02细胞的增殖和保护作用
蒋维维1,易金娥1,2,*,谭柱良1,*
(1.湖南农业大学动物医学院,湖南 长沙 410128;2.湖南畜禽安全生产协同创新中心,湖南 长沙 410128)
目的:观察γ-谷维素对过氧化氢诱导人肝细胞(L02)氧化损伤的增殖和保护作用的影响。方法:建立过氧化氢氧化损伤模型,采用不同浓度的γ-谷维素对L02细胞进行处理,检测L02细胞增殖率、丙二醛和微量谷胱甘肽含量、超氧化物歧化酶和过氧化氢酶活力及活性氧水平的变化。结果:γ-谷维素浓度在0.1~0.4 mmol/L对H2O2引起的细胞损伤具有修复作用,同时降低丙二醛含量和活性氧水平,提高超氧化物歧化酶和过氧化氢活性以及谷胱甘肽含量,且呈量效关系。结论:L02细胞经0.1~0.4 mmol/L γ-谷维素预处理后,可以缓解H2O2造成的氧化损伤,维持正常的生理形态。
γ-谷维素;氧化损伤;L02细胞
氧化应激是由于细胞内自由基的产生和抗氧化系统之间不平衡所导致。过量的自由基攻击大分子如DNA、蛋白质和脂质,对细胞造成严重损伤,导致健康障碍问题,如关节炎、糖尿病、神经变性疾病、心脑血管疾病等[1]。许多研究证明,外源性抗氧化剂能抑制或减缓自由基生成,有效调节机体氧化还原平衡,减少氧化应激的产生[2-4]。γ-谷维素是米糠油中最重要的生物活性物质之一,在米糠油中含量约1%~3%[5],其他谷物油脂中也有发现,如玉米油、小麦、黑麦等。自Kaneko等[6]于1954年报道谷维素对动物具有很好的营养作用以来,引起了人们对γ-谷维素的广泛研究与关注,随后研究发现,γ-谷维素具有抗氧化、降血脂、抗炎、抗胃酸分泌、抗癌以及调节血糖等多种生物活性[7],因而受到国内外学者的广泛重视。实验证明,γ-谷维素可使小鼠血清和肝脏中的丙二醛(malondialdehyde,MDA)含量明显下降,且对小鼠体质量无显著影响,说明γ-谷维素具有较好的抗脂质过氧化的作用[8]。但关于γ-谷维素对人肝细胞(L02)氧化损伤的影响还尚未报道。本实验采用H2O2诱导L02细胞氧化损伤模型,研究γ-谷维素对氧化损伤L02细胞的氧化保护作用,以期为进一步揭示γ-谷维素抗氧化损伤的机制和临床利用提供一定的参考。
1 材料与方法
1.1 材料与试剂
人肝细胞(L02) 湖南湘雅医学院;γ-谷维素Oryza Oil & Fat Chemical公司;RPMI-1640培养基与胎牛血清 北京四季青公司;二氯荧光素二酯(2’,7’-dichlorofluorescin diacetate,DCFH-DA)、胰蛋白酶和噻唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT) 美国Sigma公司;超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、微量还原型谷胱甘肽、总谷胱甘肽/还原型谷胱甘肽(total-glutataione/reduced glutathione,T-GSH/GSSG)、MDA、蛋白质检测试剂盒南京建成生物工程研究所;其余化学试剂均为分析纯。
1.2 仪器与设备
W201恒温水浴锅 上海申顺生物科技有限公司;Thermo 3110二氧化碳细胞培养箱 美国Thermo公司;Combi-514R冷冻离心机 韩国Hanil株式会社;Bio-Rad 680酶标仪 美国Bio-Rad公司;超净工作台 苏州净化设备工程有限公司;倒置显微镜 日本奥林巴斯公司。
1.3 方法
1.3.1 细胞培养
取L02细胞复苏,接种于25 cm2的培养瓶中,用含10%胎牛血清的RPMI-1640培养液(含1%双抗),于37 ℃、5% CO2饱和湿度条件下培养,每1~2 d换液,正常培养3~4 代后,用于后续实验。
1.3.2 细胞的处理
将处于对数生长期的L02细胞用胰蛋白酶消化,收集细胞,按3h104cells/mL接种。正常培养24 h后,细胞分组处理如下:正常对照组,H2O2模型组(10、50、100、200、400、600、800、1 000 μmol/L处理1、2、3 h),γ-谷维素预处理组(0.05~0.5 mmol/L不同浓度的γ-谷维素孵育12 h,磷酸盐缓冲液(phosphate buffer saline,PBS)清洗后,200 μmol/L H2O2处理2 h),用含1%的胎牛血清RPMI-1640培养液培养。
1.3.3 细胞存活率测定
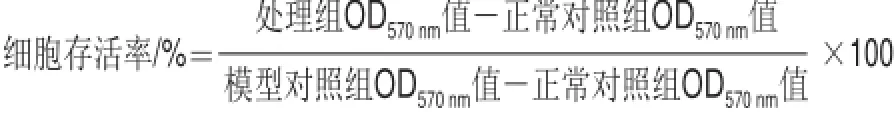
采用MTT法测定细胞存活率[9]。96 孔板中细胞分组处理,每组设定6 个复孔。培养结束后,每孔加入5 g/L MTT 10 μL,继续培养4 h后,吸弃原培养液,每孔加入二甲基亚砜(dimethyl sulfoxide,DMSO)150 μL,置摇床上低速振荡10 min,用酶标仪检测570 nm波长处光密度(OD)值。定义对照组细胞存活率为100%,其余各实验组细胞存活率按下式计算。
1.3.4 细胞MDA、GSH含量以及SOD和CAT活力的检测
收集约1h107cells用4 ℃预冷的PBS洗涤,用超声波细胞破碎仪破碎细胞,4 000hg离心,取上清,采用硫代巴比妥酸(thiobarbituric acid,TBA)显色法测定MDA含量;将细胞接种于25 cm2细胞培养瓶,培养结束后,取适量细胞培养上清液检测SOD、CAT活力以及GSH含量。SOD活力采用黄嘌呤氧化酶法(羟胺法)测定,GSH含量采用二硫代二硝基苯甲酸(5,5’-dithiobis (2-nitrobenzoic acid),DTNB)法测定,CAT活力采用钼酸铵法测定,采用考马斯亮蓝法测定L02细胞总蛋白含量。总蛋白含量、SOD活力、T-GSH/GSSG和CAT活力以及MDA含量测定均按照文献[10-12]方法进行。
1.3.5 细胞内活性氧(reactive oxygen,ROS)水平的检测
以DCFH-DA为荧光探针检测L02细胞内ROS水平。DCFH-DA本身没有荧光,可以自由穿过细胞膜,进入细胞内后,可以被细胞内的酯酶水解生成DCFH。而DCFH不能通透细胞膜,从而使探针很容易被装载到细胞内。细胞内的ROS可以氧化无荧光的DCFH生成有荧光的DCF。检测DCF的荧光就可以知道细胞内ROS的水平。将L02细胞与无血清培养液稀释的DCFH-DA(终浓度为10 μmol/L)于37 ℃细胞培养箱内孵育20 min,每隔3~5 min颠倒混匀一下,使探针和细胞充分接触。用无血清细胞培养液洗涤细胞3 次,以充分去除未进入细胞内的DCFH-DA。荧光显微镜检测DCF荧光,激发波长为488 nm,发射波长为525 nm[13]。
1.4 统计学处理
采用SPSS 19.0软件进行数据处理,多组间均数比较,采用单因素方差分析和Turkey’s多因素t检验,结果以表示,采用P<0.05为差异具有统计学意义。
2 结果与分析
2.1 L02细胞氧化损伤模型的建立
H2O2对L02细胞活性的影响如图1所示,随着H2O2浓度的增加,细胞存活率显著降低,呈量效关系;H2O2分别处理细胞1、2、3 h,显示随着H2O2处理时间延长,细胞存活率也显著降低,呈时效关系;200 μmol/L H2O2处理L02细胞1、2、3 h后,细胞存活率分别为60.7%、52.6%、48.9%。故本实验选用200 μmol/L H2O2作用2 h为构建L02细胞氧化损伤模型的最佳浓度,用于后续实验。选择200 μmol/L,2 h是因为刚好此时对细胞致死率大概50%左右,一般药物筛选实验是根据IC50的结果得到最终值。若选择3 h,细胞存活率偏低,不利于细胞后续恢复作用。

图1 H2O2对L02细胞活性的影响Fig.1 Effect of H2O2on L02 cell viability
2.2 γ-谷维素对L02细胞增殖的影响
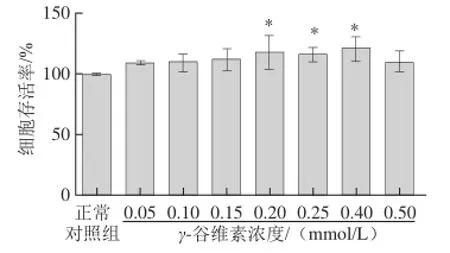
图2 不同浓度γ-谷维素对L02细胞增殖的影响Fig.2 Effect of γ-oryzanol on the proliferation of L02 cells
用0.05~0.5 mmol/L浓度梯度的γ-谷维素处理L02细胞12 h,测定其对L02细胞增殖的影响,筛选γ-谷维素的安全剂量阈值和最佳作用浓度。结果如图2所示,在0.1~0.5 mmol/L剂量范围内,γ-谷维素没有降低细胞的活性,说明在该浓度范围内,γ-谷维素是安全无毒的,而且在0.05~0.4 mmol/L剂量范围内,随着γ-谷维素浓度的增加,细胞活性增强,呈量效关系,以0.4 mmol/L γ-谷维素作用最显著(P<0.05)。0.5 mmol/L剂量下的效果没有0.4 mmol/L的效果好。
2.3 γ-谷维素对L02细胞氧化损伤的保护作用

图3 不同浓度γ-谷维素对H2O2致L02细胞氧化损伤保护作用的影响Fig.3 Effect of γ-oryzanol on cell viability of L02 cells induced by H2O2
由图3可知,与正常对照组相比,H2O2模型组L02细胞活性极显著降低(P<0.01),表明氧化损伤模型诱导成功。与H2O2模型组相比,用γ-谷维素预处理后,在0.1~0.4 mmol/L浓度范围内,L02细胞活性增强,且呈量效关系,以0.4 mmol/L γ-谷维素作用最显著(P<0.01),细胞存活率为118.8%(图2)。同时,采用倒置显微镜对L02细胞进行形态学观察,正常对照组L02细胞呈扁平多角形,相邻细胞连接成片,形态舒展,呈铺路石状,细胞生长良好,背景清晰(图4A);H2O2模型组单视野范围内细胞量明显减少,部分细胞变圆,体积缩小,部分细胞开始漂浮(图4B);当用0.4 mmol/L γ-谷维素预处理12 h后,单视野范围内的L02细胞明显增加,漂浮细胞明显减少,细胞生长较好,排列较紧密,互相衔接性较好(图4C),这进一步说明γ-谷维素对L02细胞氧化损伤具有保护作用。因此,根据细胞活性检测和细胞形态学观察,选用0.4 mmol/L作为最高剂量组,0.1、0.2 mmol/L γ-谷维素作为低、中剂量组用于后续实验。
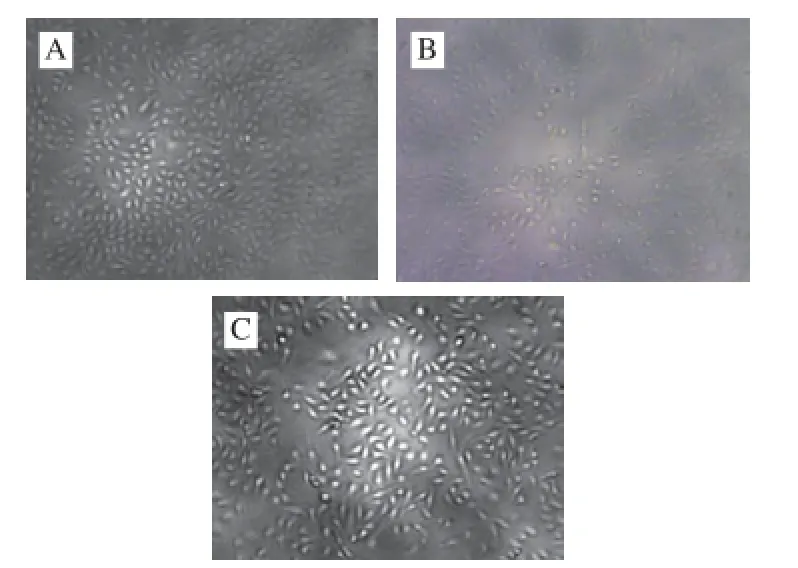
图4 L02细胞形态变化(×40)Fig.4 Morphological change of L02 cells (×40)
2.4 γ-谷维素对H2O2诱导的L02细胞中MDA含量的影响
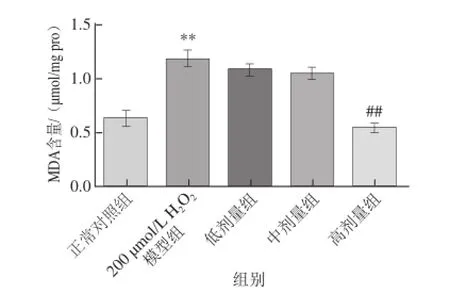
图5诱导的L02细胞内MDA含量的影响Fig.5 Effect of γ-oryzanol on MDA level in L02 cells γ-谷维素对H2O2
如图5所示,H2O2处理造成L02细胞内MDA含量极显著升高(P<0.01),造成L02细胞脂质过氧化,而采用γ-谷维素预处理后,极显著抑制MDA生成(P<0.01),并呈量效关系,说明γ-谷维素缓解了H2O2引起的脂质过氧化。
2.5 γ-谷维素对H2O2诱导的L02细胞中 SOD、CAT活力、GSH含量、T-GSH/GSSG的影响

表1γ-谷维素对H2O2诱导的L02细胞中SOD、CAT活力、GSH含量、T-GSH/GSSG的影响Table 1 Effect ofγ-oryzanol on the activities of SOD, CAT and the level of GSH, and the ratio of T-GSH/GSSG in L02 cells
由表1可知,L02细胞经过H2O2处理后,SOD、CAT活力和GSH含量以及T-GSH/GSSG比值均显著降低,说明H2O2对细胞造成了显著的氧化性损伤,而加入γ-谷维素进行预处理后,随着γ-谷维素浓度的增大,SOD、CAT活力和GSH含量以及T-GSH/GSSG比值显著增加,呈量效关系。说明L02细胞经过γ-谷维素预处理,可以有效缓解H2O2的氧化损伤,保护细胞免受氧化性损伤。
2.6 γ-谷维素对H2O2诱导的L02细胞ROS水平的影响
ROS主要通过与线粒体通透性转换蛋白相互作用而在凋亡反应中起着重要作用。过量的ROS能促进细胞凋亡[14],细胞内ROS含量变化影响结果见图6。与正常对照组相比,H2O2组L02细胞内ROS水平急剧上升,增加了29.7%,且差异显著(P<0.05),说明H2O2能诱导L02细胞ROS水平增加。当用γ-谷维素预处理后,能显著降低细胞内ROS水平(P<0.05),且呈量效关系。说明γ-谷维素能有效清除H2O2诱导细胞内过度产生的ROS,具有清除自由基的能力。
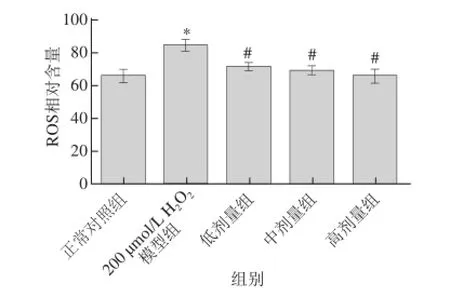
图6诱导的L02 细胞内活性氧含量的影响Fig.6 Effect of γ-oryzanol on the level of ROS in L02 cells γ-谷维素对H2O2
3 讨 论
氧化应激是自由基在体内产生的一种负面作用,并被认为是导致衰老和疾病的一个重要因素。正常生理状态下,机体内部存在有内源性抗氧化系统,包含酶类的CAT和SOD以及非酶类的GSH。内源性抗氧化物质能帮助清除体内过多的自由基和ROS以缓解氧化应激所造成的损伤[15]。ROS能通过多种机制而改变细胞的结构和功能的完整[16]。MDA是脂质过氧化反应的产物之一,常常可反映脂质过氧化的程度,间接反映出机体细胞受自由基攻击的严重程度[17]。SOD是机体细胞抵御氧化损伤最重要的酶类之一,主要功能是清除体内有氧代谢所产生的超氧阴离子自由基,使机体和细胞免受损害[18]。H2O2被广泛应用于体外氧化应激造模的诱导剂[19],因此,当研究γ-谷维素的抗氧化性作用机制时,可采用H2O2诱导L02细胞的损伤,探究γ-谷维素对其的保护作用。根据实验结果显示,与正常对照组相比,使用200 μmol/L H2O2作用2 h使得细胞存活率下降46%,GSH含量下降,CAT和SOD活力显著下降,MDA水平显著增加,细胞内ROS含量上升。因此用H2O2诱导细胞损伤,使得细胞内ROS过度产生,抗氧化剂(GSH)的消耗造成内源性抗氧化防御机制的崩解,引起脂质过氧化,最终导致细胞损伤[20]。
谷维素最初被认为是单一的化合物,之后确定为环木菠萝醇类阿魏酸酯和甾醇类阿魏酸酯的混合物,一般被称为α-、β-和γ-谷维素,而γ-谷维素是最常提到的。目前,已分离和鉴别的γ-谷维素有效成分达10 种[21-22]。据报道,γ-谷维素能抑制四氯化碳引起的肝脂质过氧化,对化学性肝损伤具有预防性保护作用[23]。本实验结果发现,经γ-谷维素预处理后,明显降低由H2O2所致L02细胞ROS的水平,CAT、SOD和GSH等活性物质的分泌量回升,MDA含量显著下降。表明γ-谷维素对H2O2诱导L02细胞氧化损伤具有修复作用,通过抑制脂质过氧化,减少GSH消耗和提高抗氧化酶活性,缓解H2O2造成的氧化损伤。另据研究报道[24],γ-谷维素能促进前列腺素E2的降解,保护由过氧化氢导致的机体损伤,能抑制NF-κB的活性同时能增加抗氧化酶的活性。γ-谷维素的抗氧化作用可能是因为它的阿魏酸基团[25],阿魏酸是一种酚酸抗氧化剂。
随着现今生活水平的提高,越来越多高脂肪食品和添加剂进入人们的生活,严重危害人类的健康,γ-谷维素作为植物源性的天然抗氧化剂,提高机体的抗氧化应激的能力,但其作用机理尚不清楚,值得深入研究与探讨,对γ-谷维素抗氧化应激机理进一步研究,有望开发成新抗氧化剂,为深入开展氧化应激的理论研究和科学应用提供依据和探索新的途径。
综上所述,γ-谷维素浓度在0.05~0.5 mmol/L时无显著细胞毒性,L02细胞经过氧化氢处理后,细胞膜氧依赖性酶受到影响,MDA含量上升,SOD、CAT酶活性下降,GSH得不到补充,自由基清除能力下降,导致细胞内ROS含量上升,细胞损伤。而经过γ-谷维素预处理后,改善了细胞的增殖情况,抵御了细胞的过度脂质过氧化,维持正常的生理形态,对细胞有良好的保护作用。
[1] DHALLA N S, TEMSAH R M, NETTICADAN T. Role of oxidative stress in cardiovascular diseases[J]. Journal of Hypertension, 2000, 18(6): 655-673.
[2] NGO D H, QIAN Z J, NGO D N, et al. Gallyl chitooligosaccharides inhibit intracellular free radical-mediated oxidation[J]. Food Chemistry, 2011, 128(4): 974-981. DOI:10.1016/j.foodchem.2011.03.128.
[3] SEVEN A, GÜZEL S, ASLAN M, et al. Lipid, protein, DNA oxidation and antioxidant status in rheumatoid arthritis[J]. Clinical Biochemistry, 2008, 41(7): 538-543. DOI:10.1016/j.clinbiochem.2008.01.029.
[4] FINKEL T. Oxygen radicals and signaling[J]. Current Opinion in Cell Biology, 1998, 10(2): 248-253. DOI:10.1016/S0955-0674(98)80147-6.
[5] SEETHARAMAIAH G S, PRABHAKAR J V. Oryzanol content of Indian rice bran oil and its extraction from soap stock[J]. Journal of Food Science and Technology, 1986, 23(5): 270-273. DOI:10.1007/ s11746-006-5021-2.
[6] KANEKO R, TSUCHIYA T. New compound in rice bran and germ oils[J]. Journal of the Chemical Society of Japan, 1954, 57: 526-529.
[7] XU Z, GODBER J S. Purification and identification of components of γ-oryzanol in rice bran oil[J]. Journal of Agricultural and Food Chemistry, 1999, 47(13): 2724-2728. DOI:10.1021/jf981175j.
[8] WANG T, HICKS K B, MOREAU R. Antioxidant activity of phytosterols, oryzanol, and other phytosterol conjugates[J]. Journal of the American Oil Chemists’ Society, 2002, 79(12): 1201-1206. DOI:10.1007/s11746-002-0628-x.
[9] STOCKERT J C, BLÁZQUEZ-CASTRO A, CAÑETE M, et al. MTT assay for cell viability: intracellular localization of the formazan product is in lipid droplets[J]. Acta Histochemica, 2012, 114(8): 785-796. DOI:10.1016/j.acthis.2012.01.006.
[10] HE Zuyong, YU Shengli, MEI Gui, et al. Maternally transmitted milk containing recombinant human catalase provides protection against oxidation for mouse offspring during lactation[J]. Free Radical Biology and Medicine, 2008, 45(8): 1135-1142. DOI:10.1016/ j.freeradbiomed.2008.07.019.
[11] BI Jing, JIANG Bo, LIU Jianhui, et al. Protective effects of catalpol against H2O2-induced oxidative stress in astrocytes primary cultures[J]. Neuroscience Letters, 2008, 442(3): 224-227. DOI:10.1016/ j.neulet.2008.07.029.
[12] WU T W, HASHIMOTO N, WU J, et al. The cytoprotective effect of Trolox demonstrated with three types of human cells[J]. Biochemistry and Cell Biology, 1990, 68(10): 1189-1194.
[13] SIMON H U, HAJ-YEHIA A, LEVI-SCHAFFER F. Role of reactive oxygen species (ROS) in apoptosis induction[J]. Apoptosis, 2000, 5(5): 415-418. DOI:10.1023/A:1009616228304.
[14] KOWALTOWSKI A J, de SOUZA-PINTO N C, CASTILHO R F, et al. Mitochondria and reactive oxygen species[J]. Free Radical Biology and Medicine, 2009, 47(4): 333-343. DOI:10.1016/ j.freeradbiomed.2009.05.004.
[15] FERNÁNDEZ-TOMÉ S, RAMOS S, CORDERO-HERRERA I, et al. In vitro chemo-protective effect of bioactive peptide lunasin against oxidative stress in human HepG2 cells[J]. Food Research International, 2014, 62: 793-800. DOI:10.1016/j.foodres.2014.04.054.
[16] FERRARI R, CECONI C, CURELLO S, et al. The occurrence of oxidative stress during reperfusion in experimental animals and men[J]. Cardiovascular Drugs and Therapy, 1991, 5(2): 277-287.
[17] 尹小萍, 林冠宇, 宝丽, 等. 正膏坊龟苓膏对氧化应激状态的改善作用[J]. 食品科学, 2009, 30(5): 239-243. DOI:10.3321/ j.issn:1002-6630.2009.05.055.
[18] MCCORD J M, FRIDOVICH I. The reduction of cytochrome c by milk xanthine oxidase[J]. Journal of Biological Chemistry, 1968, 243(21): 5753-5760.
[19] 王怡, 刘俊恒, 陈哲俊. 依达拉奉对H2O2致星形胶质细胞损伤的保护作用[J]. 药学与临床研究, 2008, 16(3): 166-169. DOI:10.3969/ j.issn.1673-7806.2008.03.002.
[20] CIRCU M L, AW T Y. Reactive oxygen species, cellular redox systems, and apoptosis[J]. Free Radical Biology and Medicine, 2010, 48(6): 749-762. DOI:10.1016/j.freeradbiomed.2009.12.022.
[21] McCASKILL D R, ZHANG F. Use of rice bran oil in foods: developing nutraceuticals for the new millenium[J]. Food Technology, 1999, 53(2): 50-53.
[22] LEE M C, LEE G I AN, LEE J R, et al. researtharticles: analysis and comparison of the γ-oryzanol content based on phylogenetic groups in Korean landraces of rice (Oryza sativa L.)[J]. Plant Breeding and Biotechnol, 2013, 1: 58-69.
[23] ISMAIL M, AL-NAQEEB G, WAN A A M, et al. Gamma-oryzanol rich fraction regulates the expression of antioxidant and oxidative stress related genes in stressed rat’s liver[J]. Nutrition and Metabolism, 2010, 7(1): 1-13.
[24] NYSTRÖM L, MÄKINEN M, LAMPI A M, et al. Antioxidant activity of steryl ferulate extracts from rye and wheat bran[J]. Journal of Agricultural and Food Chemistry, 2005, 53(7): 2503-2510. DOI:10.1021/jf048051t.
[25] 龚院生, 王素雅. γ-谷维醇对小鼠生理功能的影响[J]. 动物科学与动物医学, 2002, 19(9): 26-28. DOI:10.3969/ j.issn.1673-5358.2002.02.011.
Proliferative and Protective Effect of γ-Oryzanol on L02 Cells against Oxidative Damage Induced by Hydrogen Peroxide
JIANG Weiwei1, YI Jine1,2,*, TAN Zhuliang1,*
(1. College of Veterinary Medicine, Hunan Agricultural University, Changsha 410128, China;2. Hunan Co-innovation Center Production Safety, Changsha 410128, China)
Objective: To investigate the proliferative and protective effects of γ-oryzanol on L02 cells. Methods: The model of oxidative damage was established on L02 cells induced by H2O2. Cell viability, the contents of malondialdehyde (MDA)and glutathione (GSH), the activities of superoxide dismutase (SOD) and catalase (CAT), and the level of ROS were assayed on L02 cells treated with γ-oryzanol at various concentrations in vitro. Results: The cell viability was enhanced significantly, and the levels of ROS and MDA were decreased significantly, whereas the content of GSH and the activities of CAT and SOD were significantly increased by 0.1-0.4 mmol/L γ-oryzanol treatment after H2O2-induced oxidative damage in a dose dependent manner. Conclusion: γ-Oryzanol can effectively attenuate H2O2-induced oxidative damage at a dose of 0.1-0.4 mmol/L and maintain the normal physiology of the cells.
γ-oryzanol; oxidative damage; L02 cell
10.7506/spkx1002-6630-201607034
S854
A
1002-6630(2016)07-0187-05
蒋维维, 易金娥, 谭柱良. γ-谷维素对过氧化氢诱导氧化损伤L02细胞的增殖和保护作用[J]. 食品科学, 2016, 37(7):187-191. DOI:10.7506/spkx1002-6630-201607034. http://www.spkx.net.cn
JIANG Weiwei, YI Jine, TAN Zhuliang. Proliferative and protective effect of γ-oryzanol on L02 cells against oxidative damage induced by hydrogen peroxide[J]. Food Science, 2016, 37(7): 187-191. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201607034. http://www.spkx.net.cn
2015-06-05
湖南省自然科学基金项目(2015JJ2077);国家自然科学基金青年科学基金项目(31201964);教育部高校博士学科点专项基金新教师类资助项目(20124320120011);湖南省教育厅科学研究项目(12A066);湖南农业大学公派出国科研启动基金项目(14RCPT12)
蒋维维(1989—),女,硕士研究生,研究方向为食品保健,食品抗氧化。E-mail:weiwei13511@163.com
*通信作者:易金娥(1976—),女,教授,博士,研究方向为食品保健。E-mail:yijine@gmail.com谭柱良(1978—),男,教授,博士,研究方向为食品营养保健。 E-mail:ztandao@gmail.com

