乳糖饮水对Sprague-Dawley大鼠糖、脂、尿酸代谢的影响
牛红娟,林志健,朱春胜,王雪洁,聂安政,王 雨,李 凡,张 冰
(北京中医药大学中药学院,北京 100029)
乳糖饮水对Sprague-Dawley大鼠糖、脂、尿酸代谢的影响
牛红娟,林志健,朱春胜,王雪洁,聂安政,王 雨,李 凡,张 冰*
(北京中医药大学中药学院,北京 100029)
目的:探讨不同质量浓度乳糖饮水对Sprague-Dawley(SD)大鼠糖、脂、尿酸代谢的影响。方法:分别以清水,50、100、150 g/L乳糖水饲喂大鼠8 周,观察不同时间点大鼠的能量摄入及体质量等一般状态指标。取大鼠血清检测血糖(glucose,GLU)、尿酸(uric acid,UA)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)水平。结果:与正常组相比,150 g/L乳糖组大鼠的能量摄入显著降低,且于实验第1、2周体质量显著降低(P<0.05)。各剂量乳糖组大鼠的GLU水平均高于正常组(P<0.05或P<0.01)。50、100 g/L乳糖组大鼠的UA水平低于正常组(P<0.05或P<0.01),150 g/L乳糖组大鼠的UA水平于第1周一次性升高(P<0.05)。100 g/L乳糖组大鼠的TG水平于第6周显著升高(P<0.05),150 g/L乳糖组大鼠的TG水平于第1~3周显著升高且TC水平于第2、3、7周显著升高(P<0.05或P<0.01)。乳糖组大鼠的LDL-C水平均显著或极显著升高(P<0.05或P<0.01)。结论:不同质量浓度乳糖摄入可对大鼠血糖、血脂、尿酸代谢产生不同影响,使用时应控制乳糖适宜的摄入剂量。
乳糖;血糖;血脂;尿酸
乳糖(lactose)为哺乳动物乳汁中主要的糖类,是由D-半乳糖和D-葡萄糖通过β(1→4)糖苷键连接而成的双糖[1]。在食品工业及饮料生产中,乳糖常被作为营养型甜味剂添加于牛奶、奶粉等乳制品中。目前,中国营养学会在新的膳食指南中提出将增加乳类及其制品的摄入量作为提高居民营养状况的重要手段[2]。乳糖甜度相对较低,具有一定的热量,高纯度的α-乳糖所含有的热量为12.586 kJ/g[3]。乳糖在肠黏膜中可被乳糖酶分解为等量的半乳糖和葡萄糖[4],进入血液后经糖代谢途径可产生能量物质ATP。同时,乳糖亦可在肠道中被乳酸菌等细菌发酵利用而转化为乳酸[5]。研究表明,乳糖在脂肪代谢中具有一定的作用[6],且对于机体的胰岛素合成很必要的[7]。美国第三次全国健康与营养调查显示含乳糖乳制品的摄入与血清尿酸水平的降低及痛风风险的降低具有一定相关性[8-9]。以上研究表明,乳糖的摄入与机体的物质和能量代谢具有一定相关性,故本实验以Sprague-Dawley(SD)大鼠为受试体,通过以3 种不同质量浓度乳糖饮水干预大鼠,旨在探讨摄入不同质量浓度乳糖对大鼠机体糖、脂、尿酸代谢的影响,从而为乳糖作为食品添加剂在食品领域的应用提供一定的参考依据。本实验设定的3 种乳糖质量浓度中,50 g/L符合低糖食品标准[10],100 g/L为含糖饮料中常用糖添加量[11],而150 g/L为美国规定含糖饮料最高糖添加量[12]。
1 材料与方法
1.1 动物、材料与试剂
SPF级雄性SD大鼠,40 只,体质量(200f10) g,动物许可证号:SCXK(京)2011-0004,购自斯贝福(北京)实验动物科技有限公司。在本实验室以大小鼠维持饲料适应性饲喂5 d后用于实验。
α-乳糖(试药级,纯度≥99%) 美国Sigma-Aldrich公司;尿酸(uric acid,UA)测定试剂盒中生北控生物科技股份有限公司;总胆固醇(total cholesterol,TC)测定试剂盒(CHOD-POD法)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)测定试剂盒(直接法-选择抑制法)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)测定试剂盒(直接法-表明活性剂清除法)、葡萄糖(glucose,GLU)测定试剂盒(葡萄糖氧化酶法)、甘油三酯(triglyceride,TG)测定试剂盒(终点法)北京利德曼生化股份有限公司。
1.2 仪器与设备
电子天平 德国赛多利斯公司;恒温水浴锅 北京医疗设备厂;Sunrise酶标仪 帝肯集团奥地利有限公司;Beckman CX4全自动生化分析仪 美国贝克曼公司;恒温低速离心机 法国JOUAN公司。
1.3 方法
1.3.1 动物分组与处理
40 只雄性SD大鼠根据体质量随机分为4 组:正常组,50、100、150 g/L乳糖组。各组均予以普通大小鼠维持饲料,正常组大鼠予以清水,各剂量乳糖组分别予以50、100、150 g/L质量浓度的乳糖水。实验期间各组大鼠均自由饮食饮水,每日记录大鼠饮食量和饮水量,并计算能量摄入量。每周称量大鼠体质量并剪尾取血约0.8 mL,3 000 r/min离心10 min以获取血清。
1.3.2 大鼠一般状态指标及血清生化指标测定
大鼠一般状态指标:记录大鼠体质量、饮食量、饮水量,计算能量摄入量。
大鼠血清生化指标:测定血清UA、GLU、TG、TC、HDL-C、LDL-C水平。其中UA、GLU、TG、TC水平为每周测定一次,HDL-C、LDL-C水平于实验第8周测定一次。血清UA水平以Sunrise酶标仪测定,其余指标均以Beckman CX4全自动生化分析仪测定。
1.4 数据统计处理
2 结果与分析
2.1 大鼠一般状态指标
2.1.1 大鼠能量摄入
大鼠总能量摄入包括分别从饮食及饮水中获得的能量。由表1可知,与正常组相比,乳糖组大鼠的饮食量均极显著降低(P<0.01)。100、150 g/L乳糖组大鼠的饮水量均极显著低于正常组(P<0.01),50 g/L乳糖组大鼠的饮水量与正常组无显著差异(P>0.05)。150 g/L乳糖组大鼠的总能量摄入显著低于正常组(P<0.05),而50、100 g/L乳糖组能量摄入低于正常组,但无统计学差异(P>0.05)。
表1 乳糖饮水对大鼠饮食、饮水及能量摄入的影响()Table 1 Effect of lactose-sweetened beverage on food intake, beverage consumption and energy intake of rats ()
注:#.与正常组相比,差异显著(P<0.05);##. 与正常组相比,差异极显著(P<0.01)。下同。
指标 正常组 50 g/L乳糖组 100 g/L乳糖组 150 g/L乳糖组饮食量/(g/d) 29.38f2.26 25.70f2.34## 24.34f2.11## 21.90f1.66##饮水量/(mL/d) 52.97f4.76 50.67f4.00 39.48f3.95## 32.00f3.40##饮食能量/(kJ/d) 347.36f26.69 303.88f27.74##287.82f24.89##258.99f19.66##饮水能量/(kJ/d) 31.84f2.51 49.62f4.98 60.33f6.40总能量/(kJ/d) 347.36f26.69 335.72f26.44 337.44f24.18 319.32f21.71#
2.1.2 大鼠体质量变化
表2 乳糖饮水对大鼠体质量的影响()Table 2 Effect of lactose-sweetened beverage on body weight of rats ()g
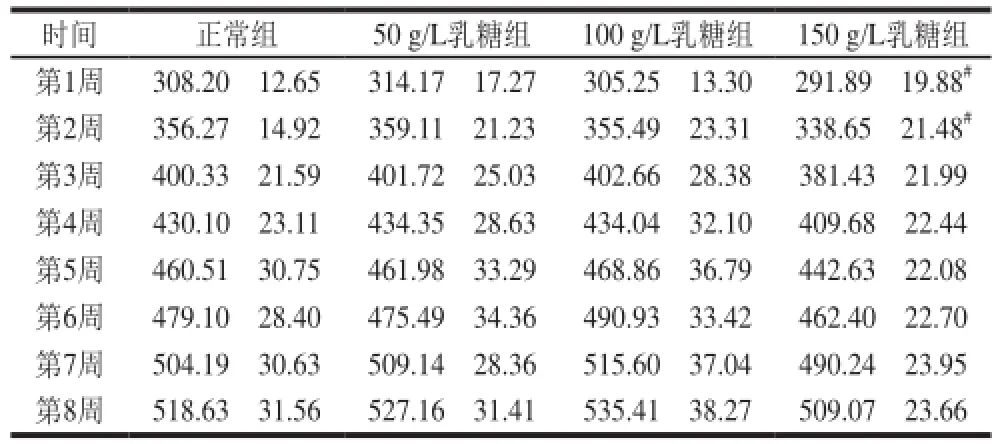
表2 乳糖饮水对大鼠体质量的影响()Table 2 Effect of lactose-sweetened beverage on body weight of rats ()g
时间 正常组 50 g/L乳糖组 100 g/L乳糖组 150 g/L乳糖组第1周 308.20f12.65 314.17f17.27 305.25f13.30 291.89f19.88#第2周 356.27f14.92 359.11f21.23 355.49f23.31 338.65f21.48#第3周 400.33f21.59 401.72f25.03 402.66f28.38 381.43f21.99第4周 430.10f23.11 434.35f28.63 434.04f32.10 409.68f22.44第5周 460.51f30.75 461.98f33.29 468.86f36.79 442.63f22.08第6周 479.10f28.40 475.49f34.36 490.93f33.42 462.40f22.70第7周 504.19f30.63 509.14f28.36 515.60f37.04 490.24f23.95第8周 518.63f31.56 527.16f31.41 535.41f38.27 509.07f23.66
由表2可知,各组大鼠的体质量均呈现增长趋势,其中150 g/L乳糖组大鼠的体质量增长缓慢,于实验第1、2周显著低于正常组(P<0.05),50、100 g/L乳糖组大鼠的体质量在实验期间与正常组均无显著差异(P>0.05)。
2.2 大鼠血清生化指标
2.2.1 大鼠血糖水平变化
由表3可知,与正常组相比,各剂量乳糖组大鼠的血糖水平均高于正常组。50 g/L乳糖组大鼠的血糖水平于第1、7周显著或极显著升高(P<0.05或P<0.01);100 g/L乳糖组大鼠的血糖水平于第1、2、4、7、8周显著或极显著升高(P<0.05或P<0.01);150 g/L乳糖组大鼠的血糖水平于第2、3、6、7、8周显著或极显著升高(P<0.05或P<0.01)。
表3 乳糖饮水对大鼠血糖水平的影响()Table 3 Effect of lactose-sweetened beverage on blood glucose level of rats (mmol/L

表3 乳糖饮水对大鼠血糖水平的影响()Table 3 Effect of lactose-sweetened beverage on blood glucose level of rats (mmol/L
时间 正常组 50 g/L乳糖组 100 g/L乳糖组 150 g/L乳糖组第1周 3.74f0.54 4.23f0.50# 4.41f0.68# 3.57f0.88第2周 2.82f1.01 3.51f0.75 4.16f0.99## 4.24f0.86##第3周 3.71f1.03 3.97f0.80 4.34f1.40 4.56f0.63#第4周 4.32f0.56 4.51f0.73 5.87f1.52## 4.59f0.52第5周 4.14f0.53 3.99f0.42 4.47f1.14 4.23f0.73第6周 4.66f0.97 5.25f0.95 5.14f0.93 5.90f1.07#第7周 4.74f0.28 5.32f0.48## 5.36f0.64## 6.00f0.31##第8周 4.91f0.48 5.11f0.66 5.50f0.63# 5.57f0.58#
2.2.2 大鼠血清尿酸水平变化
表4 乳糖饮水对大鼠血清尿酸水平的影响()Table 4 Effect of lactose-sweetened beverage on serum uric acid level of rats () μmol/L

表4 乳糖饮水对大鼠血清尿酸水平的影响()Table 4 Effect of lactose-sweetened beverage on serum uric acid level of rats () μmol/L
时间 正常组 50 g/L乳糖组 100 g/L乳糖组 150 g/L乳糖组第1周 90.74f19.31 72.40f32.99 65.81f22.52# 114.43f29.44#第2周122.57f29.50 91.92f33.60# 70.46f33.63## 112.08f29.47第3周85.59f25.90 63.42f25.58 59.41f29.18 98.68f26.61第4周72.96f21.71 69.31f34.15 71.74f23.63 73.56f25.94第5周84.22f28.31 62.45f22.37 51.14f20.55## 94.81f38.61第6周78.24f20.09 67.07f28.87 50.46f16.44 93.34f37.40第7周 83.80f18.94 63.96f23.82# 57.72f25.91# 65.09f29.04第8周102.55f25.69 74.11f31.18# 71.70f20.24## 81.29f20.67
由表4可知,与正常组相比,50、100 g/L乳糖组大鼠血清的尿酸水平均低于正常组。50 g/L乳糖组大鼠血清的尿酸水平分别于实验第2、7、8周显著降低(P<0.05);100 g/L乳糖组大鼠血清的尿酸水平于第1、2、5、7、8周显著或极显著降低(P<0.05或P<0.01);150 g/L乳糖组大鼠血清的尿酸水平于实验第1周出现一次性升高现象(P<0.05),其余时间点与正常组无显著差异(P>0.05)。
2.2.3 大鼠血清甘油三酯水平变化
表5 乳糖饮水对大鼠血清甘油三酯水平的影响()Table 5 Effect of lactose-sweetened beverage on serum triglyceride level of rats () mmol/L
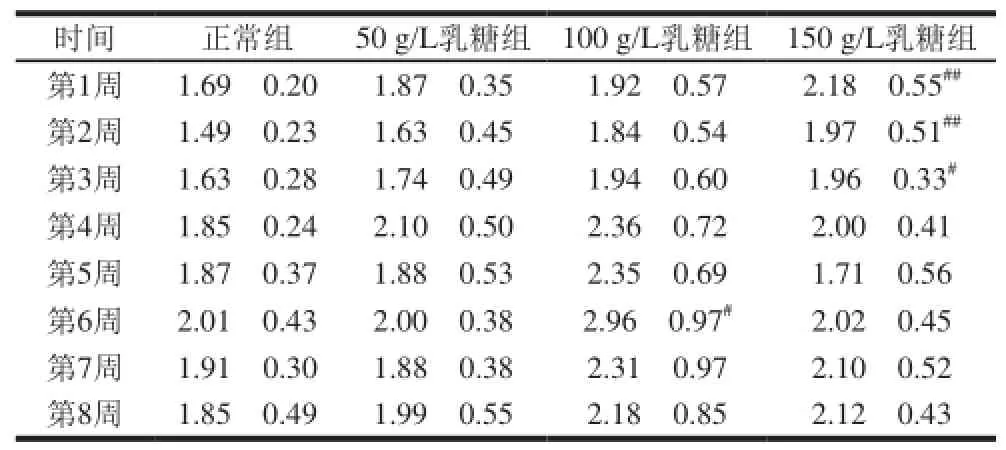
表5 乳糖饮水对大鼠血清甘油三酯水平的影响()Table 5 Effect of lactose-sweetened beverage on serum triglyceride level of rats () mmol/L
时间 正常组 50 g/L乳糖组 100 g/L乳糖组 150 g/L乳糖组第1周 1.69f0.20 1.87f0.35 1.92f0.57 2.18f0.55##第2周 1.49f0.23 1.63f0.45 1.84f0.54 1.97f0.51##第3周 1.63f0.28 1.74f0.49 1.94f0.60 1.96f0.33#第4周 1.85f0.24 2.10f0.50 2.36f0.72 2.00f0.41第5周 1.87f0.37 1.88f0.53 2.35f0.69 1.71f0.56第6周 2.01f0.43 2.00f0.38 2.96f0.97# 2.02f0.45第7周 1.91f0.30 1.88f0.38 2.31f0.97 2.10f0.52第8周 1.85f0.49 1.99f0.55 2.18f0.85 2.12f0.43
由表5可知,与正常组相比,100 g/L乳糖组大鼠血清的甘油三酯水平升高,于实验第6周呈现显著性差异(P<0.05);150 g/L乳糖组大鼠血清的甘油三酯水平于实验第1~3周显著或极显著升高(P<0.05或P<0.01);50 g/L乳糖组大鼠血清的甘油三酯水平在实验期间内与正常组无显著差异(P>0.05)。
2.2.4 大鼠血清总胆固醇水平变化
表6 乳糖饮水对大鼠血清总胆固醇水平的影响()Table 6 Effect of lactose-sweetened beverage on serum total cholesterol level of rats (x ±s,n= 10) mmol/L

表6 乳糖饮水对大鼠血清总胆固醇水平的影响()Table 6 Effect of lactose-sweetened beverage on serum total cholesterol level of rats (x ±s,n= 10) mmol/L
时间 正常组 50 g/L乳糖组 100 g/L乳糖组 150 g/L乳糖组第1周 1.98f0.31 1.97f0.23 1.95f0.36 2.19f0.38第2周 1.86f0.24 1.91f0.20 1.83f0.36 2.26f0.38##第3周 1.81f0.26 1.93f0.24 1.93f0.31 2.13f0.27#第4周 2.04f0.33 2.19f0.26 2.20f0.37 2.16f0.26第5周 1.92f0.23 1.75f0.19 1.78f0.30 1.80f0.22第6周 1.79f0.20 1.80f0.24 1.84f0.30 1.87f0.25第7周 1.71f0.23 1.88f0.23 1.77f0.34 2.00f0.24##第8周 1.83f0.16 1.98f0.29 1.82f0.34 1.98f0.31
由表6可知,与正常组相比,150 g/L乳糖组大鼠血清的总胆固醇水平升高,于实验第2、3、7周呈现显著或极显著差异(P<0.05或P<0.01)。其余剂量乳糖组大鼠血清的总胆固醇水平在实验期间内与正常组无显著差异(P>0.05)。
2.2.5 大鼠血清高/低密度脂蛋白胆固醇水平变化
表7 乳糖饮水对第8周大鼠血清高/低密度脂蛋白胆固醇水平的影响()Table 7 Effect of lactose-sweetened beverage on serum high-density lipoprotein cholesterol level and low density lipoprotein cholesterol level of rats in the eighth week (mmol/L

表7 乳糖饮水对第8周大鼠血清高/低密度脂蛋白胆固醇水平的影响()Table 7 Effect of lactose-sweetened beverage on serum high-density lipoprotein cholesterol level and low density lipoprotein cholesterol level of rats in the eighth week (mmol/L
指标 正常组 50 g/L乳糖组 100 g/L乳糖组 150 g/L乳糖组HDL-C 1.57f0.18 1.64f0.22 1.51f0.29 1.60f0.24 LDL-C 0.21f0.04 0.28f0.06## 0.25f0.04# 0.31f0.07##
由表7可知,与正常组相比,各剂量乳糖组大鼠血清的HDL-C水平在实验期间内无显著变化(P>0.05),而LDL-C水平均显著或极显著高于正常组(P<0.05或P<0.01)。
3 讨 论
乳糖作为一种常用的营养型甜味剂,其甜度较蔗糖、果糖低,仅为蔗糖甜度的20%~30%[13-14],且热量相对较低。本实验中,各剂量乳糖组大鼠在实验期间饮水量均低于正常组,且随乳糖剂量的增加呈现递减趋势,这可能与乳糖饮水的口感较差有关。乳糖水的摄入可能对大鼠食欲产生了抑制作用,导致大鼠饮食量减少,且随乳糖剂量的增加呈现递减趋势。饮食量和饮水量的减少直接导致乳糖组大鼠的能量摄入量降低,从而导致其体质量增长缓慢。本实验中,乳糖对大鼠体质量的降低作用与Goseki-Sone等[15]的研究结果一致。
实验期间,各剂量乳糖组大鼠的血糖水平均高于正常组,且在多个时间点呈现出显著性差异,这可能是因为乳糖在乳糖酶作用下分解产生的半乳糖在作用于大鼠机体后,提高了脂肪氧化的速率,进而提高了机体的血糖水平。研究报道,游泳运动前灌胃2 g/kg的乳糖溶液,可减缓小鼠游泳力竭运动后的血糖水平下降幅度[16],这表明乳糖摄入对血糖水平具有一定的升高作用。但在本实验中,乳糖摄入对大鼠血糖水平升高的作用并未表现出明显的量-效关系。不同剂量乳糖的摄入对大鼠血糖水平的升高作用对于高血糖动物模型的塑造研究具有一定的借鉴意义。50、100 g/L乳糖组大鼠的尿酸水平在多个时间点均低于正常组,可能是由于摄入的乳糖在被分解为葡萄糖后,机体细胞内增加的葡萄糖通过刺激葡萄糖转运体9[17](同时也是一个高效的尿酸转运体)而介导尿酸的排泄,致使肾脏尿酸重吸收减少,导致血清尿酸水平降低[18]。此外,本实验中乳糖组大鼠升高的血糖水平以及降低的尿酸水平所呈现出的负相关现象与张蓓等[19]在低尿酸血症患者中观察到的血糖水平变化趋势具有一致性。
本实验结果表明,乳糖对大鼠甘油三酯、总胆固醇等脂代谢指标具有一定的影响,这可能与乳糖进入机体后导致短链脂肪酸(short-chain fatty acid,SCFA)生成增多有关。研究表明,成年大鼠体内缺乏乳糖酶[20],致使乳糖进入小肠后不能被完全分解吸收,而在结肠中未被分解的部分乳糖可被肠道细菌酵解产生SCFA[21]、甲烷、氢气等物质,即产生乳糖吸收不良现象[22]。乙酸、丙酸、丁酸等成分对于机体胆固醇及脂肪酸的合成具有重要作用[23],故乳糖的摄入可能通过影响乙酸、丙酸等SCFA的种类及数量进而导致了脂代谢的改变。本实验中,不同剂量的乳糖于不同时间点分别对大鼠血清中甘油三酯、总胆固醇水平产生了不同程度的影响,这可能是因为发酵底物(乳糖)的浓度、数量、降解速率以及肠道菌群和宿主生理状态不同[24-25],进而影响了SCFA的数量和比例。肠道内SCFA的变化可能会通过改变其受体GPR41及GPR43的表达[26]而影响机体的能量平衡状态,导致机体代谢状态不同。
4 结 论
综上所述,不同剂量乳糖的摄入对于大鼠血糖、血脂、尿酸代谢具有一定的影响,这有利于促进对乳糖摄入与机体代谢改变的认识。由于乳糖自身的特性,乳糖诱导代谢改变的病理机制可能与肠道微生态环境变化有关。本实验结果表明,50、100 g/L的乳糖饮水对大鼠脂代谢影响较小,而150 g/L乳糖摄入对大鼠的脂代谢影响较大,3 个不同剂量乳糖摄入对于大鼠的血糖、尿酸代谢均会产生影响。本实验结果提示,饮水中添加乳糖会对机体代谢产生一定的不利影响,使用过程中应控制乳糖适宜的摄入剂量。
[1] 伍桃英, 李梦怡, 李亦蔚, 等. 3种测定乳制品中乳糖含量方法的比较[J]. 食品与机械, 2010, 26(5): 71-74. DOI:10.3969/ j.issn.1003-5788.2010.05.020.
[2] 余清, 荫士安. 有关乳糖不耐受的研究进展[J]. 卫生研究, 2006, 35(3): 360-362. DOI:10.3969/j.issn.1000-8020.2006.03.036.
[3] BOAKYE P A, BRIERLEY S M, PASILIS S P, et al. Garcinia buchananii bark extract is an effective anti-diarrheal remedy for lactose-induced diarrhea[J]. Journal of Ethnopharmacology, 2012, 142(2): 539-547. DOI:10.1016/j.jep.2012.05.034.
[4] 黄磊, 张亚丽. 鼠肠粘膜乳糖酶活性测定方法的研究[J].中国卫生检验杂志, 2006, 16(2): 191-194. DOI:10.3969/ j.issn.1004-8685.2006.02.026
[5] 康萍, 胡琴, 潘杰, 等. 大米糖浆替代乳糖对早期断奶仔猪生长性能及胰岛素样生长因子轴的影响[J]. 动物营养学报, 2008, 20(3): 343-348. DOI:10.3969/j.issn.1006-267X.2008.03.017.
[6] 陈洪兴. 乳糖和乳糖不耐症[J]. 盐城工学院学报(自然科学版), 2002, 15(3): 32-35. DOI:10.16018/j.cnki.32-1650/n.2002.03.010.
[7] 顾瑞霞. 乳与乳制品的生理功能特性[M]. 北京: 中国轻工业出版社, 2000: 122.
[8] CHOI H K, LIU S, CURHAN G. Intake of purine-rich foods, protein, and dairy products and relationship to serum levels of uric acid: The Third National Health and Nutrition Examination Survey[J]. Arthritis & Rheumatism, 2005, 52(1): 283-289. DOI:10.1002/art.20761.
[9] CHOI H K, ATKINSON K, KARLSON E W, et al. Purine-rich foods, dairy and protein intake, and the risk of gout in men[J]. New England Journal of Medicine, 2004, 350(11): 1093-1103. DOI:10.1056/ NEJMoa035700.
[10] 王浩, 刘艳琴, 杨红梅, 等. 液相色谱-质谱联用技术测定无糖食品中果糖、葡萄糖、蔗糖、麦芽糖和乳糖[J]. 分析化学, 2010, 38(6): 873-876. DOI:10.3724/SP.J.1096.2010.00873.
[11] ZHOU S, YOMANO L P, SHANMUGAM K T, et al. Fermentation of 10% (w/v) sugar to D (-)-lactate by engineered Escherichia coli B[J]. Biotechnology Letters, 2005, 27(23/24): 1891-1896. DOI:10.1007/ s10529-005-3899-7.
[12] JURGENS H, HAASS W, CASTANEDA T R, et al. Consuming fructose-sweetened beverages increases body adiposity in mice[J]. Obesity Research, 2005, 13(7): 1146-1156. DOI:10.1038/ oby.2005.136.
[13] 崔思荣. 乳糖的生物特性[J]. 枣庄学院学报, 2010, 27(5): 77-80. DOI:10.3969/j.issn.1004-7077.2010.05.018.
[14] 魏奎, 谷庆芳. 乳糖在人体内的营养特性[J]. 食品研究与开发, 2012, 33(3): 187-189. DOI:10.3969/j.issn.1005-6521.2012.03.054.
[15] GOSEKI-SONE M, MARUYAMA R, SOGABE N, et al. Effects of dietary lactose on long-term high-fat-diet-induced obesity in rats[J]. Obesity, 2007, 15(11): 2605-2613. DOI:10.1038/oby.2007.312.
[16] 李丕彦, 卢文彪. 乳糖对小鼠运动能力的影响研究[J]. 韶关学院学报, 2011, 32(12): 60-62. DOI:10.3969/j.issn.1007-5348.2011.12.015.
[17] 刘颖琬, 孙维峰. 尿酸转运相关蛋白SLC2A9/GLUT9的研究进展[J]. 广东医学, 2013(14): 2261-2263. DOI:10.3969/ j.issn.1001-9448.2013.14.056.
[18] 刘代焱, 姚昕韬, 倪银星, 等. 葡萄糖转运子9与尿酸代谢间关系的研究进展[J]. 中华内分泌代谢杂志, 2012, 28(1): 81-84. DOI:10.3760/cma.j.issn.1000-6699.2012.01.024.
[19] 张蓓, 何霞, 古丽尼扎·哈力阿克帕尔, 等. 低尿酸血症与糖脂代谢的相关性分析[J]. 国际检验医学杂志, 2014(17): 2277-2279. DOI:10.3969/j.issn.1673-4130.2014.17.003.
[20] ALEXANDRE V, EVEN P C, LARUE-ACHAGIOTIS C, et al. Lactose malabsorption and colonic fermentations alter host metabolism in rats[J]. British Journal of Nutrition, 2013, 110: 625-631. DOI:10.1017/S0007114512005557.
[21] 罗靓. 功能性肠病与乳糖不耐受的相关因素及相互关系[D]. 杭州:浙江大学, 2013: 2.
[22] 聂玮, 王红梅, 张立平, 等. 乳糖吸收不良与肠易激综合征[J]. 医学综述, 2014, 20(12): 2207-2209. DOI:10.3969/ j.issn.1006-2084.2014.12.037.
[23] 徐运杰, 方热军, 戴求仲. 短链脂肪酸的营养生理作用[J]. 饲料研究, 2007(8): 26-28. DOI:10.13557/j.cnki.issn.1002-2813.2007.08.010.
[24] 刘松珍, 张雁, 张名位, 等. 肠道短链脂肪酸产生机制及生理功能的研究进展[J]. 广东农业科学, 2013, 40(11): 99-103. DOI:10.3969/ j.issn.1004-874X.2013.11.029.
[25] 刘小华, 李舒梅, 熊跃玲. 短链脂肪酸对肠道功效及其机制的研究进展[J]. 肠外与肠内营养, 2012, 19(1): 56-58. DOI:10.3969/ j.issn.1007-810X.2012.01.019.
[26] 王永安, 张春雷, 王艳红, 等. 短链脂肪酸受体GPR41、GPR43的信号通路及生理功能[J]. 中国牛业科学, 2013, 39(6): 49-53. DOI:10.3969/j.issn.1001-9111.2013.06.013.
Influence of Lactose-Sweetened Beverage on Serum Glucose, Lipid and Uric Acid Levels in Sprague-Dawley Rats
NIU Hongjuan, LIN Zhijian, ZHU Chunsheng, WANG Xuejie, NIE Anzheng, WANG Yu, LI Fan, ZHANG Bing*
(School of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 100029, China)
Objective: To investigate the influence of different concentrations of lactose-sweetened beverage on serum glucose, lipid and uric acid levels in Sprague-Dawley (SD) rats. Methods: Rats were given free access to tap water, 50, 100, 150 g/L lactose-sweetened beverage for eight weeks, respectively. The indexes including food intake, beverage consumption, calories intake and body weight were measured at different time points during the experiment. Serum samples were harvested for determining the levels of blood glucose (GLU), uric acid (UA), triglyceride (TG), total cholesterol (TC), high-density lipoprotein cholesterol (HDL-C) and low-density lipoprotein cholesterol (LDL-C). Results: Compared with the control group, the total energy intake reduced significantly; moreover, the body weight in the 1stand 2ndweek decreased with statistical difference in the rats provided with 150 g/L lactose (P < 0.05). The GLU level in the treatment groups was higher than that in the water control group (P < 0.05 or P < 0.01). The serum uric acid level in 50 and 100 g/L lactose groups decreased significantly (P < 0.05 or P < 0.01), while the rats given access to 150 g/L lactose-sweetened beverage showed a temporary increase of uric acid level in the 1stweek (P < 0.05). The TG level in 100 g/L lactose group elevated significantly in the 6thweek (P < 0.05). A significant increase in TG level of rats given 150 g/L lactose was detected from the 1stweek to the 3rdweek (P < 0.05 or P < 0.01). In addition, the TC level increased significantly in the 2nd, 3rdand 7thweek during this experiment (P <0.05 or P < 0.01). A significant increase in LDL-C level was observed in the treatment groups (P < 0.05 or P < 0.01). Conclusion: Diverse influence on serum glucose, lipid and uric acid level can be exerted by different concentrations of lactose-sweetened beverage. The dose of lactose intake should be restricted in the application process.
lactose; blood glucose; blood lipid; uric acid
10.7506/spkx1002-6630-201607030
R151.2
A
1002-6630(2016)07-0163-05
牛红娟, 林志健, 朱春胜, 等. 乳糖饮水对Sprague-Dawley大鼠糖、脂、尿酸代谢的影响[J]. 食品科学, 2016, 37(7):163-167. DOI:10.7506/spkx1002-6630-201607030. http://www.spkx.net.cn
NIU Hongjuan, LIN Zhijian, ZHU Chunsheng, et al. Influence of lactose-sweetened beverage on serum glucose, lipid and uric acid levels in Sprague-Dawley rats[J]. Food Science, 2016, 37(7): 163-167. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201607030. http://www.spkx.net.cn
2015-06-12
国家自然科学基金面上项目(81403152);教育部高等学校博士学科点专项科研基金项目(20130013120001;20120013130002);北京中医药大学青年教师专项自主课题(2013-QNJSZX008);北京中医药大学科研创新团队项目(2011-CXTD-014);北京中医药大学在读研究生项目(2015-JYB-XS113)
牛红娟(1990—),女,硕士研究生,主要从事中药防治代谢性疾病研究。E-mail:niuhongjuan1@163.com
*通信作者:张冰(1959—),女,教授,博士,主要从事中药防治代谢性疾病基础与临床研究。E-mail:zhangbing6@263.net

