对羟基苯甲醛等3 种天麻成分对灰树花胞外多糖生物合成的影响
吴彩云,吴天祥,2,,朱俊杰,刘 昕,赵群丽
(1.贵州大学酿酒与食品工程学院,贵州 贵阳 550025;2.贵州大学食品科学工程技术研究中心,贵州 贵阳 550025)
对羟基苯甲醛等3 种天麻成分对灰树花胞外多糖生物合成的影响
吴彩云1,吴天祥1,2,*,朱俊杰1,刘 昕1,赵群丽1
(1.贵州大学酿酒与食品工程学院,贵州 贵阳 550025;2.贵州大学食品科学工程技术研究中心,贵州 贵阳 550025)
在灰树花液体发酵体系中,分别添加不同量的天麻素、对羟基苯甲醇和对羟基苯甲醛3 种天麻成分,分析这3 种成分对灰树花菌体生长和胞外多糖(exopolysaccharide,EPS)合成的影响,采用苯酚-硫酸法测定胞外多糖含量。结果表明:适宜质量浓度的这3 种天麻成分均能促进灰树花菌体生长和胞外多糖的生物合成,其中对羟基苯甲醛添加量为0.15 g/L时效果最佳,并且略低于体积分数7%天麻醇提取物。动态分析0.15 g/L对羟基苯甲醛和7%天麻醇提取物对灰树花EPS合成促进作用的结果表明:在整个发酵过程中,二者促进灰树花EPS生物合成的效果基本一样,并且从发酵第7天开始,二者的EPS产量均显著高于空白组(P<0.05)。采用高效液相色谱法动态测定发酵期间对羟基苯甲醛含量变化,结果表明:在发酵的第5天,对羟基苯甲醛基本被完全吸收,而此时灰树花EPS开始大量积累。因此,灰树花可利用对羟基苯甲醛来促进EPS的生物合成。
对羟基苯甲醛;天麻成分;灰树花;胞外多糖
天麻为兰科植物的干燥块茎,主产于贵州、四川、云南及陕西等地[1],是我国名贵的中药材之一,其主要成分有天麻素、对羟基苯甲醇、对羟基苯甲醛等[2-5]。灰树花(Grifola frondosa),又名贝叶多孔菌,隶属于担子菌亚门(Basidiomycotina),多孔菌科(Polyporaceae),是一种营养丰富、生物活性物质含量高的药(食)用真菌。灰树花多糖具有抗肿瘤[6-7]、清除自由基[8-9]、抗艾滋病[10]、抗氧化[8,11-12]、提高成纤维细胞增殖及促进胶原蛋白合成[10]等生物活性。液体发酵培养是获得药用真菌多糖一种快速、高效、经济的方法。为了最大量获得胞外多糖(exopolysaccharide,EPS),在药用真菌液体发酵体系中添加一定的刺激物,不仅能促进菌体细胞的生长,而且能增加次生代谢产物(如EPS)的生物合成[13]。Liu Gaoqiang等[14]在灵芝液体深层发酵体系中添加乙酸乙酯可显著促进灵芝多糖的合成和菌体生长。Tang Yajie等[15]在灵芝EPS的生物合成及其相关活力的研究表明,乳糖可促进灵芝菌体生长和EPS合成。在灰树花液体深层发酵过程中,Hsieh等[16-17]添加橄榄油、植物油,Cheng Huabing等[18]添加适量聚乙二醇,侯晓梅等[19]添加适量的白花蛇草、薏苡仁、连翘、黄芪等中药,赵亮等[20]添加山药、苦荞均可以促进灰树花细胞生长和EPS的生物合成。
本课题组承担了国家自然科学基金项目“天麻提取物有效成分对灰树花发酵的代谢影响及机理研究”课题,前期研究结果表明,在灰树花液体发酵体系中添加天麻提取物可显著促进灰树花细胞生长和EPS的生物合成[21-25]。但是并不确定这种促进作用主要是灰树花利用了哪种或者哪几种天麻主要成分所产生的结果。因此,本实验在灰树花发酵体系中添加几种不同质量浓度梯度的天麻主要成分(包括天麻素(gastrodin,GA)、对羟基苯甲醇(p-hydroxybenzyl alcohol,HA)及对羟基苯甲醛(p-hydroxylbenzaldehyde,HBA)),分析灰树花利用这些成分促进菌体生长和EPS合成的情况,并与添加天麻醇提取物实验组作比较,进一步分析单一天麻成分对灰树花EPS合成的促进作用是否高于天麻醇提取物。传统中药中有效成分不清楚、作用机理不明确等原因是阻碍中药现代化发展的关键,科学地阐述中药成分对微生物发酵的影响,能有效避免传统中药制品“大、黑、多”的缺点。通过本研究可探明天麻醇提取物中对灰树花EPS合成增效贡献力最大的成分,阐明作用机理,从而有效避免中药天麻的大量使用。
1 材料与方法
1.1 菌株与试剂
灰树花菌株5.404 中国普通微生物菌种保藏管理中心。
天麻 贵州省德江县基地;天麻素、对羟基苯甲醇和对羟基苯甲醛 美国Sigma公司;葡萄糖 天津市大茂化学试剂厂;蛋白胨 上海盛思生化科技有限公司;KH2PO4天津市福晨化学试剂厂;MgSO4g7H2O 天津市瑞金特化学品有限公司;无水乙醇 成都金山化学试剂有限公司;其余均为分析纯。
1.2 仪器与设备
CP114电子天平 奥豪斯仪器(上海)有限公司;GZX-9070 MBE数显鼓风干燥箱、BXM-30R立式灭菌锅上海博讯实业有限公司医疗设备厂;TG2-16G低速离心机 上海安亭科学仪器厂;SW-CJ-1D净化工作台苏州净化设备有限公司;Molecular Devices SPECTRA MAX 190酶标仪 昆明纳瑞科技有限公司;Agilent 1100高效液相色谱仪及检测器、UF-C18色谱柱 美国Agilent公司。
1.3 培养基
PDA培养基:马铃薯200 g/L(切成1 cm3大小,沸水煮30 min后过滤取滤液)、葡萄糖20 g/L、蛋白胨2 g/L、琼脂20 g/L、KH2PO42 g/L、MgSO4·7H2O 2 g/L,pH值自然。
液体种子培养基:葡萄糖30 g/L、蛋白胨2 g/L、酵母膏6 g/L、KH2PO40.5 g/L、MgSO4·7H2O 0.5 g/L,pH值自然。
发酵培养基:葡萄糖50 g/L、蛋白胨5 g/L、酵母膏6 g/L、KH2PO42 g/L、MgSO4·7H2O 2 g/L,pH值自然。
1.4 培养方法
1.4.1 斜面种子培养
于母种试管中切取黄豆粒大小的菌丝块接于PDA斜面中部,置于25 ℃恒温培养箱中,培养至菌丝长满整个斜面。
1.4.2 液体种子培养
将培养好的斜面菌种用接种扒切取蚕豆大小颗粒,接种于液体种子培养基中,一支PDA斜面接种一瓶。250 mL三角锥形瓶装液量100 mL、25 ℃、150 r/min摇床培养4~7 d,三角锥形瓶中应长出大量细小、均匀的菌丝球且菌液清亮为佳。
1.4.3 发酵培养
按5%的接种量接种,用移液枪量取液体种子,接种于发酵培养基中。250 mL三角锥形瓶装液量为100 mL、25 ℃、150 r/min、摇床培养时间根据需要设定。
1.5 天麻醇提取液制备
天麻经洗净、蒸煮、55 ℃烘干、粉碎,过80 目后备用。称取50 g的天麻,加1 000 mL体积分数75%乙醇浸提48 h,过滤,减压蒸去乙醇,再加50 mL的蒸馏水重溶,过滤,即1 g天麻可得1 mL的醇提液,醇提液用于灰树花液体培养。
1.6 分析方法
1.6.1 生物量的测定[24]
灰树花菌体生长以其生物量为指标。将发酵液滤纸过滤,蒸馏水冲洗菌丝体3 次,于60 ℃数显鼓风干燥箱中烘干至恒质量,称质量即得菌丝体生物量。
1.6.2 EPS产量测定[21]
取一定量发酵上清液,加入7 倍75%乙醇,于冰箱中静置24 h,于4 000 r/min离心15 min,除去上清液后,用75%乙醇清洗沉淀3 次,然后将沉淀在60 ℃条件下烘干,加水溶解,采用苯酚-硫酸法[26]测定胞外多糖含量。
1.6.3 高效液相色谱法(high performance liquid chromatography,HPLC)检测条件[3]
色谱柱为Agilent TC-C18(4.6 mmh250 mm,5 μm);流动相A:1 g/L磷酸-水,流动相B:乙腈,梯度洗脱:0~35 min,3%~30%(V/V)乙腈;35~45 min,30%~70%乙腈。流速1 mL/min,柱温30 ℃,检测波长221 nm。
1.7 统计方法
所有的实验数据均使用SPSS 17.0软件分析显著性,用Origin 8.0软件做图表。
2 结果与分析
2.1 不同体积分数的天麻醇提取物对灰树花生物量和EPS产量的影响
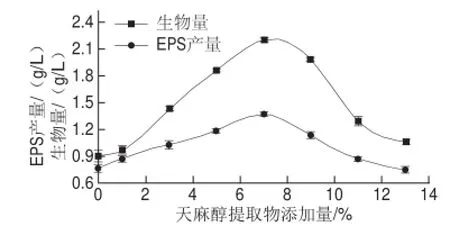
图1 天麻醇提取物对灰树花发酵液中生物量和EPS产量的影响Fig.1 Effect of addition of different amounts of R. gastrodiae extract on biomass and EPS production by Grifola frondosa in submerged culture
在灰树花发酵体系中添加不同体积分数天麻醇提取物,发酵9 d后生物量和EPS产量如图1所示,随天麻醇提取物体积分数的增加,灰树花生物量和EPS产量先增加至最大量后降低,这可能是因为高体积分数的天麻提取物对灰树花生长具有一定的抑制作用进而使EPS产量有所降低,此结果与贺宗毅[24]和Wang Na[21]等的一致。当天麻醇提取物添加量为7%时,灰树花生物量和EPS产量分别达最大值(2.196f0.034) g/L和(1.365f0.018) g/L,与空白组(不加天麻)相比,分别增加了110.1%和78.5%。基于前期研究,认为天麻醇提取物中必定存在某种或某几种可促进灰树花菌体生长和EPS生物合成的成分。因此,添加7%天麻醇提取物作为后期实验的实验组。
2.2 天麻醇提取物成分分析

表1 HPLC法测定天麻醇提取物中3 种成分的含量Table 1 Determination of three ingredients from 75%ethanol extract of R. gastrodiae by HPLC
由表1可知,天麻醇提取物灭菌后天麻素、对羟基苯甲醇和对羟基苯甲醛的含量分别增加了128.90%、21.12%和15.36%。由于灰树花液体发酵培养需经过高压灭菌,因此以灭菌后天麻醇提取物中天麻素、对羟基苯甲醇和对羟基苯甲醛的含量进行实验。
2.3 7%天麻醇提取物和3 种天麻成分对灰树花发酵液中生物量和EPS产量影响的比较

图2 天麻醇提取物和3 种天麻成分对灰树花发酵液中生物量和EPS产量影响的比较Fig.2 Comparative effect of addition of 7% of R. gastrodiae extract, GA, HA and HBA on biomass and EPS production by Grifola frondosa in submerged culture
以灭菌后7%天麻醇提取物中所含天麻素、对羟基苯甲醇和对羟基苯甲醛进行实验,并与7%天麻醇提取物作比较,分析对灰树花发酵液中生物量和EPS产量的促进作用。在灰树花发酵液中分别添加0.383 g/L的天麻素、0.685 g/L对羟基苯甲醇、0.106 g/L对羟基苯甲醛和7%天麻醇提取物,发酵9 d后各实验组生物量和EPS产量如图2所示。天麻实验组的生物量和EPS产量最高并且显著高于空白组、GA、HA实验组,其次是HBA实验组,其余3 个实验组的产量相差不大。单独添加3 种天麻成分中,对羟基苯甲醛促进灰树花生物量和EPS产量的效果最佳,但这种促进作用仍低于天麻醇提取物,这很可能是由于所添加的3 种成分的质量浓度过小或者过大,并且对羟基苯甲醛可能是天麻醇提取物中促进灰树花EPS生物合成贡献力最大的成分。
2.4 3 种天麻成分对灰树花发酵液中EPS合成的影响

图3 3 种天麻成分对灰树花发酵液中EPS合成的影响Fig.3 Comparative effect of addition of different amounts of GA, HA and HBA on EPS production by Grifola frondosa in submerged culture
为了分析这3 种天麻成分对灰树花EPS生物合成的影响和确定最佳添加量,在灰树花液体发酵体系中分别添加0.02~0.35 g/L的天麻素、对羟基苯甲醇和对羟基苯甲醛,发酵9 d后灰树花EPS结果如图3所示。EPS产量随3 种添加物质量浓度的增大先增加至最大值后降低,对羟基苯甲醛添加量在0.05~0.25 g/L时的EPS产量均高于其他实验组。此外,与空白组(不加添加物)相比,天麻素质量浓度为0.25~0.35 g/L、对羟基苯甲醇质量浓度为0.15~0.30 g/L和对羟基苯甲醛质量浓度为0.05~0.30 g/L时均能显著促进灰树花EPS的生物合成(P<0.05),其中对羟基苯甲醛添加量为0.15 g/L时对灰树花EPS合成的促进作用效果最佳,EPS达最大值(2.251 1f0.037 8) g/L,增加了40.53%。因此,在所添加的这3 种天麻成分中,对羟基苯甲醛对灰树花EPS生物合成的促进作用最大。这种促进作用是高于还是等于天麻醇提取物,后期实验将进一步说明,后期实验以0.15 g/L对羟基苯甲醛为实验组。
2.5 7%天麻醇提取物和对羟基苯甲醛对EPS合成的比较
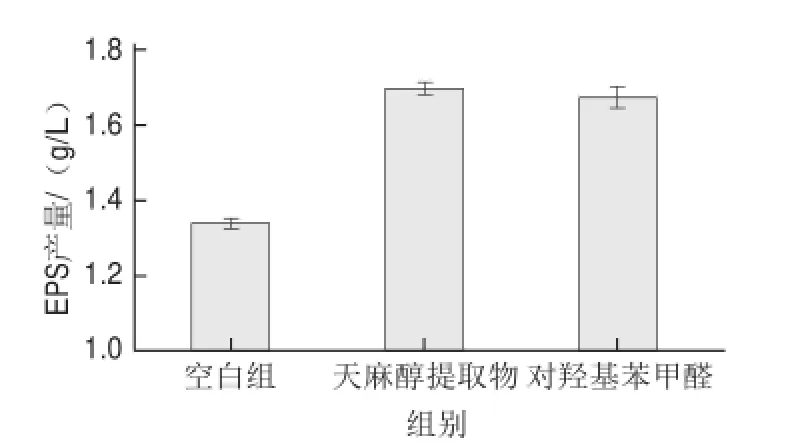
图4 0.15 g/L对羟基苯甲醛和7%天麻醇提取物对EPS合成的比较Fig.4 Comparative effect of addition of 0.15 g/L HBA and 7% R. gastrodiae extract on EPS production
由图4可知,对羟基苯甲醛和7%天麻醇提取物的EPS产量几乎一样,分别为1.674 4 g/L和1.696 8 g/L,并且均显著高于空白组的1.340 5 g/L(P<0.05)。因此,对羟基苯甲醛对灰树花EPS生物合成的促进作用与7%天麻醇提取物的基本一样。
2.6 灰树花液体发酵过程中7%天麻醇提取物和对羟基苯甲醛对生物量和EPS合成影响的动态变化

图5 天麻醇提取物和对羟基苯甲醛对灰树花发酵过程中EPS产量(a)和生物量(b)影响的比较Fig.5 Comparative effect of addition of 0.15 g/L HBA and 7% R. gastrodiae extract on dynamic curves of biomass (b) and EPS production (a) during fermentation
由图5可知,在整个发酵过程中,3 个组的生物量和EPS产量逐渐增加至最大值后趋于稳定。在发酵的0~5 d内,3 个组的生物量和EPS产量很低并且基本一样;在发酵5~13 d,对羟基苯甲醛和天麻醇提取物的生物量和EPS产量分别快速增加至发酵第9天和第11天后趋于稳定,并且两实验组的生物量和EPS产量基本一样,空白组生物量和EPS产量分别发酵至第7天和第9天后基本不再增加。这说明发酵第5天开始,灰树花大量吸收营养物质和天麻成分来促进自身菌体生长和EPS的生物合成。此外,发酵第7天后,对羟基苯甲醛和7%天麻醇提取物的生物量和EPS产量均显著高于空白组(P<0.05)。再一次说明对羟基苯甲醛和7%天麻醇提取物可显著促进灰树花菌体生长和EPS的生物合成。
2.7 灰树花液体发酵过程中对羟基苯甲醛吸收利用情况与生物量和EPS产量间的关系
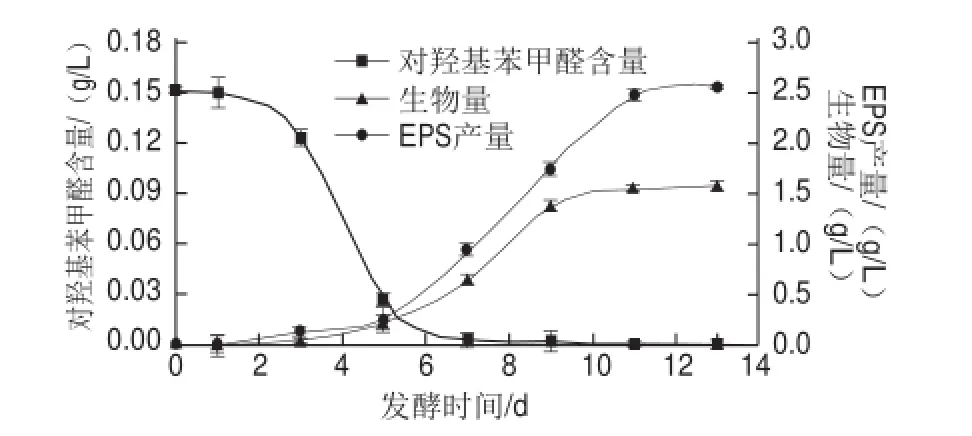
图6 灰树花液体发酵过程中对羟基苯甲醛吸收利用情况与生物量和EPS产量间的关系Fig.6 Relationship between HBA utilization and either biomass or EPS production during fermentation
图6为对羟基苯甲醛添加量为0.15 g/L时,灰树花发酵液中对羟基苯甲醛含量、生物量和EPS产量随发酵时间的动态变化情况,对羟基苯甲醛含量从发酵第3天开始大幅度减少至发酵第7天基本为零,而从发酵第5天开始,灰树花生物量和EPS产量开始大量积累。这再次说明发酵第5天后,对羟基苯甲醛被灰树花大量吸收用以促进菌体生长和EPS生物合成。
3 结 论
在灰树花深层发酵体系中,添加适宜质量浓度的天麻成分(包括天麻素、对羟基苯甲醇和对羟基苯甲醛)均能促进灰树花菌体的生长和胞外多糖的生物合成,其中对羟基苯甲醛添加量为0.15 g/L时对灰树花EPS合成的促进作用效果最佳,并且略低于7%天麻醇提取物。因此,灰树花可利用对羟基苯甲醛来促进EPS的生物合成,对羟基苯甲醛是对灰树花EPS产量增效作用最大的天麻成分。EPS合成酶是菌体分泌的一种诱导EPS产生的一类酶的总称。王琼[27]和张清丽[28]等的研究认为α-磷酸葡萄糖变位酶(α-phosphoglucomutase,α-PGM)、磷酸葡萄糖异构酶(phosphoglucose isomerase,PGI)、尿苷二磷酸葡萄糖焦磷酸化酶(UDP-glucose pyrophosphorylase)、腺苷二磷酸葡萄糖焦磷酸化酶(dTDP-glucose pyrophosphorylase)等是EPS合成的关键酶。Xu Xiaobao等[22]的研究表明天麻提取物可提高α-PGM酶活力。本研究中对羟基苯甲醛对灰树花EPS生物合成的促进作用与天麻醇提取物的基本一样。这可能是在提高EPS合成的关键酶酶活力方面,对羟基苯甲醛的效果与天麻提取物基本一样,但是二者具体提高哪种或者哪几种EPS合成酶酶活力尚不清楚,需要作进一步研究。
[1] 徐鸿华. 中草药彩图手册(二)[M]. 广州: 广东科技出版社, 2003: 43.
[2] PYO M K, JIN J L, KOO Y K, et al. Phenolic and furan type compounds isolated from Gastrodiae lata and their anti-platelet effects[J]. Archives of Pharmacal Research, 2004, 27: 381-385.
[3] 徐晓宝, 吴天祥, 张勇, 等. 灰树花发酵过程天麻成分变化的HPLC检测方法研究[J]. 中国酿造, 2012, 31(5): 182-185.
[4] 王亚威, 李志峰, 何明珍, 等. 天麻化学成分研究[J]. 中草药, 2013, 44(21): 2974-2976.
[5] 段小花, 李资磊, 杨大松, 等. 昭通产天麻化学成分研究[J]. 中药材, 2013, 36(10): 1608-1611.
[6] SUZUKI I, HASHIMOTO K, OIKAWA S, et al. Anti-tumor and immunomodualting activities of a beta-glucan obtained from liquidcultured Grifola frondosa[J]. Chemical and Pharmaceutical Bulletin, 1989, 37: 410-413.
[7] GARY D, HONG L, ANDREW S, et al. A phase I/II trial of a polysaccharide extract from Grifola frondosa (Maitake mushroom) in breast cancer patients: immunological effects[J]. Journal of Cancer Research and Clinical Oncology, 2009, 135(9): 1215-1221. DOI:10.1007/s00432-009-0562-z.
[8] LEE B C, BAE J T, PYO H B, et al. Biological activities of the polysaccharides produced from submerged culture of the edible Basidiomycete Grifola frondosa[J]. Enzyme and Microbial Technology, 2003, 32(5): 574-581. DOI:10.1016/S0141-0229(03)00026-7.
[9] KODAMA N, KAKUNO T, NANBA H. Stimulation of the natural immune system in normal mice by polysaccharide from Maitake mushroom[J]. Mycoscience, 2003, 44(3): 257-261. DOI:10.1007/ s10267-003-0099-y.
[10] NANBA H, KODAMA N, DOUGLAS S, et al. Effects of Maitake (Grifola frondosa) glucan in HIV-infected patients[J]. Mycoscience, 2000, 41: 293-295. DOI:10.1007/BF02463941.
[11] LIN E S. Production of exopolysaccharides by submerged mycelial culture of Grifola frondosa TFRI1073 and their antioxidant and antiproliferative activities[J]. World Journal of Microbiology and Biotechnology, 2011, 27(3): 555-561. DOI:10.1007/s11274-010-0489-1.
[12] FAN Yina, WU Xiangyang, ZHANG Min, et al. Physical characteristics and antioxidant effect of polysaccharides extracted by boiling water and enzymolysis from Grifola frondosa[J]. International Journal of Biological Macromolecules, 2011, 48(5): 798-803. DOI:10.1016/j.ijbiomac.2011.03.013.
[13] 李雁群, 章克昌. 12味中药对灵芝菌液体培养的影响[J]. 食品与发酵工业, 2002, 29(3): 38-40. DOI:10.3321/j.issn:0253-990X.2003.03.009.
[14] LIU Gaoqiang, ZHANG Kechang. Enhancement of polysaccharides production in Ganoderma lucidum by the addition of ethyl acetate extracts from Eupolyphaga sinensis and Catharsius molossus[J]. Applied Microbiology and Biotechnology, 2007, 74: 572-577. DOI:10.1007/s00253-006-0709-7.
[15] TANG Yajie, ZHONG Jiangjiang. Exopolysaccharide biosynthesis and related enzyme activities of the medicinal fungus, Ganoderma lucidum, grown on lactose in a bioreactor[J]. Biotechnology Letters, 2002, 24: 1023-1026. DOI:10.1023/A:1015677313598.
[16] HSIEH Chienyan, LIU Chiajang, TSENG Meihua, et al. Effect of olive oil on the production of mycelial biomass and polysaccharides of Grifola frondosa under high oxygen concentration aeration[J]. Enzyme and Microbial Technology, 2006, 39(3): 434-439. DOI:10.1016/ j.enzmictec.2005.11.033.
[17] HSIEH Chienyan, WANG Huiliang, CHEN Chiencheng, et al. Effect of plant oil and surfactant on the production of mycelial biomass and polysaccharides in submerged culture of Grifola frondosa[J]. Biochemical Engineering Journal, 2007, 38(2): 198-205. DOI:10.1016/ j.bej.2007.07.001.
[18] CHEN Huabing, HUANG Hungchang. The use of additives as the stimulator on mycelial biomass and exopolysaccharide productions in sub- merged culture of Grifola umbellate[J]. Bioprocess and Biosystems Engineering, 2010, 33: 401-406. DOI:10.1007/s00449-009-0338-5.
[19] 侯晓梅, 陈敏青, 张慧蕾, 等. 中药提取物对灰树花深层发酵的影响[J].食品科技, 2013, 38(9): 185-188.
[20] 赵亮, 张大为, 吴天祥. 山药、苦荞对灰树花深层发酵产胞外多糖的影响[J]. 酿酒科技, 2008(1): 85-87. DOI:10.3969/ j.issn.1002-8110.2008.01.035.
[21] WANG Na, WU Tianxiang, ZHANG Yong, et al. Experimental analysis on the effect of addition of Rhizoma gastrodiae on mycelia and exopolysaccharide productions by submerged culture of Grifola frondosa[J]. African Journal of Biotechnology, 2012, 11(20): 4666-4672. DOI:10.5897/AJB12.195.
[22] XU Xiaobao, WU Tianxiang, WANG Feng. The effect of exopolysaccharide biosynthesis and related enzyme activities of Grifola frondosa by the addition of ethanol extracts from traditional Chinese medicine, Gastrodia tuber[J]. African Journal of Biotechnology, 2012, 11(15): 3656-3662. DOI:10.5897/AJB11.3744.
[23] ZHANG Yong, WANG Na, WU Tianxiang. Effect of the extracts from Gastrodia elata BL. on mycelial growth and polysaccharide biosynthesis by Grifola frondosa[J]. African Journal of Microbiology Research, 2012, 6(2): 379-384. DOI:10.5897/AJMR11.1151.
[24] 贺宗毅, 吴天祥, 徐晓宝. 中药天麻成分对灰树花胞外多糖合成及相关关键酶的影响[J]. 食品科学, 2013, 34(11): 199-202. DOI:10.7506/spkx1002-6630-201311043.
[25] 张勇, 吴天祥. 天麻提取物的制备及其对灰树花发酵的影响[J]. 食品与机械, 2012, 28(1): 150-153. DOI:10.3969/ j.issn.1003-5788.2012.01.040.
[26] DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry, 1956, 28: 350-356.
[27] 王琼. 灵芝菌丝体培养中多糖组分的变化与相关酶活性分析[D]. 无锡: 江南大学, 2013.
[28] 张清丽. 酪蛋白活性肽对乳酸菌生长代谢及酸乳发酵影响的研究[D].广州: 华南理工大学, 2011.
Effect of p-Hydroxylbenzaldehyde and Other Main Ingredients of Rhizoma gastrodiae on the Biosynthesis of Exopolysaccharide by Grifola frondosa in Submerged Culture
WU Caiyun1, WU Tianxiang1,2,*, ZHU Junjie1, LIU Xin1, ZHAO Qunli1
(1. School of Liquor and Food Engineering, Guizhou University, Guiyang 550025, China; 2. Research Center of Food Science and Engineering, Guizhou University, Guiyang 550025, China)
To test the stimulatory effects of three ingredients of Rhizoma gastrodiae on the biosynthesis of exopolysaccharide (EPS) by Grifola frondosa in submerged culture, gastrodin (GA), p-hydroxybenzyl alcohol (HA) and p-hydroxylbenzaldehyde (HBA) were separately added at various concentrations into the culture medium. The EPS concentration in the culture supernatant was determined by phenol-sulphuric acid assay. The results showed that all three additives had an effective stimulatory effect on mycelial growth and EPS production. Among them, the addition of p-hydroxylbenzaldehyde at 0.15 g/L exhibited the best effect, although slightly inferior to 7% (V/V) of the 75% ethanol extract of R. gastrodiae. Furthermore, kinetic analysis suggested that the EPS production curves with 0.15 g/L p-hydroxybenzaldehyde and 7% (V/V) of the R. gastrodiae extract over the entire fermentation process were substantially same, producing significantly more EPS than the blank group from the 7thday onwards (P < 0.05). As determined by high performance liquid chromatography (HPLC), dynamic changes in the concentration of p-hydroxylbenzaldehyde during the fermentation process showed that on the 5thday, p-hydroxylbenzaldehyde was completely absorbed and EPS began to accumulate in large quantity. Therefore, Grifola frondosa could utilize p-hydroxylbenzaldehyde to promote the biosynthesis of EPS.
p-hydroxylbenzaldehyde; ingredients of Rhizoma gastrodiae; Grifola frondosa; exopolysaccharide
10.7506/spkx1002-6630-201607016
Q936
A
1002-6630(2016)07-0083-05
吴彩云, 吴天祥, 朱俊杰, 等. 对羟基苯甲醛等3 种天麻成分对灰树花胞外多糖生物合成的影响[J]. 食品科学, 2016, 37(7): 83-87. DOI:10.7506/spkx1002-6630-201607016. http://www.spkx.net.cn
WU Caiyun, WU Tianxiang, ZHU Junjie, et al. Effect of p-hydroxylbenzaldehyde and other main ingredients of Rhizoma gastrodiae on the biosynthesis of exopolysaccharide by Grifola frondosa in submerged culture[J]. Food Science, 2016, 37(7): 83-87. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201607016. http://www.spkx.net.cn
2015-04-24
国家自然科学基金地区科学基金项目(31460537)
吴彩云(1990—),女,硕士研究生,研究方向为食品生物技术。E-mail:1749753070@qq.com
*通信作者:吴天祥(1965—),男,教授,博士,研究方向为发酵工程与生物转化。E-mail:ce.txwu@gzu.edu.cn

