封育对草地深层土壤碳储量及其固持速率的影响
李建平, 陈 婧, 谢应忠,2, 葸 杰
(1.宁夏大学 农学院, 银川 750021; 2.西北退化生态系统恢复与重建国家重点实验室培育基地,银川 750021; 3.固原市原州区草原工作站, 宁夏 固原 756000)
封育对草地深层土壤碳储量及其固持速率的影响
李建平1, 陈 婧1, 谢应忠1,2, 葸 杰3
(1.宁夏大学 农学院, 银川 750021; 2.西北退化生态系统恢复与重建国家重点实验室培育基地,银川 750021; 3.固原市原州区草原工作站, 宁夏 固原 756000)
为了揭示长期封育草地深层土壤碳、氮固持及固持速率,采用空间序列代替时间序列的方法,研究了黄土高原宁夏固原云雾山自然保护区长期封育草地土壤有机碳(SOC)、土壤全氮(STN)储量及其固持速率的变化特征。结果表明封育30年草地0—500 cm各土层SOC储量显著高于封育10年草地和放牧草地,封育10年草地不同深度SOC储量与放牧草地并无差异;封育30年、10年和放牧草地STN储量在各土层无统计学上的差异,而封育30年不同深度STN储量显著高于封育10年和放牧草地;封育30年SOC,STN固持主要发生在10~30年间,0—500 cm固持量分别为(482.5±39.3) Mg/hm2,(27.7±2.4) Mg/hm2,封育前10年有机碳、全氮固持量小,分别为(42.8±6) Mg/hm2,(3.4±2.1) Mg/hm2;封育30年0—500 cm土层SOC和STN固持分别为(525.3±62.0) Mg/hm2,(25.0±3.0) Mg/hm2,固持速率分别为(17.5±2.1) Mg/(hm2·a),(0.83±0.3) Mg/(hm2·a);碳氮比随着封育年限增加而增大,随土层深度增加而降低。封育草地深层土壤有巨大固碳潜力,评估碳氮固持不仅要时间尺度,也要考虑深层土壤碳氮固持,以达到对生态系统碳氮储量评估的无偏估计。
有机碳储量; 有机碳固持; 碳固持速率; 碳氮比; 封育草地
草地是世界上分布最广的植被类型之一,也是目前受人类活动影响最为严重的区域,作为陆地生态系统的重要组成部分[1],覆盖了全球陆地面积的26%,参与了全球碳氮源/汇及其循环过程,在区域和全球气候变化和碳氮循环中扮演着重要的角色[2-3]。草地是中国主要陆地生态类型,占陆地面积的40%以上[4],草地90%的碳和氮贮存于土壤中,土壤有机碳(SOC)、全氮(TN)含量与分布对地表覆盖变化、大气组成及气候变化有着重要的影响[5-8]。土壤有机质和全氮含量及其动态平衡是评价土壤质量和草地健康的重要指标,直接影响着草地土壤肥力和草地生产力[9-10]。由于人类不合理的开发利用,中国约有90%草地处于不同退化之中[11],尤其以西北黄土高原温性草地退化更为严重。2000年以来,国家实施了各种保护草原的重大工程措施,其中封育是目前最为直接和有效修复退化草地的方法。封育不仅有利于草地植被恢复[11-15],而且改变着草地土壤的物理结构[16]与养分组成[17]。草地生态系统中,碳、氮循环密切相关,它们在相互作用和相互影响的过程中发生着复杂的变化[18],研究草地碳氮循环耦合特征以及对气候变化和人类扰动响应关系到人类发展和全球变化[19-20]。研究表明长期封育能够显著提高草地碳氮贮量,0—40 cm土壤碳固持速率相对较高[21],土壤碳密度在封育30 a后仍呈增长态势[22],而且深层土壤有着巨大的碳固持[21-23],而对于深层土壤碳氮固持及固持速率研究较少,可能会导致草地土壤碳氮固持量偏小和碳汇丢失等问题。
由于缺乏长时间尺度的研究/监测数据和深层土壤空间数据信息,科学家很难准确地评估长期围封对草地碳贮量和碳固持速率的影响,对于草地碳氮生态评估很难做出无偏估计。因此,本文采用同一生态类型不同封育年限草地的空间数据代替时间序列,以放牧草地为对照,分析长期封育对温带典型草地深层(0—500 cm)土壤碳氮储量的影响,探讨不同封育阶段草地土壤碳氮固持及其固持速率。
1 试验样地与方法
1.1 试验样地
试验样地位于宁夏固原东北部45 km处的云雾山草原,处于黄土高原腹地,本区处于温带半干旱气候区,具有典型的半干旱气候特征,植被类型为典型草原。地理范围为东经106°21′—106°27′,北纬36°10′—36°17′,海拔1 700~2 148 m,年平均气温7℃,年平均降水量425 mm(1980—2014年平均值),60%~75%的降水集中分布于7—9月,土壤类型以山地灰褐土和黑垆土为主,水资源补给主要来源于大气降水。主要优势植物有长芒草(Stipabungeana)、大针茅(Stipagrandis)、百里香(Thymusmongolicus)、铁杆蒿(Artemisiasacrorum)、星毛委陵菜(Potentillaacaulis)等[24]。自20世纪80年代至今,实行了数批严格的封山禁牧措施,具有典型的封育年限梯度。本研究在云雾山自然保护区缓冲区和核心区分别选取封育10 a和30 a样地各3块,在农户居住区选取天然放牧草地3块,样地信息见表1。
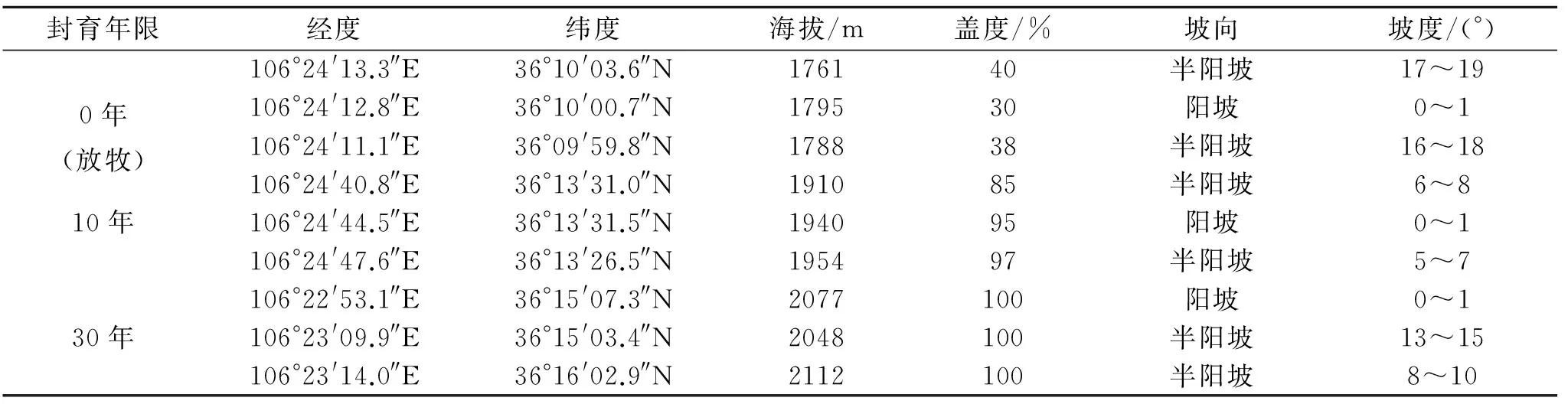
表1 试验样地信息
注:封育年限以2014年为基准,由固原市原州区草原管理站提供,封育年限会有1~2 a误差。
1.2 野外取样
每块样地间隔10 m设置一个1 m×1 m样方(每个样地共3个样方),每个样方土壤样品采样深度均为0—500 cm,每个样方中重复3次取样,其中0—40 cm土层分0—10—20—30—40 cm共4层依次取样,40—500 cm,每20 cm为1层,共计27层,本文采用各层数据累加计算1—40—100—200—300—400—500 cm土层SOC和STN储量,将取好的样品按层分装在自封袋中,并用标签写好样地号,带回实验室备用。其次,去除混入的凋落物和根系后,将土样用风干后过2 mm筛备用。最后,将每个样地对应土层土壤样品混合,构成1个土壤样品,即不同封育年限土壤样品重复3次,进行土壤SOC,TN等土壤理化性质测定。土壤容重采用根钻(直径6 cm)和“环刀钻”交替使用的方式采集。SOC含量采用重铬酸钾容量法测量,STN采用半微量凯氏蒸馏法测量[25]。本文土层指0—40 cm,40—100 cm,100—200 cm,200—300 cm,300—400 cm和400—500 cm,不同土层深度指0—40 cm,0—100 cm,0—200 cm,0—300 cm,0—400 cm和0—500 cm。
1.3 数据分析与处理
SOC储量可以根据一定土层厚度中土壤的SOC含量和土壤容重计算。通常,去除所采土壤中直径>2 mm 的土壤颗粒后,测定土壤容重和SOC含量,然后,通过以下公式计算土壤碳储量(Cs)[26]:
(1)
式中:Cs为土壤有机碳储量(Mg/hm2);BD为土壤容重(g/cm3),SOC为土壤有机碳含量(g/kg);D为土层厚度(cm),由于样地土壤中几乎无砾石,所以式中略去砾石含量参数。总体土壤碳氮储量,将各层碳氮储量累加。土壤碳固持封育后土壤碳储量与放牧草地土壤碳储量差值。
SOC固持速率的估算根据不同封育年限土壤SOC储量的变化量(SOC固持)进行估算。本研究把过度放牧(封育0 a)SOC储量作为基准值来计算封育后SOC储量的变化率。首先计算封育后土壤SOC储量(Mg/hm2):
ΔCs=CXyear-C0
(2)
式中:CXyear为草地封育后各阶段的土壤SOC储量(Mg/hm2);C0为初始土壤有机碳储量,即过度放牧草地土壤有机碳储量(Mg/hm2),以ΔCs为因变量,以封育年限为自变量,建立一元线性模型:
ΔCs=f(ΔAge)=y0+k×ΔAge
(3)
式中:k为土壤固定有机碳速率[Mg/(hm2·a)];ΔAge恢复年限;y0为常数;ΔCs对ΔAge求一阶导数,可求出k值
(4)
式中:SOC固持计算,封育10 a的SOC固持为封育10 a草地SOC储量与放牧草地SOC储量之差,封育10~30 a草地SOC固持为封育30 a与封育10 a草地SOC储量之差,封育30草地SOC固持为封育30 a与放牧草地SOC储量之差。
土壤全氮储量Ns(Mg/hm2)参照公式(1),将SOC变为土壤TN(g/kg)即可,土壤氮固持速率kn参照公式(2,3,4),将Cs变为Ns(Mg/hm2)即可。采用SAS 9.1.3软件对数据进行差异性分析,利用Origin 9.0作图。
2 结果与分析
2.1 土壤碳储量变化
试验表明,长期封育显著提高了0—500 cm各土层SOC储量。封育30 a草地0—40 cm土层SOC储量为177.5 Mg/hm2,显著高于封育10 a草地SOC储量(p<0.05)和放牧草地SOC储量(p<0.01);封育10 a草地0—40 cm土壤有机碳储量为114.2 Mg/hm2,与放牧草地土壤有机碳储量无差异(p>0.05)(图1A)。在40—100 cm土层,封育30 a草地SOC储量显著高于封育10 a和放牧草地(p<0.01),封育10 a的SOC储量为100.9 Mg/hm2,放牧草地SOC储量57.2 Mg/hm2(图1B)。在100—200 cm和200—300 cm层,封育30 a草地的SOC储量均显著高于封育10 a和放牧草地(p<0.01),而封育10 a和放牧草地有机碳储量无差异(图1C,1D)。图1E所示,在300—400 cm土层,封育30 a草地与放牧草地SOC储量无差异,而与封育10 a草地差异极其显著(p<0.01),封育10 a与放牧草地差异不显著(p>0.05)。在400—500 cm土层,封育30 a草地SOC储量为77.5 Mg/hm2,显著高于封育10 a和放牧草地,封育10 a草地与放牧草地在该土层SOC储量无显著差异(图1F)。封育30 a草地0—500 cm各土层SOC储量显著高于封育10 a土层(p<0.05),而封育10 a草地SOC储量与放牧草地并无统计学上的差异。
草地封育30 a后,0—100 cm,1—200 cm,0—300 cm,0—400 cm和0—500 cm草地SOC储量均显著高于封育10 a和放牧草地,但封育10 a SOC储量相对于放牧草地并未显著增加(图2)。在0—100 cm土层中,封育30 a草地SOC储量为380.0 Mg/hm2,封育10 a和放牧草地土壤碳储量分别为215.1 Mg/hm2,140.1 Mg/hm2(图2B)。在0—200 cm土壤中,封育30 a、10 a和放牧草地SOC储量分别为580.2,267.3,191.3 Mg/hm2,与0—100 cm土壤有机碳储量相比,封育30 a草地SOC增加了200.2 Mg/hm2,而封育10 a和放牧草地增加较小(图2B,C)。相对于0—200 cm土层土壤机碳储量,各封育年限在0—300 cm,0—400 cm和0—500 cm土壤有机碳储量都有增加,但增加相对较少(图2D,F)。
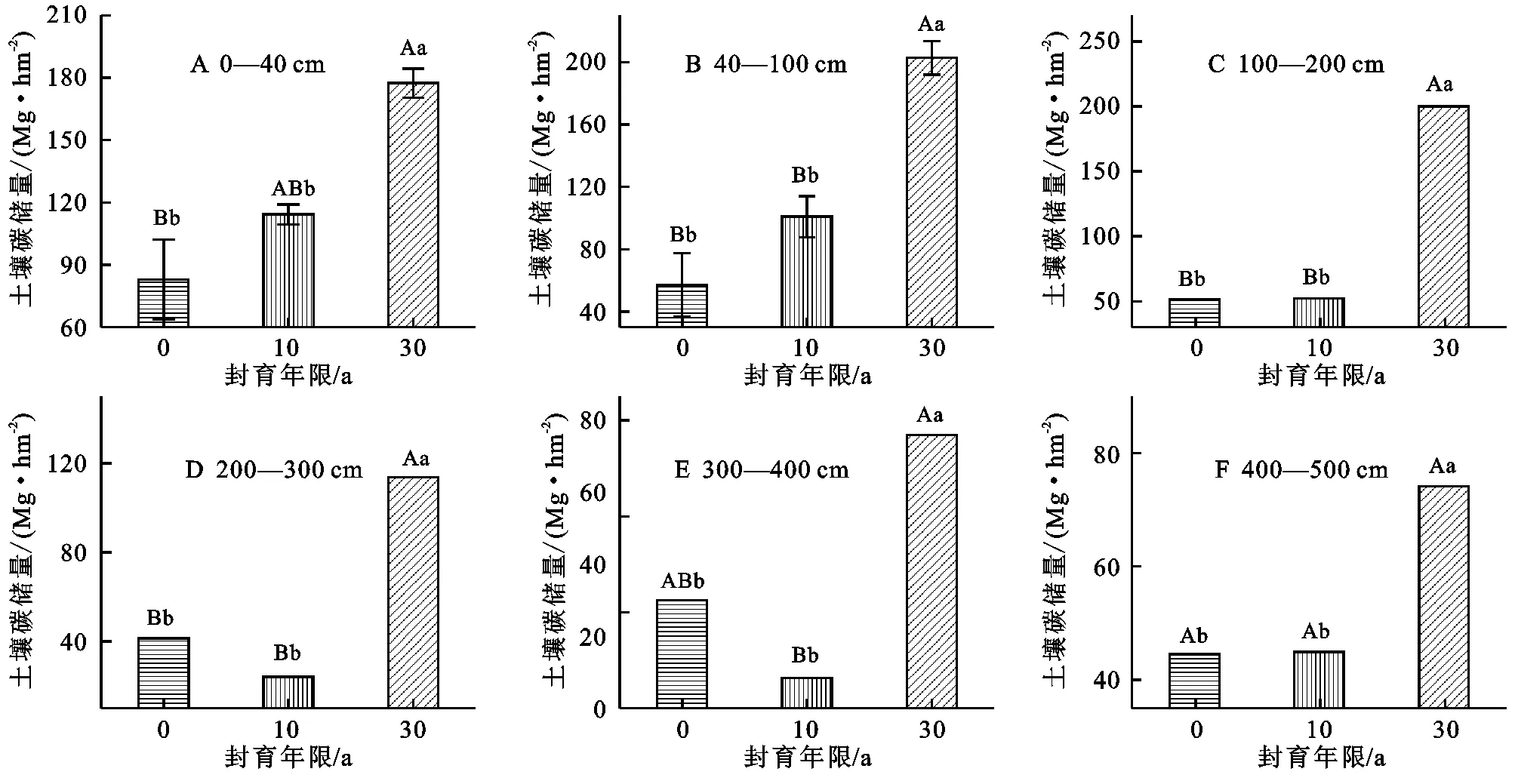
注:大写字母代表显著水平为0.01,小写字母代表显著水平为0.05,0年代表放牧草地。下图同。
图1 不同封育年限草地各土层土壤有机碳储量
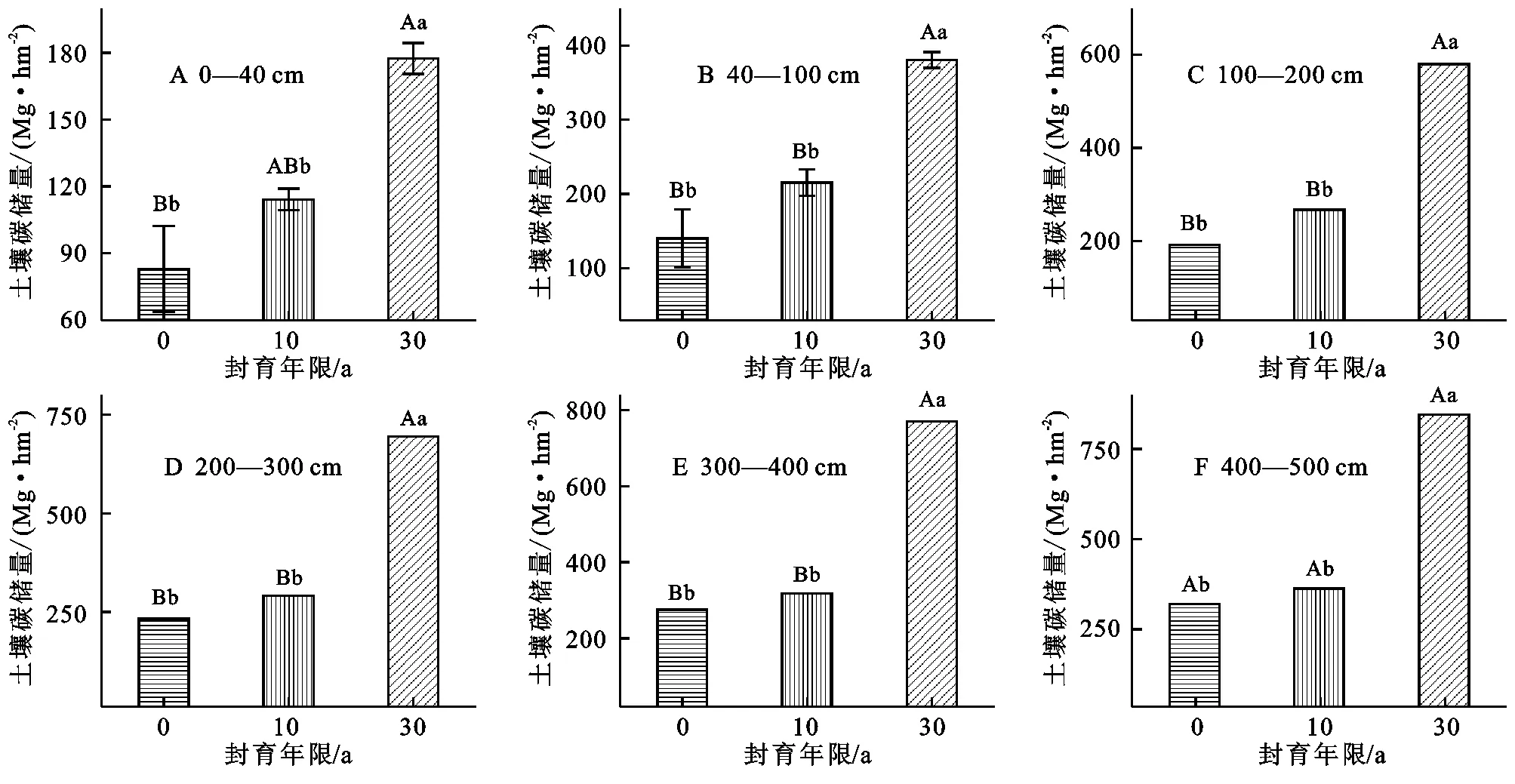
图2 不同封育年限土壤有机碳储量
2.2 土壤氮储量变化
随着封育年限的增加,0—500 cm各层STN储量都呈增加趋势,但是,封育30 a、10 a和放牧草地STN储量在0—40 cm,40—100 cm,100—200 cm,200—300 cm和400—500 cm土层均无统计学上的差异(p>0.05),在300—400 cm土层封育30 a草地STN储量显著高于封育10 a和放牧草地(p<0.05)(图3)。封育30 a、10 a和放牧草地STN储量在100 cm以下土层STN储量变化较小,分别约(17±1.5) Mg/hm2,(13±1.5) Mg/hm2,(12.5±1.0) Mg/hm2。
长期封育显著提高STN储量(图4)。在0—40 cm土壤中,草地封育30 a、10 a和放牧STN储量无差异(p>0.05);封育30 a草地在0—100 cm,0—200 cm,0—300 cm,0—400 cm和0—500 cm土壤中STN储量分别为(29±1) Mg/hm2,(48.9±2.8) Mg/hm2,(65.3±4.7) Mg/hm2,(83.0±5.8) Mg/hm2,(99.6±5.8) Mg/hm2,均显著高于封育10 a和放牧草地土壤氮储量(p<0.05)。封育10 a与放牧草地相比,各土层深度全氮储量均无显著变化(p>0.05)。
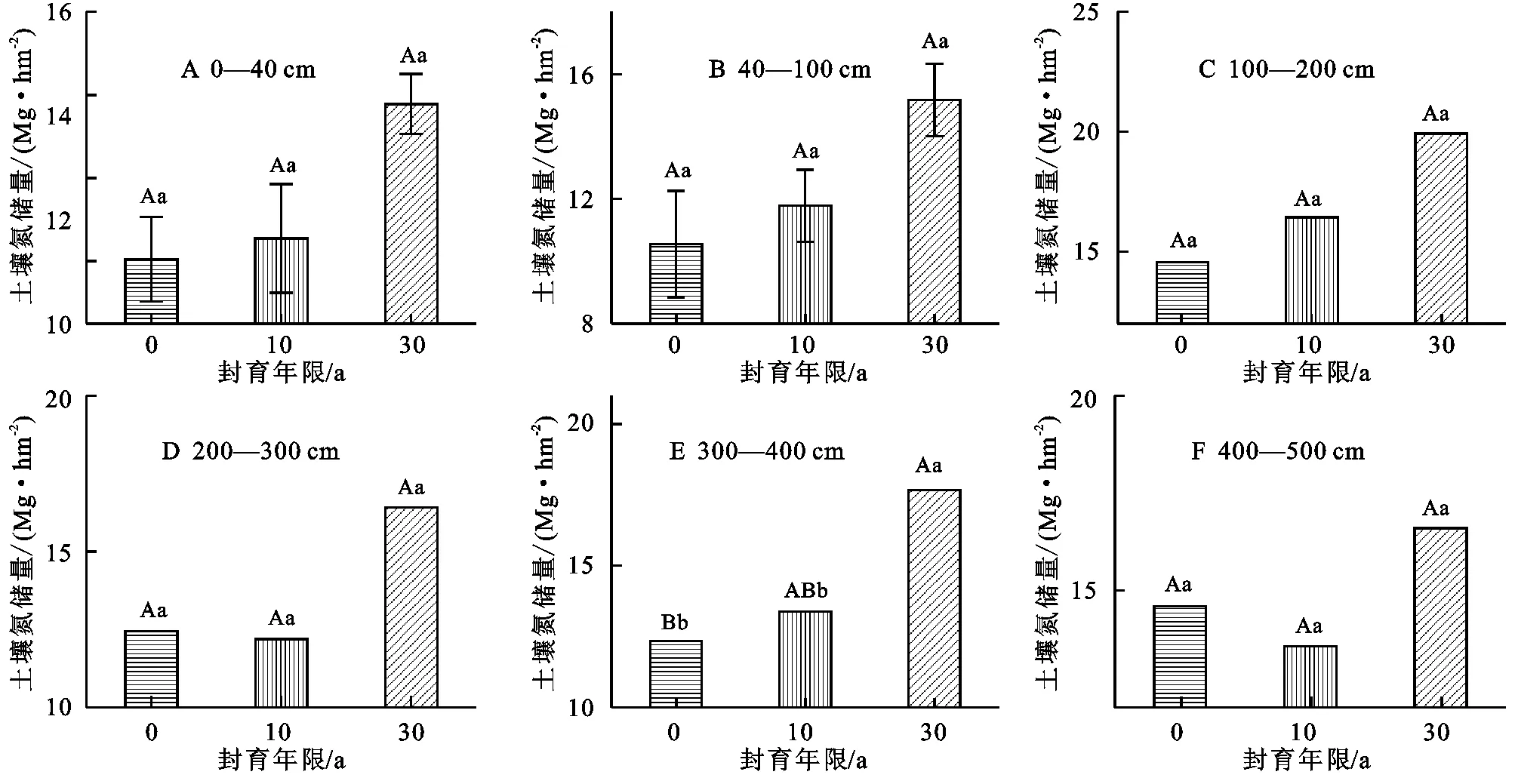
图3 不同封育年限草地各土层土壤全氮储量
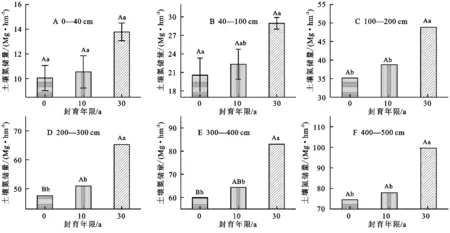
图4 不同封育年限土壤全氮储量
2.3 土壤碳氮固持速率变化
长期封育状态下,温带草地可固持大量SOC(表2)。封育10 a草地0—100 cm土层SOC持量为(75.1±6.5) Mg/hm2,平均SOC固持速率为(7.5±4.3) Mg/(hm2·a);在0—200 cm土壤中,SOC固持量为(76.0±6.7) Mg/hm2,平均SOC固持速率为(7.6±4.5) Mg/(hm2·a),碳固持速率最高;0—300 cm,0—400 cm和0—500 cm土壤中SOC固持及固持速率相对较低,表明放牧草地深层土壤有机碳在封育过程中充当碳源,封育10 a后,深层土壤有机碳储量变小。封育第10~30年期间,SOC固持及其固持速率明显高于封育前10 a,封育10~30 a草地0—100 cm土层深度SOC固持量为(165.1±9.9) Mg/hm2,平均SOC固持速率为(8.3±0.5) Mg/(hm2·a);随着土层深度的增加,SOC固持与SOC固持速率都显著增加,0—500 cm土层SOC固持与固持速率分别为(482.5±39.3) Mg/hm2,(24.1±2.0) Mg/(hm2·a)。封育30 a草地SOC固持总量0—100 cm为(240.1±44.9) Mg/hm2,仅为0—400 cm土壤碳固持的1/2,即深层土壤有巨大的碳固持潜力;封育30 a的SOC固持速率值介于封育10 a和封育10~20 a碳固持潜力,封育后SOC固持速率较高阶段为封育10~30 a间,封育前10 a土壤SOC固持速率相对较低;在0—200 cm土壤中,封育30 a草地SOC固持速率为(13.0±1.1) Mg/(hm2·a),0—500 cm土壤中SOC固持速率为(17.5±2.1) Mg/(hm2·a)。
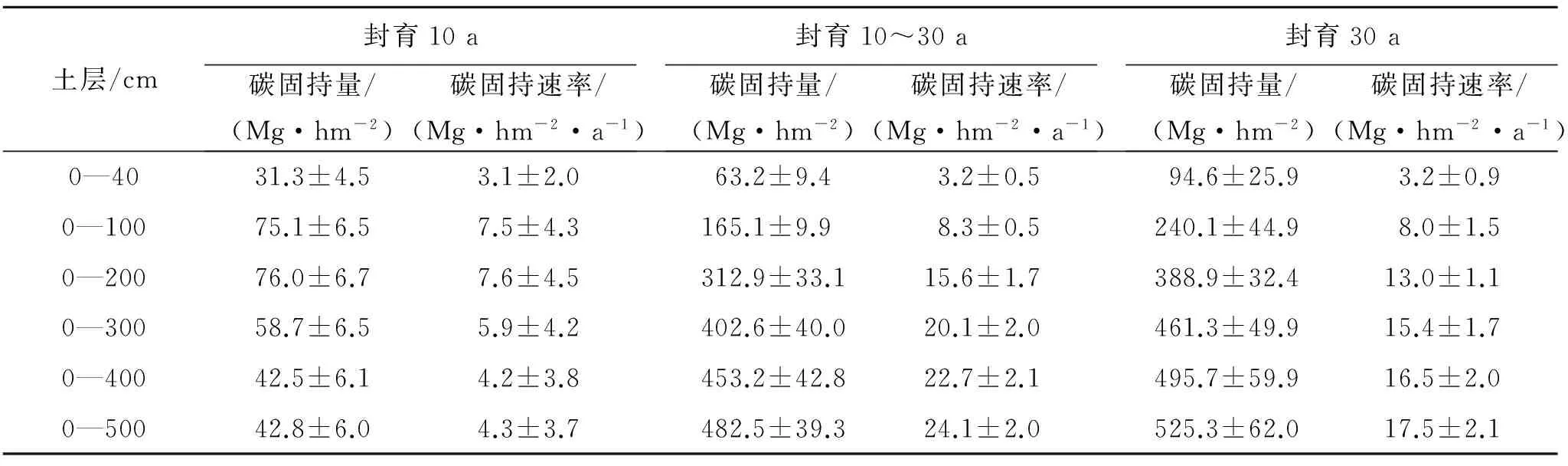
表2 不同封育阶段草地土壤有机碳固持与固持速率
研究表明,长期封育对于STN固持及固持速率有重要影响(表3),封育10 a草地0—100 cm STN固持为(1.7±0.7) Mg/hm2,平均STN固持速率为(0.09±0.03) Mg/(hm2·a);0—400 cm STN固持量为(4.4±2.3) Mg/hm2,平均STN固持速率为(0.22±0.26) Mg/(hm2·a),STN固持速率最高。封育第10—30 a期间,STN固持及其固持速率明显高于封育前10 a,0—100 cm草地STN固持量及其固持速率分别为(6.6±1.7) Mg/hm2,(0.33±0.15) Mg/(hm2·a);随着土层深度的增加,STN固持及其固持速率都显著增加,0—500 cm土壤TN固持及其固持速率分别为(21.7±2.4) Mg/hm2,(1.08±0.28) Mg/(hm2·a)。封育30 a草地0—100 cm STN固持总量为(8.4±1.8) Mg/hm2,仅为0—500 cm土壤STN固持的三分之一,即深层土壤有巨大的氮固持潜力;封育30 a的STN固持速率值大于封育10 a草地,小于封育10~20 a的STN固持速率,封育后STN固持速率较高阶段为封育10~30 a间,封育前10 a的STN固持速率相对较低;封育30 a草地0—200 cm 平均STN固持速率为(0.46±0.14) Mg/(hm2·a),0—500 cm平均STN固持速率为(0.83±0.3) Mg/(hm2·a)。
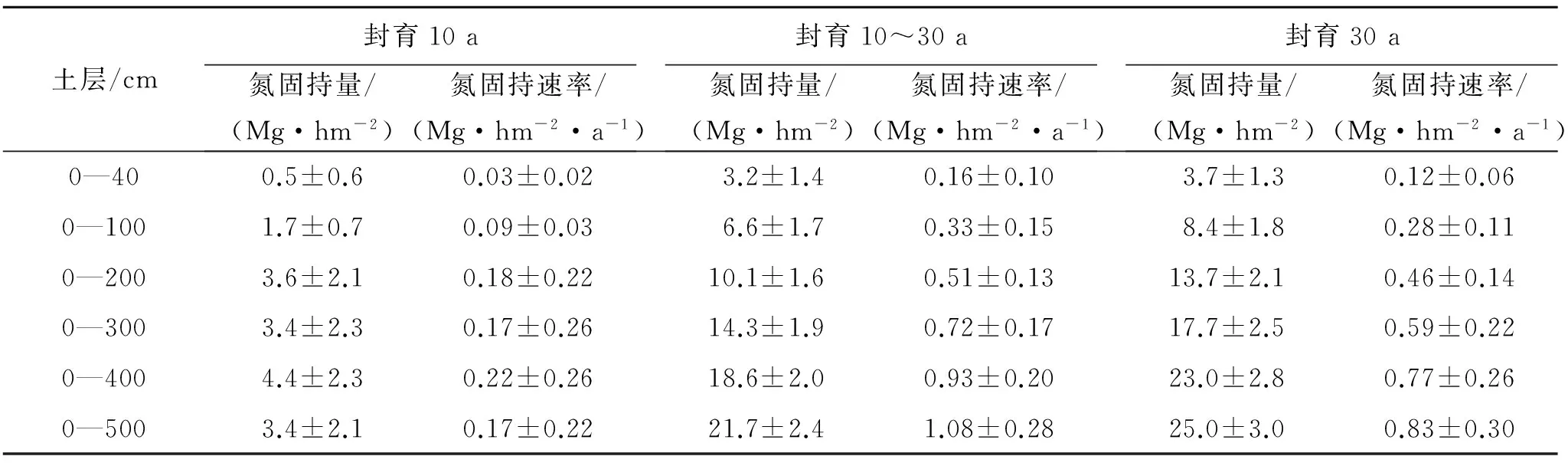
表3 不同封育阶段草地土壤全氮固持与固持速率
2.4 土壤碳氮比变化
土壤碳氮比随着封育年限增加和土层深度增加逐渐变大(图5),封育30 a草地碳氮比值在各土层深度均大于封育10 a草地和放牧草地,0—40 cm土壤碳氮比在封育30 a、10 a和放牧草地分别为13,11,8,在0—500 cm土壤碳氮比分别为51,27,22,表明在封育过程中土壤碳固持速率大于土壤氮固持速率。封育10 a草地和放牧草地碳氮比显著低于封育30 a草地(p<0.01),从而印证了封育10~30 a土壤有机碳固持速率明显高于全氮固持速率(表2,3)。随着土层深度的增加,深层土壤碳氮比值逐渐降低(图6),100—200 cm土层土壤碳氮比在封育30 a、10 a和放牧草地分别为10,3,3.5,土层深度大于100 cm各土层放牧草地碳氮比大于封育10 a草地,而小于封育30 a草地。300—500 cm土壤碳氮比在各封育年限和放牧草地基本相同,约为3。
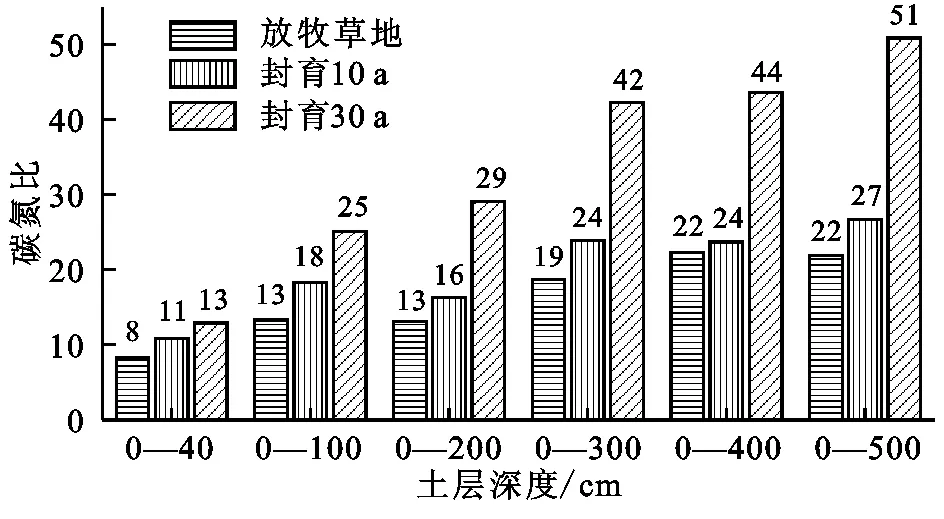
图5 不同封育年限草地不同深度土壤碳氮比
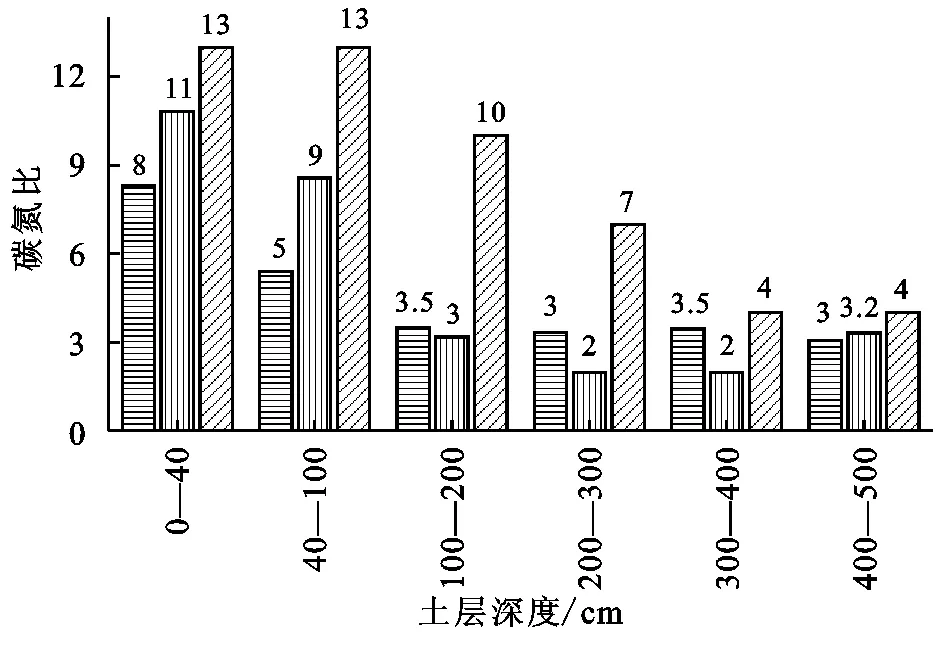
图6 不同封育年限草地不同土层土壤碳氮比
3 结论与讨论
研究表明在0—100 cm土层,封育30 a草地SOC和STN储量最高分别为380 Mg/hm2,28 Mg/hm2(图1和图3),100 cm以下土层具有较大碳氮固持潜力,尤其以100—200 cm和200—300 cm土壤SOC和STN储量较大,分别为200,20,113,16.5 Mg/hm2,因此,长期封育SOC和STN积累不仅发生在表层,深层SOC和STN积累数量可观,此观点与已有研究相吻合[27-29]。同时封育10 a草地各土层SOC和STN量与放牧草地差异不显著,而与封育30 a各土层SOC和STN储量差异极其显著,说明封育对于草地碳氮积累发生在封育第10~30年时间段,而封育前10 a土壤碳氮积累相对较少。图2和图4可以看出,封育10 a和放牧草地不同深度土壤碳、氮储量均无统计学差异,而与封育30 a不同深度土壤碳氮储量差异显著。所以,封育草地土壤碳氮积累主要发生在10~30 a间,而且发生在0—500 cm的土层。
从草地碳氮固持与固持速率来看,整体规律是封育10~30 a碳氮固持与固持速率均高于封育10 a草地(表2—3)。在我国黄土高原区2000年以来实施了退耕还林还草措施,其中封育是一个重要的工程措施,在宁夏固原市云雾山保护区试验区及农户居住区,封育草地大部分始于2003年,封育年限为10 a左右,虽然植被盖度有一定的提高(表1),但是土壤碳氮积累并未显著提升。而在云雾山自然保护区核心区封育始于20世纪80年代,碳氮固持及固持速率显著增加,研究表明云雾山草封育15 a后植被碳储量为15.56 Mg/hm2,根系碳密度所占平均比例达到82.56%,是封育30 a来最高点,封育15 a后植被碳储量下降,而土壤碳储量增加[22],同时根据中国科学院内蒙古草原生态系统定位试验可知,封育15~20 a植物根系碳储量降低,而土壤碳储量升高[21],因此,有机碳可能是在封育15 a后从植被碳库流向土壤碳库,从而增加土壤有机碳固持和固持速率。但是,由于本研究缺少封育20 a草地数据,所以很难确定10~30 a封育草地碳氮固持及固持速率的变化趋势具体时间点。
土壤有机碳氮含量的比值(C/N)是表征土壤质量变化的重要指标[30],研究表明土壤碳氮比较低,利于微生物分解有机质,促进土壤中有效氮的增加;反之,碳氮比较高,则会出现微生物分解有机质受限,不利于植物的生长及NPP的增加[30],何念鹏等[21]研究表明内蒙古草原封育21~30 a土壤0—100 cm碳氮比值为10~32.1,与本研究结果基本相似,研究发现封育30 a的0—100 cm土壤碳氮比值为27,各层土壤碳氮比值封育30 a均大于封育10 a和放牧草地。通常草地植被生物量与土壤碳呈密切正相关,碳氮比提高不利于草地植物初级生产力的提升[31],随着生态系统的发育(或恢复)进程,其碳固持能力(或速率)会逐渐下降,并最终达到一个相对平衡状态[32-35],以内蒙古羊草草地为例,经过27 a围封后,草地生态系统处于弱碳源—弱碳汇相互转换的状态[36]。因此,黄土高原温带草地在更长时间尺度上,围封是否还能进一步提高温带草地碳贮量,是否可以进行适当放牧对封育草地进行中度干扰,仍有待进一步深入研究。
由于缺乏围封处理前草地碳氮储量的本底数据,可能会增加长期封育草地碳固持及固持速率评估的不确定性。但是,通过调查得知草地封育前处于自由放牧状态,因此假设中度自由放牧对草地碳氮固持影响较小为前提,认为过去30 a自由放牧对温带草地碳氮贮量的影响较小,从而以放牧草地为草地封育前本底数据,进行试验分析,试验分析结果具有一定的可靠性。
[1] Asner G P,Elmore A J, Oler L P, et al. Grazing Systems, ecosystem responses, global change[J]. Annual Review of Environment Resources,2004,29(1):261-299.
[2] 李学斌,樊瑞霞,刘学东.中国草地生态系统碳储量及碳过程研究进展[J].生态环境学报,2014,23(11):1845-1851.
[3] 程积民,程杰,杨晓梅,等.黄土高原草地植被碳密度的空间分布特征[J].生态学报,2012,32(1):226-237.
[4] 王英舜,师桂花,许中旗,等.锡林郭勒放牧草地封育后植被恢复过程的研究[J].草业科学,2010,27(8):10-14.
[5] 陈广生,田汉勤.土地利用/覆盖变化对陆地生态系统碳循环的影响[J].植物生态学报,2007,31(2):189-204.
[6] 萨茹拉,李金祥,侯向阳.草地生态系统土壤有机碳储量及其分布特征[J].中国农业科学,2013,46(17):3604-3614.
[7] 杨婷婷,吴新宏,王加亭,等.中国草地生态系统碳储量估算[J].干旱区资源与环境,2012,26(3):127-130.
[8] 杨红飞,穆少杰,孙成明,等.草地生态系统土壤有机碳估算研究综述[J].中国草地学报,2011,33(5):107-114.
[9] Davidson E A, Trumbore S E, Amundson R. Soil warming and organic carbon content[J]. Nature, 2000,408(6814):789-790.
[10] 闫瑞瑞,辛晓平,王旭,等.不同放牧梯度下呼伦贝尔草甸草原土壤碳氮变化及固碳效应[J].生态学报,2014,34(6):1587-1595.
[11] 郑翠玲,曹子龙,王贤,等.围栏封育在呼伦贝尔沙化草地植被恢复中的作用[J].中国水土保持科学,2005,3(3):78-81.
[12] Schimel D S. Terrestrial ecosystems and the carbon cycle[J].Global Change Biology,1995,1(1):77-91.
[13] 王英舜,师桂花,许中旗,等.锡林郭勒放牧草地封育后植被恢复过程的研究[J].草业科学,2010,27(8):10-14.
[14] 魏建群,张克斌,杨俊杰,等.封育对北方农牧交错带荒漠化地区植被恢复作用的研究:以宁夏盐池县为例[J].水土保持研究,2007,14(1):208-210,214.
[15] 华娟,赵世伟,张扬,等.云雾山草原区不同植被恢复阶段土壤团聚体活性有机碳分布特征[J].生态学报,2009,29(9):4613-4619.
[16] Liang Aihua, Han Xinhui, Zhao Fazhu, et al. Dynamics of soil carbon and nitrogen stocks following afforestation in gully region of Loess Plateau, China [J]. Transactions of the Chinese Society of Agricultural Engineering, 2014,30(23):148-157.
[17] 刘凤婵,李红丽,董智,等.封育对退化草原植被恢复及土壤理化性质影响的研究进展[J].中国水土保持科学,2012,10(5):116-112.
[18] Luo Y Q, Field C B, Jackson R B. Does nitrogen constrain carbon cycling, or does carbon input stimulate nitrogen cycling[J]. Ecology, 2006,87(1):3-4.
[19] Zhang T J, Wang Y W, Wang X G, et al. Organic carbon and nitrogen stocks in reed meadow soils converted to alfalfa fields[J]. Soil and Tillage Resesrch, 2009,105(1):143-148.
[20] Deng L, Sweeney S, Shangguan Z P. Grassland responses to grazing disturbance:plant diversity changes with grazing intensity in a desert steppe[J]. Grass and Forage Science, 2014,69(3):524-533.
[21] 何念鹏,韩兴国,于贵瑞.长期封育对不同类型草地碳贮量及其固持速率的影响[J].生态学报,2011,31(15):4270-4276.
[22] 高阳,马虎,程积民,等.黄土高原半干旱区不同封育年限草地生态系统碳密度[J].草地学报,2016,24(1):28-34.
[23] 戴尔阜,翟瑞雪,葛全胜,等.1980s—2010s内蒙古草地表层土壤有机碳储量及其变化[J].地理学报,2014,69(11):1651-1660.
[24] 孙文义,郭胜利,周小刚.黄土丘陵沟壑区地形和土地利用对深层土壤有机碳的影响[J].环境科学,2010,31(11):2740-2747.
[25] 鲍士旦.土壤农化分析[M].3版.北京:中国农业出版社,1999.
[26] Guo L B, Gifford R M. Soil carbon stocks and land use change: A Meta analysis[J]. Global Change Biology, 2002,8(4):345-360.
[27] 张帅,许明祥,张亚锋,等.黄土丘陵区土地利用变化对深层土壤有机碳储量的影响[J].环境科学学报,2014,34(12):3094-3101.
[28] 张金,许明祥,王征,等.黄土丘陵区植被恢复对深层土壤有机碳储量的影响[J].应用生态学报,2012,23(10):2721-2727.
[29] 王征,刘国彬,许明祥.黄土丘陵区植被恢复对深层土壤有机碳的影响[J].生态学报,2010,30(14):3947-3952.
[30] 王建林,钟志明,王忠红,等.青藏高原高寒草原生态系统土壤碳氮比的分布特征[J].生态学报,2014,34(22):6678-6691.
[31] 张彦军,郭胜利,南雅芳,等.黄土丘陵区小流域土壤碳氮比的变化及其影响因素[J].自然资源学报,2012,27(7):1214-1223.
[32] Wu L, He N, Wang Y, et al.Storage and dynamics of carbon and nitrogen in soil after grazing exclusion in Leymus chinensis grasslands of northern China[J].Journal of Environmental Quality, 2008,37(2):663-668.
[33] Elmore A J,Asner G P.Effects of grazing intensity on soil carbon stocks following deforestation of a Hawaiian dry tropical forest[J].Global Change Biology, 2006,12(9):1761-1772.
[34] Taylor A R, Wang J R, Chen H Y H.Carbon storage in achrono sequence of red spruce(Picearubens)for estsincentral Nova Scotia,Canada[J]. Canadian Journal of Forest Research, 2007,37(11):2260-2269.
[35] Matamala R, Jastrow J D, Miller RM, et al.Temporal changes in C and N stocks of restored prairie: Implications for C sequestration strategies[J]. Ecological Applications, 2008,18((6):1470-1488.
[36] 王春燕,张晋京,吕瑜良,等.长期封育对内蒙古羊草草地土壤有机碳组分的影响[J].草业科学,2014,23(5):31-39.
Dynamics of Carbon Storage and Its Sequestration Rate in Deeper Soil Layers Following Long-term Fenced Grasslands
LI Jianping1, CHEN Jing1, XIE Yingzhong1,2, XI Jie3
(1.SchoolofAgriculture,NingxiaUniversity,Yinchuan, 750021,China; 2.BreedingBaseofStateKeyLaboratoryforPreventingLandDegradationandEcologicalRestoration,NingxiaUniversity,Yinchuan750021,China; 3.WorkstationofGrasslandinGuyuan,Guyuan756000,China)
In order to measure soil carbon and nitrogen storages and their sequestration rates in long-term fenced grasslands, different period fenced grasslands in variety location stand for sequential vegetation restoration in Guyuan Yunwushan of the Loess Plateau were selected. The results showed that soil organic carbon(SOC) storage in each soil layers of 0—500 cm soil depth, in 30 years of fenced grassland is significantly higher than in 10 years of fenced grassland and grazing grassland, but there was no significant difference of SOC storage in each soil layer between 10 years of fenced grassland and grazing grassland; there were also no significant difference of soil total nitrogen (STN) storage in different soil layers between 30 years of fenced grassland and 10 years of fenced grassland and grazing grassland, while STN storage in the 30 years of fenced grassland was significantly higher than 10 years of fenced grassland and grazing grassland; meanwhile, during the 30 years of enclosure, the SOC and STN sequestration accumulated dramatically between the 10thyear and the 30thyear, the values were (482.5±39.3) Mg/hm2and (27.7±2.4) Mg/hm2, respectively, but during the first 10 years of fenced grassland, the amounts of SOC and STN sequestration were very small, which were (42.8±6) Mg/hm2and (3.4±2.1) Mg/hm2, respectively; SOC and STN sequestration in 0—500 cm soil depth after 30 years of enclosure of was (525.3±62.0) Mg/hm2and (25.0±3.0) Mg/hm2, respectively, SOC and STN sequestration rates in 0—500 cm soil depth were (17.5±2.1) Mg/(hm2·a) and (0.83±0.3) Mg/(hm2·a); C/N ratio had decreased with increase of soil depth, but it had increased with increase of fencing duration. This study demonstrated that deeper soil layers in fenced grassland have great potential for carbon sequestration, the SOC and STN accumulated mainly happened between the 10thand 30thyears of enclosure, so, the more attention should be paid to fencing period scales and carbon and nitrogen storage in deeper soil layer in order to achieve unbiased estimate of carbon and nitrogen storage in ecological assessment.
SOC storage; SOC sequestration; rate of C sequestration; C/N ratio; fenced grassland
2016-05-07
2016-05-17
宁夏自然科学基金“黄土高原草地深层土壤有机碳、全氮固持动态对封育的响应”(NZ15049)
李建平(1982—),男,陕西人延安人,博士后,主要从事草地生态和模型构建研究。E-mail:lijianpingsas@163.com
S153.6
A
1005-3409(2016)06-0001-08

