白细胞介素-17在活动期炎症性肠病患者血浆和肠黏膜中的表达及其意义
裴中美 赵振亚 肖静波 陈达凡 宛新建*
上海交通大学附属第一人民医院消化科1(200080) 上海市青浦区中医医院内科2
白细胞介素-17在活动期炎症性肠病患者血浆和肠黏膜中的表达及其意义
裴中美1,2赵振亚1肖静波1陈达凡1宛新建1*
上海交通大学附属第一人民医院消化科1(200080) 上海市青浦区中医医院内科2
背景:白细胞介素-17(IL-17)是一种强促炎细胞因子,可能参与炎症性肠病(IBD)的发病机制和病理过程。目的:探讨IL-17在活动期IBD患者血浆和肠黏膜中的表达及其意义。方法:纳入2014年9月—2015年7月上海交通大学附属第一人民医院收治的活动期IBD患者25例,其中溃疡性结肠炎(UC)17例,克罗恩病(CD)8例。选取同期行结肠镜检查的结肠息肉患者10例作为对照组。采集入选者血浆和肠黏膜组织,采用ELISA法检测血浆IL-17表达,采用免疫组化和免疫荧光法检测肠黏膜组织IL-17表达。结果:UC组和CD组血浆IL-17表达水平显著高于对照组[(18.92±3.72) ng/L、(19.10±3.83) ng/L对(15.78±2.98) ng/L,P<0.05]。UC组和CD组肠黏膜组织IL-17表达均为阳性,对照组肠黏膜组织未见IL-17表达。结论:活动期IBD患者血浆和肠黏膜组织中IL-17表达升高,提示IL-17可能参与IBD的发病过程。
炎症性肠病; 结肠炎,溃疡性; Crohn病; 白细胞介素17; 血浆
炎症性肠病(IBD)是一种病因未明确的肠道慢性非特异性炎症性疾病,包括溃疡性结肠炎(UC)和克罗恩病(CD)。IBD患者发病高峰年龄为20~40岁,病程迁延,反复发作,病情轻重不一[1]。IBD在西方国家常见,欧洲和北美的UC发病率为(10~24.3)/10万,CD发病率为(12.7~20.2)/10万[2]。亚洲地区IBD发病率和患病率较西方国家低,但呈逐年增加趋势[3]。近年我国IBD患者和相关文献报道逐渐增多[4-5]。以往研究认为IBD发病与遗传、感染、免疫、环境、微生物等多种因素有关,但具体发病机制尚未完全阐明。白细胞介素-17(IL-17)是由辅助性T细胞17(Th17细胞)分泌的一种强促炎细胞因子,近年研究发现IL-17在多种免疫性疾病中发挥重要作用,其在IBD发病机制中的角色备受关注[6]。诸多国外研究[7-9]表明IL-17可能参与IBD发病,但其在中国IBD患者体内的表达及其意义尚待证实。本研究通过检测上海地区活动期IBD患者血浆和肠黏膜组织中IL-17的表达情况,旨在探讨IL-17在IBD 发病过程中的作用。
材料与方法
一、研究对象
纳入2014年9月—2015年7月上海交通大学附属第一人民医院消化科收治的IBD患者25例,其中UC 17例,CD 8例。IBD诊断标准参考《炎症性肠病诊断与治疗的共识意见(2012年·广州)》[10]。分别采用Mayo评分系统[11]和简化CD活动指数(CDAI)[10]对UC和CD疾病活动性进行评估。排除标准:①缓解期IBD;②诊断不明确的肠炎;③严重心、肝、肺、肾疾病;④不能耐受结肠镜检查;⑤拒绝行活组织检查或采集静脉血。选取同期行结肠镜检查的结肠息肉患者10例作为对照组。研究方案经上海交通大学附属第一人民医院医学伦理委员会批准,所有入选者均签署知情同意书。
二、方法
1. 主要试剂:人IL-17 ELISA试剂盒购自上海酶联生物科技有限公司,IL-17抗体购自Santa Cruz Biotechnology公司,免疫组化试剂盒购自上海志立生物科技有限公司,DAPI染液购自上海翊圣生物科技有限公司。
2. ELISA法检测血浆IL-17表达:UC组(17例)、CD组(8例)和对照组(10例)患者于入院第2 d 清晨空腹抽取肘静脉血5 mL,3 000 r/min离心15 min,取血浆,-80 ℃液氮冻存待测。ELISA操作步骤参照人IL-17 ELISA试剂盒说明书,于酶标仪450 nm波长处读取吸光度(A)值。绘制标准曲线,计算血浆标本IL-17浓度。
3. 免疫组化法检测肠黏膜组织IL-17表达:UC组(12例)、CD组(4例)患者于结肠镜下取病变明显处肠黏膜组织,对照组(5例)于结肠镜下取非病变肠黏膜组织(距肠息肉5 cm处),组织标本常规石蜡包埋、切片,切片脱蜡至水,采用 0.01 mol/L 柠檬酸盐缓冲液抗原修复,10%山羊血清封闭,依次加入IL-17抗体(滴度1∶100)和酶标二抗,4 ℃湿盒孵育48 h,DAB 显色,苏木精复染,梯度乙醇脱水,二甲苯透明后封片。以PBS 代替一抗作为空白对照。结果判定:光学显微镜下单核巨噬细胞膜和(或)胞质黄色、棕黄色染色为阳性。
4. 免疫荧光法检测肠黏膜组织IL-17表达:肠黏膜组织切片脱蜡后,免疫荧光封闭液室温封闭,加入免疫荧光IL-17抗体(滴度1∶100),4 ℃湿盒孵育过夜,洗涤后避光加入免疫荧光二抗孵育1 h,DAPI 染色,免疫荧光洗涤液洗涤,加入抗荧光淬灭封片液封片,于激光共聚焦显微镜下成像。
三、统计学分析
结 果
一、一般情况
UC组男10例,女7例,年龄21~82岁,平均(44.8±17.5)岁;CD组男4例,女4例,年龄19~74岁,平均(36.3±17.6)岁;对照组男7例,女3例,年龄21~70岁,平均(40.9±16.4)岁。三组间性别构成、年龄差异无统计学意义(P>0.05)。UC组疾病活动度分别为轻度2例、中度10例、重度5例;CD组分别为中度4例、重度4例。
二、血浆IL-17表达
UC组、CD组和对照组血浆IL-17表达水平分别为(18.92±3.72) ng/L、(19.10±3.83) ng/L和(15.78±2.98) ng/L,UC组和CD组显著高于对照组(P<0.05),UC与CD组间差异无统计学意义(P>0.05)。
三、肠黏膜组织IL-17表达
免疫组化检测显示,UC和CD组病变肠黏膜上皮均出现IL-17染色阳性细胞,为黄色或棕黄色胞质染色,黏膜固有层和淋巴小结内亦可见散在阳性细胞,多呈体积小、核圆形或类圆形的淋巴细胞样特征;少部分染色阳性细胞体积较大、胞体形状不规则、胞质丰富,呈巨噬细胞样特征。UC组阳性细胞主要位于上皮固有层,分布于腺体周围,黏膜固有层内散在阳性单核细胞;CD组肠黏膜全层均可见阳性细胞,各层中分布未见明显差异;对照组肠黏膜全层均未见阳性染色细胞(图1)。
免疫荧光检测显示,细胞核为 DAPI 染色,呈蓝色荧光,边缘清晰;IL-17呈绿色荧光,包绕于细胞核周围,分布较弥散。UC、CD组病变肠黏膜均可见IL-17免疫荧光阳性细胞,对照组肠黏膜全层均未见IL-17阳性细胞(图2)。
讨 论
IBD的发病机制目前仍未明确。以往研究显示,
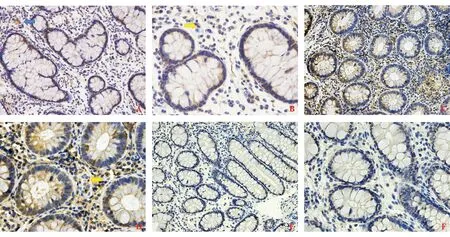
A、B:UC组(×200,×400);C、D:CD组(×200,×400);E、F:对照组(×200,×400);蓝色、黄色箭头所示分别为巨噬细胞样、淋巴细胞样 IL-17染色阳性细胞。
图1 肠黏膜组织IL-17表达(免疫组化染色)

A-C:UC组;D-F:CD组;G-I:对照组
Th1/Th2细胞比例失衡是IBD发生的重要环节[12]。Th细胞是机体介导免疫反应的主要细胞类型,CD肠黏膜炎症主要由Th1型CD4+淋巴细胞介导[13],UC则主要由Th2型CD4+淋巴细胞介导[14]。尽管CD与UC的发生机制不完全相同,但两者肠道炎症和黏膜损伤的关键均为促炎与抗炎细胞因子失衡[15]。近年研究显示,Th17细胞在自身免疫性疾病和特应性反应中发挥重要作用,其具有完全独立于Th1、Th2细胞的分化途径和功能特征,可通过分泌促炎细胞因子IL-17,激活并募集大量中性粒细胞至炎症部位,从而诱导严重的免疫反应。哮喘、多发性硬化、类风湿性关节炎等多种自身免疫性疾病患者的血清和组织中IL-17呈高表达[16-18]。
研究认为IBD发病机制与肠黏膜免疫屏障对肠道抗原的反应失调有关,IL-23/IL-17轴介导的Th17型反应在其中发挥关键作用[6,19]。Th17细胞介导炎症反应的机制可能为病原体侵入肠道黏膜引起转化生长因子-β(TGF-β)、IL-6、IL-23等表达,TGF-β和IL-6诱导Th17细胞表达IL-23受体(IL-23R),从而激发Th17细胞对IL-23应答,并释放IL-17等细胞因子反作用于肠上皮细胞、巨噬细胞等,发挥促炎效应,即IL-23/IL-17轴[20-22]。Th17细胞激活后主要分泌IL-17A,亦可分泌IL-17F、IL-21、IL-22、肿瘤坏死因子-α(TNF-α)、IL-6等细胞因子。IL-17通过诱导趋化因子、集落刺激因子以及黏附因子表达和释放,招募、激活炎性细胞,介导炎症反应。
Fujino等[7]的研究发现,相对于正常人或缺血性结肠炎患者,CD、UC患者肠黏膜IL-17水平显著升高。Kobayashi 等[23]的研究发现,IBD患者体内Th17细胞相关因子合成和分泌增加。Seiderer等[8]的研究发现,活动性IBD患者结肠黏膜和血清Th17/IL-17F含量显著高于正常对照者和非活动性IBD患者,推测Th17细胞及其分泌的IL-17与IBD严重程度密切相关。目前国内仅有少量研究[24-25]关注于IL-17在中国IBD患者病程中的作用,相关结论尚待验证。本研究纳入上海交通大学附属第一人民医院收治的25例活动期IBD患者,通过检测其血浆和肠黏膜组织IL-17 的表达情况,旨在探讨IL-17在IBD 发病过程中的作用。本研究以结肠息肉患者作为对照组,比较UC、CD患者与对照组的血浆和肠黏膜组织IL-17表达,结果显示IL-17在UC和CD组血浆和肠黏膜组织中的表达水平均显著高于对照组,提示IL-17参与IBD发病,血液中的Th17细胞可能趋化至肠黏膜,从而在IBD的肠道炎症反应中发挥重要作用,但具体作用机制尚未明确,有待进一步研究探讨。
有关IL-23/IL-17轴与Th17细胞的研究不但有助于对IBD发病机制的认识,亦为IBD的治疗提供了新靶点和线索。糖皮质激素等传统IBD治疗方案可导致严重不良反应,因此研究作用于IBD炎性通路关键靶点的新型非激素类药物具有重要意义。二氢乳清酸脱氢酶(DHODH)抑制剂vidofludimus(4SC-101)具有抑制淋巴细胞增殖和IL-17分泌的作用,可在核因子-κB(NF-κB)通路中抑制DHODH,从而降低IL-17A和IL-17F表达水平[26]。Fitzpatrick等[27]的研究 显示,应用vidofludimus治疗三硝基苯磺酸(TNBS)和葡聚糖硫酸钠(DSS)诱导的小鼠结肠炎可显著减轻肠道炎症反应。Herrlinger等[28]应用vidofludimus治疗34例IBD患者,结果显示治疗结束时57.1%的CD患者和50.0%的UC患者达到无激素缓解(完全应答),证实了vidofludimus治疗IBD的有效性,亦提示抑制IL-17表达可作为治疗IBD的新途径。本研究尚未涉及IL-17及其抑制剂在IBD治疗中的作用,有待后期进一步研究探讨。
综上所述,Th17细胞是近年来自身免疫性疾病的研究热点,诸多研究聚焦于Th17细胞及其分泌的IL-17等细胞因子在IBD发病机制中的作用。本研究对中国活动期IBD患者血浆和肠黏膜组织的IL-17表达进行检测,结果显示IL-17表达升高,提示其可能参与IBD 的发病过程。然而,本研究为单中心研究,样本量较小,未来需进一步行多中心研究对该结果进行验证,以期为IBD的临床治疗提供新靶点和新方向。
1 Loftus EV Jr. Clinical epidemiology of inflammatory bowel disease: Incidence, prevalence, and environmental influences[J]. Gastroenterology, 2004, 126 (6): 1504-1517.
2 Molodecky NA, Soon IS, Rabi DM, et al. Increasing incidence and prevalence of the inflammatory bowel diseases with time, based on systematic review[J]. Gastroenterology, 2012, 142 (1): 46-54.
3 Prideaux L, Kamm MA, De Cruz PP, et al. Inflammatory bowel disease in Asia: a systematic review[J]. J Gastroenterol Hepatol, 2012, 27 (8): 1266-1280.
4 胡仁伟,欧阳钦,陈曦,等. 近15年我国炎症性肠病文献分析[J]. 胃肠病学, 2007, 12 (2): 74-77.
5 王玉芳,欧阳钦,胡仁伟,等. 炎症性肠病流行病学研究进展[J]. 胃肠病学, 2013, 18 (1): 48-51.
6 Cătană CS, Berindan Neagoe I, Cozma V, et al. Contribution of the IL-17/IL-23 axis to the pathogenesis of inflammatory bowel disease[J]. World J Gastroenterol, 2015, 21 (19): 5823-5830.
7 Fujino S, Andoh A, Bamba S, et al. Increased expression of interleukin 17 in inflammatory bowel disease[J]. Gut, 2003, 52 (1): 65-70.
8 Seiderer J, Elben I, Diegelmann J, et al. Role of the novel Th17 cytokine IL-17F in inflammatory bowel disease (IBD): upregulated colonic IL-17F expression in active Crohn’s disease and analysis of the IL17F p.His161Arg polymorphism in IBD[J]. Inflamm Bowel Dis, 2008, 14 (4): 437-445.
9 Rovedatti L, Kudo T, Biancheri P, et al. Differential regulation of interleukin 17 and interferon gamma production in inflammatory bowel disease[J]. Gut, 2009, 58 (12): 1629-1636.
10 中华医学会消化病学分会炎症性肠病学组. 炎症性肠病诊断与治疗的共识意见(2012年·广州)[J]. 胃肠病学, 2012, 17 (12): 763-781.
11 Pdarienzo G. Topical treatment of distal active ulcerative colitis with beclomethasone dipropionate or mesalamine: A single-blind randomized controlled trial[J]. J Clin Gastroenterol, 2005, 39 (4): 291-297.
12 岳文杰, 刘懿. T辅助细胞在炎症性肠病免疫发病机制中的研究进展[J]. 国际消化病杂志, 2009, 29 (4): 238-240.
13 Parronchi P, Romagnani P, Annunziato F, et al. Type 1 T-helper cell predominance and interleukin-12 expression in the gut of patients with Crohn’s disease[J]. Am J Pathol, 1997, 150 (3): 823-832.
14 Fuss IJ, Heller F, Boirivant M, et al. Nonclassical CD1d-restricted NK T cells that produce IL-13 characterize an atypical Th2 response in ulcerative colitis[J]. J Clin Invest, 2004, 113 (10): 1490-1497.
15 Strober W, Fuss IJ. Proinflammatory cytokines in the pathogenesis of inflammatory bowel diseases[J]. Gastroenterology, 2011, 140 (6): 1756-1767.
16 Hashimoto T, Akiyama K, Kobayashi N, et al. Comparison of IL-17 production by helper T cells among atopic and nonatopic asthmatics and control subjects[J]. Int Arch Allergy Immunol, 2005, 137 Suppl 1: 51-54.
17 Ishizu T, Osoegawa M, Mei FJ, et al. Intrathecal activation of the IL-17/IL-8 axis in opticospinal multiple sclerosis[J]. Brain, 2005, 128 (Pt 5): 988-1002.
18 Zizzo G, De Santis M, Bosello SL, et al. Synovial fluid-derived T helper 17 cells correlate with inflammatory activity in arthritis, irrespectively of diagnosis[J]. Clin Immunol, 2011, 138 (1): 107-116.
19 Geremia A, Jewell DP. The IL-23/IL-17 pathway in inflammatory bowel disease[J]. Expert Rev Gastroenterol Hepatol, 2012, 6 (2): 223-237.
20 Ouyang W, Kolls JK, Zheng Y. The biological functions of T helper 17 cell effector cytokines in inflammation[J]. Immunity, 2008, 28 (4): 454-467.
21 Noronha AM. New insights into the role of IL-17 in inflammatory bowel disease[J]. Inflamm Bowel Dis, 2010, 16 (12): 2180-2181.
22 Sugihara T, Kobori A, Imaeda H, et al. The increased mucosal mRNA expressions of complement C3 and interleukin-17 in inflammatory bowel disease[J]. Clin Exp Immunol, 2010, 160 (3): 386-393.
23 Kobayashi T, Okamoto S, Hisamatsu T, et al. IL-23 differentially regulates the Th1/Th17 balance in ulcerative colitis and Crohn’s disease[J]. Gut, 2008, 57 (12): 1682-1689.
24 林艳华,周平,马培娥,等. IL-17在炎性肠病中的表达及其与LPS协同诱导肠上皮细胞表达IL-8的作用机制[J]. 世界华人消化杂志, 2012, 20 (12): 991-997.
25 郑紫丹,万晓强,刘梁英. 溃疡性结肠炎患者血清IL-23和IL-17的水平变化及意义[J]. 细胞与分子免疫学杂志, 2011, 27 (2): 203-204.
26 Fitzpatrick LR. Novel pharmacological approaches for inflammatory bowel disease: targeting key intracellular pathways and the IL-23/IL-17 axis[J]. Int J Inflam, 2012, 2012: 389404.
27 Fitzpatrick LR, Deml L, Hofmann C, et al. 4SC-101, a novel immunosuppressive drug, inhibits IL-17 and attenuates colitis in two murine models of inflammatory bowel disease[J]. Inflamm Bowel Dis, 2010, 16 (10): 1763-1777.
28 Herrlinger KR, Diculescu M, Fellermann K, et al. Efficacy, safety and tolerability of vidofludimus in patients with inflammatory bowel disease: the ENTRANCE study[J]. J Crohns Colitis, 2013, 7 (8): 636-643.
(2015-12-20收稿;2016-01-28修回)
Expression and Significance of Interleukin-17 in Plasma and Intestinal Mucosa of Patients with Active Inflammatory Bowel Disease
PEIZhongmei1,2,ZHAOZhenya1,XIAOJingbo1,CHENDafan1,WANXinjian1.
1DepartmentofGastroenterology,ShanghaiGeneralHospital,ShanghaiJiaotongUniversity,Shanghai(200080);2DepartmentofInternalMedicine,QingpuChineseMedicineHospital,Shanghai
WAN Xinjian, Email: wanxj99@163.com
Inflammatory Bowel Disease; Colitis, Ulcerative; Crohn Disease; Interleukin-17; Plasma
10.3969/j.issn.1008-7125.2016.09.009
*本文通信作者,Email: wanxj99@163.com
Background: Interleukin-17 (IL-17) is a potent proinflammatory cytokine and may be involved in the pathogenesis and pathophysiology of inflammatory bowel disease (IBD). Aims: To investigate the expression and significance of IL-17 in plasma and intestinal mucosa of patients with active IBD. Methods: A total of 25 patients with active IBD at Shanghai General Hospital, Shanghai Jiaotong University from September 2014 to July 2015 were enrolled, in which 17 cases were ulcerative colitis (UC), 8 cases were Crohn’s disease (CD). Ten patients with colonic polyp undergoing colonoscopy were served as controls. Plasma and intestinal mucosal tissue were collected. Expression of IL-17 in plasma was determined by ELISA, and expression of IL-17 in intestinal mucosal tissue was detected by immunohistochemistry and immuno-fluorescence. Results: Plasma expression of IL-17 was significantly higher in UC and CD groups than that in control group [(18.92±3.72) ng/L and (19.10±3.83) ng/Lvs. (15.78±2.98) ng/L,P<0.05]. Intestinal mucosal tissue was positive for IL-17 in all the cases in UC and CD groups, however, IL-17 was not detected in control group. Conclusions: Expression of IL-17 is increased in both plasma and intestinal mucosal tissue in patients with active IBD, which indicates that IL-17 may be involved in the pathogenesis of IBD.

