含布洛芬的碳酸钙@磷酸八钙颗粒的制备及药物释放行为*
李成峰,陆 昊,杨丽爽,方艳峰,杨赞中
(山东理工大学 材料科学与工程学院无机非金属材料系,山东 淄博 255049)
含布洛芬的碳酸钙@磷酸八钙颗粒的制备及药物释放行为*
李成峰,陆 昊,杨丽爽,方艳峰,杨赞中
(山东理工大学 材料科学与工程学院无机非金属材料系,山东 淄博 255049)
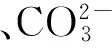
碳酸钙;磷酸八钙;布洛芬;药物载体;核壳结构
0 引 言
无机质药物载体,如碳酸钙等具有表面亲水性、生物相容性和体内降解等优点,近年来备受研究者广泛关注[1-2]。药物与载体间发生的化学键合、物理吸附和氢键等作用保障药物分子的装载,而在外界溶液中药物往往会自载体内部快速释放出来,这是因为药物分子与载体间键合力较弱,而载体内部与溶液中的浓度梯度则导致明显的药物突释现象的发生[3]。采用LBL方法在药物载体表面包裹有机物[2,4-5],通过分子的位阻作用可以有效调控药物分子的释放行为,只是所采用的有机物在生物相容性和体内降解性能方面需要改善。
布洛芬(ibuprofen, IBU)是临床上常用的非甾体消炎药、镇痛药,临床常用的给药方式是口服,味道苦涩,溶解度小,半衰期短导致病人需要频繁给药[6-7],而将IBU吸附至载体内,通过调控药物分子与药物载体的作用机制和药物载体的结构来实现控制IBU释放行为的目的,在短期内释放的药物少可以掩味,同时IBU自颗粒内缓慢释放可大幅度减轻对人体的伤害。我们采用气相扩散法制备得到含IBU的碳酸钙(CaCO3-IBU)微米球,在研究碳酸钙结晶行为的基础上,再在含IBU的碳酸钙微米球上沉积磷酸八钙(OCP)层制备得到含IBU的碳酸钙/磷酸八钙颗粒(CaCO3-IBU@OCP),研究壳层结构对药物分子自壳层结构的颗粒中释放行为的影响规律,所获得的结论可为药物载体的制备和药物释放行为研究提供有益帮助。
1 实 验
1.1 含布洛芬的碳酸钙的制备
采用气相扩散法制备碳酸钙纳米颗粒[8-9]:将0.26 g二水氯化钙(CaCl2·2H2O)加入装有100 mL无水乙醇和IBU的烧杯A中,待其完全溶解后用保鲜膜封口并扎20个小孔,然后将66 g碳酸氢铵(NH4-HCO3)放入烧杯B中,也用保鲜膜封口并扎孔,随后将两烧杯一并放入硅胶干燥器中,3 d后将A烧杯中的沉淀物分离、酒精洗涤2次后,经60 ℃干燥12 h得到颗粒样品。为研究IBU对碳酸钙结晶行为的影响,在烧杯A中分别加入0,0.20,0.30和0.40 g IBU,再用上述方法制备得到CaCO3、CaCO3-IBU-02、CaCO3-IBU-03和CaCO3-IBU。
1.2 CaCO3-IBU@OCP的制备
将未经干燥的CaCO3-IBU分散在10 mL酒精中配成CaCO3-IBU胶体溶液,再以改性的Pechini工艺为基础[10-11],制备具有核壳结构的CaCO3-IBU@OCP颗粒:即先将1.13 g的一水合柠檬酸(CiA)溶解在含有11.53 mL无水乙醇和34.58 mL去离子水的混合溶液中,再加入0.62 g四水合硝酸钙和0.21 g磷酸氢二铵,磁力搅拌使其溶解后调节溶液的pH值到9后加入0.40 g IBU,并加入2.31 g聚乙二醇2000(PEG2000,分子量为2 000 g/mol),待其完全溶解后倒入CaCO3-IBU胶体溶液,反应3 h后在2 000 r/min的速度下离心2 s,酒精洗涤两次后经60 ℃干燥12 h,即制得含IBU的碳酸钙@磷酸八钙颗粒(CaCO3-IBU @OCP)。为考察颗粒壳层结构对药物释放性能的影响,在上述Pechini制备工艺中改变PEG和CiA的用量以及PEG分子量制备得到核壳结构的颗粒,具体的反应条件如表1所示。

表1 CaCO3-IBU@OCP的制备条件(聚乙二醇的分子量(MW)、聚乙二醇(PEG)和柠檬酸(CiA)的用量)及其对IBU的装载量(IBU)
1.3 结构表征与性能测试
用德国Brucker AXS公司D8 ADVANCE型多晶X射线衍射仪(X-ray diffractometer,XRD)对颗粒的物相进行分析(铜靶,扫描范围(2θ)为3~70°,扫描速度为0.1°/min)。用荷兰FEI公司Sirion 200型扫描电子显微镜(Scanning electron microscope,SEM)表征颗粒的显微组织形貌。用微电泳仪测定HA分散体系的Zeta电位(济南微纳,js94h)将样品分散在去离子水中,使得所述样品略微浑浊。每个pH值下测定五次取平均值。实验用紫外-可见分光光度计(北京普析通用,TU1901)来进行颗粒载药性和释放行为的表征,即测定药物分子-IBU分子在222 nm处的吸光度随时间的变化,取0.02 g样品分别置于25 mL磷缓冲液(PBS,pH值=7.2~7.4)和lysosome-like缓冲液(pH值=4.7,含4.4 mmol/L柠檬酸和5.6 mmol/L柠檬酸三钠的水溶液,模拟溶酶体内环境)中,在37 ℃下以120 r/min的速度振荡,每隔一段时间测一次吸光度,通过IBU在溶液中的吸光度-浓度标准曲线来确定释放量,从而研究载体结构和溶液条件(选用不同pH值的缓冲液,以保障IBU释放过程中溶液pH值保持不变)对IBU释放行为的影响规律。
2 结果与讨论
2.1 布洛芬对碳酸钙结晶行为的影响

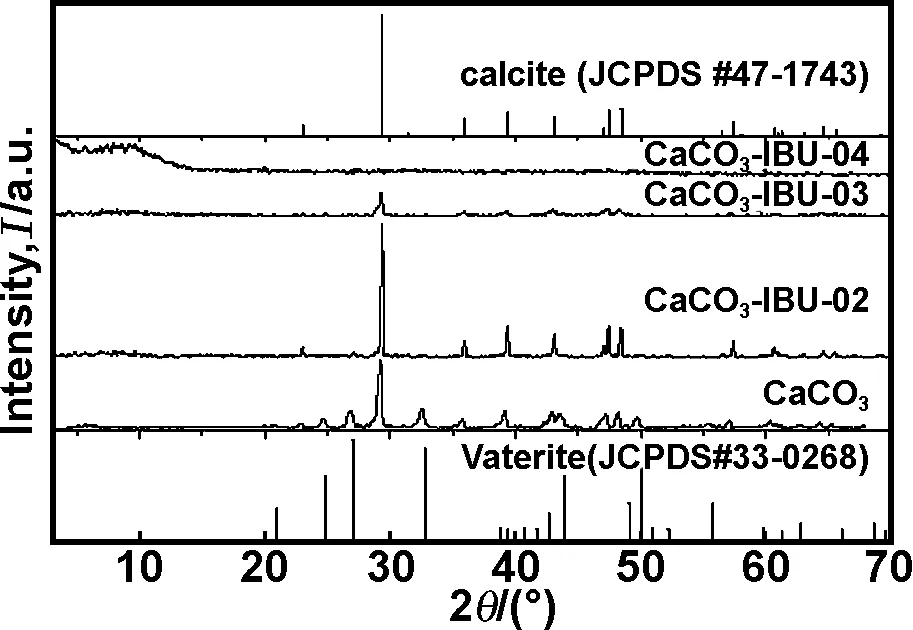
图1 不同IBU添加量制备得到的碳酸钙的XRD谱图
如图2所示,CaCO3微米球分散性较好,并由大量纳米球形颗粒聚集而成。在硅胶干燥器中,碳酸氢铵粉末分解产生的NH3、CO2和H2O气相在乙醇中扩散缓慢,使晶核在溶液中生成纳米球形颗粒,而这些纳米球形颗粒在乙醇中自组装为碳酸钙微米球。在制备碳酸钙的过程中IBU的加入量对其形貌的影响非常明显,CaCO3-IBU-02为立方体形,CaCO3-IBU-03为不规则的球形,而CaCO3-IBU呈表面光滑的球形。随着添加量的增加,IBU将吸附在碳酸钙晶体的特定晶面上并抑制这些晶面的生长,最终使晶体发育为球形。
2.2 含布洛芬的碳酸钙@磷酸八钙颗粒


图2 样品的SEM图片
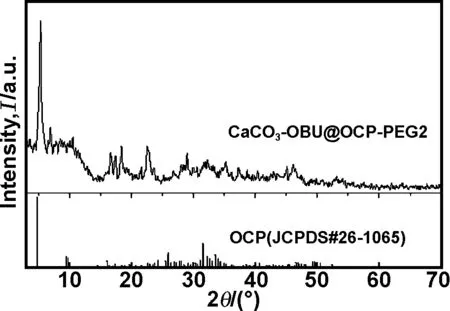
图3 样品的XRD谱图

图4 CaCO3-IBU@OCP-PEG2的SEM照片
如图5所示,CaCO3-IBU颗粒的Zeta电位随着pH值的增大而减小,pH值在9~12之间碳酸钙的Zeta电位<-30 mV,颗粒之间的排斥力可保障分散稳定性[13-14],从而可保障在Pechini工艺过程中OCP会均匀地沉积在CaCO3-IBU表面。在不同pH值下CaCO3-IBU@OCP-PEG2的Zeta电位的绝对值都比CaCO3-IBU颗粒的值要低,这是因为CaCO3-IBU和CaCO3-IBU@OCP-PEG2两种颗粒表面结构不同。
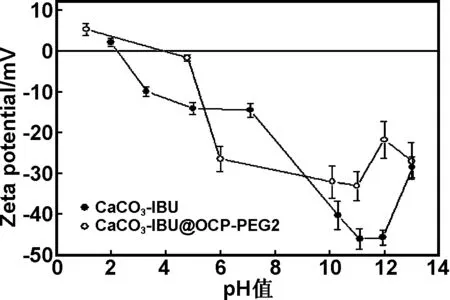
图5 样品的Zeta电位随pH值变化情况
2.3 药物释放行为研究
IBU自CaCO3-IBU和CaCO3-IBU@OCP中释放至PBS和lysosome缓冲液中,由最大释放量可计算出IBU在颗粒中的装载量,如表1所示。在本研究中我们采用生成载药颗粒的过程中原位吸附IBU的方法完成药物的装载,并用酒精对所制得的载药颗粒洗涤2次以去除表面吸附的IBU,这导致IBU在载药颗粒中的装载量有所降低,可通过改变洗涤时间、洗涤溶剂的用量和种类等方法加以提高。相比于在CaCO3-IBU中的装载量,IBU在CaCO3-IBU@OCP中的包裹量并未大幅度下降。IBU在CaCO3-IBU中的装载量约为118 mg/g,即释放出的IBU分子在lysosome-like溶液中浓度高达0.094 mg/mL,远高于IBU在酸性溶液中的溶解度(pH值=1.2时溶解度为0.036 mg/mL)[4,7],这是因为IBU分子在CaCO3-IBU内部以非晶态的方式发生吸附,其溶解度的提高会使药物活性大幅度提高[7]。
如图6所示,在PBS缓冲液中,IBU自CaCO3-IBU释放速度非常慢,72 h仅仅释放8%,这源于电离的IBU离子(荷负电,pKa=4.85)与CaCO3(表面荷正电)之间存在强的静电相互作用。而在lysosome-like缓冲液中,1 h时CaCO3-IBU即释放出35%的IBU,随后释放几乎停止,直至48 h后又开始增加,到72 h时释放完成。IBU自CaCO3-IBU中释放的行为对pH值敏感,这是因为H+离子扩散进CaCO3-IBU颗粒内部就会使IBU分子发生质子化反应,大大减弱其与CaCO3的结合力。
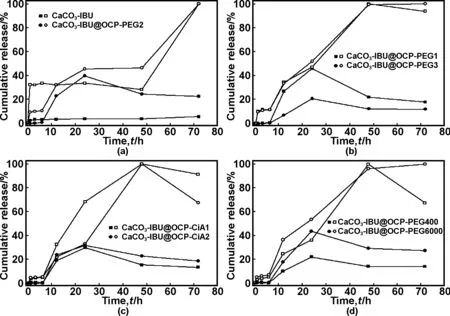
图6 在PBS(实心符号)和lysosome缓冲液(空心符号)中IBU自CaCO3-IBU和CaCO3-IBU@OCP颗粒释放的行为
如图6(a)所示,CaCO3-IBU@OCP-PEG2在PBS中6 h释放出3%的IBU,直至72 h也仅释放出25%;在lysosome-like缓冲液中,约有8%在6 h之前释放,随后释放速度逐渐增大,72 h的释放量约为65%。在PBS中,CaCO3-IBU@OCP壳层中柠檬酸分子(pKa: 3.13、4.76和6.40)发生电离,阻碍IBU分子的释放,而在lysosome-like缓冲液中,H+离子一旦扩散进颗粒内部就会使IBU分子与CaCO3的结合力减弱,壳层内发生质子化反应的柠檬酸分子也大大促进IBU分子快速释放。CaCO3-IBU@OCP壳层内PEG的醚键与柠檬酸离子的羧基之间的键合密度也会对IBU的释放行为有影响,如图6(b)、(c)和(d)可以看出随着PEG用量增加、柠檬酸分子用量降低和PEG分子量增加使得键合密度增大后,药物自颗粒中释放受到的阻碍增大,释放速率也相应地减慢。
3 结 论
在气相扩散法中添加IBU制备得到CaCO3-IBU微米球,并通过Pechini工艺在其表面沉积OCP制备得到CaCO3-IBU@OCP颗粒。随IBU添加量增加,碳酸钙在气相扩散法中自球霰石相逐渐转变为方解石相,颗粒的形貌和聚集形态也随之发生变化。IBU在CaCO3-IBU中的包裹量为118 mg/g,而在CaCO3-IBU@OCP颗粒中包裹量也没有大幅度降低。在磷缓冲液(pH值=7.2~7.4)和lysosome-like缓冲液(pH值=4.7)中IBU自CaCO3-IBU中释放表现出pH值敏感性能,而自CaCO3-IBU@OCP颗粒内释放的行为对溶液pH值和OCP壳层结构(受柠檬酸、聚乙二醇及其分子量因素影响)敏感,这与IBU分子与CaCO3的作用机制及壳层内键合分子的位阻作用影响IBU的扩散有关。
[1] Lauth V, Maas M, Rezwan K. Coacervate-directed synthesis of CaCO3microcarriers for pH-responsive delivery of biomolecules [J]. Journal of Materials Chemistry B, 2014, 44(2): 7725-7731.
[2] Du C, Shi J, Shi J, et al. PUA/PSS multilayer coated CaCO3microparticles as smart drug delivery vehicles [J]. Materials Science and Engineering C, 2013, 33(7): 3745-3752.
[3] Qiu N, Yin H, Ji B, et al. Calcium carbonate microspheres as carriers for the anticancer drug camptothecin [J]. Materials Science and Engineering C, 2012, 32(8): 2634-2640.
[4] Wang C, He C, Tong Z, et al. Combination of adsorption by porous CaCO3microparticles and encapsulation by polyelectrolyte multilayer films for sustained drug delivery [J]. International Journal of Pharmaceutics, 2006, 308(1-2): 160-167.
[5] Peng C, Zhao Q, Gao C. Sustained delivery of doxorubicin by porous CaCO3and chitosan/alginate multilayers-coated CaCO3microparticles [J]. Colloids Surface A, 2010, 353(2-3): 132-139.
[6] Azum N, Rub M A, Asiri A M. Analysis of surface and bulk properties of amphiphilic drug ibuprofen and surfactant mixture in the absence and presence of electrolyte [J]. Colloids Surface B, 2014, 121: 158-164.
[7] Zhang P, Forsgren J, Strφmme M. Stabilisation of amorphous ibuprofen in Upsalite, a mesoporous magnesium carbonate, as an approach to increasing the aqueous solubility of poorly soluble drugs [J]. International Journal of Pharmaceutics, 2014, 472(1-2): 185-191.
[8] Lee H S, Ha T H, Kim H M, et al. Fabrication and micropatterning of a hybrid composite of amorphous calcium carbonate and poly(ethylenimine) [J]. Bulletin of the Korean Chemical Society, 2007, 28(3): 457-462.
[9] Xu A W, Antonietti M, Yu S H, et al. Polymer-mediated mineralization and self-similar mesoscale-organized calcium carbonate with unusual superstructures [J]. Advanced Materials, 2008, 20(7): 1333-1338.
[10] Dembski S, Rupp S, Gellermann C, et al. Luminescent silicate core-shell nanoparticles: synthesis, functionalization, optical, and structural properties [J]. Journal of Colloid and Interface Science, 2011, 358(1): 32-38.
[11] Kong H D Y, Yu M, Lin C K, et al. Sol-gel synthesis and characterization of Zn2SiO4∶Mn@SiO2spherical core-shell particles [J]. J Electrochemical Society, 2005, 152(10): H146-H151.
[12] Jaime G M, José M D L, Michele I, et al. Amino acidic control of calcium phosphate precipitation by using the vapor diffusion method in microdroplets [J]. Crystal Growth & Des, 2011, 11(11): 4802-4809.
[13] Sun Y P, Li X Q, Zhang W X, et al. A method for the preparation of stable dispersion of zero-valent iron nanoparticles [J]. Colloids Surface A, 2007, 308(1-3): 60-66.
[14] Li C F, Li G C, Liu S G, et al. Spherical hydroxyapatite with colloidal stability prepared in aqueous solutions containing polymer/surfactant pair [J]. Colloids Surface A, 2010, 366(1-3): 27-33.
Synthesis of calcium carbonate @ octacalcium phosphate powders with encapsulation of ibuprofen and its release behavior
LI Chengfeng, LU Hao, YANG Lishuang, FANG Yanfeng, YANG Zhanzhong
(Department of Inorganic Materials, School of Materials Science and Engineering,Shandong University of Technology, Zibo 255049, China)
calcium carbonate; octacalcium phosphate; ibuprofen; drug carrier; core-shell structure
1001-9731(2016)10-10096-05
山东省自然科学基金资助项目(ZR2013EML008,ZR2012EMM016);山东省高等学校科技计划资助项目(J11LD52);山东省科技发展计划资助项目(2014GZX201008)
2015-06-02
2016-04-04 通讯作者:李成峰,E-mail: cfli@sdut.edu.cn
李成峰 (1979-),男,山东青州市人,副教授,博士,主要从事生物医用材料研究。
TB321
A
10.3969/j.issn.1001-9731.2016.10.017

