赤眼鳟Toll 样受体3基因cDNA全长克隆及表达分析
肖调义 李 伟 王荣华 刘巧林 彭慧珍 苏建明
(1. 湖南农业大学,湖南省特色水产资源利用工程技术研究中心,长沙 410128; 2. 水产高效健康生产湖南省协同创新中心,常德 415000; 3. 湖南农业大学动物医学院,长沙 410128)
赤眼鳟Toll 样受体3基因cDNA全长克隆及表达分析
肖调义1,2李伟1王荣华1刘巧林1,2彭慧珍1,2苏建明1,3
(1. 湖南农业大学,湖南省特色水产资源利用工程技术研究中心,长沙 410128; 2. 水产高效健康生产湖南省协同创新中心,常德 415000; 3. 湖南农业大学动物医学院,长沙 410128)
为探究赤眼鳟(Squaliobarbus curriculus) Toll样受体3(Toll-like receptor 3,ScTLR3)基因是否参与抗病毒免疫反应,实验运用RACE技术,克隆得到ScTLR3基因cDNA全长序列,并进行了生物信息学分析; 通过Real-Time qPCR技术,检测了ScTLR3 mRNA在健康赤眼鳟10个组织中的分布以及感染草鱼呼肠孤病毒(GCRV)后肝脏、脾脏、体肾和头肾中的表达特征。结果表明:ScTLR3基因cDNA序列全长4043 bp,包括5′-非编码区(UTR) 216 bp,开放阅读框(ORF)2715 bp和3′-UTR 1112 bp; ScTLR3共编码904个氨基酸残基,推导的蛋白分子量102.67 kD,理论等电点8.76; SMART结构域预测显示,ScTLR3由N端的信号肽(SP)、富亮氨酸结构域(LRRs)、跨膜结构域(TM)和C端的Toll/白介素-1受体结构域(TIR)组成。实时荧光定量结果显示,ScTLR3 mRNA在检测的各组织中均有表达,肝脏中的相对表达量极显著高于其他组织(P<0.01); 感染GCRV后,肝脏、脾脏、体肾和头肾组织中ScTLR3 mRNA均上调表达,肝脏、脾脏和体肾组织中的相对表达量在24h达到峰值,分别为对照组的5倍、7倍和6倍。研究表明,ScTLR3具有TLRs家族基因的典型结构特征,并能被GCRV诱导表达,推测其在赤眼鳟抗GCRV入侵免疫反应中发挥了重要作用。
赤眼鳟;Toll样受体3;分子克隆;表达特征
Toll样受体(Toll-like receptor,TLRs)是一类识别病原体保守结构——病原相关分子模式(Pathogen associated molecular patterns,PAMPs)的模式识别受体(Pattern recognition receptors,PRRs)[1,2]。自1985年在果蝇中被发现起,TLRs基因受到广大研究者的关注[3]。鱼类中首个TLRs基因由Sangrador-Vegas等[4]2000年从虹鳟(Oncorhynchus mykiss)cDNA文库中克隆得到。TLR3同时存在于哺乳动物和鱼类,位于细胞质核内体上,参与双链RNA(Double-stranded RNA,dsRNA)的识别,是抗病毒免疫反应和免疫机制进化研究的理想对象[5,6]。
目前,已有多种鱼类的TLR3基因的cDNA序列、识别配体及功能被报道,如稀有鮈鲫(Gobiocypris rarus)[7]、草鱼(Ctenopharyngodon idella)[8]、斑马鱼(Danio rerio)[9]、鲫(Carassius auratus)[10]、河豚(Fugu rubripes)[11]、虹鳟(O. mykiss)[12]、南亚野鲮(Labeo rohita)[13]、大菱鲆(Scophthalmus maximus)[14]等。研究显示,草鱼呼肠孤病毒(Grass Carp Reovirus,GCRV)感染稀有鮈鲫[7]或传染性造血坏死病病毒(Infectious Hematopoietic Necrosis Virus,IHNV)感染虹鳟[12]后,相关组织中TLR3表达量均显著上调,且dsRNA病毒类似物poly(I:C)同样能诱导虹鳟巨噬细胞[12]、人胚肾293细胞[15]和大黄鱼脾脏[16]中TLR3显著上调表达。另外,细菌也能引起鱼类TLR3基因的表达水平变化[16,17]。鱼类TLR3的功能与哺乳动物相似,在免疫反应中富亮氨酸结构域(Leucine-rich repeats,LRRs)与病毒dsRNA特异性结合并通过MyD88非依赖信号转导途径,激活相关信号因子,诱导干扰素的产生[18,19]。研究表明,Ⅰ型干扰素通过促进下游干扰素刺激基因(MX1、TRIM等)表达,从而抑制病毒的繁殖[20,21]。
近年来,草鱼出血病严重影响草鱼养殖业的发展,其病原GCRV受到广泛关注[22]。赤眼鳟(Squaliobarbus curriculus)与草鱼亲缘关系较近,同属雅罗鱼亚科,分属赤眼鳟属和草鱼属,其作为一种优质的淡水经济鱼类,亦被大量研究报道[23]。刘巧林[24]用GCRV感染赤眼鳟和草鱼后发现,赤眼鳟存活率较草鱼高一倍以上。为探究ScTLR3基因是否参与赤眼鳟抗病毒免疫反应,本实验克隆了ScTLR3基因cDNA全长,并对其进行生物信息学分析,同时检测了ScTLR3 mRNA在赤眼鳟各组织中分布和感染GCRV后肝脏、脾脏、体肾和头肾组织中的表达特征,为进一步研究其结构和功能提供线索和参考。
1 材料与方法
1.1实验材料
实验用赤眼鳟购自浏阳市北盛镇乌龙渔场(湖南长沙),为2014年5月繁育个体,实验前培育于面积333 m2,水深1 m的池塘。选取180尾6月龄的健康赤眼鳟[体长(8.45±0.74) cm,体重(12.33±1.34) g],于80 L/箱的恒温循环水养殖系统28℃养殖4周,30尾/箱,每天定时光照12h并按照体重的1%投喂粗蛋白含量为30%的膨化饲料2次。
本实验用GCRV(106毒株,1.78×107TCID50/mL)由中国水产科学研究院长江水产研究所曾令兵研究员惠赠。
1.2实验方法
总RNA提取和第一链cDNA合成选取一尾健康赤眼鳟,丁香酚(国药,上海)麻醉处理后,用无核酸酶匀浆管(Bertin,法国)分别收集约80 mg肾脏和脾脏组织(预先加入5粒0.8—1.0 mm陶瓷研磨珠和600 μL裂解液,并在冰上预冷),立即用均质仪Precellys 24(Bertin,法国)匀浆,匀浆程序:5000 r/ min,15s/次,共2次,间隔5s,总RNA提取的其他步骤参考MiniBEST Universal RNA Extraction Kit(TaKaRa,大连)说明书。将总RNA分装成3份,分别用于RNA浓度(纯度)检测、稳定性(完整性)检测和第一链cDNA及RACE cDNA合成。使用BioSpectrometer Basic核酸蛋白仪(Eppendorf,德国) 检测总RNA浓度(纯度),稳定性(完整性)检测步骤:1%琼脂糖凝胶电泳对比分析置于-70℃和37℃的总RNA样品,28S∶18S条带亮度约等于2∶1且无明显变化的样品视为稳定(完整)的。使用First Strand cDNA Synthesis Kit(Fermentas,美国)试剂盒,以Oligo(dT)18为引物、约2 μg总RNA为模板,按照说明书进行第一链cDNA合成,产物-20℃储存备用。
cDNA 部分序列克隆根据GenBank中草鱼(DQ864497.1)、团头鲂(DQ986365.1)、斑马鱼(AY616582.1) TLR3基因cDNA序列保守区设计2对同源PCR引物F1/R1、F2/R2(表1),克隆ScTLR3基因cDNA部分序列,50 μL PCR反应体系由:赤眼鳟脾脏和肝脏cDNA各0.5 μL、0.25 μL TaKaRa Ex Taq(TaKaRa,大连)、5 μL 10×Ex Taq缓冲液、4 μL dNTP 混合液、正反引物(10 μmol)各1 μL和37.75 μL Mili-Q等级水组成,扩增程序:95℃ 5min; 95℃ 30s,58℃ 30s,72℃ 90s,25 cycles; 72℃ 7min; 4℃ 保存。PCR产物经1%琼脂糖凝胶电泳纯化后采用Gel Extraction Kit(Omega Bio-Tek,美国)回收,产物连接pEGM-T easy载体(Promega,北京),选取2个阳性克隆送生工生物工程(上海)股份有限公司测序。

表1 本研究相关引物Tab. 1 Primers used in this study
末端快速扩增(RACE)依据SMARTer RACE 5′/3′ Kit(Clontech,美国)用户手册,应用Oligo7软件以拼接的ScTLR3基因部分cDNA序列为模板,设计RACE外引物GSP-5′-outer和GSP-3′-outer以及RACE内引物GSP-5′-inner和GSP-3′-inner(表1),同时分别制备5′RACE cDNA和3′RACE cDNA。使用RACE外引物GSP-5′-outer和GSP-3′-outer分别进行5′或3′第一次PCR,电泳检测首次PCR产物,若无目的条带,使用50倍稀释的首次PCR产物和相应的RACE外引物进行巢式PCR,两次PCR的反应体系和反应程序均同用户手册。目的片段经1%琼脂糖凝胶电泳纯化后使用In-Fusion®HD Cloning Kit(Clontech,美国)连接,选取3个阳性克隆送生工生物工程(上海)股份有限公司测序,序列经SeqMan软件拼接后,得到ScTLR3的cDNA全长序列。
序列分析应用ExPASy-Translate tool(http://web.expasy.org/translate/)预测ScTLR3开放阅读框(ORF),并推导其编码的氨基酸序列。对推导的氨基酸序列进行生物信息学分析:分子量和等电点应用在线工具ExPASy-Compute pI/Mw tool(http://web.expasy.org/compute_pi/)计算; 在线软件SignalP 4.1(http://www.cbs.dtu.dk/services/ SignalP/)被用来预测信号肽; 结构域预测使用在线软件SMART(http://smart.embl-heidelberg.de/); ITASSER(http://zhanglab.ccmb.med.umich.edu/ITASSER/)被用于氨基酸序列3D建模,其数据分析和图表构建采用PyMOL 2.7软件; 使用MEGA 6.06软件,采用邻接法(Neighbor-joining) 构建TLR3系统进化树。
组织表达分析选取3尾健康赤眼鳟,分别提取心脏、脑、肝脏、脾脏、体肾、头肾、肌肉、肠、鳃和胸腺10个组织的总RNA,并合成第一链cDNA。根据ScTLR3保守区设计特异的荧光定量引物(ScTLR3-Q-F/R,E=96.64%),以β-actin作为内参基因设计引物(actin-F/R,E=95.37%)(表1)。利用CFX96 TouchTMReal-Time PCR Detection System(Bio-Rad,美国)进行实时荧光定量PCR检测,20 μL反应体系由10 μL 2×UltraSYBR Mixture(康为世纪,北京)、上下游引物各0.4 μL和9.2 μL 10倍稀释的cDNA组成。反应条件为95℃ 10min; 95℃ 5s,60℃ 10s,72℃ 10s,采集荧光,35 cycles; 溶解曲线从65℃上升至95℃,每5s上升0.5℃,采集荧光。每个样品进行3次重复。
病毒感染和表达特征分析GCRV攻毒实验设实验组和对照组,均设3个重复,每个重复30尾。实验组腹腔注射GCRV病毒悬液200 μL/尾,对照组注射等量磷酸缓冲液(PBS)。在注射后的0、6h、12h、24h、48h、72h、96h和120h分别从3个实验箱随机选取一尾,用含丁香酚自来水处理后立即取头肾、肝脏、脾脏、体肾,提取总RNA,并合成第一链cDNA,对照组采用同样的方法制备cDNA模板。Real-Time qPCR方法同上。
数据处理应用Bio-Rad CFX Manager软件,采用2-ΔΔCt法计算单个样品中ScTLR3的相对表达量,并用SPSS 19.0软件进行单因素方差分析(One-Way ANOVA),显著性水平为*P<0.05,**P<0.01。
2 结果
2.1ScTLR3 基因的克隆和序列分析
ScTLR3基因全长4043 bp,GenBank No. KT 186364,其中ORF为2715 bp,编码904个氨基酸残基,5′-非编码区(Untranslated region,UTR) 216 bp和3′-UTR 1112 bp,在其3′-UTR包含3个多聚腺苷酸加尾信号“aataaa”或“aacaaa”和5个mRNA不稳定信号“attta”以及典型的Poly A尾巴。预测的ScTLR3蛋白相对分子量为102.67kD,理论等电点为8.76。SMART结构显示,ScTLR3由N-端的信号肽(SP,1—23aa)、14个LRR基序(53—72aa,99—118aa,146—173aa,170—193aa,275—297aa,298—321aa,353—376aa,430—454aa,506—529aa,530—553aa,563—585aa,586—609aa,610—633aa,635—658aa)、LRR_CT 基序(646—698aa)、TM(704—726aa)和TIR(757—900aa)组成(图1a)。I-TASSER 3D结构模型显示,ScTLR3包括14个α螺旋、13个β折叠,LRRs区域为马蹄形结构(图1b/c)。
2.2不同物种TLR3的进化分析
结果显示,整个系统发育树分为两支:硬骨鱼类聚为一支,两栖类和其他参与分析的陆生动物聚为一支; 硬骨鱼类中,淡水硬骨鱼类和海水硬骨鱼类各为一支,其中赤眼鳟和武昌鱼聚为一支。进一步分析不同物种TLR3 TIR 结构域氨基酸序列,ScTLR3与草鱼(ABI64155.1)和鲤(ABC86865.1)相似度高达97%,其次是团头鲂(ABI83673.1) 96%(图2)。
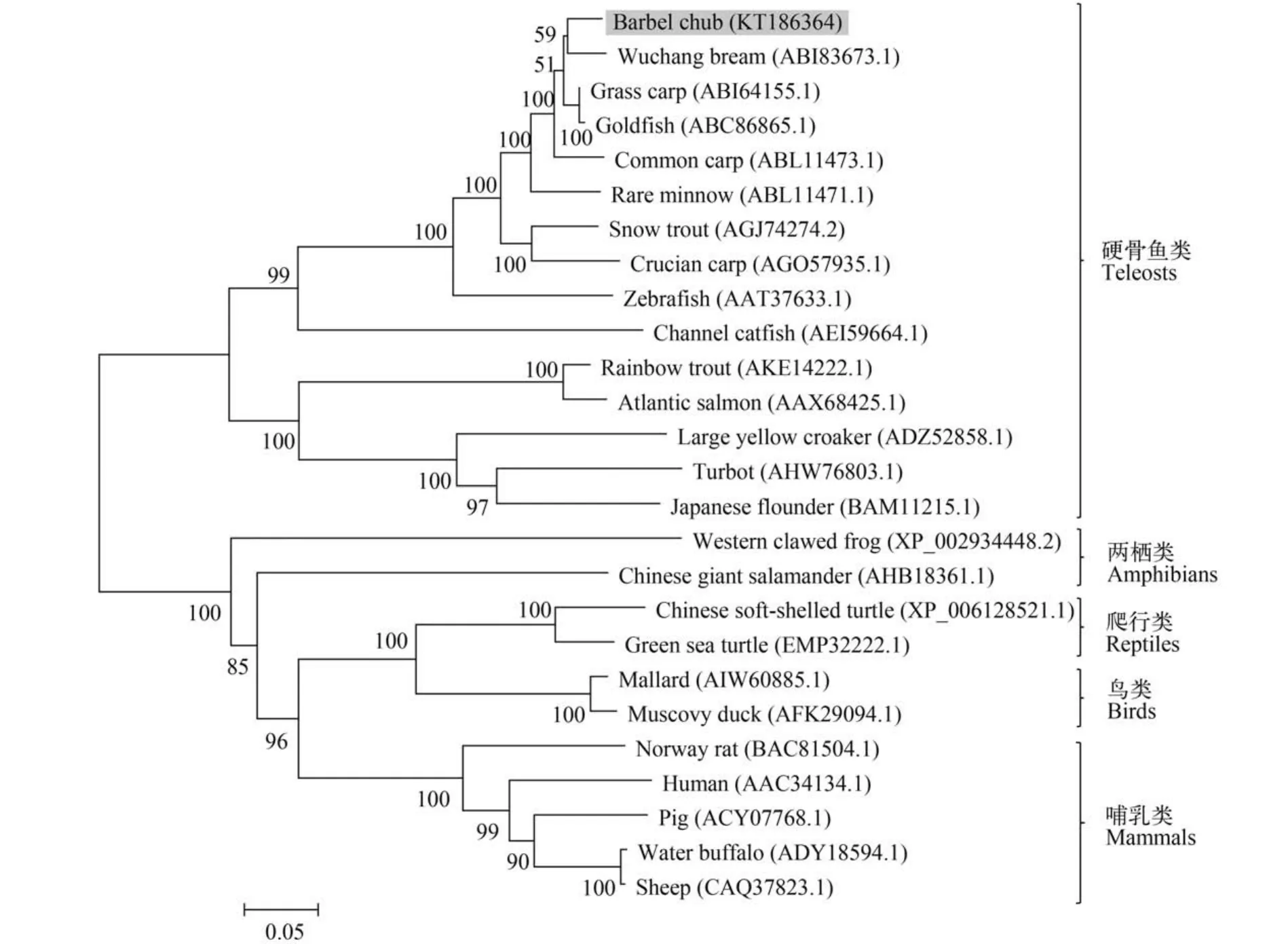
图2 应用CLUSTALW进行多序列比对并使用MEGA 6.06采用邻接法构建TLR3的系统进化树Fig. 2 Phylogenetic tree constructed from a CLUSTALW alignments and MEGA version 6.06 Neighbor-Joining of selected TLR3 sequences
2.3ScTLR3的组织表达及GCRV诱导表达分析
采用Real-Time qPCR方法检测ScTLR3 mRNA在健康赤眼鳟不同组织的相对表达量及GCRV攻毒后的表达量变化,结果表明:ScTLR3 mRNA在所检测的10个组织中均有表达,由低到高依次为:胸腺<鳃<体肾<脑<肠<脾脏<肌肉<头肾<心脏<肝脏,且肝脏中的相对表达量极显著高于其他9个组织(P<0.01)(图3)。与对照组相比,感染GCRV后肝脏、脾脏、肾脏和头肾组织中ScTLR3 mRNA均上调表达,其中,肝脏和脾脏中相对表达量除0和120h外均极显著高于对照组(P<0.01),头肾中相对表达量除0外均极显著高于对照组(P<0.01)。感染GCRV后ScTLR3 mRNA在被检测的四种组织中表达特征相似,均出现两个表达峰,同时又具有一定差异性,肝脏和脾脏组织中第一个表达峰出现在24h,第二个表达峰出现在96h但低于前一个,肾脏组织中第一个表达峰出现在24h,但第二个表达峰并不明显,头肾组织中两个表达峰出现较肝脏和脾脏早,分别出现在12h和72h且表达量相近(图4)。
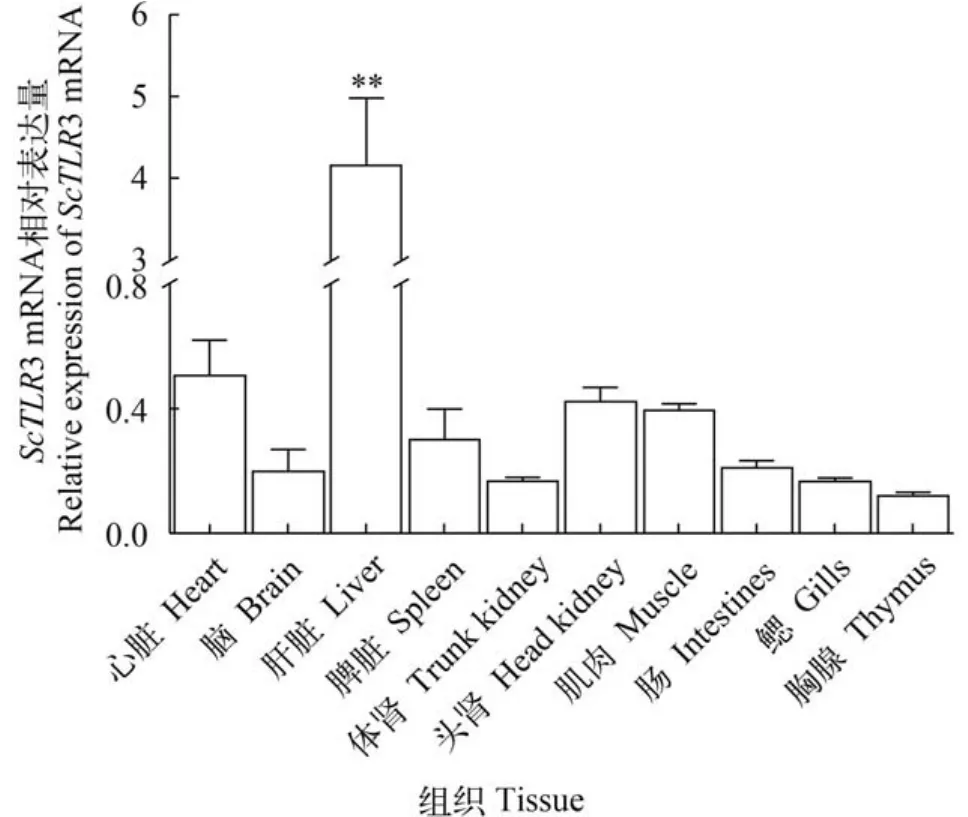
图3 健康赤眼鳟心脏、脑、肝脏、脾脏、体肾、头肾、肌肉、肠、鳃和胸腺组织中ScTLR3相对表达量Fig. 3 Relative expression of ScTLR3 in different tissues of barbel chub,include heart,brain,liver,spleen,trunk kidney,head kidney,muscle,intestines,gills and thymus
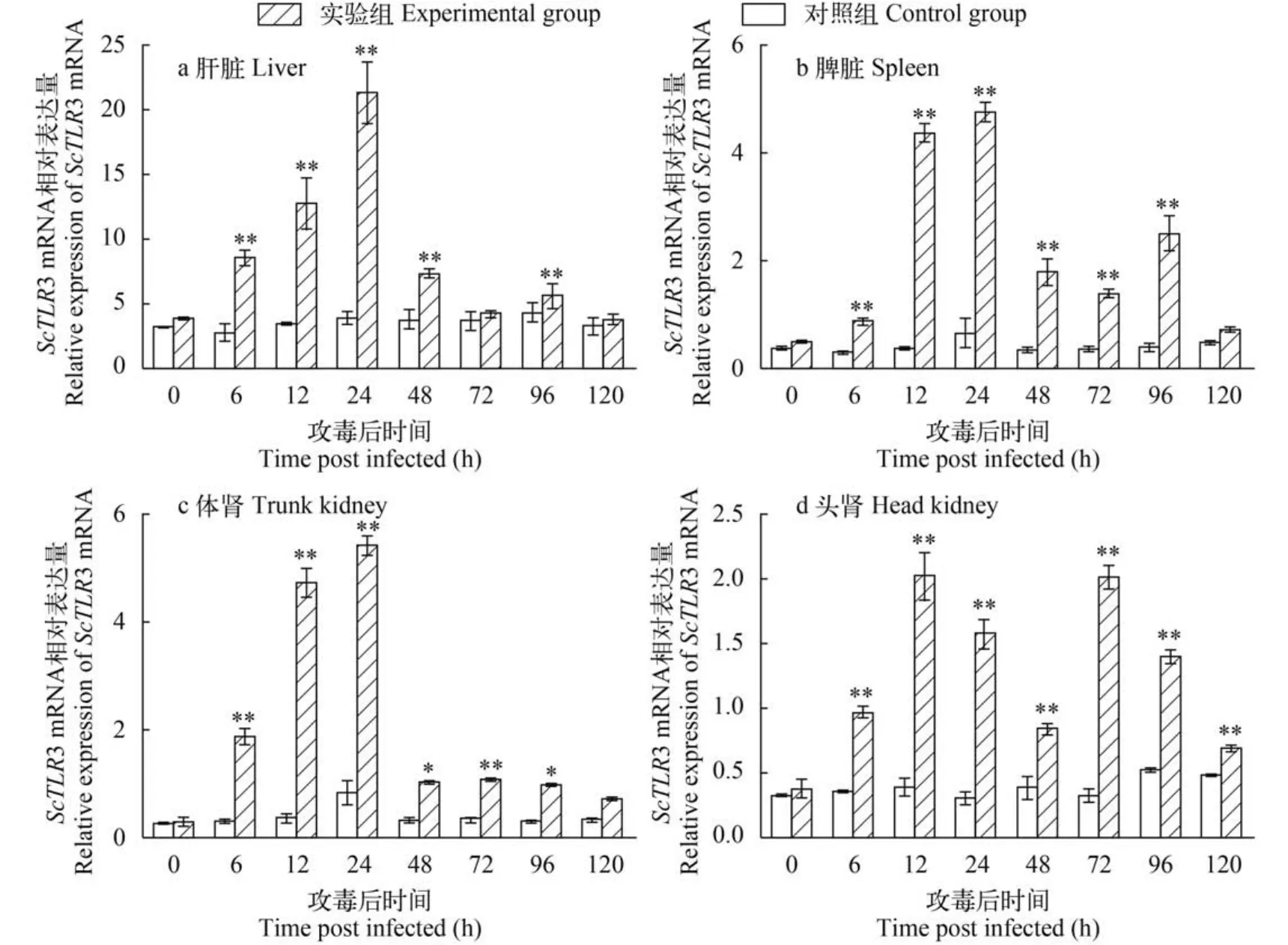
图4 感染GCRV后ScTLR3基因的时空表达特征Fig. 4 Expression pattern of ScTLR3 after infected by GCRV
3 讨论
在免疫反应中,机体对病原的识别、呈递与免疫反应的强度、速度直接相关,TLR3主要参与识别胞内病毒dsRNA,并以其特有的MyD88非依赖途径激活下游免疫因子,诱导I型干扰素(α-IFN和β-IFN)表达和分泌,达到抑制病毒复制的目的[25—27]。基于前期赤眼鳟GCRV攻毒实验中赤眼鳟死亡率显著低于草鱼的结果和TLR3在哺乳动物免疫反应中的重要作用以及其在各物种间的保守性,我们希望探究TLR3是否在赤眼鳟抗病毒免疫反应中也发挥了作用。
3.1ScTLR3 cDNA序列及结构特征分析
本实验运用RACE方法获得了ScTLR3基因cDNA全长序列4043 bp,预测其开放阅读框(ORF) 2715 bp,ScTLR3基因3′-UTR 1112 bp,较草鱼(DQ864497.1)、团头鲂(DQ986365.1)、斑马鱼(NM_001013269.3)等长400—600 bp,已有研究表明,3′-UTR的长度和序列构成与mRNA的稳定性、转录调控和蛋白定位均有一定的影响[28—30]。不稳定的mRNA 3′-UTR通常含有AU富含基序(AU-rich elements,AREs),如免疫调节和炎症反应相关基因IL-1、IL-2、IL-4、TNF和IFN等,ARE结构中最典型的基序为ATTTA[31—33]。在本实验中,ScTLR3基因mRNA 3′-UTR包含5个ATTTA序列,而草鱼(DQ864497.1)包含4个、人(NM_003265.2)包含3个、团头鲂(DQ986365.1)包含2个、斑马鱼(NM_001013269.3)一个也没有。结果表明,ScTLR3基因的稳定性不及草鱼、人、团头鲂和斑马鱼。氨基酸序列对比分析发现,ScTLR3是一个保守型很高的基因,ScTLR3与草鱼TLR3相似度高达96%,与其他鲤科鱼类(团头鲂、斑马鱼、稀有鮈鲫、鲫等)相似度也达到了达82%以上,这提示ScTLR3很可能是赤眼鳟体内一种重要的基础分子。结构域分析发现,ScTLR3主要由胞外的LRRs结构域、TM结构域和胞内的TIR结构域组成,具有TLRs的典型结构。3D模型显示ScTLR3基因LRRs结构域为典型的马蹄形结构,有资料证明,该结构能与dsRNA形成稳定的二聚体,有利于dsRNA的识别[34,35]。
3.2ScTLR3表达特征
不同物种TLR3 mRNA在健康个体组织中的表达情况有所差异。Su等[7]定量检测未经GCRV攻毒的稀有鮈鲫,发现TLR3在鳃、心脏、肠、体肾、肝脏、肌肉和脾脏中均有表达,在肝脏、肌肉和体肾中表达量较高。Yang等[36]定量检测健康鲤鳃、心脏、肠、体肾、肝脏、肌肉和脾脏中TLR3的表达量,发现鲤肌肉和心脏中TLR3表达量较低,而在肠、体肾和肝脏中表达量较高。在本实验中,ScTLR3 mRNA在被检测的10个组织中均有表达,在肝脏中的表达量极显著的高于其他9个组织,这可能与组织的功能差异有关。
大量诱导表达实验表明,鱼类TLR3基因能被dsRNA病毒、dsRNA类似物poly(I∶C)或DNA病毒诱导表达[37]。Su等[8]用GCRV感染草鱼后发现,草鱼脾脏中TLR3的表达量在1—7d均上调表达,1—2d上升到对照组的3倍以上,除第4天略微下降外,至第7天(实验结束)一直上升。Huang等[16]定量检测注射poly(I:C)的大黄鱼,发现其脾脏组织TLR3表达量在注射后6h显著上升,之后逐步下降,至48h下降到初始水平; 而肝脏中在24h前上升较为缓慢,至48h迅速上升,达到最大值。Hu等[14]发现感染大菱鲆虹彩病毒(Turbot reddish body irido-virus,TRBIV)后,大菱鲆肝脏和肌肉中TLR3表达量在1d迅速上升,然后缓慢下降至第5天达到初始水平。在本实验中,赤眼鳟在感染GCRV后赤眼鳟肝脏、脾脏和体肾中的TLR3 mRNA的表达特征相似,整体表现为先上升后下降,然后小幅上升,最后回归初始水平,在24h出现表达量峰值。这一结果与Phelan等[9]用SHRV感染斑马鱼成鱼后TLR3的表达情况相似,与Su等[8,38]用GCRV感染稀有鮈鲫后鳃中TLR3表达特征以及GCRV感染草鱼后脾脏中TLR3表达特征不同。另外,赤眼鳟在感染GCRV后,头肾中的TLR3 mRNA表达量在12h迅速上升,在72h迅速达到第二表达峰值,这一结果较草鱼和稀有鮈鲫TLR3表达变化更加快速,但是否与赤眼鳟对GCRV抗性有关需要进一步研究证明。
4 结论
ScTLR3主要由富亮氨酸结构域(LRRs)、跨膜结构域(TM)和Toll/白介素-1受体结构域(TIR)组成,具有TLRs的典型结构特征,在健康赤眼鳟肝脏中特异性表达; GCRV攻毒后,ScTLR3 mRNA在赤眼鳟肝脏、脾脏、体肾和头肾中的表达水平显著升高,这些结果提示TLR3在赤眼鳟抵抗GCRV入侵反应中发挥了重要作用。
[1]Akira S,Uematsu S,Takeuchi O. Pathogen recognition and innate immunity [J]. Cell,2006,124(4):783—801
[2]Takeda K,Kaisho T,Akira S. Toll-like receptors [J]. Annual Review of Immunology,2003,21(1):335—376
[3]Anderson K V,Jürgens G,Nüsslein-Volhard C. Establishment of dorsal-ventral polarity in the drosophila embryo:genetic studies on the role of the Toll gene product[J]. Cell,1985,42(3):779—789
[4]Sangrador-Vegas A,Martin S A M,O'Dea P G,et al. Cloning and characterization of the Rainbow trout(Onco-rhynchus mykiss) type Ⅱ interleukin-1 receptor cDNA[J]. European Journal of Biochemistry,2000,267(24):7031—7037
[5]Roach J C,Glusman G,Rowen L,et al. The evolution of vertebrate Toll-like receptors [J]. PNAS,2005,102(27):9577—9582
[6]Wu B,Peisley A,Richards C,et al. Structural basis for dsRNA recognition,filament formation,and antiviral signal activation by MDA5 [J]. Cell,2012,152(1—2):276—289
[7]Su J,Zhu Z,Wang Y,et al. Toll-like receptor 3 regulates Mx expression in rare minnow Gobiocypris rarus after viral infection [J]. Immunogenetics,2008,60(3—4):195—205
[8]Su J,Jang S,Yang C,et al. Genomic organization and expression analysis of Toll-like receptor 3 in grass carp(Ctenopharyngodon idella) [J]. Fish & Shellfish Immunology,2009,27(3):433—439
[9]Phelan P E,Mellon M T,Kim C H. Functional characterization of full-length TLR3,IRAK-4,and TRAF6 in zebrafish(Danio rerio) [J]. Molecular Immunology,2005,42(9):1057—1071
[10]Zhang Y B,Jiang J,Chen Y R,et al. The innate immune response to grass carp hemorrhagic virus(GCHV) in cultured Carassius auratus blastulae(CAB) cells [J]. Developmental & Comparative Immunology,2007,31(3):232—243
[11]Oshiumi H,Tsujita T,Shida K,et al. Prediction of the prototype of the human Toll-like receptor gene family from the pufferfish,Fugu rubripes,genome [J]. Immunogenetics,2003,54(11):791—800
[12]Rodriguez M F,Wiens G D,Purcell M K,et al. Characterization of Toll-like receptor 3 gene in rainbow trout(Oncorhynchus mykiss) [J]. Immunogenetics,2005,57(7):510—519
[13]Samanta M,Basu M,Swain B,et al. Molecular cloning and characterization of toll-like receptor 3,and inductive expression analysis of type I IFN,Mx and pro-inflammatory cytokines in the Indian carp,rohu(Labeo rohita) [J]. Molecular Biology Reports,2013,40(1):225—235
[14]Hu G B,Li X P,Liu D H,et al. A toll-like receptor 3 homologue that is up-regulated by poly I:C and DNA virus in turbot Scophthalmus maximus [J]. Journal of Fish Biology,2015,86(2):431—447
[15]Matsuo A,Oshiumi H,Tsujita T,et al. Teleost TLR22 recognizes RNA duplex to induce IFN and protect cells from birnaviruses [J]. The Journal of Immunology,2008,181(5):3474—3485
[16]Huang X,Wang Z,Yao C. Characterization of Toll-like receptor 3 gene in large yellow croaker,Pseudosciaena crocea [J]. Fish & Shellfish Immunology,2011,31(1):98—106
[17]Bilodeau A L,Waldbieser G C. Activation of TLR3 and TLR5 in channel catfish exposed to virulent [J]. Developmental & Comparative Immunology,2005,29(8):713—721
[18]Magnadóttir B. Innate immunity of fish(overview) [J]. Fish & Shellfish Immunology,2006,20(2):137—151
[19]Magnadottir B. Immunological control of fish diseases[J]. Marine Biotechnology,2010,12(4):361—379
[20]Stetson D B,Medzhitov R. Type I interferons in host defense [J]. Immunity,2006,25(3):373—381
[21]McNab F,Mayer-Barber K,Sher A,et al. Type I interferons in infectious disease [J]. Nature Reviews Immunology,2015,15(2):87—103
[22]Chen L,Li Q,Su J,et al. Trunk kidney of grass carp(Ctenopharyngodon idella) mediates immune responses against GCRV and viral/bacterial PAMPs invivo and invitro [J]. Fish & Shellfish Immunology,2013,34(3):909—919
[23]Liu Q L,Xiao T Y,Liu M,et al. Research Progress of Biology in Squaliobarbus curriculus [J]. Fisheries Science,2012,31(11):687—691 [刘巧林,肖调义,刘敏,等. 赤眼鳟生物学研究进展. 水产科学,2012,31(11):687—691]
[24]Liu Q L. Studies on genetic characteristics and grass carp reovirus resistance of F1hybrids between grass carp(Ctenopharyngodon idellus) and barbel chub(Squaliobarbus curriculus) [D]. Changsha:Hunan Agricultural University. 2013 [刘巧林. 草鱼与赤眼鳟杂交F1遗传特征及对草鱼呼肠孤病毒抗性的研究. 长沙:湖南农业大学. 2013]
[25]Tatematsu M,Seya T,Matsumoto M. Beyond dsRNA:Toll-like receptor 3 signalling in RNA-induced immune responses [J]. Biochemical Journal,2014,458(2):195—201
[26]Tatematsu M,Nishikawa F,Seya T,et al. Toll-like receptor 3 recognizes incomplete stem structures in singlestranded viral RNA [J]. Nature Communications,2013,4(5):1833
[27]Alexopoulou L,Holt A C,Medzhitov R,et al. Recognition of double-stranded RNA and activation of NF-kB by toll-like receptor 3 [J]. Nature,2001,413(18):732—738
[28]Moor C H D,Meijer H,Lissenden S. Mechanisms of translational control by the 3′UTR in development and differentiation [J]. Seminars in Cell & Developmental Biology,2005,16(1):49—58
[29]Mazumder B,Seshadri V,Fox P L. Translational control by the 3′-UTR:the ends specify the means [J]. Trends in Biochemical Sciences,2003,28(2):91—98
[30]Zhang Y,Sturgis E M,Sun Y,et al. A functional variant at miRNA-122 binding site in IL-1α 3′UTR predicts risk and HPV-positive tumours of oropharyngeal cancer [J]. European Journal of Cancer,2015,51(11):1415—1423
[31]Qian X,Huang X X,Leng X J,et al. cDNA sequence analysis and tertiary structure prediction of Toll-like re-ceptor 3 gene from Carassius auratus gibelio [J]. Journal of Fisheries of China,2008,32(2):190—199 [钱曦,黄旭雄,华雪铭,等. 异育银鲫Toll样受体3的cDNA序列分析与蛋白质高级结构预测. 水产学报,2008,32(2):190—199]
[32]Kracht M,Saklatvala J. Transcriptional and post-transcriptional control of gene expression in inflammation [J]. Cytokine,2002,20(3):91—106
[33]Luchin A I,Nadella M V P,Thudi N K,et al. AU-rich elements in the 3'-UTR regulate the stability of the 141 amino acid isoform of parathyroid hormone-related protein mRNA [J]. Molecular and Cellular Endocrinology,2012,364(1—2):105—112
[34]Liu L,Botos I,Wang Y,et al. Structural basis of toll-like receptor 3 signaling with double-stranded RNA [J]. Science,2008,320(5874):379—381
[35]Jungwoo C,Kelker M S,Wilson I A. Crystal structure of human toll-like receptor 3(TLR3) ectodomain [J]. Science,2005,309(5734):581—585
[36]Yang C,Su J. Molecular identification and expression analysis of Toll-like receptor 3 in common carp Cyprinus carpio [J]. Journal of Fish Biology,2010,76(8):1926—1939
[37]Fan Z J,Zou P F,Yao C L. Toll-like receptors(TLR) and its signaling pathway in teleost [J]. Acta Hydrobiologica Sinica,2015,39(1):173—184 [范泽军,邹鹏飞,姚翠鸾.鱼类Toll样受体及其信号传导的研究进展. 水生生物学报,2015,39(1):173—184]
[38]Su J G,Zhu Z Y,Wang Y P. Up-regulating expressions of Toll-like receptors 3 and Mx genes in gills by grass carp reovirus in rare minnow,Gobiocypris rarus [J]. Acta Hydrobiologica Sinica,2008,32(5):728—734 [苏建国,朱作言,汪亚平. 草鱼呼肠孤病毒上调稀有鮈鲫鳃中TLR3和Mx基因的表达. 水生生物学报,2008,32(5):728—734]
MOLECULAR CLONING AND EXPRESSION ANALYSIS OF TOLL-LIKE RECEPTOR 3 GENE IN BARBEL CHUB SQUALIOBARBUS CURRICULUS
XIAO Tiao-Yi1,2,LI Wei1,WANG Rong-Hua1,LIU Qiao-Lin1,2,PENG Hui-Zhen1,2and SU Jian-Ming1,3
(1. Hunan Engineering Technology Research Center of Featured Aquatic Resources Utilization,Hunan Agricultural University,Changsha 410128,China; 2. Collaborative Innovation Center for Efficient and Health Production of Fisheries in Hunan Province,Changde 415000,China; 3. College of Animal Veterinary and Medicine,Hunan Agricultural University,Changsha 410128,China)
To investigate whether the toll-like receptor 3(ScTLR3) gene involve in antiviral immune response,TLR3 full-length cDNA in barbel chub(Squaliobarbus curriculus) was cloned and characterized with RACE technique and grass carp reovirus(GCRV) infection was used The method of real-time qPCR was used to examine the expression of ScTLR mRNA in 10 different tissues and the relative expression in liver,spleen,trunk kidney and,head kidney after infection at different times. The results showed that the full-length cDNA of ScTLR3 was 4043 bp including a 216 bp 5′-terminal untranslated region(UTR),an 1112 bp 3′-terminal untranslated region(UTR) and a 2715 bp open reading frame(ORF) encoding a polypeptide of 904 amino acid residues. The putative isoelectric point(pI) and molecular weight(Mw) of ScTLR3 were 8.76 and 102.67 kD,respectively. The ScTLR motifs were consisted of N-terminal signal peptide(SP),14 leucine-rich repeats(LRRs),transmembrane domain(TM),and the Toll/IL-1 Receptors domain(TIR) in C-terminal. ScTLR3 mRNA was expressed in all tested tissues,and its expression in liver was extremely significant higher than other tested tissues in health barbell chub(P<0.01). GCRV infection induced the ScTLR expression in liver,spleen,trunk kidney,and head kidney. Compared with the control group,the ScTLR mRNA expression levels in liver,spleen and trunk kidney tissues of barbel chub was induced 5-,7-,and 6- fold at 24h post infection,respectively. These results suggest that ScTLR3 may play an important role in the immune response of barbel chub against GCRV infection.
Squaliobarbus curriculus; Toll-like Receptor 3; Molecular cloning; Expression characterizations
Q781
A
1000-3207(2016)05-0894-08
10.7541/2016.115
2015-10-30;
2016-04-21
国家自然科学基金面上项目(31272652); 国家自然科学基金青年项目(31402289); 湖南农业大学科学基金项目(13YJ04)资助[Supported by the National Natural Science Foundation of China(31272652,31402289); Science Foundation of Hunan Agricultural University(13YJ04)]
肖调义(1964—),男,湖南邵阳人; 教授; 研究方向为水产动物遗传育种。E-mail:tyx1128@163.com;李伟(1989—),男,湖南常德人; 硕士研究生; 研究方向为水产动物遗传育种。E-mail:match10@qq.com
肖调义,E-mail:tyx1128@163.com

