基于HepG2细胞模型的香菇柄粉多酚抗氧化及抗增殖活性
李 谣,陈金龙,夏春燕,卢可可,吴素蕊,明 建,3,*(.西南大学食品科学学院,重庆 40075;.中华全国供销合作总社昆明食用菌研究所,云南 昆明 6503;3.西南大学 国家食品科学与工程实验教学中心,重庆 4 0075)
基于HepG2细胞模型的香菇柄粉多酚抗氧化及抗增殖活性
李 谣1,陈金龙1,夏春燕1,卢可可1,吴素蕊2,明 建1,3,*
(1.西南大学食品科学学院,重庆 400715;2.中华全国供销合作总社昆明食用菌研究所,云南 昆明 650223;3.西南大学 国家食品科学与工程实验教学中心,重庆 4 00715)
以人肝癌细胞HepG2为细胞模型,经过不同粉碎条件处理香菇柄粉后,研究香菇柄粉游离酚的细胞抗氧化及多酚抗增殖活性。结果表明:香菇柄粉游离酚的细胞抗氧化活性(cellular antioxidant activity,CAA)值为9.90~24.22 μmol QE/100 g,普通粉碎组最高,纳米超微粉碎组最低,CAA值随粉体粒径减小而降低(不经磷酸盐缓冲液(phosphate buffer saline,PBS)清洗);气流超微粉碎组CAA值为0.65 μmol QE/100 g,普通粉碎组和纳米超微粉碎组未表现出细胞抗氧化活性(PBS清洗)。香菇柄粉游离酚的抗增殖活性(半数有效浓度(median effective concentration,EC50)值)为1.888~5.213 mg/mL,结合酚的抗增殖活性(EC50值)为2.225~4.751 mg/mL,气流超微粉碎处理对香菇柄粉结合酚的抗增殖活性有增强作用。
香菇柄粉;多酚;细胞抗氧化活性;抗增殖活性
香菇(Lentinus edodes(Berk.)sing)又名香蕈、香信、香菌、冬菇,是仅次于双胞蘑菇的世界第二大食用菌[1]。作为一种药食两用真菌,香菇不仅营养丰富,还具有降血脂、降血压、抗菌、延缓衰老、免疫调节和抗肿瘤等多种生理活性[2-4]。香菇的食用部分由菌伞和菌柄两部分组成,分别占干质量的75%和25%,两者的化学成分有很大的不同,刘存芳等[5]研究发现每100 g干香菇菌柄中含糖类物质73 g、蛋白质6.8 g、脂溶性成分2.68 g、灰分6.1 g,还含有大量的维生素、矿物质,具有较高的营养价值,但是菌柄因不溶性粗纤维含量较高(约38 g/100 g),难以咀嚼,多被丢弃,不仅造成了极大的浪费还产生了许多环境问题[6]。目前,微粉化已被证明是一种改善富含纤维植物食品质地的有效方法,所以将香菇柄进行粉碎处理是对其开发利用的有效途径之一[7-9]。
对于香菇多酚抗氧化活性的研究,目前主要是通过化学分析法进行测定,主要方法有1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除法、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)自由基清除法、羟自由基清除法、铁还原力法、β-胡萝卜素亚油酸法以及氧化自由基吸收能力法(oxygen radical absorbance capacity,ORAC)等,如Cheung等[10]研究发现香菇多酚比草菇具有更强的自由基清除活性,在β-胡萝卜素和亚油酸体系的抗氧化活性达到75.9%(20 mg/mL),DPPH自由基清除率为55.4%(6 mg/mL),自由基介导的红细胞氧化性溶血抑制率为94.9%(5 mg/mL)。但是化学抗氧化分析方法是在体外进行的,不能反映机体对抗氧化剂的摄入情况以及机体内复杂的环境对抗氧化剂作用效果的影响。美国康奈尔大学刘瑞海教授于2007年建立了细胞抗氧化活性(cellular antioxidant activity,CAA)评价方法[11-13]。此方法以人体肝癌细胞HepG2为实验模型,观察抗氧化物质在细胞内的生物利用、分布、吸收和代谢等情况,比传统的化学分析法更具有生物相关性,且实验周期短、测定程序简单,是一种测定抗氧化活性更合理的方法。
本实验将香菇柄干燥后分别进行普通粉碎、气流超微粉碎、纳米超微粉碎处理,以人肝癌细胞HepG2为细胞模型,研究不同粉碎处理后香菇柄粉多酚物质的细胞抗氧化及抗增殖活性,为合理利用香菇柄、开发香菇柄功能产品提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
香菇“808”购于重庆北碚农贸市场。
丙酮、氢氧化钠、浓盐酸、正己烷、乙酸乙酯、甲醇、没食子酸、福林-酚试剂、碳酸钠均为分析纯 成都科龙化工试剂厂;二甲苯、磷酸盐缓冲液(phosphate buffer saline,PBS)均为分析纯 美国Fisher公司;2,2’-偶氮二异丁基脒二盐酸盐(2,2’-azobis(2-amidinopropane) dihydrochloride,ABAP)为分析纯 美国Wako化学试剂公司;二甲基亚砜(dimethyl sulfoxide,DMSO)、2’,7’-二氯荧光素二乙酸酯(2’,7’-dichlorodihydrofluorescein diacetate,DCFH-DA)均为分析纯,青霉素、链霉素、庆大霉素均为生化试剂 美国Sigma公司;Hank平衡盐溶液(Hank balanced salt solution,HBSS)、WME培养基(William’s medium E)、表皮生长因子、肝素、胰岛素以及其他细胞培养试剂均为生化试剂 美国Gibco生物科技公司;胎牛血清(fetal bovine serum,FBS) 美国Atlanta生物科技公司;HepG2人体肝癌细胞 美国模式培养物集存库(American Type Culture Collection,ATCC)。
1.2 仪器与设备
JYL-C012型高速粉碎机 九阳股份有限公司;YSC-701型超微粉碎机 北京燕山正德机械有限公司;LNJ-120型气流粉碎机 绵阳流能粉体设备有限公司;CJM-SY-B型高能纳米冲击磨 秦皇岛市太极环纳米制品有限公司;BHC-II A2系列生物安全柜 苏净安泰空气技术有限公司;5180R型冷冻离心机 德国Eppendorf公司;DM IRB型倒置显微镜 德国Leica仪器有限公司;HERA cell 240型CO2培养箱 美国Thermo公司;T75细胞培养瓶、96孔黑色底部透明微孔板、96孔白色底部透明微孔板 美国Corning公司。
1.3 方法
1.3.1 材料预处理
香菇采摘后24 h内运输至实验室,挑选无病虫害、大小均匀的个体,小心用水洗干净后,将香菇柄沿香菇伞1 cm处切分。摆放在通风处至表面干燥,低温烘干(45~60 ℃)至水分含量低于10%。
1.3.2 不同粉碎方式处理
普通粉碎香菇柄粉(coarse milled stipe,CMS):烘干的香菇柄经高速粉碎机粉碎后,过100 目筛,得到普通粉碎香菇柄粉;气流超微粉碎香菇柄粉(jet milled stipe,JMS):将普通粉碎的香菇柄粉用LNJ-120气流粉碎机粉碎2 h,得到气流超微粉碎香菇柄粉,经Mastersizer 2000激光粒度测定仪测得香菇柄粉平均粒径分别为7.00、7.05 μm;纳米超微粉碎香菇柄粉(nanomicronized stipe,NMS):将普通粉碎的香菇柄粉用CJM-SY-B高能纳米冲击磨(不锈钢粉碎腔体,氧化锆球粉碎磨介,5~35 ℃调频)粉碎处理6 h,制得纳米超微粉碎香菇柄粉,经Mastersizer 2000激光粒度测定仪测得香菇柄粉平均粒径分别为0.54 μm和0.46 μm,最后于干燥阴凉处密封保藏,备用。
1.3.3 香菇柄粉多酚制备[14-15]
准确称取香菇柄粉2.0 g,加入丙酮(80%,4 ℃冷藏)50 mL,漩涡振荡5 min后用均质机(12 000 r/min)均质3 min,于高速离心机中2 500×g分离10 min,取上清液。滤渣重复以上操作,并合并2 次的提取液,抽滤后将滤液转移至圆底烧瓶,用旋转蒸发仪在45 ℃旋转蒸干。用超纯水定容至25 mL,-80 ℃条件下贮存备用,此为香菇柄粉游离酚(free polyphenol)。向残渣中加入20 mL 2 mol/L NaOH溶液,在氮气环境下消化90 min,用盐酸调至pH 2.0,然后使用正己烷除脂并弃去油脂层,加入30 mL乙酸乙酯,振荡10 min后,4 000×g离心10 min,取上清液。乙酸乙酯重复提取5 次,合并上清液,抽滤后将滤液转移至圆底烧瓶,用旋转蒸发仪在45 ℃旋转蒸干。用超纯水定容至25 mL,-80℃条件下贮存备用,此为香菇柄粉结合酚(bound polyphenol)。多酚含量用福林-酚法进行测定[16]。
1.3.4 细胞培养
[17-18]的方法进行培养。HepG2细胞在含5% FBS的完全生长培养基(WME、2 mmol/L谷氨酸盐、10 mmol/L 4-羟乙基哌嗪乙磺酸(2-[4-(2-hydroxyethyl)-1-piperazinyl]ethanesulfonic acid,Hepes)、5 μg/mL胰岛素、0.05 μg/mL氢化可的松、50 U/mL青霉素、50 μg/mL链霉素、100 μg/mL庆大霉素)中,37 ℃、5% CO2条件下培养。
1.3.5 细胞抗氧化活性测定[12,18]
将对数生长期的HepG2细胞接种到96孔板中(只接种内部孔,为防止边缘效应),每孔细胞数约为6×104个,于37 ℃、5% CO2条件下培养24 h后,移去残余培养基,PBS清洗1 次。加入新鲜培养基、香菇柄粉游离酚(终质量浓度梯度为0、1、2、4、6、8、10 mg/mL)、DCFH-DA荧光探针溶液(终浓度为25 μmol/L)以及标准品槲皮素(终浓度梯度为0、1、2、4、6、8、10 μmol/L)。
将上述96孔板,于37 ℃、5% CO2条件下继续培养1 h,移去残余培养液,然后加入100 μL/孔PBS,清洗一次或不经PBS清洗,加入100 μL/孔ABAP溶液(终浓度为600 μmol/L),然后,立即于发射波长538 nm,入射光波长485 nm条件下测定荧光强度,每5 min测定一次,测定1 h。对照组用DCFH-DA和ABAP处理,不加香菇柄粉游离酚;空白组用DCFH-DA处理,不加入ABAP和香菇柄粉游离酚。
减去空白和初始荧光值后,香菇柄粉游离酚质量浓度对应时间-荧光值曲线下的面积即为CAA值,计算公式如下。

式中:∫SA为加入不同质量浓度香菇柄粉游离酚提取物后的时间-荧光值曲线下积分面积;∫CA为空白组的时间-荧光值曲线下积分面积。
香菇柄粉游离酚提取物的半数有效质量浓度(median effective concentration,EC50)根据lg(fa/fu)对lg(剂量)的中效原理来计算[19],式中:fa为香菇柄粉游离酚作用效应(CAA值);fu为(1-CAA)值,EC50值以3 次平行实验结果取计算平均值,再将EC50值转化为CAA值。香菇柄粉游离酚的CAA值以每100 g香菇柄粉相当于槲皮素的含量表示(μmol QE/100 g)。
1.3.6 细胞毒性测定[12,16-17]
取对数生长期的HepG2细胞接于96孔白板,使每孔细胞数约为4×104个,于37 ℃、5% CO2培养24 h后,移去残余培养基,PBS清洗1 次。其中,样品孔中加入100 μL含香菇柄粉多酚的培养基(每个质量浓度梯度做3 个平行孔)。控制孔中加入100 μL的培养基,于37 ℃、5% CO2条件下培养24 h后开始测板:移去96孔板内残余培养基,PBS清洗1 次,加50 μL/孔亚甲基蓝溶液(98% HBSS、0.67%戊二醛、0.6%亚甲基蓝)染色,于37 ℃培养1 h,然后移去染色液,并用去离子水清洗该96孔板至清洗液无色,吸去板中多余水分并风干2~3 min,加100 μL/孔洗脱液(49% PBS、50%乙醇、1%醋酸),然后漩涡振荡20 min,使孔内已染色的细胞形成均匀的细胞悬浮液。最后,于570 nm波长处读取各孔中染色细胞悬浮液的吸光度。减少的吸光度计算公式如下。

1.3.7 细胞抗增殖能力的测定[12,20-21]
取对数生长期的HepG2细胞接于96孔板,使每孔细胞数约为2.5×104个,于37 ℃、5% CO2培养24 h后,移去残余培养基,PBS清洗1 次。其中,样品孔中加入100 μL含香菇柄粉多酚的培养基(每个质量浓度梯度做3个平行孔),控制孔中加入100 μL的培养基,于37 ℃、5% CO2条件下培养72 h后开始测板,测板操作同上述细胞毒性实验。细胞增殖抑制率计算公式如下。
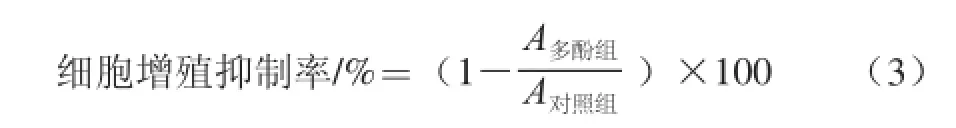
1.4 数据处理
数据采用SigmaPlot12.5统计分析,实验重复3次,结果用±s表示,并用SPSS软件进行统计处理,采用方差分析(analysis of variance,ANOVA)进行Turkey多重比较分析(P<0.05)。
2 结果与分析
2.1 不同粉碎方式处理后的香菇柄粉中多酚含量
不同粉碎方式处理后香菇柄粉中多酚含量如图1所示。总体来看,香菇柄粉总酚含量约为4 mg/g,主要以游离酚为主,约占总多酚含量的94%。与普通粉碎组相比,气流超微粉碎处理组中总酚含量显著上升(P<0.05),而游离酚与结合酚变化差异不显著;在纳米超微粉碎处理组中,游离酚、结合酚、总酚含量均显著下降(P<0.05)。综上所述,气流超微粉碎处理组效果优于纳米超微粉碎组,原因可能是由于气流超微粉碎机的压缩气体在喷嘴处膨胀时可降温,粉碎过程不伴随热量的生成,该处理在较低温度下既能完成。然而纳米超微粉碎是机械的研磨过程,会导致局部升温,对酚类物质产生一定的破坏[22]。张小利等[16]通过高效液相色谱(high performance liquid hromatography,HPLC)对香菇柄多酚进行检测发现,香菇柄多酚主要为没食子酸、儿茶素、咖啡酸、芦丁、阿魏酸和槲皮素,其中游离酚以没食子酸和儿茶素为主,结合酚以没食子酸、儿茶素和槲皮素为主。

图1 不同粉碎方式处理的香菇柄粉中多酚含量Fig. 1 Polyphenol contents of Lentinus edodes stipe powders with different sizes
2.2 基于HepG2细胞模型的香菇柄粉游离酚细胞抗氧化活性

表1 不同粉碎处理的香菇柄粉游离酚CAA值Table 1 CAA values of free polyphenols inLentinus eodes stipe powders with different sizes μmol QE/100 g
HepG2细胞内ABAP产生的过氧 化氢自由基氧化还原型DCFH生成荧光物氧化型二氯荧光素(2’,7’-dichlorofluorescein,DCF),槲皮素标准品和香菇柄粉游离酚作为抗氧化剂抑制了反应的进行,反映在实验中即为荧光强度的减小。细胞抗氧化能力的测定采用了2 种处理方法:不经PBS清洗,主要反映抗氧化剂在细胞膜表面的抗氧化活性;PBS清洗,主要反映抗氧化剂在细胞内部的抗氧化活性。由图2~4可知,槲皮素标准品抑制荧光物DCF生 成的能力明显强于香菇柄游离酚提取液,在2 种处理方法中,槲皮素标准品并没有明显的变化(图2~4中a、b),而对于香菇柄粉游离酚未经PBS清洗处理组抑制DCF生成的能力明显强于经PBS清洗处理组(图2~4中c、d)。

图2 普通粉碎香菇柄粉中游离酚的细胞抗氧化动力学曲线Fig. 2 Cellular antioxidant activity (CAA) kinetic curve of free polyphenols in coarse-milled Lentinus edodes stipe powder


图3 气流超微粉碎香菇柄粉游离酚的细胞抗氧化动力学曲线Fig. 3 CAA kinetic curve of free polyphenols in jet-milled Lentinus edodes stipe powder
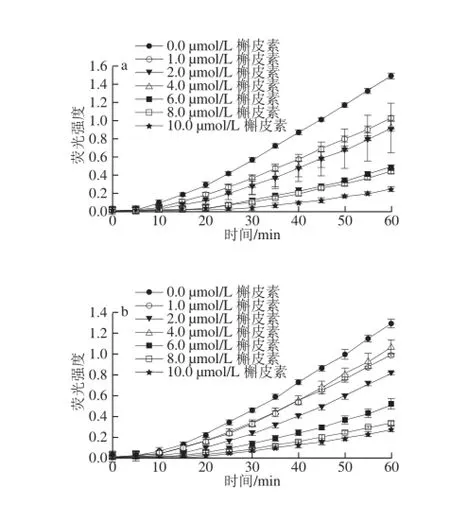
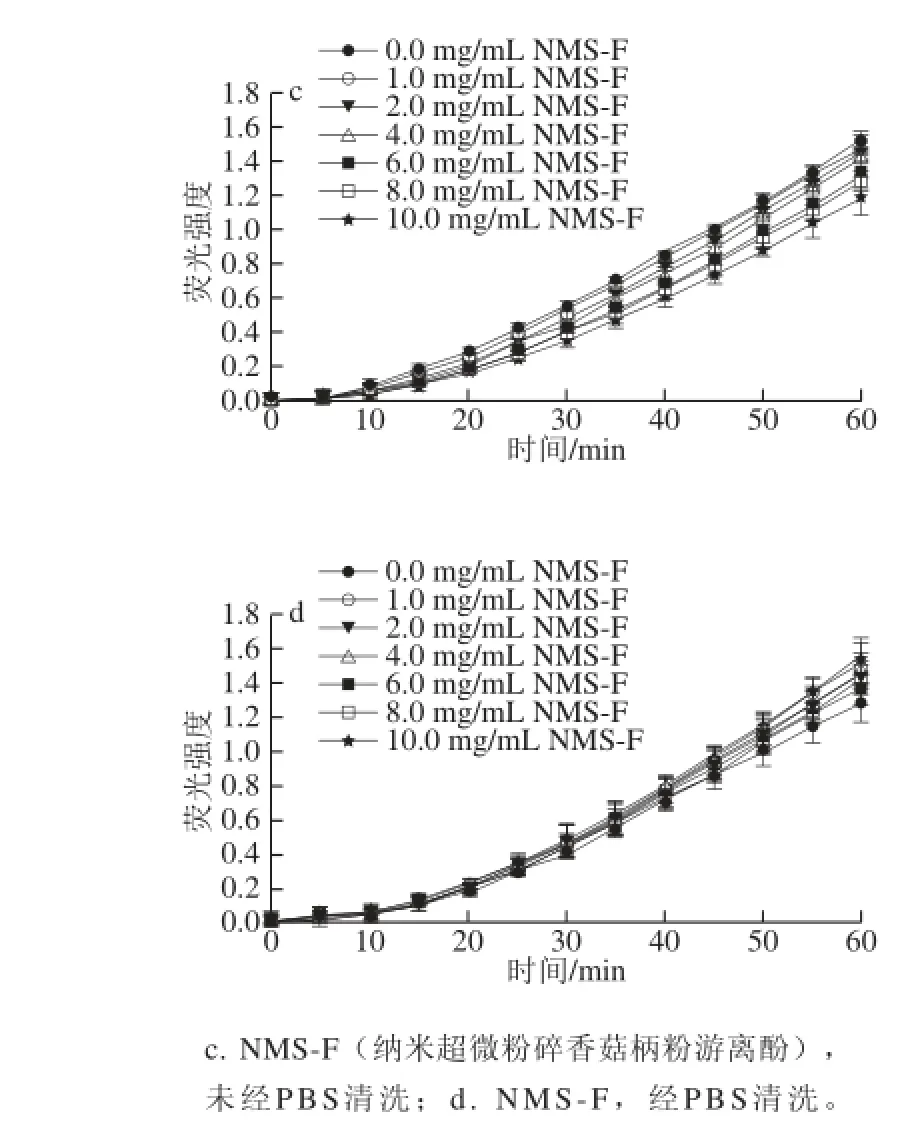
图4 纳米超微粉碎香菇柄粉游离酚的细胞抗氧化动力学曲线Fig. 4 CAA kinetic curve of free polyphenols in nano-micronized Lentinus edodes stipe powder
不同粉碎处理后的香菇柄游离酚细胞抗氧化活性(CAA值)如表1所示。在未经过PBS清洗处理组中,香菇柄粉游离酚CAA值顺序为CMS-F>JMS-F>NMS-F;在经过PBS清洗处理组中,普通粉碎处理组和纳米超微粉碎处理组未检测出具有CAA活性,气流超微粉碎组CAA值为0.65 μmol QE/100 g,可能是由于气流超微粉碎处理能增加香菇柄粉游离酚的溶出率,同时改变多酚的物理结构,使其分子大小及颗粒大小降低,同时增加颗粒表面积,使香菇柄粉游离酚能顺利进入到细胞内呈现出CAA活性[23-24]。Rosa等[25]研究了小麦糠颗粒大小对其抗氧化能力的影响,结果发现,当小麦糠表面积从0.09 m2增加到0.26~0.30 m2时,其抗氧化能力从30 mmol TEAC/kg增加到45 mmol TEAC/kg。整体而言,气流超微粉碎处理能在一定程度上增强香菇柄游离酚的CAA活性,在各个粉碎处理组中,不经过PBS清洗处理的CAA活性显著大于经过PBS清洗处理的CAA活性。
2.3 基于HepG2细胞模型的香菇柄粉多酚抗增殖活性

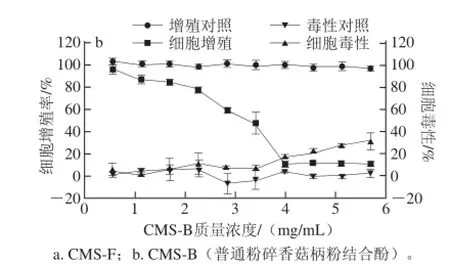
图5 普通粉碎香菇柄粉多酚对HepG2细胞的毒性和增殖抑制作用Fig. 5 Inhibitory effect of polyphenols extracts from coarse-milledLentinus edodes stipe powder on human HepG2 liver cancer cells

图6 气流超微粉碎香菇柄粉多酚对HepG2细胞的毒性和增殖抑制作用Fig. 6 Inhibitory effect of polyphenols extracts from jet-milled Lentinus edodes stipe powder on human HepG2 liver cancer cells
不同粉碎方式处理的香菇柄粉中多酚对HepG2细胞的抗增殖活性和细胞毒性如图5~7所示。普通粉碎处理组中,游离酚(图5a)在质量浓度≥1.71 mg/mL时显示细胞毒性,此时对HepG2细胞增殖的抑制率为45.02%;结合酚(图5b)在质量浓度≥4 mg/mL时显示细胞毒性,此时对HepG2细胞增殖的抑制率为89.33%。气流超微粉碎处理组中,游离酚(图6a)在质量浓度≥2.85 mg/mL时显示细胞毒性,此时对HepG2细胞增殖抑制率为55.14%;结合酚(图6b)在质量浓度≥1.71 mg/mL时显示细胞毒性,此时对HepG2细胞增殖抑制率为44.87%。纳米超微粉碎处理组中,游离酚(图7a)和结合酚(图7b)分别在质量浓度≥3.24 mg/mL、≥4.80 mg/mL时显示细胞毒性,此时对HepG2细胞增殖抑制率均低于20%,可能是由于香菇柄经过纳米超微粉碎处理后,其粒径太小(<1 μm),一方面容易造成香菇柄粉粉体凝结而影响多酚的溶出,另一方面对多酚分子本身也造成一定的破坏,从而使其抗增殖活性降低[26]。由此可知,当达到一定质量浓度时,香菇柄多酚均显示出一定毒性,而在无细胞毒性质量浓度范围内,香菇柄粉游离酚和结合酚提取物对HepG2细胞增殖均有抑制作用。

图7 纳米超微粉碎香菇柄粉多酚对HepG2细胞的毒性和增殖抑制作用Fig. 7 Inhibitory effect of polyphenols extracts from nano-micronizedLentinus edodes stipe powder on human HepG2 liver cancer cells
不同粉碎方式处理后的香菇柄粉中多酚对HepG2细胞的抗增殖EC50值和细胞毒性CC50值如表2所示。香菇柄粉中游离酚EC50值从1.888 mg/mL到5.213 mg/mL,结合酚EC50值从2.225 mg/mL到4.751 mg/mL。其中,在普通粉碎处理组和气流超微粉碎处理组中,游离酚抗增殖活性高于结合酚,而在纳米粉碎处理组中,结合酚抗增殖活性高于游离酚,抗增殖活性大小顺序为CMS-F>JMS-B>JMS-F>CMS-B>NMS-B>NMS-F。因此,气流超微粉碎能在一定程度上增强香菇柄结合酚的抗增殖活性,而纳米超微粉碎对香菇柄多酚的抗增殖活性并没有增强作用。

表2 香菇柄粉多 酚对于HepG2细胞的抗增殖能力(EC50)和细胞毒性(CC50Table 2 Antiproliferation (EC50) and cytotoxicity (CC50) of polyphenols from Lentinus edodes stipe powders with different sizes on human HepG2 liver cancer cells
3 结 论
本实验将香菇柄干燥后分别进行普通粉碎、气流超微粉碎、纳米超微粉碎处理,再以人肝癌细胞HepG2为细胞模型,对不同粉碎处理后香菇柄粉中多酚物质的细胞抗氧化及抗增殖活性进行了研究。结果表明,香菇柄总酚含量约为4 mg/g,主要以游离酚为主,约占总酚的94%。细胞抗氧化活性评价结果显示,未经PBS清洗处理的香菇柄粉中游离酚CAA值为9.90~24.22 μmol QE/100 g,CAA活性顺序为CMS-F>JMS-F>NMS-F;在经PBS清洗处理的普通粉碎处理组和纳米超微粉碎处理组未检测出CAA活性,气流超微粉碎组CAA值为0.65 μmol QE/100 g。因此,未经PBS清洗处理的香菇柄粉中多酚物质的CAA活性显著大于经过PBS清洗处理的CAA活性。同时,在无细胞毒性浓度范围内,香菇柄粉游离酚和结合酚提取物对HepG2细胞增殖均有抑制作用,游离酚EC50值为1.888~5.213 mg/mL,结合酚EC50值为2.225~4.751 mg/mL,抗增殖活性大小为CMS-F>JMS-B>JMS-F>CMS-B>NMS-B>NMS-F。综上所述,香菇柄粉多酚具有一定的细胞抗氧化及抗增殖活性,气流超微粉碎能在一定程度上增强香菇柄粉多酚的细胞抗氧化及抗增殖活性,而纳米超微粉碎对香菇柄粉多酚的抗氧化及抗增殖活性并没有增强作用。
参考文献:
[1] KLEIN M A. Encyclopedia of dietary supplements[M]. New York: Mercel Dekker, 2005: 653-654. DOI:10.1081/E-EDS-120024880.
[2] BISEN P S, BAGHEL R K, SANODIYA B S, et al. Lentinus edodes: a macrofungu s with pharmacological activities[J]. Current Medicinal Chemistry, 2010, 17(22): 2419-2430. DOI:10.2174/092986710791698495.
[3] XU X, YAN H, TANG J, et al. Polysaccharides in Lentinus edodes: isolation, structure, immunomodulating activity and future prospective[J]. Critical Reviews in Food Science and Nutrition, 2014, 54(4): 474-487. DOI:10.1080/10408398.2011.587616.
[4] CHUNG W S, WANG J H, BOSE S, et al. Hepatoprotective effect of Lentinus edodes mycelia fermented formulation against alcoholic liver injury in rats[J]. Journal of Food Biochemistry, 2015, 39(3): 251-262. DOI:10.1111/jfbc.12124.
[5] 刘存芳, 田光辉, 赖普辉. 香菇柄中营养成分的开发与利用综述[J]. 科技信息, 2008(1): 14-14. DOI:10.3969/ j.issn.1001-9960.2008.01.009.
[6] JIANG T, WANG Q, XU S, et al. Structure and composition changes in the cell wall in relation to texture of shiitake mushrooms (Lentinula edodes) stored in modified atmosphere packaging[J]. Journal of the Science of Food and Agriculture, 2010, 90(5): 742-749. DOI:10.1002/ jsfa.3876.
[7] 高虹, 史德芳, 何建军, 等. 超微粉碎对香菇柄功能成分和特性的影响[J]. 食品科学, 2010, 31(5): 40-43.
[8] WANG C C R, CIOU J Y, CHIANG P Y. Effect of micronization on functional properties of the water caltrop (Trapa taiwanensis Nakai) pericarp[J]. Food Chemistry, 2009, 113(4): 970-974. DOI:10.1016/ j.foodchem.2008.08.048.
[9] MING J, CHEN L, HONG H, et al. Effect of superfi ne grinding on the physico-chemical, morphological and thermogravi metric properties of Lentinus edodes mushroom powders[J]. Journal of the Science of Food and Agriculture, 2014, 95(12): 2431-2437. DOI:10.1002/jsfa.6967.
[10] CHEUNG L M, CHEUNG P C K, OOI V E C. Antioxidant activity and total phenolics of edible mushroom extracts[J]. Food Chemistry, 2003, 81(2): 249-255. DOI:10.1016/S0308-8146(02)00419-3.
[11] 夏春燕, 郭晓晖, 李富华, 等. 细胞抗氧化活性方法在食物抗氧化活性评价中的研究进展[J]. 食品科学, 2012, 33(15): 297-302.
[12] WOLFE K L, LIU R H. Cellular antioxidant activity (CAA) assay for assessing antioxidants, foods, and dietary supplements[J]. Journal of Agricultural and Food Chemistry, 2007, 55(22): 8896-8907. DOI:10.1021/jf0715166.
[13] WOLFE K L, LIU R H. Structure-activity relationships of fl avonoids in the cellular antioxidant activity assay[J]. Journal of Agricultural and Food Chemistry, 2008, 56(18): 8404-8411. DOI:10.1021/jf8013074.
[14] SUN J, CHU Y F, WU X Z, et al. Antioxidant and antiproliferative activities of common fruits[J]. Journal of Agricultural and Food Chemistry, 2002, 50(25): 7449-7454. DOI:10.1021/jf0207530.
[15] OKARTER N, LIU C S, SORRELLS M E, et al. Phytochemical content and antioxidant activity of six diverse varieties of whole wheat[J]. Food Chemistry, 2010, 119(1): 249-257. DOI:10.1016/ j.foodchem.2009.06.021.
[16] 张小利, 夏春燕, 王慧清, 等. 超微粉碎对香菇多酚组成及抗氧化活性的影响[J]. 食品科学, 2015, 36(11): 42-49. DOI:10.7506/spkx1002-6630-201511009.
[17] FALLER A L K, FIALHO E, LIU R H. Cellular antioxidant activity of Feijoada whole meal coupled with an in vitro digestion[J]. Journal of Agricultural and Food Chemistry, 2012, 60(19): 4826-4832. DOI:10.1021/jf300602w.
[18] WOLFE K L, KANG X, HE X, et al. Cellular antioxidant activity of common fruits[J]. Journal of Agricultural and Food Chemistry, 2008, 56(18): 8418-8426. DOI:10.1021/jf801381y.
[19] CHOU T C. Theoretical basis, experimental design, and computerized simulation of synergism and antagonism in drug combination studies[J]. Pharmacological Reviews, 2006, 58(3): 621-681. DOI:10.1124/pr.58.3.10.
[20] FELICE D L, SUN J, LIU R H. A modifi ed methylene blue assay for accurate cell counting[J]. Journal of Functional Foods, 2009, 1(1): 109-118. DOI:10.1016/j.jff.2008.09.014.
[21] 王立峰, 陈静宜, 谢慧慧, 等. 薏米多酚细胞抗氧化及HepG2细胞毒性和抗增殖作用[J]. 中国农业科学, 2013, 46(14): 2990-3002. DOI:10.3864/j.issn.0578-1752.2013.14.015.
[22] 张洁, 于颖, 徐桂花. 超微粉碎技术在食品工业中的应用[J]. 农业科学研究, 2010, 31(1): 51-54. DOI:10.3969/ j.issn.1673-0747.2010.01.014.
[23] HEMERY Y M, ANSON N M, HAVENAAR R, et al. Dryfractionation of wheat bran increases the bioaccessibility of phenolic acids in breads made from processed bran fractions[J]. Food Research International, 2010, 43(5): 1429-1438. DOI:10.1016/ j.foodres.2010.04.013.
[24] 姚秋萍, 马亚丽, 李健, 等. 超微粉碎技术对油菜花粉中槲皮素和山奈素溶出率的影响[J]. 食品科学, 2009, 30(6): 43-45. DOI:10.3321/ j.issn:1002-6630.2009.06.004.
[25] ROSA N N, BARRON C, GAIANI C, et al. Ultra-fine grinding increases the antioxidant capacity of wheat bran[J]. Journal of Cereal Science, 2013, 57(1): 84-90. DOI:10.1016/j.jcs.2012.10.002.
[26] 张晶, 王秀全, 王德清, 等. 超微粉碎对人参中皂苷测定量的影响[J]. 食品科学, 2009, 30(18): 96-98. DOI:10.3321/ j.issn:1002-6630.2009.18.017.
Antioxidant and Antiproliferative Activity of Polyphenols in Lentinus edodes Stipe Powder on HepG2 Cells
LI Yao1, CHEN Jinlong1, XIA Chunyan1, LU Keke1, WU Surui2, MING Jian1,3,*
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. Kunming Edible Fungi Institute, All China Federation of Supply and Marketing Cooporatives, Kunming 650223, China; 3. National Food Science and Engineering Experimental Teaching Center, Southwest University, Chongqing 400715, China)
The antioxidant activity of free phenols and anti-proliferation activity of polyphenols in Lentinus edodes stipe powder after different crushing treatments on human liver cancer HepG2 cells were investigated in this study. The results showed that the cellular antioxidant activity (CAA) decreased with the decrease in power size. Specifi cally, the CAA value of free phenols from Lentinus edodes stipe powder ranged from 9.90 to 24.22 μmol QE/100 g; the coarse-ground group indicated the highest CAA value, while and the nano-ground group exhibited the lowest CAA level. The CAA of free phenols in Lentinus edodes stipe powder without washing with phosphate buffer saline (PBS) became lower with decreasing particle size. With PBS washing, only the jet-milled group had antioxidant activity with a CAA value of 0.65 μmol QE/100 g. The antiproliferative activity assay showed that EC50values of free phenols from Lentinus edodes stipe powder were 1.888–5.213 mg/mL while those of bound phenols were 2.225–4.751 mg/mL. This study shows that jet milling can improve the antiproliferative activity of Lentinus edodes stipe powder.
Lentinus edodes stipe powder; polyphenols; cellular antioxidant activity; antiproliferative activity
10.7506/spkx1002-6630-201611033
R151.2
A
1002-6630(2016)11-0190-07
李谣, 陈金龙, 夏春燕, 等. 基于HepG2细胞模型的香菇柄粉多酚抗氧化及抗增殖活性[J]. 食品科学, 2016, 37(11): 190-196. DOI:10.7506/spkx1002-6630-201611033. http://www.spkx.net.cn
LI Yao, CHEN Jinlong, XIA Chunyan, et al. Antioxidant and antiproliferative activity of polyphenols in Lentinus edodes stipe powder on HepG2 cells[J]. Food Science, 2016, 37(11): 190-196. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201611033. http://www.spkx.net.cn
2015-12-15
国家自然科学基金面上项目(31471576);“十二五”国家科技支撑计划项目(2013BAD16B01)
李谣(1992—),女,硕士研究生,研究方向为食品化学与营养学。E-mail:liyao427@163.com
*通信作者:明建(1972—),男,教授,博士,研究方向为食品化学与营养学。E-mail:mingjian1972@163.com

