人类腺苷酸激酶家族中几个新亚型及其功能特点
孔凡志,沈欢欢,姜楠,杨焕民,杨锐
(1.黑龙江八一农垦大学动物科技学院,大庆 163319;2.大庆市人民医院检验科)
人类腺苷酸激酶家族中几个新亚型及其功能特点
孔凡志1,沈欢欢1,姜楠2,杨焕民1,杨锐
(1.黑龙江八一农垦大学动物科技学院,大庆163319;2.大庆市人民医院检验科)
腺苷酸激酶(Adenylate kinase,AK)是一种催化磷酸基团在腺嘌呤核苷酸之间相互转换,从而调节细胞内的不同部分腺嘌呤核苷酸比例的磷酸转移酶。近年来,越来越多的腺苷酸激酶同工酶新亚型被发现,现从编码腺苷酸激酶基因的定位、腺苷酸激酶的底物偏好及其功能等几个方面做了综述,为全面深入了解腺苷酸激酶家族提供了良好的理论基础和新线索。
腺嘌呤核苷酸;腺苷酸激酶;核苷二磷酸激酶
腺苷酸激酶(AK)家族同工酶是细胞内核苷酸合成的机器。核苷酸既是核酸结构的组成部分,又在细胞代谢、许多生物合成途径以及细胞信号转导中作为化学能的来源或作为活化的中间体,又或作为辅酶的成分发挥作用。由于细胞膜上没有其相应的载体蛋白,并且带负电荷的磷酸基团会阻止其通过膜扩散,所以所有核苷酸需要在细胞内合成。在哺乳动物细胞中核苷酸的合成有两种途径,一种称为从头合成途径,另一种为补救途径,这两种途径都涉及到许多核苷和核苷酸激酶。核苷酸合成缺陷会引起一些疾病,但现缺乏有效的治疗方法。增加有关核苷酸的合成代谢途径知识,对于疾病的诊断和治疗非常重要。在研究中,总结了最近几年确定的人类腺苷酸激酶家族中的几个新亚型及其特点。
1 核苷酸
1.1腺嘌呤核苷酸的功能
所有类型的细胞中含有各种各样的核苷酸和它们的衍生物,它们都参与了许多与细胞生长和功能有关的代谢过程。核糖核苷酸和脱氧核糖核苷酸分别是RNA和DNA的单体亚基,除此之外,它们也是辅酶,例如辅酶A,黄素腺嘌呤二核苷酸和烟酰胺腺嘌呤二核苷酸的组成部分。ATP作为化学能的主要存在形式对细胞是极其重要的,它可以充当许多代谢反应的驱动力,也可以作为磷酸供体。环腺苷一磷酸(cAMP)是一种普遍存在的细胞内第二信使,当细胞受到各种激素和化学刺激时cAMP水平升高。cAMP可以激活cAMP依赖性蛋白激酶,从而激活或抑制几种酶的活性,调节特定基因的表达,活化钙离子通道,并且控制糖原合成和分解。AMP调节一些AMP敏感元件,包括糖酵解、糖原分解途径中的感受器和效应器(如K-ATP通道和AMP活化的蛋白激酶),这反过来又可以通过调节钙离子内流和磷酸化靶蛋白来调节细胞能量平衡[1]。ADP在正常血小板聚集中起着关键作用,因此血液才能凝固[2]。腺嘌呤核苷酸的另一个重要功能是在抗病毒和抗肿瘤治疗中作为药理学活性剂使用。
1.2嘌呤核苷酸的从头合成途径
在细胞增殖过程中,通过从头合成途径合成的核苷酸是核DNA复制和转录的主要来源。次黄嘌呤核苷酸(IMP)在腺苷酸从头合成途径中作为AMP和GMP合成的前体。核苷一磷酸激酶(NMPKs)将AMP和GMP分别磷酸化为他们的二磷酸形式ADP和GDP。ADP和GDP由二磷酸核苷激酶(NDPKs)进一步磷酸化为三磷酸形式(ATP和GTP),或者是由核糖核苷还原酶转化为脱氧核糖核苷二磷酸(dADP和dGDP),进而又被NDPKs磷酸化为dATP和dGTP[3]。
1.3嘌呤核苷酸补救合成途径
补救途径是为静态细胞或者终末分化细胞DNA复制、转录和修复过程提供核糖核苷三磷酸(NTPs)和脱氧核糖核苷三磷酸(dNTPs)的。核糖和脱氧核糖核苷分别来源于RNA和DNA中去磷酸化的NTPs和dNTP,或者来源于游离的碱基。核糖核苷和脱氧核糖核苷被一种载体蛋白导入到细胞内。然后,核糖核苷激酶和脱氧核糖核苷激酶分别将核糖核苷和脱氧核糖核苷磷酸化为其单磷酸形式。最后,核苷一磷酸再在NMPKs和NDPKs的催化下经过两个连续的磷酸化步骤生成其三磷酸形式。
2 核苷一磷酸激酶
NMPKs是一种普遍存在于原核生物和真核生物中的酶,能够可逆的催化核苷酸代谢中补救途径和从头途径中单磷酸核苷和三磷酸核苷之间磷酸的转移。这种酶家族根据底物特异性的差异,被进一步分成四个亚型,包括腺苷酸激酶[EC2.7.4.3],尿苷-胞苷酸激酶(UMPCMPK)[EC2.7.4.14],鸟苷酸激酶(GUK)[EC2.7.4.8]和胸苷激酶(dTMPK)[EC2.7.4.9]。与每个亚型具有独特磷酸受体特异性形成鲜明对比的,它们磷酸供体的特异性不高,一般是以ATP作为磷酸供体。NMPKs的一级结构包含三个功能域:结合磷酸供体的甘氨酸富集区(p-loop),底物结合位点以及底物结合后立刻关闭的盖子结构域(lid domain)[4]。dTMPK将dTMP和dUMP分别磷酸化为其二磷酸形式[5]。dTMPK的最佳磷酸供体是ATP,dATP,GTP和dGTP,截至目前,没有嘧啶三磷酸盐可作为磷酸供体的报道。胸苷被发现能抑制dTMPK的活性,除此之外,ADP,dADP,dTDP和dTTP也能表现出抑制作用[6]。该dTMPK基因位于2q37,dTMPK是唯一一个与细胞周期调控有关的NMPK。dTMPK的mRNA水平和酶活性随着细胞周期而波动。在非增殖组织中,dTMPK没有活动或者活动很少,而在显著增殖的组织中dTMPK的活性增加[7]。
除了dTMPK,还有两个具有磷酸化嘧啶核苷单磷酸的酶;胞质UMP-CMPK1和线粒体UMPCMPK2。人类UMP-CMPK1的染色体位置被确定为1q32,UMP-CMPK2的基因组序列位于2p25。UMP-CMPK1能够高效的磷酸化CMP、dCMP和UMP,但是对dUMP、AMP和dAMP的磷酸化效率却很低。Northern印迹分析表明,UMP-CMPK1的mRNA普遍存在于人体组织中,但是在胰腺、骨骼肌和肝脏的水平最高[8]。UMP-CMPK2以ATP作为磷酸供体磷酸化dUMP,dCMP,CMP和UMP,但是磷酸化脱氧核糖核苷酸的效率高于核糖核苷酸。根据现有数据库中UMP-CMPK2的表达谱显示,UMP-CMPK2在骨髓中高表达,而其他组织中少见有其转录[9]。
GUKs催化GMP和dGMP的磷酸化。在人类中,有几个GUK同工酶被报道[10],但仅GUK1已被克隆和表达。GUK的mRNA广泛表达,预期将作为一个基本持家基因,它染色体定位被确定为1号染色体的长臂(1q32-41)。
3 腺苷酸激酶同工酶
腺苷酸激酶是一种参与能量代谢并调节细胞内不同区室腺嘌呤核苷酸比例稳定的酶。它们可逆的催化ATP和AMP之间磷酸基团的转移,并释放2分子ADP。虽然有些AKs可使用其它磷酸盐为供体并磷酸化其它底物,但是所有AK的优选底物是AMP,其主要供体是ATP(表1)。AKs的结构包含三个功能域:包含结合磷酸供体的CORE结构域,LID结构域和底物结合位点(图1)。在没有配体结合的情况下,AK处于“开放式”构象。一旦与磷酸供体(ATP或者其他)结合,伴随着LID domain的关闭,底物就会被结合。发生磷酸基团的转移,会产生两个结合的ADP,其中一个ADP会随着LID domain的打开随后被释放。LID domain的打开会对底物结合位点发出信号使其打开并释放第二个ADP[11-12]。
哺乳动物组织中AK的几种亚型已被确立。人体组织中的九个不同的AK同工酶已被确定和表达,并根据它们被发现的顺序被命名为AK1-AK9。AKs的序列比对和进化树分析如图2和图3。

图1 人类AK1的晶体结构Fig. 1Crystal structure of human AK1

表1 人类AK亚型的基因位点、亚细胞定位、组织分布、磷酸供体和底物特异性Table1Gene locus,subcellular localization,tissue distribution,phosphate donor and substrate specificity of the human AK isoforms
3.1腺苷酸激酶1
AK1是主要的细胞质AK亚型,其基因位于9q32。它在人体大部分组织中都有表达,但在骨骼肌、脑和红细胞中表达量最高。AK1没有磷酸供体特异性,它可以使用所有的三磷酸核苷作为磷酸供体去磷酸化AMP和相对少的dAMP[13-14]。
红细胞中AK1的缺乏是一种与溶血性贫血相关的罕见疾病。虽然有一些病例在AK1低酶活性的基础上被记录和诊断,但是只有极少数病例被鉴定为遗传缺陷。在日本溶血性贫血患者中,发现单个碱基的替换导致AK1第128位精氨酸突变为色氨酸。这种替换导致了AK1的酶活降低为野生型的44%,并引起其轻微的热不稳定性和电泳迁移率的改变。患者的母亲和哥哥有同样的突变,但是却没有贫血的症状。因此,在某些情况下,红细胞可以规避由于AK1不足引起的严重后果。在意大利,一个孩子患有先天性溶血性贫血,其体内AK1的第164位酪氨酸被半胱氨酸替代,引起AK1酶活性下降,酶活下降的原因可能是由于在额外的半胱氨酸残基上形成了二硫键导致的[15-16]。而且,在两例轻度慢性溶血性贫血的病例中,纯合的无义突变导致截短的AK1完全丧失活性。
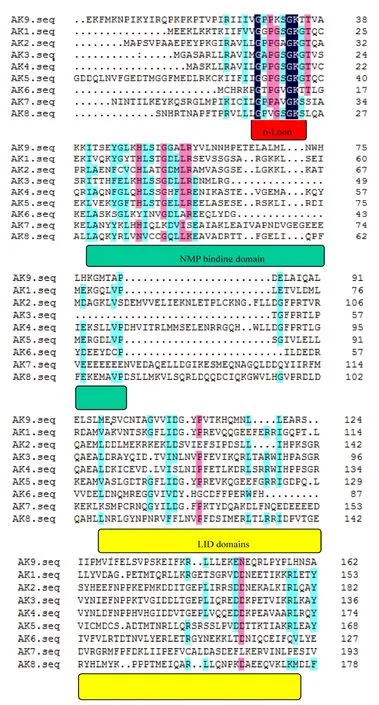
图2 人类AK亚型的序列以及氨基酸序列的比对Fig. 2Amino acid sequence alignment and motifs of human AK isoforms
与野生型小鼠相比,敲除AK1基因的小鼠心脏收缩力减弱,表明心脏对于缺血性应激的耐受力降低。与野生型相比,在缺血心脏中总腺嘌呤核苷酸的含量降低了20%,从而证明了当AK1缺乏时,再灌注会引起更多腺嘌呤核苷酸的损失,从而激活了核苷酸的补救合成途径[17]。在AK1缺陷的小鼠骨骼肌中,由收缩介导的AMPK的磷酸化功能降低,所以AMP的产量也有限。AMPK的激活是一种信号,这种信号对于能量需求的增加非常敏感,它在收缩的肌肉中参与调控葡萄糖的摄入和脂肪酸的氧化[18]。然而,一些研究表明,在AK1敲除的肌肉中,其它AK亚型的存在能完全补偿AK1活性的损失,使得肌肉细胞具有正常的由收缩介导的葡萄糖摄入能力,这是由于AMP的增加和活性氧簇(ROS)的产生激活了AMPK。开始ADP含量的突然增加,是由于ATP水解造成的,进而其它AK亚型将ADP脱磷酸化形成AMP[19]。最近有研究报道,AK-1作为SIRT2的抑制剂,在人HCT116结肠癌细胞中通过下调导致细胞周期阻滞,细胞增殖缓慢;在HT-29结肠癌细胞中AK-1也会对Snail-p21进行调节,因此,AK-1作为SIRT2的抑制剂将在结肠癌的治疗中发挥作用[20]。

图3 人类AKs的进化树Fig. 3Phylogenetic tree of human AK isoforms
3.2腺苷酸激酶2
AK2是位于线粒体内膜中的主要腺苷酸激酶亚型,其基因位于1p34[21]。Northern blot分析表明,AK2的mRNA在肝脏,心脏,骨骼肌和胰腺中含量较高,在肾脏,胎盘和大脑中略少。然而,AK2的蛋白在肝,肾和心脏中呈高表达,在肺和骨骼肌中呈低表达[22]。
线粒体中AK2的缺陷与人类疾病相关。已有文献表明,编码AK2的基因突变与网状组织发育不全有关,这是先天性人类联合免疫缺陷病最严重的形式。该疾病的症状主要是粒细胞和淋巴细胞较少甚至没有,胸腺和次级淋巴器官发育不全,先天性、适应性体液免疫和细胞免疫缺陷。该酶在线粒体中的定位暗示其在造血前体细胞增殖和凋亡的能量需求中起着关键作用[23]。最近的研究表明,网状组织发育不全除了能引起出生几天后的致命性败血症,还能引起感觉神经性耳聋[24]。有关AK2在细胞凋亡中的作用中,有研究表明AK2能与FADD和Caspase-10结合形成复合物从而激活一种新的细胞凋亡通路[25]。
3.3腺苷酸激酶3
AK3位于线粒体基质中,它在肝,脑,心脏,骨骼肌和肾脏中高表达[26]。人类AK3基因的染色体定位于9号染色体的短臂(9p24)。AK3对底物和磷酸供体的要求具有特异性,因为它仅可以使用GTP和ITP来磷酸化AMP。
3.4腺苷酸激酶4
1992年,人类AK4基因被确定,因为其序列与牛AK3的非常相似,所以它最初被命名为AK3[27]。然而,当小鼠和大鼠的AK4被鉴定后,人类AK3被重命名为人类AK4,因为它与鼠的AK4的序列有较高相似性[28]。AK4存在于线粒体基质,其基因位于1p31[26]。该酶主要在富含线粒体的组织中表达,如脑,心脏,肾脏和肝脏。AK4既可以以ATP或GTP作为磷酸供体催化dAMP,CMP和dCMP的磷酸化,又可以以UTP作为磷酸供体磷酸化AMP。将AK4的基因序列导入线粒体后,发现位于其N端第11位的氨基酸残基,与磷酸供体结合区域非常接近。导入分析表明,线粒体中导入的序列不被切割,因此在进入线粒体以后该酶仍然保持其活性[29]。ADP/ATP移位酶(ANT)是一种线粒体内膜蛋白,其可以与线粒体外模上的电压依赖性阴离子通道(VDAC)形成复合物(VDACANT)。VDAC-ANT复合物的最重要的功能是使ADP穿梭进入线粒体并将ATP泵出线粒体,从而维持细胞的能量平衡。有研究报道ANT为AK4的相互作用蛋白质,发现其与AK4能够发生相互作用。因此AK4可以调节腺苷酸平衡,从而影响细胞的存活和增殖。此外,由于ANT和VDAC能形成可以调节线粒体膜通透性,因此,我们假设AK4可能是通过与ANT的相互作用间接调节线粒体膜通透性的。
AK4基因在低氧环境下(1%O2,5%CO2,94% N2)培养的人肝癌细胞系(HepG2)和人胚胎肾细胞(HEK293)中的表达呈相反的趋势,在HepG2细胞中AK4的表达明显下调,然而,在HEK293细胞中其表达明显上升,并且HepG2细胞的增殖速度明显减弱,凋亡细胞明显增多;但是,HEK293细胞具有正常的增值速度与凋亡率。暗示,AK4基因的表达对于低氧应激细胞具有保护作用[30]。
3.5腺苷酸激酶5
AK5存在两个主要的变体,它们的区别在于N末端的不同,其中一个变体N末端具有额外的26个氨基酸。AK5定位于细胞质或细胞质和细胞核,这主要决于其具体亚型,与大多数其它AK的多组织表达相比,该酶的几乎只在脑中表达。AK5有两个独立的功能域,分别命名为AK5p1和AK5p2。当以ATP或GTP作为磷酸供体磷酸化AMP,dAMP,CMP和dCMP时,AK5的全酶和它的两个结构域具有相似的活性[31]。人体AK5基因染色体定位于1p31。
在两例非病毒免疫介导的边缘脑炎患者中检测到针对AK5的自身抗体。尽管给以皮质类固醇,免疫球蛋白静脉注射(IVIG)和血浆置换等治疗,但是该患者预后不良,并且迅速发展成老年痴呆症[32]。
3.6腺苷酸激酶6
AK6为定位于细胞核的AK亚型,AMP和dAMP是AK6的首选底物,CMP和dCMP次之。所有的NTPs和dNTPs均可作为其磷酸供体,但CTP和UTP是其首选磷酸供体。AK6的核定位以及磷酸供体的广泛性,表明它可能在调节细胞核中ATP/ADP和GTP/ GDP的比率中发挥作用[33]。尽管AK6的组织分布尚未确定,但根据数据库分析,它几乎在所有的正常组织中表达。AK6的基因位于5号染色体长臂(5q13)。
3.7腺苷酸激酶7
AK7是定位于细胞质的AK亚型,其长度比其它已确定单功能域的AKs要长一些,其他单功能域AKs的长度大约在172到239个氨基酸之间,AK7的全长cDNA表达显示,其能够产生一个含有656个氨基酸的蛋白质,而根据数据库信息,AK7的基因产物预期为723个氨基酸。这是由于在该基因的末端存在终止密码子,所以AK7基因有可能存不只一个转录变构体。该酶不仅可以以ATP作为磷酸供体磷酸化AMP,dAMP,CMP和dCMP,还可以以GTP作为磷酸供体磷酸化AMP,CMP和dCMP。AK7基因的染色体定位于14号染色体的长臂(14q32)。AK7的表达似乎具有组织局限性,主要表达于纤毛上皮细胞丰富的组织中,如肺脏,乳腺,气管,睾丸和骨骼肌中,其活性与纤毛功能有关[34]。
近期研究表明,AK7的表达与人类疾病有关,主要是由于其表达仅限于富含纤毛的上皮细胞组织。运动型纤毛需要动力蛋白臂以及ATP水解产生的丰富能量。纤毛功能障碍会导致一种称为原发性纤毛运动障碍的疾病,这种疾病会导致反复性的呼吸道感染,通常发展成支气管扩张症,在成年期可引起肺衰竭。原发性纤毛运动障碍的患者会伴有一些先天性病症,如脑积水,视网膜变性,听力损伤和智力缺陷。分析吸烟者或曾经有吸烟史人的支气管上皮样细胞的基因表达谱,发现了一些新的支气管富集基因,包括与先天免疫和纤毛形成相关的基因和AK7[35]。AK7基因缺陷小鼠模型表现出原发性纤毛运动障碍的典型病理特征,如微管缺陷,纤毛摆动频率降低,脑积水,精子畸形,粘液积聚和对过敏原的严重呼吸道反应。
3.8腺苷酸激酶8
AK8是另一种定位于细胞质的AK亚型,其基因位于第9号染色体的长臂(9q34)。虽然AK8也像AK5一样有两个结构域,但是与AK5的不同之处在于AK8只存在一个转录变构体。当AK8的两个结构域单独表达时,他们都表现出相似的AK活性。由于该酶有非常高的磷酸化活性,因此AK8蛋白的一条多肽链中可能含有两个功能性结构域。全长AK8和它的两个结构域以ATP作为磷酸供体磷酸化AMP,dAMP,CMP和dCMP,以GTP作为磷酸供体磷酸化AMP,CMP和dCMP。数据库信息显示,AK8主要表达于肝脏,胰腺,肺脏,气管和睾丸中,AK8是在上皮细胞迁移过程中起负调节作用的基因之一[36]。
3.9腺苷酸激酶9
最新发现的AK9基因定位于6q21。AK9的表达谱表明其在脑下垂体,气管,胸腺,睾丸,乳腺中呈高表达,在脑,咽,子宫,脾脏和淋巴结中表达量稍低。用GFP融合蛋白进行亚细胞定位研究表明,该蛋白质缺少亚细胞靶向信号,AK9是一种可以在细胞质和细胞核之间自由扩散的蛋白质。该酶以ATP作为磷酸供体磷酸化AMP,dAMP,CMP和dCMP,而当GTP作为磷酸供体时,主要是CMP被磷酸化[37]。
4 二磷酸核苷激酶
NDPKs的功能是磷酸化核苷二磷酸盐变为相应的核苷三磷酸盐,NDPKs与参与前两步核苷酸磷酸化通路的核苷酸激酶相反,其在底物的选择上没有特异性,它们可以催化所有的嘌呤和嘧啶的核糖核苷和脱氧核糖核苷二磷酸。它们的ATP结合位点没有p-loop结构域。人类NDPKs由nm23基因编码,截至目前,已经发现10个nm23/NDPK的家族成员,它们分别被命名为nm23-H1到nm23-H9,第10个基因被命名为RP2。nm23-H1到nm23-H6这6个基因已经被完全解析。NDPKs催化磷酸基团转移的通路由两个连续的反应组成:(1)组氨酸残基的自我磷酸化和(2)磷酸基团的转移,从磷酸组氨酸转移到核苷二磷酸[38]。
最新研究表明,AK9除了具有预期的NMPK活性之外,还具有NDPK活性。AK9能够在磷酸供体存在的情况下,高效催化产生ATP、CTP、GTP、UTP、dATP、dCTP,、dGTP和TTP,在此催化反应中,AK9对底物具有选择性,优先顺序是CDP>UDP>ADP> GDP>TDP。人类的其他AK成员(AK1,AK4,AK5,AK7和AK8)和UMP-CMPK家族成员也表现除了NDPK的活性,他们中的绝大多数都能够将任何(d)NDP转换到相应的(d)NTP。其中只有2种酶表现出有限的底物亲和力。当以ATP作为磷酸供体时,AK8不能转换UDP到其三磷酸形式;UMP-CMPK不能转换TDP或UDP到其三磷酸形式。另一方面,当以GTP作为磷酸供体时,这些酶均可以磷酸化TDP和UDP。为什么AKs具有NDPKs的活性?我们可以解释为AK的活性中心更适合与(d)NMPs结合,但是(d)NDPs也可以与其活性中心结合,即使(d)NDPs与AKs活性中心不会完全契合,AKs仍然可以把磷酸基团从供体转移至(d)NDPs。
5 结论
人类的AKs有许多亚型,它们分布的位置和表达形式不同,表明AKs对于细胞功能多样性的维持是必要的。然而,许多重要的酶只以一种存在形式,那为什么人类需要像AKs这样具有多种亚型的酶呢?这需要我们付出更多的努力来进行更深层次的研究。人AKs广泛分布于细胞核、细胞质和线粒体中,这可能是由于其功能保守,所以在进化过程中得到保留。虽然已知AKs缺陷能够引起一些特殊疾病,但是,关于AK活性低下而引起的更加复杂的疾病,如退行性疾病却知之甚少。考虑到ATP是最重要的携带高能量的分子,因此,细胞在发挥不同功能时,产生ATP的量也不同。整体能量缺乏会导致各种器官衰竭,这是正常老化过程的一部分,那么在各种疾病中如何持续提高ATP的产量将成为一个有趣并且有挑战性的研究课题。通过研究能量代谢相关酶,更好的理解磷酸基团转移机制,可以为将来发展治疗由能量代谢紊乱引起的疾病提供坚实的理论基础。
[1]Dzeja P,Terzic A. Adenylate kinase and AMP signaling networks:metabolic monitoring,signal communication and body energy sensing[J]. International Journal of Molecular Sciences,2009,10(4):1729-1772.
[2]Cattaneo M,Gachet C. ADP receptors and clinical bleeding disorders[J]. Arteriosclerosis,Thrombosis,and Vascular Biology,1999,19(10):2281-2285.
[3]Oudman I,Clark JF,Brewster L M. The effect of the creatine analogue beta-guanidinopropionic acid on energy metabolism:a systematic review[J]. PLoS One,2013(1):e52879.
[4]Worrall E G,Worrall L,Blackburn E,et al. The effects ofphosphomimetic lid mutation on the thermostability of the N-terminal domain of MDM2[J]. Journal of Molecular Biology,2010,398(3):414-28.
[5]Auvynet C,Topalis D,Caillat C,et al. Phosphorylation of dGMP analogs by vaccinia virus TMP kinase and human GMP kinase[J]. Biochem Biophys Researcj Communication,2009,388(1):6-11.
[6]Doharey P K,Suthar M K,Verma A,et al. Molecular cloning and characterization of Brugia malayi thymidylate kinase[J]. Acta Tropica,2014,133:83-92.
[7]Liu Y,Marks K,Cowley G S,et al. Metabolic and functional genomic studies identify deoxythymidylate kinase as a target in LKB1-mutant lung cancer[J]. Cancer Discovery,2013(8):870-879.
[8]Van A R,Johansson M,Karlsson A. Identification of a novel human adenylate kinase[J]. European Journal of Biochemistry,1999,261(2):509-517.
[9]Xu Y,Johansson M,Karlsson A. Human UMP-CMP kinase 2,a novel nucleoside monophosphate kinase localized in mitochondria[J]. Journal of Biological Chemistry,2008,283(3):1563-1571.
[10]Auld RR,Quattro J M,Merritt JS. Molecular evolution of teleost neural isozymes[J]. Journal of Molecular Evolution,2012,75(5-6):198-213.
[11]Snow C,Qi G,Hayward S. Essential dynamics sampling study of adenylate kinase:comparison to citrate synthase and implication for the hinge and shear mechanisms of domain motions[J]. Proteins:Structure,Function,and Bioinformatics,2007,67(2):325-337.
[12]Whitford P C,Gosavi S,Onuchic JN. Conformational transitions in adenylate kinase allosteric communication reduces misligation[J]. Journal of Biological Chemistry,2008,283(4):2042-2048.
[13]Panayiotou C,Solaroli N,Xu Y,et al. The characterization of human adenylate kinases 7 and 8 demonstrates differences in kinetic parameters and structural organization among the family of adenylate kinase isoenzymes[J]. Biochemistry Journal,2011,433:527-534.
[14]Gloria-Bottini F,Pietropolli A,Neri A,et al. A study of adenylate kinase locus 1 genetic polymorphism in diabetic pregnancy[J]. Journal of Reproduction and Infertility,2014,15(3):161-164.
[15]Abrusci P,Chiarelli LR,Galizzi A,et al. Erythrocyte adenylate kinase deficiency:characterization of recombinant mutant forms and relationship with nonspherocytic hemolytic anemia[J]. Experimental Hematology,2007,35(8):1182-1189.
[16]Yaish H M,Nussenzveig R H,Agarwal AM,et al. A Previously Unknown Mutation in the Pyruvate Kinase Gene(PKLR)Identified from a Neonate with Severe Jaundice[J]. Neonatology,2014,106(2):140-142.
[17]Pucar D,Bast P,Gumina RJ,et al. Adenylate kinase 1 knockout heart:energetics and functional performance under ischemia-reperfusion[J]. American Journal of Physiology-Heart and Circulatory Physiology,2002,283(2):776-782.
[18]Hancock C R,Janssen E,Terjung R L. Contraction-mediated phosphorylation of AMPK is lower in skeletal muscle of adenylate kinase-deficient mice[J]. Journal of Applied Physiology,2006,100(2):406-413.
[19]Zhang S J,Sandstr m M E,Aydin J,et al. Activation of glucose transport and AMP-activated protein kinase during muscle contraction in adenylate kinase 1 knockout mice[J]. Acta Physiologica,2008,192(3):413-420.
[20]Cheon M G,Kim W,Choi M,et al. AK-1,a specific SIRT2 inhibitor,induces cell cycle arrest by downregulating Snail in HCT116 human colon carcinoma cells[J]. Cancer Letters,2015,28:637-645.
[21]Ma J,Rahlfs S,Jortzik E,et al. Subcellular localization of adenylate kinases in Plasmodium falciparum[J]. FEBS letters,2012,586(19):3037-3043.
[22]Tanimura A,Horiguchi T,Miyoshi K,et al. Differential Expression of Adenine Nucleotide Converting Enzymes in Mitochondrial Intermembrane Space:A Potential Role of Adenylate Kinase Isozyme 2 in Neutrophil Differentiation[J]. PloS One,2014,9(2):e89916.
[23]Pannicke U,Hnig M,Hess I,et al. Reticular dysgenesis(aleukocytosis)is caused by mutations in the gene encoding mitochondrial adenylate kinase 2[J]. Nature Genetics,2008,41(1):101-105.
[24]Lagresle-Peyrou C,Six E M,Picard C,et al. Human adenylate kinase 2 deficiency causes a profound hematopoietic defect associated with sensorineural deafness[J]. Nature Genetics,2008,41(1):106-111.
[25]Lee H J,Pyo JO,Oh Y,et al. AK2 activates a novel apoptotic pathway through formation of a complex with FADD and caspase-10[J]. Nature Cell Biology,2007,9(11):1303-1310.
[26]Noma T,Fujisawa K,Yamashiro Y,et al. Structure and expression of human mitochondrial adenylate kinase targeted to the mitochondrial matrix[J]. Biochemistry Journal, 2001,358:225-232.
[27]Xu G,O'Connell P,Stevens J,et al. Characterization of human adenylate kinase 3 (AK3)cDNA and mapping of the AK3 pseudogene to an intron of the NF1 gene[J]. Genomics,1992,13(3):537-542.
[28]Hoffman G G,Ellington WR. Arginine kinase isoforms in the closest protozoan relative of metazoans[J]. Comparative Biochemistry and Physiology Part D:Genomics and Proteomics,2011,6(2):171-177.
[29]Panayiotou C,Solaroli N,Johansson M,et al. Evidence of an intact N-terminal translocation sequence of human mitochondrial adenylate kinase 4[J]. The International Journal of Biochemistry and Cell Biology,2010,42(1):62-69.
[30]Kong F Z,Binas B,Moon J H,et al. Differential expression of adenylate kinase 4 in the context of disparate stress response strategies of HEK293 and HepG2 cells [J]. Archives of Biochemistry and Biophysics,2013,533:11-17.
[31]Solaroli N,Panayiotou C,Johansson M,et al. Identification of two active functional domains of human adenylate kinase 5[J]. FEBS letters,2009,583(17):2872-2876.
[32]Tüzü n E,Rossi J E,Karner S F,et al. Adenylate kinase 5 autoimmunity in treatment refractory limbic encephalitis[J]. Journal of Neuroimmunology,2007,186(1):177-180.
[33]Ren H,Wang L,Bennett M,et al. The crystal structure of human adenylate kinase 6:An adenylate kinase localized to the cell nucleus[J]. Proceedings of the National Academy of Sciences of the United States of America,2005,102(2):303-308.
[34]Fernandez-Gonzalez A,Kourembanas S,Wyatt T A,et al. Mutation of murine adenylate kinase 7 underlies a primary ciliary dyskinesia phenotype[J]. American Journal of Respiratory Cell and Molecular Biology,2009,40(3):305-313.
[35]Lonergan K M,Chari R,Deleeuw R J,et al. Identification of novel lung genes in bronchial epithelium by serial analysis of gene expression[J]. American Journal of Respiratory Cell and Molecular Biology,2006,35(6):651-661.
[36]Simpson K J,Selfors L M,Bui J,et al. Identification of genes that regulate epithelial cell migration using an siRNA screening approach[J]. Nature Cell Biology,2008,10(9):1027-1038.
[37]Amiri M,Conserva F,Panayiotou C,et al. The human adenylate kinase 9 is a nucleoside mono-and diphosphate kinase[J]. The International Journal of Biochemistry and Cell Biology,2013,45(5):925-931.
[38]Boissan M,Dabernat S,Peuchant E,et al. The mammalian Nm23/NDPK family:from metastasis control to cilia movement[J]. Molecular and Cellular Biochemistry,2009,329(1-2):51-62.
Several New Members and Their Functional Characteristics of Human Adenylate Kinase Family
Kong Fanzhi1,Shen Huanhuan1,Jiang Nan2,Yang Huanmin1,Yang Rui
(1.College of Animal Science and Technology,Heilongjiang Bayi Agricultural University,Daqing 163319;2.Laboratory Department,People's Hospital of Daqing)
Adenylate kinase(AK)was a kind of phosphotransferases which catalyzed phosphate transferring between adenine nucleotides,thus regulated the ratio of adenine nucleotides in different parts of cells.In recent years,more and more AKs were identified.The location of encode AKs genes,preferred substrate and phosphate donor and functions were summarized,which provided a theoretic basis and new clue for better studying the AK family.
adenine nucleotides;adenylate kinases;nucleoside diphosphate kinase
Q78
A
1002-2090(2016)02-0037-08
10.3969/j.issn.1002-2090.2016.02.008
2015-03-31
黑龙江省教育厅海外学人科研资助项目(1253HQ013);黑龙江八一农垦大学学成、引进人才科研启动计划资助课题。
孔凡志(1984-),男,讲师,韩国汉阳大学毕业,现主要从事腺苷酸激酶功能解析及动物冷应激发生机制的相关研究。
杨焕民,男,教授,博士研究生导师,E-mail:yanghuanmin@aliyun.com。

