磁共振在中央带前列腺癌与结节型增生诊断中的价值
夏远舰
磁共振在中央带前列腺癌与结节型增生诊断中的价值
夏远舰
目的探讨中央带前列腺癌与结节型增生的MR表现与诊断价值。方法回顾性分析经病理证实的中央带前列腺癌34例(39个癌灶)、前列腺结节型增生121例,比较病灶的T1WI、T2WI、DWI与增强表现,测量病灶的表观弥散系数(ADC)值,观察中央带与外周带间的低信号环的完整性。结果中央带前列腺癌灶大多边界不清,形态不规则,T1WI呈等信号,T2WI呈稍低、低信号,DWI呈高信号,增强呈轻度均匀强化,中央带与外周带之间的正常分界线大多数不完整;增生结节多数T1WI呈等信号,T2WI信号不均匀。癌灶与增生结节的ADC值分别为(0.859±0.079) ×10-3mm2/s、(1.517±0.315)×10-3mm2/s,差异有统计学意义(P<0.05)。结论磁共振可用于中央带前列腺癌与结节型增生诊断与鉴别诊断。
前列腺肿瘤;前列腺增生;磁共振成像
前列腺癌是中老年男性最常见的肿瘤之一,常导致患者生活质量下降,甚至死亡。尽管前列腺癌以外周带多见,仍有接近30%的病例发生在中央带,而前列腺中央带以良性增生多见,且前列腺增生结节的超声、CT和临床表现均与发生在中央带的前列腺癌相似,中央带的前列腺癌常发展至中晚期才明确诊断,严重影响患者的治疗和预后[1,2]。磁共振成像与其他影像学检查技术相比具有软组织分辨率高、多参数、多层面成像等优势,是目前前列腺影像学诊断、分期的最佳手段[3],为提高中央带前列腺癌诊断的及时性和准确性,本研究分析中央带前列腺癌和前列腺增生的MR表现及其临床意义。
1 资料与方法
1.1一般资料选择2005年6月至2015年6月在我院接受前列腺MR检查,并经手术或活检病理证实完全局限于中央带的前列腺癌34例(39个病灶,均为腺癌为观察组。年龄58~79岁,平均年龄(63±10)岁;34例中央带腺癌病理Gleason评分为4~10分,平均(6.3±1.4)分。前列腺结节型增生121例为对照组,年龄57~89岁,平均年龄(65±13)岁。因弥漫型前列腺增生与中央带前列腺癌MR相对容易鉴别,本研究未予对比。所有患者均接受T1WI、T2WI和DWI序列检查,测量兴趣区的ADC值,60例前列腺增生,20例中央带前列腺癌患者接受增强检查。上述病例均在MR检查后经手术或活检病理结果证实。见表1。
1.2设备与方法使用2台GE公司1.5T Signa Twin-Speed磁共振扫描仪行常规MRI和DWI检查。

表1 患者相关临床资料
常规MRI用体线圈为射频发射线圈,以腹部相控阵线圈为接受线圈。扫描前嘱充盈膀胱,取仰卧位,扫描中心置于耻骨联合上方2.0 cm处。常规扫描序列包括横断面T1WI、T2WI、 T2WI-FS;矢状面T1WI;冠状面T2WI。DWI检查以体线圈为射频发射和接受线圈,扫描序列为单次激发SE-EPI(ssh-EPI-DWI)序列加STIR抑脂; 扫描参数:TR=3 000 ms,TE=50 ms,视野(FOV)=24 cm×24 cm,激励次数(NEX)=19,层厚(Thick)=5 mm,层间距=0 mm,矩阵=96×96,扩散敏感系数( b值)采用0 s/mm2和700 s/mm2。取层面选择、频率编码、相位编码3个方向。增强扫描:于平扫后保持体位不变,静脉注入钆喷酸葡胺针(德国拜耳医药保健有限公司生产),剂量0.1 mml/kg,然后行横断、矢状、冠状面的扫描。
1.3数据采集、处理扫描数据传输至GE高级工作站(Advanced Workstation 4.3,AW4.3)上,由3名高年资医生经GE Function 2软件自动后处理后获得ADC图。兴趣区(ROI)测量选择图像上的异常信号区域测量,测量面积按病变大小而定,一般稍小于病灶,每个ROI面积3~10 mm2,尽量避开粘液、脂肪、钙化、血管、气体、尿道组织。另外,要在病灶同侧远隔部位及对侧正常部位测量,取3名医生测量的平均值,再进行分析处理。
2 结果
2.1前列腺癌患者情况本组中央带前列腺癌34例均为腺癌,术前诊断中央带前列腺癌18例(52.9%),误诊为前列腺增生结节12例(35.3%),漏诊4例(11.8%)。
2.2中央带前列腺癌的MR表现34例中央带前列腺癌,合并前列腺增生23例(67.6%),表现为中央带体积增大,信号不均匀,外周带受压变形。前列腺包膜局限性隆起24例(70.6%),包膜光整10例(29.4%);前列腺中央带癌34例的包膜均连续且无明显增厚改变。39个中央带前列腺癌灶中,形态不规则30个(76.9%),呈圆形或椭圆形9个(23.1%);病灶边界多欠清,大小为1.1~2.4 cm,平均(1.55±0.39)cm;34例前列腺癌患者中央带与外周带间的低信号环影完整的仅6例(17.6%),不完整25例(73.5%),完全破坏3例(8.8%)。T1WI中央带前列腺癌灶均呈等信号影,显示不清。T2WI瘤灶呈稍低信号影14个(35.9%),低信号25个(64.1%),信号均匀。DWI呈明显高信号影有30个(76.9%),稍高信号9个(23.1%);癌灶ADC值为(0.57~1.09)×10-3mm2/s,平均(0.859±0.079)×10-3mm2/s。20例患者行增强MR检查,增强后中央带前列腺癌灶呈中等度强化,相对周围明显强化的中央带组织呈稍低信号表现12例(60.0%),呈稍高信号8例(40.0%)。见图1~2,表2。

图1中央带前列腺癌:前列腺中央带左侧部癌灶T2WI呈不规则形稍低信号,左侧外周带与中央带间低信号影显示不清,而右侧外周带与中央带间低信号影显示清晰,前列腺包膜光整

图2中央带前列腺癌 ADC图:显示中央带左侧部的前列腺癌灶ADC值明显降低,ADC值为(0.898±0.059)×10-3mm2/s;中央带右侧部正常腺体的ADC值为(1.59±0.197)×10-3mm2/s
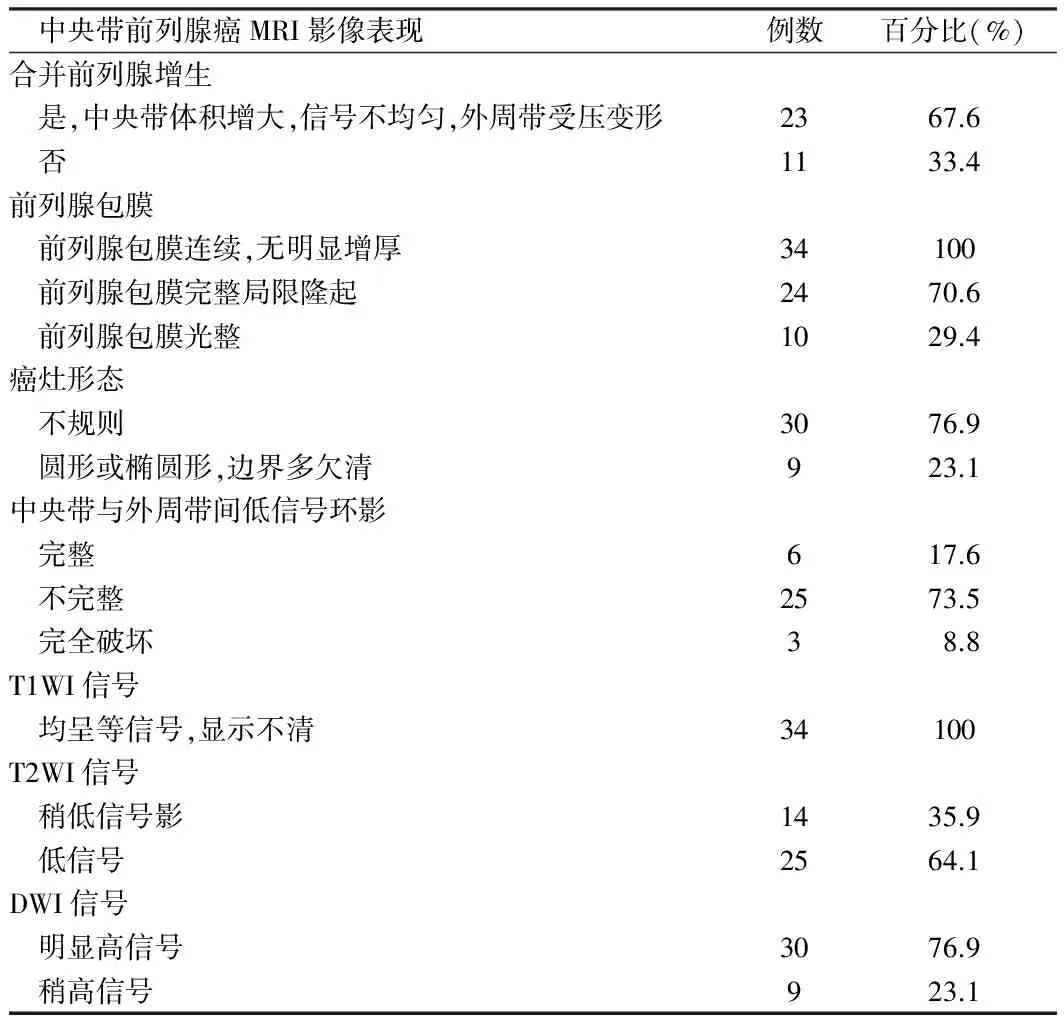
表2 34例中央带前列腺癌的MR表现
2.3病例组与对照组ADC值比较121例中央带前列腺结节型增生病例,均表现为中央带体积明显增大,前列腺上下径4.1~6.3 cm,外周带明显受压变形,中央带与外周带间的低信号环影完整仅116例(95.9%),欠完整5例(4.1%)。前列腺中央带增生结节T1WI呈等信号,难于识别;T2WI呈等、稍高混杂信号;DWI呈稍高或等信号;ADC值为(1.13~1.97)×10-3mm2/s,平均(1.517±0.315) ×10-3mm2/s。前列腺中央带癌与增生结节ADC值比较差异有统计学意义(P<0.05)。见图3、4,表3。
3 讨论
前列腺癌起源于前列腺腺泡或导管上皮,90%以上为腺癌[4],本组起源于中央带的前列腺癌全部为腺癌。一般认为前列腺癌Whitmore 分期为C期、D期(相当于TNM分期的T3期、N和M期)无外科手术指征,临床称为晚期前列腺癌,治疗效果和预后较差[4]。

图3中央带前列腺增生结节:中央带体积增大,内见多发圆形或椭圆形增生结节灶,T2WI呈不均匀稍高信号影;两侧外周带受压变形,中央带与两侧外周带间低信号影显示清晰,前列腺包膜连续光整只有早期诊断局限于前列腺包膜内的前列腺癌,才有可能进行根治性治疗[5]。本组中央带前列腺癌34例,MR初检时的误漏诊率高达47.1%,分析其原因可能与中央带前列腺癌发生率低,对其与增生结节MR表现的差异认识不足,且中央带前列腺也常合并前列腺增生有关。

图4中央带前列腺增生结节灶ADC值:前列腺增生结节灶ADC值相对周围组织无明显变化,ADC值为(1.681±0.165)×10-3mm2/s
表3病例组与对照组ADC值比较

组别ADC值t值P值病例组(n=34)0.859±0.079(0.57~1.09)2.230.026对照组(n=121)1.517±0.315(1.13~1.97)
中央带前列腺癌,癌灶形态常不规则,常因浸润性生长而边界不清,在T2WI上呈低信号表现,分析其组织病理基础,与癌灶区域有大量紧密排列癌变细胞,其间粘蛋白和液体含量明显减少有关。而前列腺增生病理上分为腺体型、间质型和混合型,增生组织成分不一,MR表现也有所不同,增生结节病灶形态呈圆形或椭圆形,T2WI呈等、稍高混杂信号影,DWI 呈稍高信号影为主,增强后增生结节灶大多不均匀强化,而存在于中央带与外周带腺体之间的正常分界线完整,个别欠清晰可能与增生显著和部分容积效益有关。
有研究显示:前列腺中央带癌表现为T2WI 均匀低信号,DWI 高信号,瘤灶边界不清,形态不规则,无包膜,ADC值平均为(1.05×10)-3mm2/s(95%可信区间为0.97~1.11),并且与中央带良性前列腺增生结节的ADC值存在显著性差别[6,7]。本组34例中央带前列腺癌与121例前列腺增生的ADC值分别为(0.859±0.079)×10-3mm2/s和(1.517±0.315)×10-3mm2/s,与文献[8,9]报道相近。表明ADC值的量化指标对前列腺癌和前列腺增生具有鉴别价值,前列腺癌的ADC值明显小于前列腺增生,前者通常不超过(1.1×10)-3mm2/s。
中央带前列腺癌与增生结节的鉴别要点:(1)中央带前列腺癌常伴有PSA异常升高,而前列腺增生PSA升高常不明显;(2)癌灶形态常不规则,导致边界不清或中央带与外周带间低信号环影不清,而增生结节多呈圆形或卵圆形,且边界清楚;(3)T2WI癌灶常比增生结节信号更低、更均匀一点;(4)DWI癌灶常比增生结节信号更高,ADC值常在1.1×10-3mm2/s以下;(5)动态增强扫描有助于显示中央带前列腺癌灶与周围背景的对比。在临床工作中,对于前列腺高危人群,应常规推荐MRI检查、高分辨弥散成像加ADC测量。
1何海青,樊树峰,李玉晶,等.MRI在中央带前列腺癌早期诊断中的作用.中华医学杂志,2014,94:1051-1054.
2Jagannathan NR.Prostate MR: current status,challenges and future directions.NMR Biomed,2014,27:1-2.
3陈志强,杨文君,郭玉林,等.磁共振扩散加权成像在前列腺癌诊断和鉴别诊断中的价值.中华老年医学杂志,2011,30:216-219.
4徐勇,张志宏.我国前列腺癌的临床热点问题探讨.中华泌尿外科杂志,2011,32:585-587.
5张海洋,王慕文,赵勇,等.前列腺癌的诊断和治疗现状的探讨.泌尿外科杂志(电子版),2013,5:8-14.
6Oto A,Kayhan A,Jiang YL,et al. Prostate cancer:differentiation of central gland cancer from benign prostatic hyperplasia by using diffusion-weighted and dynamic contrast-enhanced MR imaging.Radiology,2010,257:715-723.
7梁宇霆,靳二虎 ,张艺,等. 磁共振扩散加权成像在前列腺癌检出和鉴别诊断中的价值.磁共振成像杂志,2010,11:272-276.
8Park SY,Kim CK,Park BK,et al.Diffusion-tensor MRI at 3 T: differentiation of central gland prostate cancer from benign prostatic hyperplasia.Am J Roentgenol,2014,202:W254-W262.
9Peng Y,Jiang Y,Yang C,et al.Quantitative analysis of multiparametric prostate MR images: differentiation between prostate cancer and normal tissue and correlation with Gleason score--a computer-aided diagnosis development study.Radiology,2013,267:787-796.
10.3969/j.issn.1002-7386.2016.21.015
056001河北省邯郸市中心医院
R 814.46
A
1002-7386(2016)21-3255-03
2016-04-19)

