重复经颅磁刺激对抑郁症患者治疗前后前额叶质子磁共振波谱定量研究
朱程,徐乐平,孙剑,惠李,刘林晶
重复经颅磁刺激对抑郁症患者治疗前后前额叶质子磁共振波谱定量研究
朱程,徐乐平,孙剑,惠李,刘林晶
目的探讨高频重复经颅磁刺激(rTMS)治疗对单相抑郁症患者局部脑内代谢物质的影响。方法收集20例抑郁症患者为观察组,20例健康对照者为对照组,在治疗前及4周末用汉密尔顿抑郁量表(HAMD)评定观察组的抑郁状况,利用1H-MRS检测治疗前、4周末两组前额叶皮质N-乙酰天门冬氨酸(NAA)、谷氨酸复合物(Glx)、胆碱复合物(Cho)及肌酸(Cr)4种代谢物,分别计算NAA、Glx、Cho与Cr的比值。结果在治疗前观察组左侧前额叶NAA/Cr、Glx/Cr,右侧前额叶NAA/Cr均明显低于对照组(均P<0.05);观察组左侧前额叶背外侧NAA/Cr、Glx/Cr,右侧前额叶背外侧NAA/Cr较治疗前明显升高;观察组治疗后HAMD量表(14.00±3.84)分,明显低于治疗前(36.17±5.42)分,差异有统计学意义(P<0.05);观察组左侧前额叶皮质NAA/Cr、Glx/Cr变化值与HAMD减分率呈正相关(P<0.01);其余生化指标变化值与减分率无明显相关性(均P>0.05)。结论抑郁症患者双侧前额叶NAA及左侧前额叶Glx水平降低,高频rTMS可升高其水平,这可能是高频rTMS具有抗抑郁作用的途径之一。
抑郁症;重复经颅磁刺激;前额叶皮质;磁共振波谱
重复经颅磁刺激(rTMS)是基于经颅磁刺激发展形成的一种新技术,作为物理治疗手段,已被用于治疗多种神经精神疾病。关于rTMS改善抑郁症状的作用机制,可能与rTMS改善大脑局部以及边缘系统等区域异常的皮质代谢[1]、调节脑内单胺类神经递质[2-3]、氨基酸水平[4]、降低血清中皮质醇和促肾上腺皮质激素浓度[5]、增加血清中脑源性神经营养因子[6]有关。磁共振波谱(MRS)是目前唯一可以无损伤检测活体器官组织中不同代谢产物浓度、反映其生理及病理变化特点的定量分析方法。目前利用氢质子磁共振波谱(1H-MRS)对rTMS治疗抑郁症的研究很少,本研究旨在研究高频rTMS对抑郁症患者脑内生化指标影响,探讨其治疗抑郁症的可能机制。现报道如下。
1 资料与方法
1.1一般资料选取2013年6月至2014年9月中国人民解放军第102医院精神科连续住院的抑郁症患者为观察组。入组标准:(1)符合中国精神障碍分类与诊断标准第三版(CCMD-3)中单相抑郁症的诊断标准;(2)年龄18~50岁;(3)汉密尔顿抑郁量表(HAMD)24项评定总分≥20分;(4)入组前4周内未服用过抗抑郁药,未行电休克治疗。排除标准:(1)伴有脑器质性疾病;(2)既往有躁狂发作史;(3)合并有精神活性物质所致精神障碍等其他精神疾患;(4)安置心脏起搏器或体内有金属物质。共收集符合上述条件的抑郁症患者20例,男5例,女15例;平均年龄(30.7±11.3)岁;平均受教育年限(8.3±2.6)年;病程1~240个月。收集20例健康对照者为对照组,男7名,女13名;平均年龄(31.9±11.8)岁;平均受教育年限(8.9±2.8)年;均排除器质性疾病、躯体疾病、精神疾病。两组一般资料差异无统计学意义(P>0.05)。
本研究获中国人民解放军第102医院医学伦理委员会的批准,受试者及监护人员均已签署对本研究知情同意并签署知情同意书。
1.2方法
1.2.1rTMS治疗采用YRDCCY-I型经颅磁刺激仪(武汉依瑞德),8字形线圈。高频组选取刺激部位为左侧背外侧前额叶,线圈放置与颅骨平行,刺激强度为100%运动阈值,刺激频率为10 Hz,每串刺激1 s,间歇11 s,治疗时间为20min。入院第2天进行第1次治疗,每周5次,连续治疗4周。
1.2.2HAMD量表评定使用HAMD-24项抑郁量表评定抑郁症患者治疗前后抑郁症状严重程度。HAMD量表减分率= HAMD差值/治疗前分值×100%。治疗前及治疗4周末分别由2名高年资心理测量室专业人员完成。
1.2.3剔除标准出现不良反应无法耐受或经相应处理无缓解,主动要求停止治疗的患者,停止rTMS治疗选择其他治疗方案。观察组中3例因不良反应,5例因主动要求而终止rTMS治疗,行rTMS治疗4周的病例分别为12例。
1.2.41H-MRS检测采用Siemens 1.5T磁共振系统(Magnetorn Trio Tim,Siemens),在标准头线圈内完成扫描。扫描时受试者仰卧,使用耳塞减少噪声对实验的影响,并用配套的泡沫垫固定在头部周围以减少头部的运动。本研究选择兴趣区(ROI)2.5 cm×2.5 cm×2.5 cm为双侧前额叶背外侧区。观察组在rTMS治疗前检测第1次1H-MRS数据,在最后一次rTMS治疗后的24h内进行第2次1H-MRS检查。匀场、水抑制及调谐均由机器自动完成,信号经西门子公司提供的软件包进行后处理,测定N-乙酰天门冬氨酸(NAA)、谷氨酸复合物(Glx)、胆碱复合物(Cho)、肌酸(Cr)的相对水平,并以Cr为内标计算NAA/Cr、Cho/Cr、Glx/Cr的比值。所有扫描及后处理工作均由同一经验丰富的影像学医师操作完成。
1.3统计方法采用SPSS 17.0统计软件进行数据分析,计数资料以率表示,采用2检验;计量资料以均数±标准差表示,采用t检验;相关性分析采用Pearson相关分析。P<0.05为差异有统计学意义。
2 结果
2.1两组治疗前1H-MRS比较在治疗前观察组左侧前额叶NAA/Cr、Glx/ Cr,右侧前额叶NAA/Cr均明显低于对照组,差异均有统计学意义(均P<0.05)。见表1。
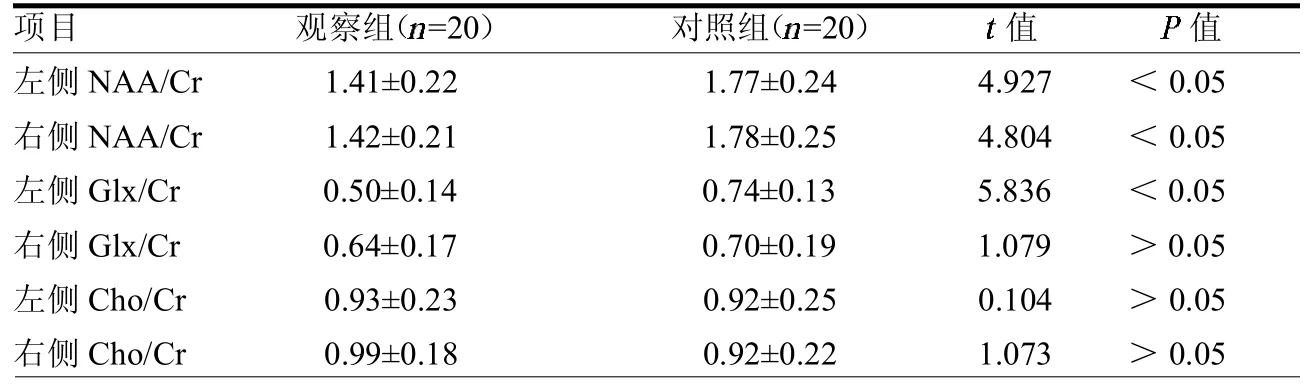
表1 两组治疗前双侧前额叶1H-MRS比较
2.2观察组治疗前后1H-MRS比较左侧前额叶背外侧NAA/Cr、Glx/Cr,右侧前额叶背外侧NAA/Cr较治疗前明显升高,差异均有统计学意义(均P<0.05)。见表2。
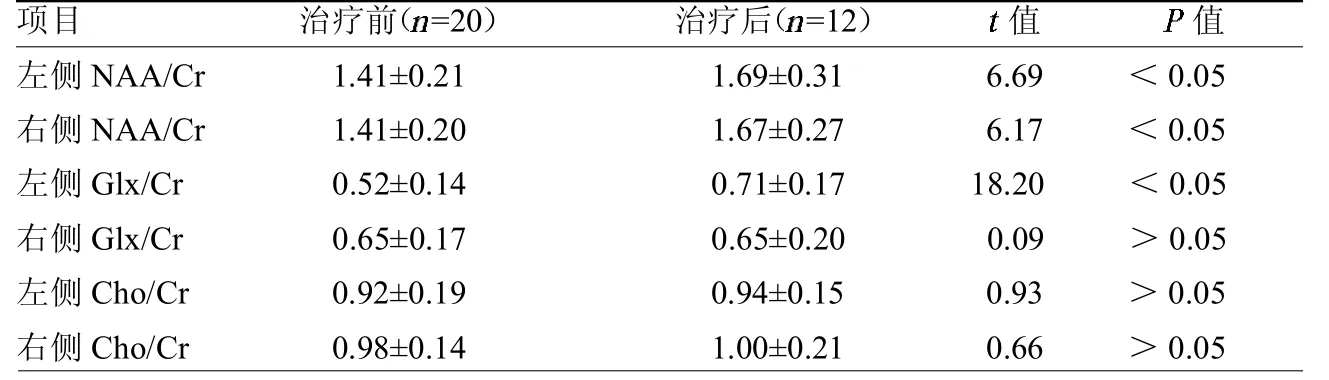
表2 观察组治疗前后1H-MRS结果变化
2.3观察组治疗前后HAMD分值比较
治疗后HAMD量表(14.00±3.84)分,明显低于治疗前(36.17±5.42)分,差异有统计学意义(t=19.91,P<0.05)。
2.4观察组治疗前后前额叶各生化指标的变化值与HAMD减分率的相关性分析观察组左侧前额叶皮质NAA/ Cr、Glx/Cr变化值与HAMD减分率呈正相关(r=0.573、0.697,均P<0.01);其余生化指标变化值与减分率无明显相关性(均P>0.05)。
3 讨论
已有研究表明,心境障碍与前额叶背外侧皮质功能异常有关,而抑郁症通常左侧前额叶背外侧皮质功能减退,右侧前额叶背外侧皮质功能相对亢进。高频rTMS对脑皮质产生兴奋作用。因此通常利用高频rTMS刺激左侧前额叶背外侧[7]。
NAA主要存在于神经元内,反映神经元密度、活性及完整性,只要存在神经元缺损的病理改变,就会出现NAA水平的下降。本研究结果显示观察组中患者双侧前额叶NAA含量低于对照组,提示抑郁症患者双侧前额叶神经元活力下降,存在神经元缺失。这与国内夏军[8]、谢洪武等[9]的研究结果一致。在高频rTMS治疗4周后,抑郁症患者双侧前额叶NAA水平均明显升高。Gonul等[10]利用MRS检测抑郁症患者在抗抑郁药物治疗前后左侧前额叶NAA、Cho、Cr3种生化指标,结果显示NAA水平明显升高,与本研究结果部分一致。前额叶NAA水平的这种变化提示在治疗后抑郁症患者前额叶的神经元活性、完整性得到提高。
谷氨酸作为脑内主要的兴奋性神经递质,具有记忆认知、神经营养及诱导神经元重塑等生理功能[11]。有研究发现脑内谷氨酸水平异常可能与心境障碍的发病有关,这可能是抑郁症的发病机制之一。且已有药理学研究显示,谷氨酸受体调节剂有抗抑郁作用[12]。本研究结果发现,抑郁症患者左前额叶谷氨酸水平显著低于正常对照组。Hasler等[13]利用MRS技术,发现抑郁症组谷氨酸水平显著低于正常对照组,与本结果一致。也有研究结果得出相反的结果[14-15],由于部分研究检测的为血清谷氨酸水平或尸检脑内谷氨酸水平,且混杂因素多,尚难以解释不一致的结果。本研究结果还发现,观察组患者治疗后左侧Glx水平较治疗前显著升高,Glx变化值与HAMD减分率呈正相关,Luborzewski[16]利用MRS检测高频rTMS治疗单相抑郁症患者左侧前额叶皮质及前扣带回皮质代谢物质变化,发现左侧前额叶皮质Glx水平变化与抗抑郁疗效呈正相关,支持本研究结果。提示高频rTMS产生抗抑郁样作用可能还与提高左侧前额叶Glx水平有关。由于谷氨酸的神经活动及突触释放与脑内葡萄糖代谢相关,功能影像学发现抑郁症患者左侧前额叶脑血流量和葡萄糖代谢明显降低,在经过抗抑郁治疗后可逆转其水平[17]。Li等[1]研究发现高频rTMS可以提高葡萄糖代谢,可以证明该结论。
本研究未发现在治疗前抑郁症患者前额叶Cho水平较正常对照组有明显改变,进一步证实了郑会蓉等[18]的结论。林铮等[19]研究显示抑郁症患者前额叶存在Cho水平异常,其中首发抑郁症患者左侧前额叶Cho水平高于正常对照组,而复发组右侧前额叶Cho水平高于正常对照组。亦有研究结果发现抑郁症前额叶Cho水平低于正常对照组[20]。Yildiz[21]发现关于抑郁症前额叶Cho水平与正常对照组相比,大多数研究的结果都是无显著差异的。
综上所述,rTMS可明显升高抑郁症患者双侧前额叶NAA及左侧前额叶Glx水平,这可能是其改善抑郁症状的途径之一。由于本研究还存在一些不足,如无药物干预,部分病例被剔除,导致样本量少,观察时间短等。目前相关研究较少,尚需要更多研究进一步验证本研究结果。
[1]Li CT,Wang SJ,Hirvonen J,et al.Antide pressant mechanism of add-on repetitive transcranialmagneticstimulationinmedication-resistant depression using cerebral glucose metabolism[J].J Affect Disord,2010,127(1):219-229.
[2]Juckel G,Mendlin A,Jacobs BL.Electrical stimulation of rat medial prefrontal cortex enhances forebrain serotonin output: implicationsfor electroconvulsivetherapy and transcranial magnetic stimulation in depression[J].Neuropsychopharmacology,1999,21(3):391-398.
[3]KeckME,WeltT,MüllerMB,etal.Repetitive transcranial magnetic stimulation in creases thereleaseof dopamine in themesolimbic and mesostriatal system[J].Neuropharmacology,2002,43(1):101-109.
[4]陈运平,孙圣刚,梅元武,等.低频重复经颅磁刺激对抑郁模型大鼠游泳及海马内氨基酸递质的影响[J].中华物理医学与康复杂志,2006,28(8):507-509.
[5]BuckleyTM,Schatzberg AF.On the interactions of the hypothalamic-pituitary-adrenal(HPA)axis and sleep:normal HPA axis activity and circadian rhythm,exemplary sleep disorders[J].J Clin Endocrinol Metab,2005,90(5):3106-3114.
[6]Zanardini R,Gazzoli A,Ventriglia M,et al.Effect of repetitive transcranial magnetic stimulation on serum brain derived neurotrophic factor in drug resistant depressed patients[J].J Affect Disord,2006,91(1): 83-86.
[7]陈进,倪朝民.重复经颅磁刺激及其在抑郁症康复中的应用进展[J].安徽医学,2010,31(2):173-177.
[8]夏军,雷益,周义成.抑郁症的1H-MRS研究[J].医学影像学杂志,2008,18(7):697-701.[9]谢洪武,陈日新,徐放明,等.首发抑郁症患者前额叶皮质氢质子磁共振波谱研究[J].中国神经精神疾病杂志,2012,38(6):329.
[10]GonulAS,KitisO,OzanE,etal.Theeffect of antidepressant treatment on N-acetyl aspartate levels of medial frontal cortex in drug-free depressedpatients[J].Prog Neuropsychopharmacol Biol Psychiatry,2006,30(1):120-125.
[11]Kugaya A,Sanacora G.Beyond monoamines:glutamatergic functioninmooddisorders[J].CNS spectrums,2005,10(10):808.
[12]Hashimoto K.Emerging role of glutamate in the pathophysiology of major depressivedisorder[J].BrainResRev,2009,61(2): 105-123.
[13]Hasler G,van der Veen JW,Tumonis T,et al.Reduced prefrontal glutamate/glutamine and-aminobutyricacidlevelsinmajordepression determined usingprotonmagnetic resonancespectroscopy[J].ArchGenPsychiatry,2007,64(2):193-200.
[14]Mitani H,Shirayama Y,Yamada T,et al. Correlationbetweenplasmalevelsofglutamate,alanine and serine with severity of depression[J].Prog NeuropsychopharmacolBiolPsychiatry,2006,30(6):1155-1158.
[15]Hashimoto K,Sawa A,Iyo M.Increased levels of glutamate in brains from patients with mood disorders[J].Biol Psychiatry,2007,62(11):1310-1316.
[16]Luborzewski A,Schubert F,Seifert F,et al. Metabolic alterations in the dorsolateral prefrontal cortex after treatment with highfrequency repetitive transcranial magnetic stimulation in patients with unipolar major depression[J].JPsychiatrRes,2007,41(7): 606-615.
[17]Mayberg HS,BrannanSK,Tekell JL,etal. Regional metabolic effects of fluoxetine inmajordepression:serialchangesandrelationshiptoclinicalresponse[J].BiolPsychiatry,2000,48(8):830-843.
[18]郑会蓉,李凌江,刘鹏,等.难治性抑郁症患者rTMS治疗前后双侧前额叶质子磁共振波谱定量研究[J].中国临床心理学杂志,2012,20(6):802-804.
[19]林铮,李惠春,龚向阳,等.抑郁症患者前额叶、海马磁共振质子波谱成像的研究[J].中华精神科杂志,2005,38(4):193-197.
[20]Caetano SC,Fonseca M,Olvera RL,et al. Proton spectroscopy study of the left dorsolateral prefrontal cortex in pediatric depressed patients[J].Neurosci Lett,2005,384(3):321-326.
[21]Yildiz-YesilogluA,AnkerstDP.Neurochemicalalterationsofthebraininbipolardisorder andtheirimplicationsforpathophysiology: a systematic review of the invivo protonmagneticresonancespectroscopyfindings[J].ProgNeuropsychopharmacol Biol Psychiatry,2006,30(6):969-995.
(本文编辑:陈志翔)
10.3969/j.issn.1671-0800.2016.09.056
R749.4
A
1671-0800(2016)09-1232-03
325000浙江省温州,温州医科大学附属康宁医院(朱程、惠李、刘林晶);中国人民解放军第102医院(徐乐平、孙剑)
孙剑,Email:sj102@126. com
2016-03-21

