颈脊柱损伤与挥鞭性损伤后脑脊液中神经组织损伤标记物变化对评估神经组织损伤程度的影响
杨志华,韩雷,李青,王震
颈脊柱损伤与挥鞭性损伤后脑脊液中神经组织损伤标记物变化对评估神经组织损伤程度的影响
杨志华,韩雷,李青,王震
目的探讨脑脊液中神经组织损伤标记物在颈脊柱损伤与挥鞭性损伤后的变化对评估神经组织损伤程度的影响。方法选取脊髓损伤患者46例作为研究组,健康神经系统46例作为对照组,比较两组及研究组中不同类型患者的脑脊液神经丝蛋白(NFL)、神经胶质原酸性蛋白(GAFp)水平。结果研究组脑脊液NFL、GAFp水平均高于对照组(均P<0.05)。颈脊柱损伤患者的脑脊液NFL、GAFp水平均高于挥鞭性损伤患者(均P<0.05);颈脊柱损伤中局部神经障碍患者的脑脊液NFL、GAFp水平均低于脊髓完全损伤患者(均P<0.05),脊髓完全损伤患者的脑脊液GAFp水平低于四肢轻瘫患者(P<0.05),NFL水平高于四肢轻瘫患者(P<0.05)。结论颈脊柱损伤与挥鞭性损伤后脑脊液NFL、GAFp水平能有效评估神经组织损伤程度。
颈脊柱损伤;挥鞭性损伤;脑脊液神经组织损伤标记物;神经组织损伤程度
1 资料与方法
1.1一般资料选取浙江萧山医院2008年4月至2015年4月收治的脊髓损伤患者46例(研究组),均接受急诊MRI检查,有显著神经缺陷。其中男32例,女14例;年龄27~57岁,平均(40.2± 10.3)岁。疾病类型:颈脊柱损伤12例,挥鞭性损伤34例;致伤原因:交通事故伤24例,坠落伤22例。另选本院同期收治的健康神经系统人员46例为对照组,其中男24例,女22例;年龄24~57岁,平均(32.3±10.5)岁。两组一般资料差异无统计学意义(P>0.05),具有可比性。
1.2方法在受伤后1d至3周内对患者进行腰部穿刺,穿刺位置为L4/5、L5/ S1。将受试者的脑脊液仔细混匀离心后在-270℃的温度下进行1 h的冰冻,然后运用酶联免疫吸附法(ELISA)检测脑脊液中神经丝蛋白(NFL)、神经胶质原酸性蛋白(GAFp)水平,NFL的正常上限制为125ng/L,GAFp的正常上限为16ng/L。
1.3统计方法采用SPSS20.0统计软件进行分析,计量资料用均数±标准差表示,多组比较采用方差分析,两组比较用t检验。P<0.05为差异有统计学意义。
2 结果
2.1两组脑脊液NFL、GAFp水平比较研究组脑脊液NFL、GAFp水平均高于对照组(均P<0.05),见表1。
2.2研究组中不同类型患者的脑脊液NFL、GAFp水平比较颈脊柱损伤患者的脑脊液NFL、GAFp水平均高于挥鞭性损伤患者(均P<0.05)。颈脊柱损伤中局部神经障碍患者的脑脊液NFL、GAFp水平均低于脊髓完全损伤患者(均P<0.05);脊髓完全损伤患者的脑脊液GAFp低于四肢轻瘫患者(P<0.05),NFL水平高于四肢轻瘫患者(P<0.05),见表2。
3 讨论
神经丝作为一种结构成分在神经元中占有极为重要的地位,在大多数神经细胞中,神经丝蛋白的组成成分为3个亚基,与在树突及胞体中相比,其在轴突中具有较高的浓度[4]。NFL核心的基本成分为三联体中的轻链,可作为动物模型中神经退变的标志物[5]。中枢神经系统急性退变性及器质性病变、坐骨神经痛及椎间盘突出患者具有较高的脑脊液NFL浓度,说明病变损害了神经根中的轴图。在神经胶质细胞中间丝中,GAFp属于一种结构蛋白,在星形胶质细胞骨架中占有极为重要的地位[6],可作为星形胶质细胞增生的标志物[7]。许多神经退变性疾病患者具有较高的脑脊液GAFp水平,急性缺血性卒中患者也具有较高的脑脊液GAFp水平。
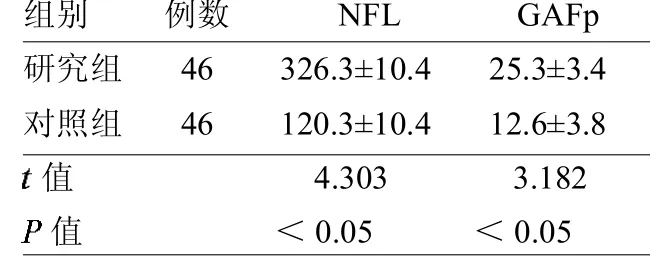
表1 两组脑脊液NFL、GAFp水平比较ng/L
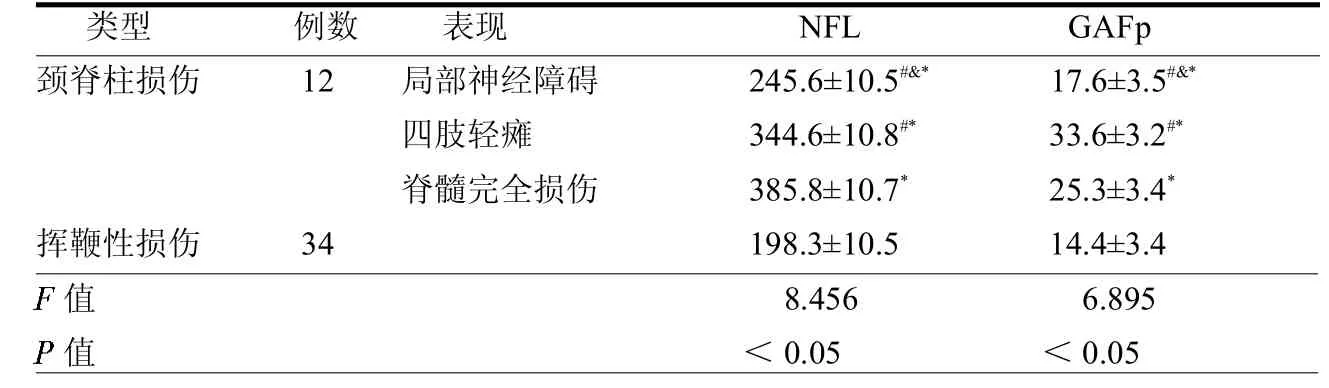
表2 研究组中不同类型患者的脑脊液NFL、GAFp水平比较ng/L
MRI能够将所有脊髓损伤及颈椎骨折患者的脊髓水肿及出血显示出来,但不能对脊髓损伤患者的疾病预后进行准确预测。神经元在脊髓损伤的情况下坏死,会造成更多的神经细胞凋亡及继发性轴突蜕变,这一过程的持续时间长达数天到数月[8]。本研究表明,研究组脑脊液NFL、GAFp水平均高于对照组(均P<0.05),颈脊柱损伤患者的脑脊液NFL、GAFp水平均高于挥鞭性损伤患者(均P<0.05);颈脊柱损伤中局部神经障碍患者的脑脊液NFL、GAFp水平均低于脊髓完全损伤患者(均P<0.05),脊髓完全损伤患者的脑脊液GAFp水平低于四肢轻瘫患者(P<0.05),但NFL水平高于四肢轻瘫患者(P<0.05),这可能是继发的轴突损害对脑脊液NFL、GAFp水平造成了直接而深刻的影响。伤后即刻广泛神经胶质细胞坏死极易在短时间内以较快的速度提升脑脊液中GFAp水平,符合脑梗死后最初2d患者具有一过性增高的GFAp水平,但是之后几周却具有正常的GFAp水平[9]。NFL水平在挥鞭伤的作用下提升说明病变损伤了轴突。
[1]周婧.成人眼眶来源脂肪干细胞联合17-beta-雌二醇对大鼠脊髓损伤的修复研究[D].浙江大学,2012.
[2]孙长笈.不同程度急性压迫对兔颈2脊髓损伤影响的实验研究[D].南方医科大学,2013.
[3]郝海虎.自噬在丙戊酸治疗脊髓损伤中的作用研究[D].山西医科大学,2013.
[4]谭波涛.脊髓损伤后内源性神经干细胞的增殖与分化及相关机制研究[D].重庆医科大学,2013.
[5]吴天定.川芎嗪对大鼠急性脊髓损伤后血管再生的作用及相关机制的研究[D].中南大学,2012.
[6]陈光.微流控技术在联合应用FK506、NGF促进神经再生研究中的应用[D].大连医科大学,2013.
[7]徐伟伟.miR-124调节骨髓源神经干细胞在大鼠脊髓损伤中的治疗作用[D].南方医科大学,2012.
[8]丁春劲.骨髓间充质干细胞与脂肪源性干细胞治疗大鼠脊髓损伤的抗凋亡作用[D].苏州大学,2012.
[9]Andrew JY,Wolfe L,Tinkoff G,et al.Assessingincidenceandriskfactorsofcervical spine injury in blunt trauma patients using thenationaltraumadatabank[J].TheAmerican Surgeon,2015,81(9):879-883.
(本文编辑:孙海儿)
10.3969/j.issn.1671-0800.2016.09.016
R653;R681.5[1],且以30岁以下的年轻人多见[2]。甲基强的松龙等神经保护剂能够显著减轻脊髓损伤引发的复杂炎症反应,脊髓损伤的大小及程度在一定程度上决定着脊髓损伤后的恢复,特别是有神经压迫客观征象[3]。本研究分析46例脊髓损伤患者的临床资料,探讨脑脊液中神经组织损伤标记物在颈脊柱损伤与挥鞭性损伤后的变化对评估神经组织损伤程度的影响,报道如下。
A
1671-0800(2016)09-1159-02在创伤及残疾性疾病中急性脊髓损伤最为严重,发病率高达(15~40)万/100万
杭州市萧山区重大科技攻关项目(2008208)
311202杭州,浙江萧山医院
韩雷,Email:youxirsk@163.com
2015-07-25

