拟南芥叶绿体发育必需蛋白PAC的原核表达及多克隆抗体制备
王 玥,梁 爽,梁慧珂,郁 飞,齐亚飞
(西北农林科技大学 生命科学学院/旱区作物逆境生物学国家重点实验室,陕西 杨凌 712100)
拟南芥叶绿体发育必需蛋白PAC的原核表达及多克隆抗体制备
王玥,梁爽,梁慧珂,郁飞,齐亚飞
(西北农林科技大学 生命科学学院/旱区作物逆境生物学国家重点实验室,陕西 杨凌 712100)
【目的】 将拟南芥叶绿体发育必需蛋白PAC进行大肠杆菌原核表达和纯化,并免疫家兔,获得针对PAC蛋白的多克隆特异性抗体,为进一步研究PAC蛋白在叶绿体发育中的功能提供保证。【方法】 将编码拟南芥PAC蛋白的cDNA克隆至原核表达载体pET-28a中,转化BL21(DE3) 表达菌,经IPTG诱导后,对诱导产生的 PAC蛋白进行镍柱亲和纯化和SDS-PAGE割胶纯化,并将纯化的PAC蛋白通过皮下注射免疫家兔,利用分离得到的抗血清,针对拟南芥野生型、PAC敲除突变系pac-1和PAC过表达系PACOE的总蛋白进行免疫印迹检测。【结果】 成功构建了拟南芥基因PAC的原核表达载体pET-28a-PAC,在37 ℃、1 mmol/L IPTG诱导4 h的大肠杆菌细胞中,可检测到分子质量为38.9 ku的重组蛋白,其大部分以可溶形式存在。用纯化诱导后的重组蛋白免疫家兔获得PAC抗血清,该抗血清能够有效地检测出1 ng原核表达的PAC重组蛋白,并在植物样品中检测出1条分子质量约为35 ku的条带。【结论】 成功制备了PAC蛋白的多克隆抗体,可用于植物中PAC蛋白含量的检测。
叶绿体;PAC蛋白;原核表达;抗体制备
在高等植物中,叶绿体是进行光合作用的细胞器,同时还是合成氨基酸、脂类和植物激素等重要代谢物的场所[1]。叶绿体由前质体转化而来,整个发育过程受遗传、环境等因子的紧密调控[2]。当参与叶绿体发育的必需基因功能完全丧失时,植物通常会表现出白化致死的表型[3]。PALECRESS(PAC)是参与叶绿体早期发育过程的必需基因。目前报道的拟南芥PAC缺失突变体pac-1和pac-2均白化致死[4-6],导致关于PAC的功能研究积累很少。PAC缺失导致叶绿体发育受阻,但并不影响核基因RbcS和LhcB的表达。虽然PAC缺失突变体叶绿体的mRNA成熟和积累异常[7],但是该异常也可能是叶绿体发育受阻而产生的次级效应。蛋白质结构分析表明,PAC是一个富含α-螺旋的酸性蛋白,没有可辨识的功能域,但酸性蛋白富含负电荷的结构域,通常参与蛋白间相互作用的调控[8]。本研究对PAC蛋白进行原核表达和纯化,制备特异性的多克隆抗体,并对制备的多克隆抗体进行免疫印迹检测,以期为后续从蛋白水平上研究PAC的生物学功能提供条件。
1 材料与方法
1.1材料
1.1.1植株、细菌和载体野生型拟南芥植株(Col-0)、pac-1 (SALK_012320)和CaMV 35S启动子调控的PAC过表达材料(PACOE),由西北农林科技大学生命科学学院梁爽博士提供;大肠杆菌TOP10和BL21(DE3)、原核表达载体pET-28a,由西北农林科技大学生命科学学院植物分子遗传实验室保存。
1.1.2主要工具酶与试剂T4 DNA连接酶、限制性内切酶和TaqDNA聚合酶等购自TaKaRa公司,质粒提取试剂盒、琼脂糖凝胶回收试剂盒均购自天根生化科技公司,His标签蛋白纯化柱填料Ni Sepharose 6 Fast Flow购自GE Healthcare Life Science公司,蛋白免疫印迹化学发光试剂盒购自Bio-Rad公司。
1.2方法
1.2.1原核表达载体的构建根据TAIR(The Arabidopsis Information Resource)数据库发布的拟南芥PAC基因序列(AT2G48120)以及pET-28a多克隆位点,设计1对特异性引物:
上游引物P1:5′-CATGGATCCGCTACGAA-GAAGCTGACTACA-3′;
下游引物P2:5′-CGGGATCCCTACTTATCA-TCATCATCTTTATAATCCCACTTCAAGTTG-AGGGCTAAAT-3′。
上游引物下划线部分为BamHⅠ酶切位点。以本实验室保存的pBluescript-AT2G48120质粒为模板,利用P1和P2引物进行PACcDNA片段的PCR扩增。PCR产物和pET-28a载体经BamH Ⅰ限制性内切酶酶切,并经琼脂糖凝胶回收试剂盒回收。回收后的pET-28a载体和PACcDNA用T4 DNA连接酶于4 ℃下连接过夜,连接产物经热激法转化大肠杆菌克隆菌株TOP10。经卡那霉素及菌落PCR筛选阳性克隆,提取质粒进行酶切验证。将阳性克隆送至华大基因公司测序,对测序正确的原核表达重组载体pET28a-PAC,将用于表达重组蛋白Hisx6-PAC。
1.2.2pET28a-PAC的诱导表达及重组蛋白Hisx6-PAC的纯化将pET28a-PAC转化大肠杆菌表达菌株BL21(DE3)。挑取阳性单克隆,接种到含有50 μg/mL卡那霉素的LB液体培养基中, 37 ℃、200 r/min培养至菌液OD600达到0.5~1.0时,加入终浓度1 mmol/L 的IPTG于37 ℃诱导表达4 h。分别取1 mL诱导前菌液和诱导后菌液,利用12% SDS-聚丙烯酰氨凝胶(SDS-PAGE)电泳检测Hisx6-PAC的表达。
收集1 L上述IPTG诱导后的菌液,加入30 mL裂解缓冲液(50 mmol/L NaH2PO4、300 mmol/L NaCl、10 mmol/L咪唑,pH 8.0),经超声波细胞破碎仪(宁波新芝,功率200 W)于冰水浴内裂解。大肠杆菌裂解液经12 000 r/min 离心后,收集上清液。将上清液与1 mL Ni Sepharose 6 Fast Flow填料孵育30 min,转入简易重力柱装置中。填料经裂解缓冲液洗10个柱体积,使用4 mL洗脱缓冲液(50 mmol/L NaH2PO4、300 mmol/L NaCl、100 mmol/L咪唑,pH 8.0)洗脱收集Hisx6-PAC。将收集的Hisx6-PAC经SDS-PAGE电泳,进一步割胶纯化[9]。将纯化的蛋白利用SDS-PAGE及BSA质量浓度梯度(1.0,0.5,0.25,0.125 mg/mL)检测Hisx6-PAC的纯度和浓度。
1.2.3抗血清的制备及验证取纯化后的Hisx6-PAC蛋白免疫家兔。首免剂量200 μg /只,加入等体积弗氏完全佐剂剧烈混匀后,于背部多点皮下注射[10]。此后每隔2周进行1次加强免疫,加强免疫剂量100 μg/只。2次加强免疫之后,心脏采血并收集血清。利用蛋白免疫印迹检测抗血清能否识别Hisx6-PAC。
将纯化的Hisx6-PAC抗原进行梯度稀释,分别取100,10 和1 ng进行12% SDS-PAGE电泳。蛋白样品经半干法转移到硝酸纤维素膜(0.45 μm)上。硝酸纤维素膜经封闭液(质量分数5%脱脂牛奶/TBST)室温封闭1 h后,加入经封闭液稀释的抗血清(1∶5 000)于室温下孵育1 h;用TBST(20 mmol/L Tris-HCl(pH7.5)、150 mmol/L NaCl、体积分数0.1% Tween 20)洗涤3次;用HRP标记羊抗兔IgG(1∶10 000稀释)室温孵育1 h后再经TBST洗涤3次;用ECL进行显色处理[11]。
1.2.4拟南芥总蛋白提取及抗血清检测将野生型拟南芥、pac-1杂合自交种子(SALK_012320)和PACOE种子经次氯酸钠消毒后,种植在装有1/2 MS培养基的三角瓶中[12],在光照培养箱中24 h光照培养,光照强度100 μmol/(m2·s),温度22 ℃。取3周龄的植物叶片材料,经液氮研磨后,每mg鲜质量加入10 μL蛋白提取缓冲液(125 mmol/L Tris-HCl (pH6.8)、质量分数4%SDS、体积分数20%甘油和100 mmol/L巯基乙醇),55 ℃提取1 h。提取的蛋白样品经12%SDS-PAGE分离后,进行蛋白免疫印迹检测。
2 结果与分析
2.1重组质粒pET28a-PAC的构建和鉴定
以pBluescript-AT2G48120质粒为模板,进行PCR扩增。扩增条带经BamHⅠ单酶切后构建至pET-28a的多克隆位点。由图1可以看到,阳性质粒经BamHⅠ单酶切验证获得5.3 kb的质粒骨架和0.9 kb的单插入;再经XbaⅠ单酶切验证为正向插入(若是反向插入,则PACcDNA和pET-28a质粒各有一个XbaⅠ,距离为0.9 kb)。测序结果表明,酶切验证获得的阳性质粒PAC序列完全正确。
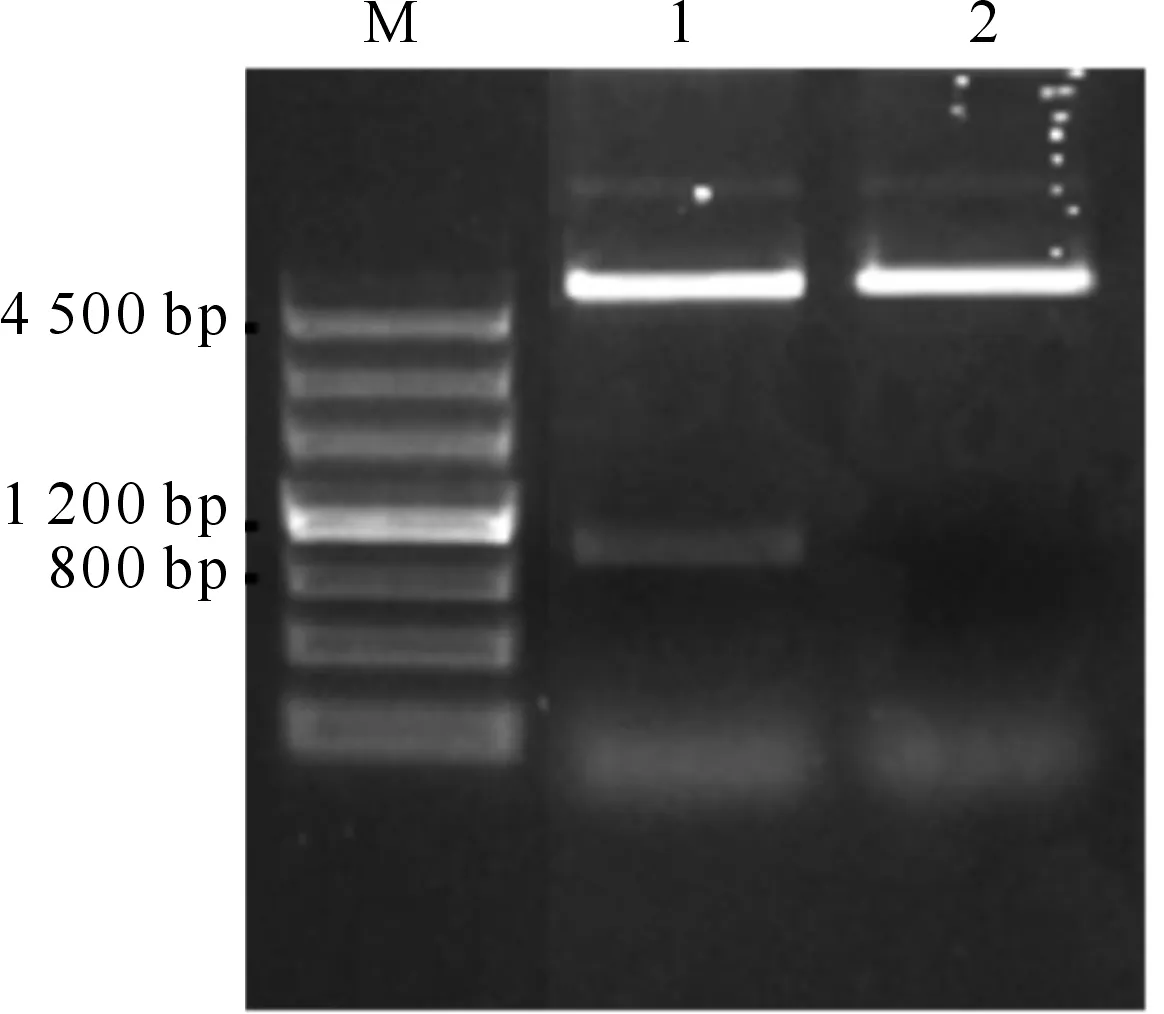
图 1 重组质粒pET28a-PAC的酶切验证M.DNA ladder;1.pET28a-PAC的BamHⅠ酶切; 2.pET28a-PAC的XbaⅠ酶切Fig.1 Confirmation of the recombinant plasmid pET28a-PACM.DNA ladder;1.pET28a-PAC digested by BamHⅠ; 2.pET28a-PAC digested by XbaⅠ
2.2重组质粒pET28a-PAC的原核表达和纯化
将pET28a-PAC转入大肠杆菌表达菌株BL21(DE3)中,利用1 mmol/L IPTG于37 ℃诱导表达4 h。取诱导前后的大肠杆菌进行SDS-PAGE电泳检测,由图2可见,在分子质量为33和45 ku处各出现1条诱导型蛋白条带。利用Ni Sepharose 6 Fast Flow对该蛋白进行纯化富集,为了进一步验证被富集的诱导条带为Hisx6-PAC,采用Hisx6-标签抗体进行蛋白免疫印记验证,结果(图2)表明,该富集蛋白含有Hisx6标签。
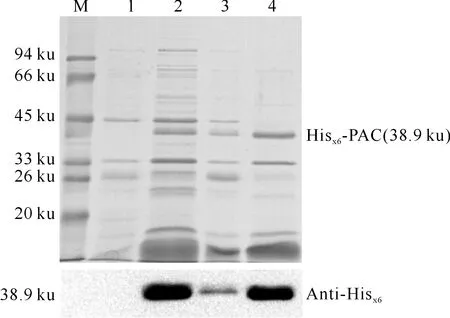
图 2重组质粒pET28a-PAC的诱导表达
M.Protein Marker;1.诱导前的BL21(DE3)/pET28a-PAC菌液;2.IPTG诱导后的BL21(DE3)/pET28a-PAC菌液;3.上柱蛋白穿出液;4.100 mmol/L咪唑蛋白洗脱液
Fig.2Induced expression of pET28a-PAC
M.Protein Marker;1.BL21(DE3)/pET28a before induction;2.BL21(DE3)/pET28a induced with IPTG;3.Flow-through supernatant after incubation with Ni2+resin;4.Eluted samples with 100 mmol/L imidazole
鉴于Hisx6-PAC属于可溶性表达,在纯化过程中会引入大肠杆菌杂质蛋白,因此采用割胶和电洗脱的方法纯化2次,并采用BSA质量浓度梯度(1.0,0.5,0.25,0.125 mg/mL)对纯化产物进行相对定量,测得纯化的Hisx6-PAC重组蛋白质量浓度约为0.3 mg/mL(图3)。
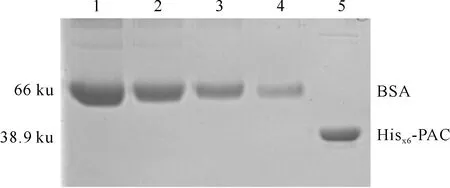
图 3 重组蛋白Hisx6-PAC的纯化及定量 1~4.分别为1.0,0.5,0.25,0.125 mg/mL BSA; 5.割胶纯化后的Hisx6-PACFig.3 Purification and quantification of recombinant Hisx6-PAC 1-4.1.0,0.5,0.25,0.125 mg/mL BSA; 5.Gel purification of Hisx6-PAC
2.3Hisx6-PAC抗血清的制备与检测
将纯化得到的Hisx6-PAC重组蛋白进行家兔免疫试验,对收集的免疫后血清进行蛋白质免疫印迹检测。结果(图4)表明,在对Hisx6-PAC抗血清进行1∶5 000倍稀释后,能够清晰检测到低至1 ng的Hisx6-PAC重组蛋白。
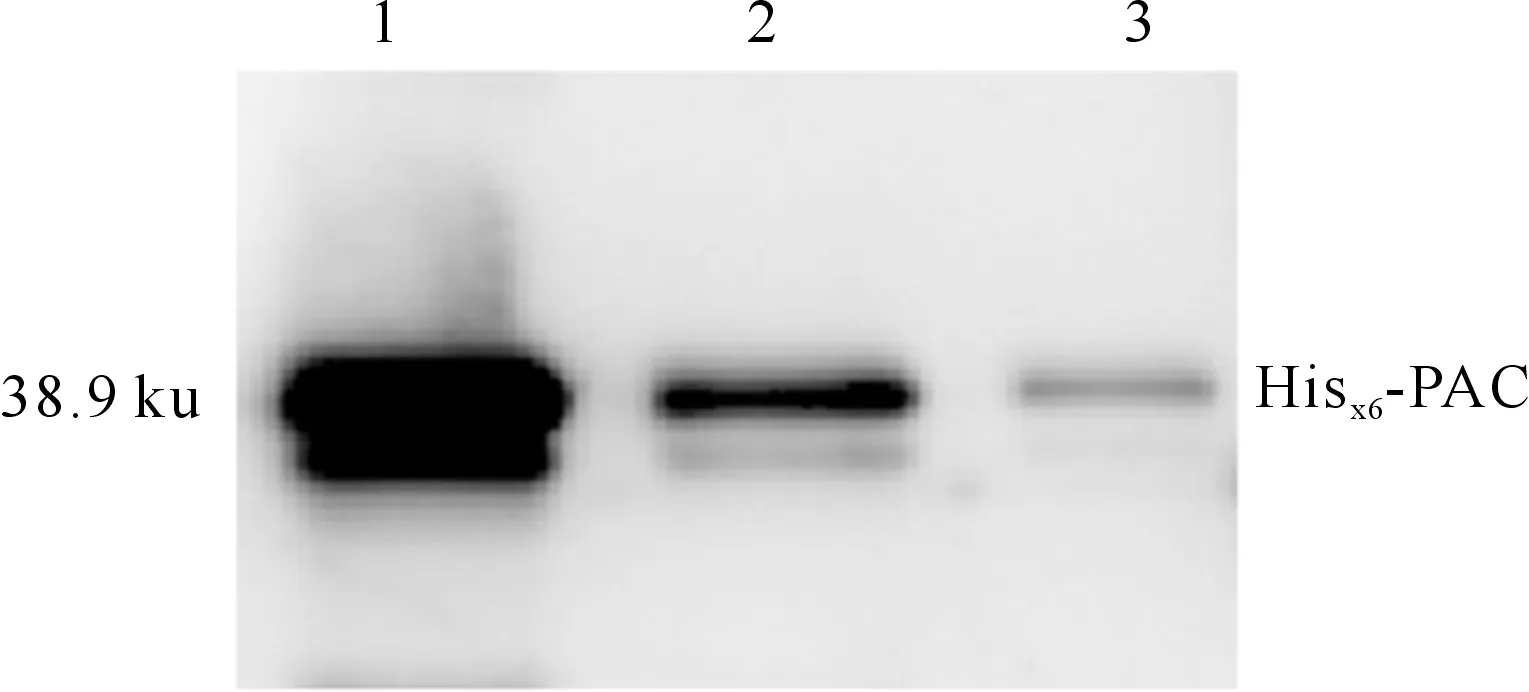
图 4 Hisx6-PAC抗血清的蛋白免疫印迹检测 1~3.100,10,1 ng的Hisx6-PAC抗原Fig.4 Immunoblot analysis of antisera to Hisx6-PAC 1-3.100,10,1 ng of Hisx6-PAC antigen
2.4pac-1突变体的白化表型
已报道的pac-1突变体均会白化致死[4-6]。在1/2 MS培养基上种植野生型拟南芥(WT)和pac-1杂合自交种子,由图5结果可见,与野生型拟南芥相比,3周龄的pac-1纯合突变体呈现出白化表型,并发育出可辨识的嫩黄色真叶组织。表明在pac-1突变体中,PAC缺失导致叶绿体不能够正常发育,叶绿素合成能力减弱,与已有的报道结论“PAC基因敲除致死”[6-7]相一致。

图 5 野生型拟南芥和pac-1突变体的表型 WT.野生型;pac-1.pac-1突变体Fig.5 Phenotype of wild type and pac-1 mutant WT.Wild type;pac-1.pac-1 mutant
2.5植物PAC蛋白的表达量
按每mg鲜质量幼嫩植物加入10 μL提取液提取野生型拟南芥、pac-1纯合突变体和PACOE的总蛋白,对3种植物样品中PAC蛋白含量进行蛋白免疫印记检测,使用1 ng的Hisx6-PAC重组蛋白抗原作为阳性对照。图6显示,在pac-1样品中,与叶绿体发育相关的捕光天线色素蛋白(LHCB)的表达量明显下降,这与pac-1突变体白化表型一致。由图6还可知,在野生型植物叶片中检测到1条分子质量约为35 ku的蛋白条带,该蛋白条带在pac-1样品中缺失,但在过表达样品PACOE中表达量显著提高。这些数据表明,在野生型拟南芥中检测到的35 ku的蛋白条带为野生型的PAC。
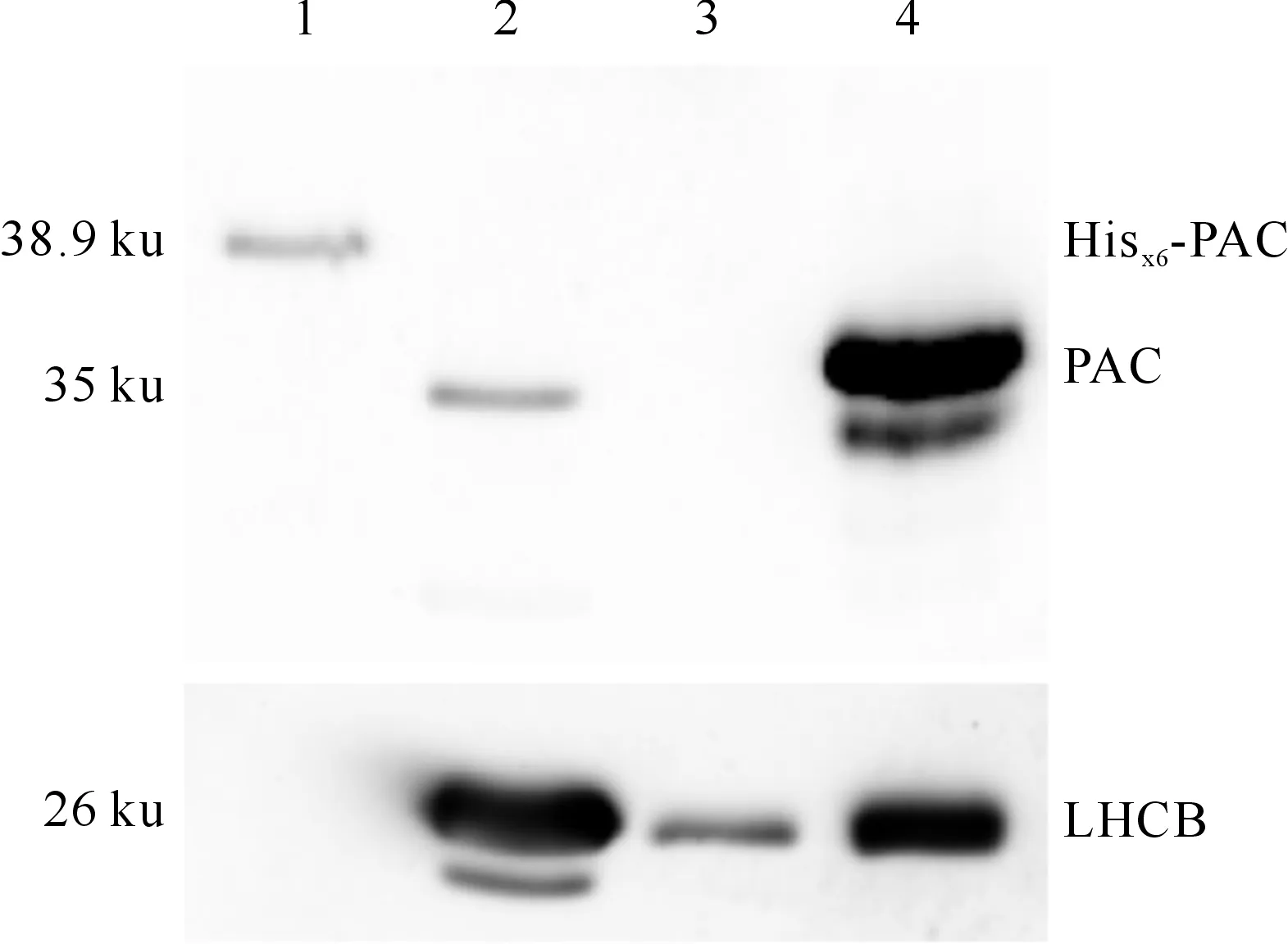
图 6 Hisx6-PAC抗血清在植物样品中的特异性检测 1.1 ng Hisx6-PAC抗原;2~4.分别为野生型、pac-1突变体、PACOE叶片总蛋白Fig.6 Specific detection of PAC in different plant lines 1.1 ng Hisx6-PAC antigen;2-4.Total leaf proteins from wild type,pac-1 mutant and PACOE,respectively
3 讨 论
自Pac-1突变体1994年被首次发现以来[4],由于其纯合致死的表型,并没有关于其功能研究的深入报道。为了深入研究PAC蛋白在叶绿体发育过程中的作用,本研究制备了其多克隆抗体。由于Hisx6-PAC的可溶性表达,在纯化Hisx6-PAC重组蛋白时,可能会因蛋白间的相互作用造成大肠杆菌杂质蛋白的污染[13],从而对后续免疫试验产生不利影响,因此采取了进一步割胶纯化。2次割胶纯化后的Hisx6-PAC在纯度和浓度上都能够满足后续免疫试验的需要。
研究表明,具有313个氨基酸残基的PAC蛋白的前22个氨基酸残基为叶绿体定位信号肽,切去信号肽的成熟野生型PAC蛋白的分子质量约为35 ku[14]。本研究制备的PAC抗血清在植物样品中检测到了相应分子质量大小的蛋白信号。但是,拟南芥叶绿体蛋白组可能包含有3 000余种蛋白质[15],而pac-1突变体属于叶绿体发育突变体,其叶绿体发育受阻可能导致很多叶绿体功能蛋白不能够正常积累,如本试验中pac-1突变体的LHCB积累严重下降。因此,仅用野生型植株和pac-1突变体不足以证实该35 ku信号就属于PAC蛋白。在本试验中,加入了CaMV 35S启动子调控的PAC过表达材料PACOE来进一步证实,结果表明制备的PAC抗血清有效。
[1]Sakamoto W,Miyagishima S,Jarvis P.Chloroplast biogenesis:Control of plastid development,protein import,division and inheritance [J].Arabidopsis Book,2008,6:e0110.
[2]Pogson B J,Albrecht V.Genetic dissection of chloroplast biogenesis and development: an overview [J].Plant Physiol,2011,155(4):1545-1551.
[3]Heinnickel M L,Grossman A R.The GreenCut:Re-evaluation of physiological role of previously studied proteins and potential novel protein functions [J].Photosynth Res,2013,116(2/3):427-436.
[4]Reiter R S,Coomber S A,Bourett T M,et al.Control of leaf and chloroplast development by theArabidopsisgene pale cress [J].Plant Cell,1994,6(9):1253-1264.
[5]Holding D,Springer P,Coomber S.The chloroplast and leaf developmental mutant,pale cress,exhibits light-conditional severity and symptoms characteristic of its ABA deficiency [J].Ann Bot,2000,86(5):953-962.
[6]Grevelding C,Suter-Crazzolara C,von Menges A,et al.Characterisation of a new allele of pale cress and its role in greening inArabidopsisthaliana[J].Mol Gen Genet,1996,251(5):532-541.
[7]Meurer J,Grevelding C,Westhoff P,et al.The PAC protein affects the maturation of specific chloroplast mRNAs inArabidopsisthaliana[J].Mol Gen Genet,1998,258(4):342-351.
[8]Luna E J,Hitt A L.Cytoskeleton-plasma membrane interactions [J].Science,1992,258 (5084):955-964.
[9]时永全,韩者艺,王新,等.利用聚丙烯酰胺凝胶电泳纯化的微量蛋白制备抗血清 [J].细胞与分子免疫学杂志,2002,18(6):621-623.
Shi Y Q,Han Z Y,Wang X,et al.Preparation of antiserum using trace protein purified by SDS-PAGE as immunogen [J].Chin J Cell Mol Immunol,2002,18(6):621-623.
[10]李芳,罗军,许会芬,等.西农萨能羊MAT基因的原核表达及多克隆抗体制备 [J].西北农林科技大学学报(自然科学版),2014,42(12):1-6,12.
Li F,Luo J,Xu H F,et al.Prokaryotic expression and polyclonal antibody preparation of malonyl/acetyl transacylase gene of Xinong Saanen Goat [J].Journal of Northwest A&F University (Natural Science Edition),2014,42(12):1-6,12.
[11]Yu F,Park S S,Liu X,et al.Suppressor of variegation 4,a new var2 suppressor locus,encodes a pioneer protein that is required for chloroplast biogenesis [J].Mol Plant,2011,4(2):229-240.
[12]李啸浪,胡新文,刘晓丽,等.热带地区拟南芥栽培技术及基因转化体系的构建 [J].热带作物学报,2005,26(3):56-60.
Li X L,Hu X W,Liu X L,et al.Cultivation and transformation of the model plantArabidopsisthalianain tropical areas [J].Chinese Journal of Tropical Crops,2005,26(3):56-60.
[13]徐建强,周裕军,张聪,等.禾谷镰孢菌β2-微管蛋白在大肠杆菌中的可溶性表达及纯化 [J].中国农业科学,2012,45(6):1084-1092.
Xu J Q,Zhou Y J,Zhang C,et al.Soluble expression and purification ofFusariumgraminearumβ2-tubulin inEscherichiacoli[J].Scientia Agricultura Sinica,2012,45(6):1084-1092.
[14]Emanuelsson O,Nielsen H,Brunak S,et al.Predicting subcellular localization of proteins based on their N-terminal amino acid sequence [J].J Mol Biol,2000,300(4):1005-1016.
[15]Leister D.Chloroplast research in the genomic age [J].Tren-ds Genet,2003,19(1):47-56.
Prokaryotic expression and preparation of polyclonal antibody for essential protein PAC ofArabidopsischloroplast
WANG Yue,LIANG Shuang,LIANG Huike,YU Fei,QI Yafei
(CollegeofLifeSciences/StateKeyLaboratoryofCropStressBiologyforAridAreas,NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
【Objective】 The essential protein PAC ofArabidopsischloroplast was purified and expressed inE.colibefore being injected into rabbits as antigen to generate specific polyclonal antibody.【Method】 PAC cDNA was cloned into prokaryotic expression vector pET-28a,and the recombinant vector was transformed intoE.coliBL21(DE3).After IPTG induction,induced PAC was purified via Nickel affinity chromatography,followed by electrophoretic elution from SDS-PAGE gel slices.Purified PAC protein was used to immunize rabbits,and anti-PAC antiserum was obtained and tested against total proteins fromArabidopsis,including the wild type,the PAC knockout line and PAC overexpression lines with Western blot.【Result】 The prokaryotic expression vector pET-28a-PAC was constructed successfully and expressed inE.coliBL21(DE3) induced with 1 mmol/L IPTG.A recombinant protein with molecular weight of 38.9 ku was detected.The anti-PAC antiserum was efficient to detect 1 ng of PAC antigen.A specific band with molecular weight of ~35 ku corresponding to PAC in total protein ofArabidopsiswas also detected.【Conclusion】 The specific antiserum against PAC protein was prepared successfully,which can be used for detection of PAC in chloroplasts.
chloroplast;PAC protein;prokaryotic expression;antibody preparation
时间:2016-09-0709:03DOI:10.13207/j.cnki.jnwafu.2016.10.024
2015-04-03
国家自然科学基金项目(31300988);教育部博士点基金新教师项目(20120204120036);国家级大学生创新训练计划项目(20140712071)
王玥(1993-),男,河北邯郸人,在读本科生,主要从事植物叶绿体发育基因功能研究。
E-mail:Wangss1993@126.com
齐亚飞(1984-),男,河南淮阳人,副教授,硕士生导师,主要从事叶绿体发育研究。E-mail:Yafei.Qi@gmail.com
Q78
A
1671-9387(2016)10-0171-05
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160907.0903.048.html

