羊伪结核抗体间接ELISA检测方法的建立
霍宁宁,朱伟英,高 洋,杨雯昱,岳进华,赵燕清,陈德坤
(西北农林科技大学 动物医学院,陕西 杨凌 712100)
羊伪结核抗体间接ELISA检测方法的建立
霍宁宁,朱伟英,高洋,杨雯昱,岳进华,赵燕清,陈德坤
(西北农林科技大学 动物医学院,陕西 杨凌 712100)
【目的】 建立羊伪结核棒状杆菌抗体的间接ELISA检测方法。【方法】 分别用不同浓度的伪结核棒状杆菌菌体抗原和培养上清可溶性抗原包被酶标板,用脱脂奶粉封闭酶标板,设置封闭时间分别为1.0,1.5和2 h,再用不同稀释度的血清(1∶100,1∶200,1∶400和1∶800)与之反应,以此优化间接ELISA反应条件,确定阳性结果判定的临界值。对间接ELISA方法的特异性和重复性进行考察,并在此基础上对采集的临床样本进行检测。【结果】 选用伪结核棒状杆菌菌体为包被抗原,最佳包被抗原菌体密度为OD600=0.08,血清的最佳稀释度为1∶400,封闭时间为2 h,阳性血清的临界值为0.329。该抗体检测方法可特异性地检测出伪结核阳性血清,羊口疮阳性血清、羊痘阳性血清、乳房炎阳性血清均呈阴性反应;组内,组间变异系数<10%。该方法对临床样本的检测结果与实际患病状况一致。【结论】 成功建立了伪结核抗体间接ELISA检测方法,该方法特异性强、重复性好,可用于临床诊断和批量血清学检测。
羊干酪性淋巴结炎;伪结核棒状杆菌;间接酶联免疫吸附试验
羊干酪性淋巴结炎(Caseous lymphadenitis,CLA),又称羊伪结核病,是由伪结核棒状杆菌(Corynebacteriumpseudotuberculosis,C.p)引起的一种山羊和绵羊的慢性人兽共患病,在全世界养羊区域广泛分布。该病在临床上有体表型、内脏型、混合型3种表现形式,体表型以体表淋巴结(腮腺淋巴结、颌下淋巴结等)形成脓胞为主要特征,内脏型在内脏器官和纵膈淋巴结形成脓肿且伴随严重的渐行性消瘦,内脏型一般在体表无脓胞症状。临床中亦有体表型和内脏型共存的羊只,即混合型[1]。该病主要的传染源是患病羊只,患病山羊破溃的脓肿能够向外界释放大量的活菌菌体,从而造成外界环境污染,健康羊只通过直接接触患病羊只破溃脓汁或者接触污染的环境而感染该病,亦有报道称该病可通过呼吸道或媒介传播[1-3]。CLA多呈慢性经过,患病羊只食欲不减退但产奶量、产肉量、产毛量下降,身体渐行性消瘦,生产力下降但是能源消耗不减,且出现繁殖功能障碍[1,3]。
抗生素对本病的治疗效果不明显[4],因此及时准确地检测并隔离患病羊只是控制该病最有效的方法。有效的诊断方法对该病尤其对内脏型患病羊只的诊断具有极其重要的意义。鉴于目前国内山羊均没有免疫接种CLA疫苗,因而通过测定CLA抗体水平,可以有效反映羊只的感染情况。目前,CLA的诊断方法有协同溶血抑制试验[5]和PCR[6-8],但这些方法均需要分离病原菌,且主要针对体表型患病羊只,在实际临床中诊断意义不大。CLA血清学诊断方法主要有菌体凝集抑制试验[9]和琼脂双扩散试验,但菌体凝集抑制试验操作繁琐、耗时耗力,不利于大规模临床应用,而琼脂双扩散试验特异性和灵敏度较差。为此,本研究建立了CLA抗体的间接ELISA检测方法,以期为CLA患病羊只的及时诊断提供方法上的支持。
1 材料与方法
1.1材料
1.1.1试验菌株伪结核棒状杆菌,由西北农林科技大学动物医学院免疫实验室(以下简称本实验室)从患病山羊破溃脓汁中分离鉴定。
1.1.2试验血清CLA阳性血清采自具有典型伪结核临床症状的山羊,阴性血清采自健康新生羔羊脐带血。羊口疮阳性血清、羊痘阳性血清、乳房炎阳性血清由本实验室保存。待检血清共12份,其中4份采自体表具有典型脓胞症状的山羊,4份来自屠宰场宰杀的体表正常但肝脏、消化道有很多脓胞的CLA山羊(经实验室细菌分离鉴定为CLA),4份来自屠宰场宰杀的正常健康山羊。
1.1.3主要试剂及仪器设备间接ELISA酶标板购自康宁公司,封闭液用市售脱脂奶粉配制,TMB底物显色液购自天根生化科技有限公司,辣根过氧化物酶(HRP)标记的兔抗羊酶标二抗购自北京博奥森生物技术有限公司,胰蛋白胨、酵母提取物购自OXOID公司,其他试剂为国产分析纯试剂;摇床购自上海智城分析仪器制造有限公司,高速离心机购自Sigma,酶标仪购自BIO-RAD,分光光度计购自尤尼柯(上海)仪器有限公司。
1.2间接ELISA包被抗原的筛选
1.2.1抗原的制备将分离培养的伪结核棒状杆菌单菌落接种于5 mL LB培养液中,在220 r/min、37 ℃的条件下扩大培养48 h后,12 000 r/min离心4 min,分别收集培养上清液和菌体,4 ℃保存, 1周内使用。
1.2.2包被抗原的确定菌体抗原和细菌培养上清中的可溶性抗原(简称可溶性抗原)哪个更适宜作为包被抗原,对此尚未见到报道。本研究将伪结核棒状杆菌培养上清和菌体抗原作为包被抗原使用,取培养上清,加入到间接ELISA酶标板中,加入量为100 μL/孔,封口后置于4 ℃作用14 h。用碳酸盐包被缓冲液重悬菌体,取菌悬液,加入到间接ELISA酶标板中,加入量为100 μL/孔,封口后于4 ℃作用14 h。其余步骤按照ELISA常规操作方法进行。运用 SPSS 17.0 对测定结果进行分析。
1.3间接ELISA试验条件的优化
1.3.1菌体抗原密度的确定用碳酸盐包被缓冲液重悬菌体,在分光光度计上调整菌体密度,使其OD600分别为0.120,0.080,0.050,0.035和0.010,取菌悬液,加入到间接ELISA酶标板中,加入量为100 μL/孔,封口后于4 ℃作用14 h。上述每个包被浓度设3个重复孔。包被结束后弃掉菌悬液,将PBST加入到间接ELISA酶标板中,加入量为200 μL/孔,轻微振荡10 s后弃掉洗涤液,该洗涤操作重复3次,最后一次洗涤完成后在干净的纱布上拍干洗涤液。将50 g/L脱脂奶粉加入到间接ELISA酶标板中,加入量为100 μL/孔,37 ℃封闭,设置封闭时间为1.0,1.5和2.0 h。封闭结束后弃掉封闭液,洗涤方法同前。
1.3.2一抗血清稀释度的确定在间接ELISA酶标板中加入稀释度分别为1∶100,1∶200,1∶400和1∶800的阴性血清、阳性血清,同时用PBST代替阳/阴性血清做空白对照,每个稀释度设3个重复孔。封口后于37 ℃孵育1 h,孵育结束弃掉一抗血清后洗涤。
1.3.3加酶标二抗用PBST将辣根过氧化物酶标记的兔抗羊酶标二抗进行1∶5 000稀释,按照100 μL/孔的量加入到间接ELISA酶标板中,封口后于37 ℃孵育1 h,孵育结束后弃掉酶标二抗洗涤。
1.3.4显色取4 ℃避光保存的显色液,按照100 μL/孔的量加入到间接ELISA酶标板中,于37 ℃避光孵育20 min。
1.3.5反应终止及测定取2 mol/L稀H2SO4,加入到间接ELISA酶标板中,加入量为100 μL/孔,立即于酶标仪450 nm处读取结果。
1.4阳性临界值的确定
参照文献[10],以20份健康孕羊所分娩的新生胎儿的脐带血作为阴性血清,每份阴性血清1∶400稀释后作为一抗血清,按上述方法进行间接ELISA试验,检测该稀释度的OD450值,计算其平均值和标准差(SD),阳性临界值为OD450平均值与3SD之和。当待检血清1∶400稀释样品的OD450检测值大于阳性临界值时,即可判定该样品为伪结核阳性。
1.5间接ELISA方法的重复性试验
批内重复性试验:在同一块酶标板上,取伪结核阳性和阴性血清各5份,1∶400稀释后作为一抗血清,按上述方法进行ELISA试验,并设以PBST代替血清的空白对照,每份血清做3个重复。计算批内变异系数(CV),批内CV=(SD/OD450平均值)×100%。
批间重复性试验:取3块不同批次包被的酶标板,取伪结核阳性和阴性血清各5份,1∶400稀释后作为一抗血清,按上述方法进行ELISA试验,每份血清做3个重复,并用PBST代替血清做空白对照。计算批间变异系数(CV):批间CV=(SD/OD450平均值)×100%。
1.6间接ELISA方法的特异性试验
以本试验确定的最佳用量抗原包被酶标板,分别用羊口疮、羊痘、乳房炎阳性血清作为一抗加入,另设伪结核阳性血清、伪结核阴性血清为对照,按上述方法进行ELISA试验,统计测定结果。
1.7间接ELISA方法对临床样品的检测
取待检血清样品,按照本试验确定的最佳条件,设置伪结核阳性血清、伪结核阴性血清对照,并将PBST代替阴/阳血清做空白对照,进行ELISA试验,统计并分析试验结果。
2 结果与分析
2.1间接ELISA包被抗原的确定
这段时间景花厂没一个人提出辞工,工作都很投入。八十个人等米下锅啊,王义山多次告催,说车间没活干了,员工们闲着了。他的话像一根鞭子,抽在我和阿花的身上,我们马不停蹄往外跑,为八十名员工打工。跑了老客户,又找新客户,丢了大客户,捡起小客户。阿花那张俏丽的脸是一张惹人注目的名片,无须开口,先给了人家几份好感。我的技术也是一张漂亮的名片,给景花厂赢来了技术和质量上的口碑。人家有订单呢,多少会分一点,没订单呢,人家只有耸耸肩。
表1结果显示,当用菌体抗原包被酶标板时,各个稀释度阴、阳血清的测定值差异极显著(P<0.01);当用可溶性抗原包被酶标板时,各个稀释度阴、阳血清的测定值差异不显著(P>0.05)。说明包被抗原选用菌体抗原效果更好。

表 1 伪结核棒状杆菌菌体和可溶性抗原的ELISA测定Table 1 ELISA results of somatic antigen and soluble antigen
注:用t检验法对同一稀释度的伪结核阴性、阳性血清测定值进行差异显著性分析,**表示差异极显著(P<0.01),*表示差异显著(P<0.05),不标注者表示差异不显著。
Note:Significance analysis of positive and negative serums of CLA at the same dilution level were taken by the method of student’sttest.* and ** represent significant differences atP<0.05 andP<0.01, respectively.
2.2间接ELISA包被抗原菌体密度和血清稀释度的确定
以伪结核棒状杆菌菌体为包被抗原,设置不同的梯度对包被抗原菌体密度和血清稀释度进行分析。结果(表2)显示,当用碳酸盐缓冲液重悬菌体调整菌液OD600=0.080、血清的稀释度为1∶400时,阳性血清的OD450接近于1.0,阴性血清的OD450较接近本底值(0.030)。故本研究确定包被抗原菌体密度为OD600=0.080,血清的稀释度为1∶400。
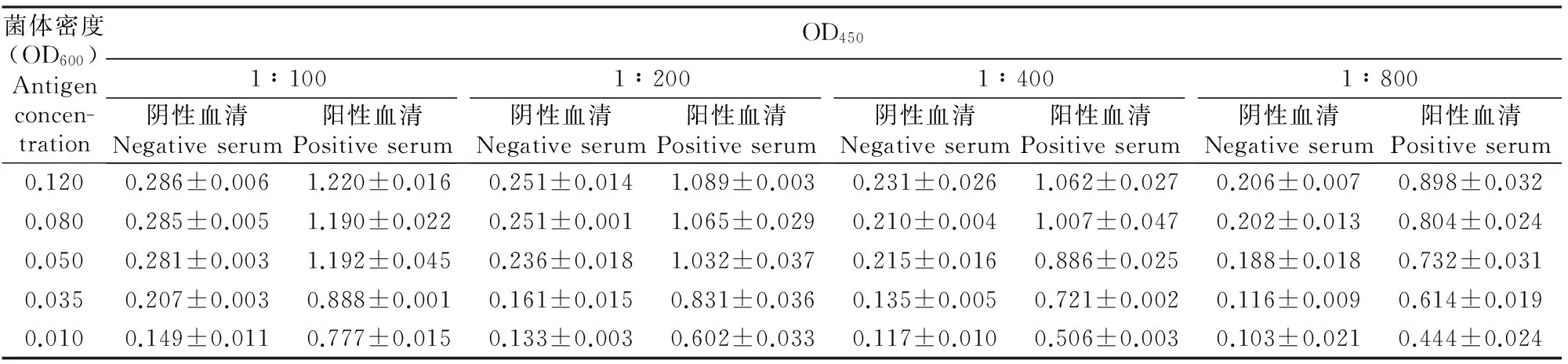
表 2 包被抗原菌体密度和血清稀释度对伪结核棒状杆菌抗体间接ELISA测定结果的影响Table 2 Effect of coating antigen concentration and dilution of serum on the indirect ELISA for detecting antibodies against C.pseudotuberculosis
2.3间接ELISA封闭时间的优化
由表3可知,封闭时间不同时,阳性血清、空白对照的测定值差异显著(P<0.05),说明封闭时间对血清测定值有影响;封闭时间为2 h时,阳性血清测定值接近于1.0,阴性血清测定值、空白对照值最接近本底值(0.030)。因此,确定封闭时间为2 h。

表 3 封闭时间对伪结核棒状杆菌抗体间接ELISA测定结果的影响Table 3 Effect of blocking time on the indirect ELISA for detecting antibodies against C.pseudotuberculosis
注:同列数据后标不同小写字母者表示组间差异显著(P<0.05)。
Note:Different lowercase letters in each column indicate significant difference (P<0.05).
2.4间接ELISA阳性血清临界值的确定
对20份健康孕羊脐带血的检测结果(表4)显示,其OD450最大值为0.285,最小值为0.207,平均值为0.251,标准差为0.026,则阳性血清的临界值应为0.329,即当检测样品OD450≥0.329时,即可判定该样品为伪结核阳性血清;当检测样品OD450<0.329时,即可判定该样品为伪结核阴性血清。
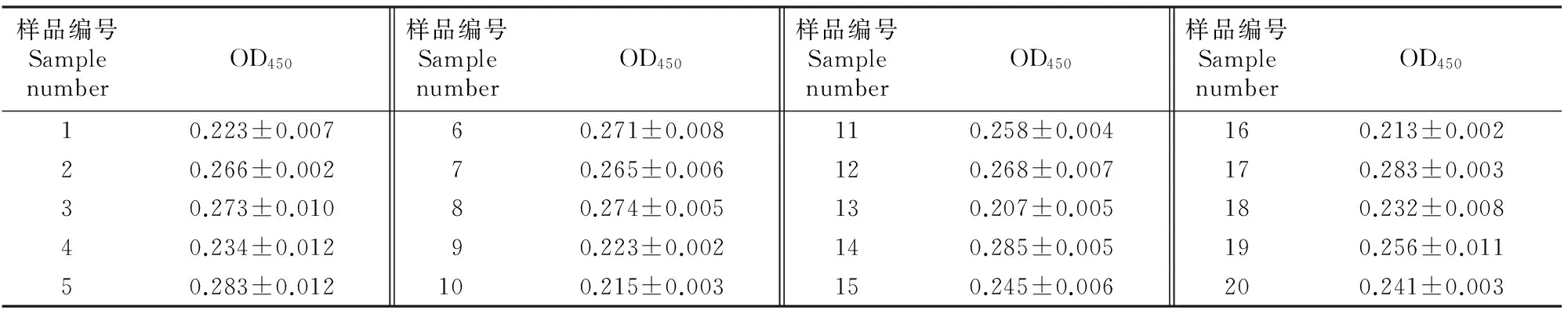
表 4 羊伪结核阴性血清的间接ELISA测定结果Table 4 ELISA results of negative serums of CLA
2.5间接ELISA重复性试验
组内重复性试验结果(表5)显示变异系数小于5%(0.7%~4.5%),组间重复性试验结果(表6)显示变异系数小于10%(1.4%~9.2%),表明所建立的间接ELISA检测方法具有良好的重复性。

表 5 伪结核棒状杆菌抗体间接ELISA检测方法的组内重复性试验结果Table 5 Results of intro-batch repetition test of the indirect ELISA for detecting antibodies against C.pseudotuberculosis

表 6 伪结核棒状杆菌抗体间接ELISA检测方法的组间重复性试验结果Table 6 Results of inter-batch repetition test of the indirect ELISA for detecting antibodies against C.pseudotuberculosis
2.6间接ELISA特异性试验
特异性检测结果显示,羊口疮阳性血清OD450(0.256±0.008)、羊痘阳性血清OD450(0.273±0.001)、乳房炎阳性血清OD450(0.241±0.007)与伪结核阳性血清OD450(0.995 5±0.017)差异极显著,与伪结核阴性血清OD450(0.252 5±0.004)相比差异不显著,且均小于临界值0.329,说明所建立的检测方法具有良好的特异性。
2.7羊伪结核抗体间接ELISA的临床检测
检测结果(表7)显示,4份具有典型脓胞症状和4份体表正常的内脏型患病羊只血清样品的检测值均大于0.329,呈伪结核阳性,正常健康羊只的检测值均小于0.329,呈伪结核阴性,与羊只实际患病情况一致,说明该检测方法可有效检出患病羊只。

表 7 临床样品的检测结果Table 7 ELISA results of clinical samples
3 讨 论
羊干酪性淋巴结炎是羊常见疾病,在羊场普遍发生,调查数据显示发病率多在9.3%~72.8%[11]。由于国内目前没有商品化的疫苗可以对羊只进行免疫接种,使得该传染病难以防控,因而及时检出患病羊只尤为重要。患病羊只的检测方法包括病原学检测和血清学检测,对于体表型的患病羊只,采集病料后分离病原菌即可确诊该病;对于内脏型患病羊只,其不表现典型体表脓胞症状,因而给病原学诊断带来很大困难。由于感染本病原菌的羊只会产生特异性抗体,加之本病目前无疫苗接种免疫,因此可通过测定抗体诊断本病,据此笔者认为建立一种间接ELISA抗体诊断方法对该病进行诊断是可行的。影响间接ELISA抗体测定结果的主要因素之一是抗原的选择。Kaba等[12]、Binns等[13]、Nassar等[14]均采用超声裂解的羊伪结核棒状杆菌菌体作为包被抗原,建立了间接ELISA抗体诊断方法,但该方法存在以下缺点:超声裂解后,细菌内部蛋白全部释放,导致间接ELISA检测方法的灵敏度下降,且即使控制超声条件相同,也不能消除不同批次裂解蛋白间的差异,导致检测结果不稳定。也有人尝试用伪结核棒状杆菌的可溶性抗原作为包被抗原,如Ribeiro等[15]利用48 h培养上清中的可溶性抗原作为包被抗原,Seyffert等[16]用三相分离法(TPP)从培养上清中提取分泌外毒素蛋白作为包被抗原,Menzies等[17]将分泌蛋白PLD表达纯化后作为包被抗原,分别建立了间接ELISA抗体诊断方法,但是当用分泌的可溶性抗原进行抗体检测时,患病羊只体内必定有大量的病原菌增殖,对患病晚期羊只检出意义不大,且可溶性抗原提取过程复杂,操作不便。Muckle等[18]的研究也表明,在培养上清中至少缺少3种高免疫原性的蛋白,从而导致血清中的抗体无法全面检出。本研究结果表明,将培养上清用作包被抗原时,各个稀释度阴、阳血清OD450差异不显著;当用伪结核棒状杆菌菌体作为包被抗原时,各个稀释度阴、阳血清的OD450差异显著,所以本研究采用的包被抗原为伪结核棒状杆菌菌体。
在本检测方法建立过程中,笔者发现封闭时间对测定结果有较大影响,当封闭时间不足时,导致伪结核阳性血清、伪结核阴性血清、空白对照的测定结果偏高,原因是当用菌体抗原包被酶标板时,酶标孔底部菌体间留有空隙,封闭时间不足时,酶标孔底部的空隙没有被完全封闭,导致后续试验非特异性结合,使测定结果偏高。本研究结果表明,封闭时间为2 h时,空白对照的测定结果最接近于本底值,所以本研究采用的封闭时间为2 h。重复性试验结果表明,批内试验重复性优于批间试验的重复性,可能是由于批内重复性试验更有利于控制相同的试验条件,这提示运用建立的间接ELISA抗体检测方法进行疾病诊断时,应注意使反应时间、反应温度等检测条件保持一致。
4 结 论
本研究成功建立了伪结核棒状杆菌抗体间接ELISA诊断方法,该诊断方法特异性强、重复性好,可用于临床诊断和流行病学调查。
[1]Dorella F A,Pachecol G C,Oliveira S C,et al.Corynebacteriumpseudotuberculosis:microbiology,biochemical properties,pathogenesis and molecular studies of virulence [J].Veterinary Research,2006,37(2):201-218.
[2]Guimar E S A,Carmo F B,Pauletti R B,et al.Caseous lymphadenitis:epidemiology,diagnosis,and control [J].The IIOAB Journal,2011,2(2):33-43.
[3]Baird G J,Fontaine M C.Corynebacteriumpseudotuberculosisand its role in ovine caseous lymphadenitis [J].J Comp Pathol,2007,137(4):179-210.
[4]杨雪红,郭雪洁,马宁君,等.羊干酪性淋巴结炎研究进展 [J].上海畜牧兽医通讯,2008(1):2-3.
Yang X H,Guo X J,Ma N J,et al.Research advance of caseous lymphadenitis [J].Shanghai Journal of Animal Husbandry and Veterinary Medicine,2008(1):2-3.
[5]Corrie C B,Harvey J O,Carlos Z,et al.Serodiagnosis of inapparent caseous lymphadenitis in goats and sheep,using the synergistic hemolysis-inhibition test [J].Am J Vet Res,1986,47(7):1461-1463.
[6]Kumar J,Tripathi B N,Kumar R,et al.Rapid detection ofCor-ynebacteriumpseudotuberculosisin clinical samples from sheep [J].Tropical Animal Health and Production,2013,45(6):1429-1435.
[7]Pacheco L G C,Pena R R,Castro T L P,et al.Multiplex PCR assay for identification ofCorynebacteriumpseudotuberculosisfrom pure cultures and for rapid detection of this pathogen in clinical samples [J].J Med Microbiol,2007,56(4):480-486.
[8]Cetinkaya B,Karahan M,Atil E,et al.Identification ofCorynebacteriumpseudotuberculosisisolates from sheep and goats by PCR [J].Veterinary Microbiology,2002,88(1):75-83.
[9]赵宏坤,王春芬,张学富,等.用菌体凝集抑制试验诊断伪结核病 [J].中国畜禽传染病,1996(1):36-37.
Zhao H K,Wang C F,Zhang X F,et al.Diagnosis of caseous lymphadenitisby using inhibited agglutination [J].Chinese Journal of Preventive Veterinary Medicine,1996(1):36-37.
[10]陈丽颖,张祥,李晓博,等.猪源粪肠球菌Ace蛋白间接ELISA方法的建立与应用 [J].中国兽医学报,2014,34(5):766-771.
Chen L Y,Zhang X,Li X B,et al.Development of indirect ELISA for detection of anti-Ace antibody for swine-originated Enterococcus faecalis [J].Chinese Journal of Veterinary Science,2014,34(5):766-771.
[11]赵宏坤,范伟兴,胡敬东,等.羊伪结核病研究进展 [J].中国预防兽医学报,2000,22(3):236-237.
Zhao H K,Fan W X,Hu J D,et al.Advance inCorynebacteriumpseudotuberculosis[J].Chinese Journal of Preventive Veterinary Medicine,2000,22(3):236-237.
[12]Kaba J,Kutschke L,Gerlach G F.Development of an ELISA for the diagnosis ofCorynebacteriumpseudotuberculosisinfections in goats [J].Veterinary Microbiology,2001,78(2):155-163.
[13]Binns S H,Green L E,Bailey M.Development and validation of an ELISA to detect antibodies toCorynebacteriumpseudotuberculosisin ovine sera [J].Veterinary Microbiology,2007,123(1/2/3):169-179.
[14]Nassar A F C,Miyashiro S,Gregori F,et al.Standardization of an enzyme-linked immunosorbent assay (ELISA) for detection of antibodies anti-Corynebacteriumpseudotuberculosisin sheep [J].Small Ruminant Research,2014,116(2/3):229-232.
[15]Ribeiro D,Dorella F A,Pacheco L G C,et al.Subclinical diagnosis of caseous lymphadenitis based on ELISA in sheep from Brazil [J].Journal of Bacteriology & Parasitology,2013,4(3):32-35.
[16]Seyffert N,Guimaraes A S,Pacheco L G C,et al.High seroprevalence of caseous lymphadenitis in Brazilian goat herds revealed byCorynebacteriumpseudotuberculosissecreted proteins-based ELISA [J].Research in Veterinary Science,2010,88(1):50-55.
[17]Menzies P,Muckle C,Hwang Y,et al.Evaluation of an enzyme-linked immunosorbent assay using anEscherichiacolirecombinant phospholipase D antigen for the diagnosis ofCorynebacteriumpseudotuberculosisinfection [J].Small Ruminant Research,1994,13(2):193-198.
[18]Muckle C A,Menzies P I,Li Y,et al.Analysis of the immunodominant antigens ofCorynebacteriumpseudotuberculosis[J].Veterinary Microbiology,1992,30:47-58.
Establishment of indirect ELISA for detecting antibodies againstCorynebacteriumpseudotuberculosis
HUO Ningning,ZHU Weiying,GAO Yang,YANG Wenyu,YUE Jinhua,ZHAO Yanqing,CHEN Dekun
(CollegeofVeterinaryMedicine,NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
【Objective】 This study established an indirect ELISA to detect antibodies againstCorynebacteriumpseudotuberculosisin serum. 【Method】 After the ELISA plates were coated with somatic antigen and soluble antigen,blocking buffer was added,blocking time (1,1.5,and 2 h) was determined,and serums with different dilution times (1∶100,1∶200,1∶400,and 1∶800) were added.Then the optimal conditions were determined and positive criterion was obtained.The sensitivity and repeatability were detected and the assay was used to test clinical samples.【Result】 The optimal conditions were:concentration of coating antigen OD600=0.08,dilution times of serum 1∶400,and blocking time 2 h.The positive criterion was 0.329.No cross reaction with positive serum of orf,goat pox and mastitis was observed.The coefficient of variation (CVs) of intro-batch and inter-batch repetition tests was less than 10%.The ELISA results were consistent with clinical results.【Conclusion】 The established indirect ELISA method can be used for epidemiologic survey and clinical tests with high sensitivity and specificity.
caseous lymphadenitis;Corynebacteriumpseudotuberculosis;indirect ELISA
时间:2016-09-0709:02DOI:10.13207/j.cnki.jnwafu.2016.10.003
2015-04-02
陕西省科技统筹创新工程计划项目(2015KTTSNY04-04)
霍宁宁(1989-),女,河南清丰人,在读硕士,主要从事山羊细菌病研究。E-mail:18706857456@163.com
陈德坤(1964-),男,陕西渭南人,教授,博士,博士生导师,主要从事山羊疫病免疫防控研究。
E-mail:chendekun163@163.com
S858.265.1+2
A
1671-9387(2016)10-0012-06
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160907.0902.006.html

