奥曲肽相关低血糖的自动监测评估与应用
赵粟裕,汤智慧,郭代红,赵 靓,朱 曼,马 亮,赵鹏芝(解放军总医院药品供应中心,北京 100853)
奥曲肽相关低血糖的自动监测评估与应用
赵粟裕,汤智慧,郭代红,赵靓,朱曼,马亮,赵鹏芝(解放军总医院药品供应中心,北京 100853)
目的:实施奥曲肽致低血糖的自动监测,并评价药源性低血糖模块的功能。方法:采用回顾性分析方法,利用“医疗机构ADE主动监测与智能评估警示系统”对2016年1 - 6月我院使用醋酸奥曲肽注射液的住院患者进行自动监测,对系统报警病例进行人工甄别,并对监测数据结果进行分析比较。结果:共监测950例患者,其中自动报警26例,人工甄别为阳性12例,ADR发生率范围为1.26% ~ 1.56%,与说明书报道结果相符;发生药源性低血糖的风险因素为“罹患胰腺相关疾病”患者。结论:奥曲肽致低血糖发生率常见,使用时应密切监测患者血糖水平;专项软件系统中药源性低血糖模块能够较为准确的反映临床用药人群发生ADR的真实情况,为药品安全风险防控提供参考和帮助。
奥曲肽;低血糖;药品不良反应;自动监测
借助“医疗机构ADE主动监测与智能评估警示系统”(简称“系统”)的研发和使用[1],临床药品不良反应/事件(ADR/ADE)的评估与预警方面取得了一系列成效[2-7]。随着对药源性损害研究的不断深入,系统的监测模块配置也在不断增加。有文献报道因ADR入院的患者中,20%与低血糖相关[8],因此我们在基于触发器原理量化指标异常的研发基础上,开发了“药源性低血糖”模块。本研究拟通过醋酸奥曲肽致低血糖的自动监测研究,验证该模块的功能,同时对目标药物进行评估,了解其真实发生情况,为临床药品安全防控提供参考。
1 资料与方法
1.1研究方法
利用“医疗机构ADE主动监测与智能评估警示系统”,提取2016年1月1日- 2016年6月30日于我院使用醋酸奥曲肽注射液(诺华-CH公司,规格: 0.1 mg·mL-1)且临床资料及用药医嘱完整、真实、准确的住院患者病历,进行药源性低血糖事件的回顾性自动监测。系统筛选的报警病例由药师逐一甄别,按照我国《药品不良反应报告和监测管理办法》中五项判定标准进行关联性评价,确定ADR阳性病例。
数据处理采用SPSS 17.0统计学软件,对各组间数据进行χ2检验,检验水准α = 0.05。计量资料以表示。
1.2参数设置
1.2.1报警规则 根据中国2型糖尿病防治指南(2013年版)规定,低血糖的判定指标为:糖尿病患者血糖水平≤3.9 mmol·L-1,非糖尿病患者血糖水平<2.8 mmol·L-1。因此药源性低血糖模块的报警规则分为糖尿病和非糖尿病患者两项,区分标准为患者医嘱中的诊断。
本次自动监测研究共分三组:A组两种标准同时测试,B组只监测糖尿病患者,C组只监测非糖尿病患者。通过对三次监测结果的比较,测试并验证模块报警触发功能的稳定性。
1.2.2排除因素 1)指标缺失:用药前无血糖值;2)基值异常:用药前已出现低血糖;3)排除诊断:胰岛细胞瘤。
1.2.3参数设置 根据醋酸奥曲肽注射液药代药动学特点,经过多次预实验摸索,最终得到以下触发器参数,详见表1。
1.2.4其他规则 怀疑药品包括所有胰岛素类;解救药品为50%葡萄糖注射液。人工甄别时遵循1 U胰岛素中和4 ~ 6 g葡萄糖,判断怀疑药品对目标药品的干扰。
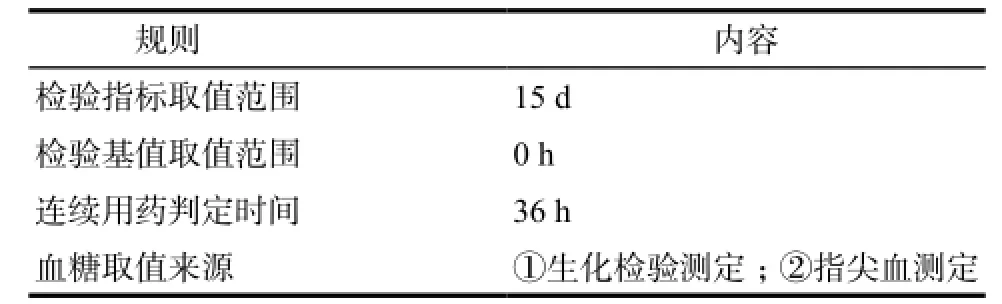
表1 醋酸奥曲肽致药源性低血糖触发器参数设置Tab 1 Parameters of octreotide-induced hypoglycemia trigger
本研究将正常病例(未发生低血糖的病例)加上报警中的假阳性病例(人工甄别后判定为非药源性低血糖的病例)定义为非阳性病例,作为对照组与阳性病例区分。
2 结果
2.1自动监测分组情况
A组耗时约5 min,共监测病例836例、950例次,排除171例、182例次,其中因无用药前血糖排除181例次,因诊断为“胰岛细胞瘤”排除1例次;正常642例、742例次,报警23例、26例次,经甄别后判定为阳性12例、12例次。
B组和C组监测病例情况与A组基本一致,耗时约5 min,共监测836例、950例次,排除171例、182例次。不同之处在于B组结果中,报警0例次,正常768例次,C组报警26例次,阳性12例次,与A组结果一致,发生26例次低血糖的患者均为非糖尿病患者,详见表2。
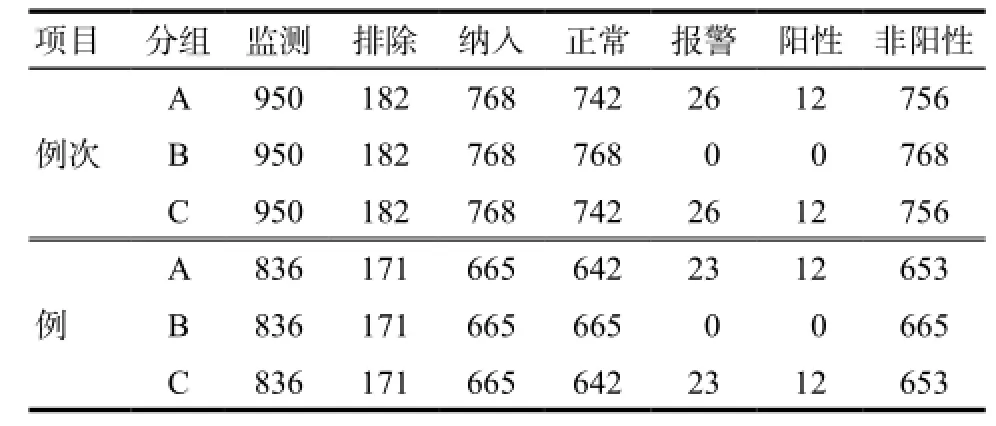
表2 奥曲肽致低血糖的自动监测结果Tab 2 Automatic monitoring results of octreotide-induced hypoglycemia
2.2年龄与性别分布
12例阳性病例中,男性7例,女性5例;756例非阳性病例中,男性495例,女性261例;阳性病例最小年龄为17岁,最大为88岁,平均年龄为(44.33±23.57)岁,而非阳性病例中最小年龄为7岁,最大为93岁,平均年龄为(57.70±15.01)岁。患者性别与年龄无统计学差异(P > 0.05)。
2.3原患疾病的影响
按患者诊断中是否有胰腺相关疾病,对纳入的768例患者进行再分组,分为“罹患胰腺相关疾病的阳性病例”、“罹患胰腺相关疾病的非阳性病例”、“无胰腺相关疾病的阳性病例”和“无胰腺相关疾病的非阳性病例”,检验结果P值为0.023,有统计学差异,详见表3。

表3 胰腺相关疾病对发生ADR的影响情况Tab 3 Disease of pancreas effect on ADR
2.4ADR发生时间
醋酸奥曲肽注射液致低血糖的病例中,发生时间最短为用药后2 h,最长为15 d,详见表4。

表4 ADR发生时间分布情况Tab 4 Distribution of ADR occurrence time
3 讨论
3.1药源性低血糖模块监测的可行性
药源性低血糖自动监测模块以“医疗机构ADE主动监测与智能评估警示系统”中已有的成熟量化指标监测模块为蓝本,将患者血糖波动情况与药品使用时间相关联,实现了对目标药品的自动监测筛选报警。三组实验前后监测和排除了相同的例数/例次,体现了模块对病历筛选和提取有着较高的稳定性;自动监测耗时短,相比人工主动监测而言,大大节省了药师审查病历的时间和人力。
3.2醋酸奥曲肽注射液致药源性低血糖的发生率
奥曲肽是人工合成的八肽环状化合物,有诸多的生理活性[9],能够对几乎所有已知的内、外分泌功能进行抑制,导致诸如胰高血糖素、胰岛素、降钙素、生长素、肾素、促甲状腺激素以及促肾上腺皮质激素等一些激素的分泌平衡出现失调[10],国内文献中有奥曲肽导致低血糖的病例报道[11-12],但未见发生率的报道。本次研究得到醋酸奥曲肽注射液导致药源性低血糖的发生率在1.26% ~ 1.56%之间,与说明书中其低血糖的发生率1% ~ 10%(常见)相符。通过查阅正常病例的病程记录及医嘱,多数病例在血糖还未达到低血糖标准时就已经对症处理,这与临床医护人员经验丰富、具备高预警性并及时干预有关。
3.3醋酸奥曲肽注射液致药源性低血糖的风险因素
本研究结果显示,“罹患胰腺相关疾病”的患者是用药后出现ADR的高风险人群,并且发生药源性低血糖的病例中没有糖尿病患者,这可能与糖尿病患者较其他患者血糖水平监测更加密切,在血糖出现下降趋势时已经及时纠正有关,而患者的年龄、性别差异均无统计学意义。阳性病例ADR发生时间主要集中在用药后2 ~ 7 d,与文献报道ADR发生在24 h以内更为迟滞[11-12];可能是因为低血糖有具体临床表现、短时间内发生易被及时关联发现;而超过24 h后的ADR因病情、联合用药等因素不易被关联。因此,在使用醋酸奥曲肽注射液的全过程中,医护人员应注意监测患者的血糖水平,对于罹患胰腺相关疾病等高风险人群需做用药教育;当患者出现头晕乏力或血糖异常波动时,及早对症处理,避免造成更大损害。
综上,依托专项研发软件开展药源性低血糖的自动监测,能够快捷、高效、详实的获取真实世界中醋酸奥曲肽注射液致药源性低血糖的发生率及相关影响因素,进而明确用药风险警示点,为临床用药安全防范提供参考和帮助。
[1] 陈超,郭代红,薛万国,等.住院患者药品不良事件主动监测与评估警示系统的研发[J].中国药物警戒,2013,10(7):411-414,418.
[2] 陈超,郭代红,王东晓,等.利奈唑胺相关性血小板减少的主动监测研究[J].中国药物应用与监测,2014,11(1):22-25.
[3] 朱曼,陈超,郭代红.万古霉素相关肾毒性的主动监测研究[J].中国药物应用与监测,2014,11(1):26-29.
[4] 王伟兰,陈超,郭代红.吉西他滨相关性贫血的主动监测研究[J].中国药物应用与监测,2014,11(1):29-30,59.
[5] 裴斐,陈超,郭代红.阿托伐他汀致转氨酶异常升高的主动监测研究[J].中国药物应用与监测,2014,11(1):31-33.
[6] 王啸宇,郭代红,徐元杰.基于文本分类技术的住院患者药源性变态反应自动监测模块研究[J].中国药物应用与监测,2016,13(2):117-120.
[7] 赵粟裕,郭代红,徐元杰,等.头孢哌酮/舒巴坦致血小板减少的主动监测系统应用与评价[J].药物流行病学杂志,2016,25(1):17-20.
[8] Ben Salem C, Fathallah N, Hmouda H, et al. Drug-induced hypoglycemia: an update[J]. Drug Saf, 2011, 34(1): 22-45.
[9] 付蔷,李光学.奥曲肽所致不良反应的一般规律及特点回顾性分析[J].中国医药指南,2012,10(35):273-274.
[10] 刘志峰,李萍,刘坷.奥曲肽的研究和应用进展[J].青岛大学医学院学报,2011,37(2):165-167.
[11] 赵家瑞,刘燕燕.皮下注射善得定致低血糖反应2例[J].包头医学院学报,2009,20(1):10,14.
[12] 施淑静,李梦杰,张旭.万苏林、奥曲肽合用导致低血糖反应1例[J].中医临床研究,2010,2(23):94.
Application and evaluation of the new automatic monitoring module and octreotide-induced hypoglycemia
ZHAO Su-yu, TANG Zhi-hui, GUO Dai-hong, ZHAO Liang, ZHU Man, MA Liang, ZHAO Peng-zhi(Department of Pharmaceutical Care, PLA General Hospital, Beijing 100853, China)
Objective: To investigate the hypoglycemia induced by octreotide acetate injection, evaluate the performance of hypoglycemia module. Methods: The retrospective analysis was used to do automatic monitoring on inpatients using of octreotide acetate injection from January to June in 2016 detected by the intelligence assessment warning system for ADE. We manual screened the cases which selected by system, and analyzed the monitoring data. Results: A total of 950 cases using octreotide acetate injection were automatically monitored. There were 26 cases of automatic alarm, in which 12 cases were positive by artificial evaluation. The incidence rate of adverse drug reactions was between 1.26% - 1.56%, which was in conformity with the specification. People with pancreatic disease had the risk factors for hypoglycemia. Conclusion: Hypoglycemia induced by octreotide is common, and patient's blood glucose levels should be monitored closely; hypoglycemia module can accurately reflect the real situation of ADR in clinical and make sure of drug safety.
Octreotide; Hypoglycemia; Adverse drug reaction; Automatic monitoring
R969.4
A
1672 - 8157(2016)05 - 0309 - 03
(2016-07-05
2016-07-29)

