3种相思16年生优树外植体芽诱导研究
王 鸿 黄烈健 胡 峰
(中国林业科学研究院热带林业研究所,广州 510520)
3种相思16年生优树外植体芽诱导研究
王 鸿 黄烈健*胡 峰
(中国林业科学研究院热带林业研究所,广州 510520)
以16年生马占相思、大叶相思和马大杂种相思优树为材料,研究外植体消毒、部位、收集的季节、类型、以及6-BA、蔗糖、培养基类型对芽诱导的影响,以建立3种相思成年优树高效芽诱导体系。结果表明:3种相思的出芽率受消毒剂的影响较大,马占相思对消毒剂处理最敏感(升汞9 min和酒精15 s为最佳),大叶相思和马大杂种相思较耐受消毒剂的处理(分别以升汞和酒精处理18 min,15 s和15 min,30 s为最佳)。3个树种均以第3~5个腋芽茎段为最佳外植体部位,以类型2(母株枝条先通过扦插繁殖来建立采穗圃,通过选取采穗圃中的枝条),8月采集的外植体为最佳,分别接种于最适培养基:改良MS+6-BA 0.5 mg·L-1+蔗糖30 g·L-1(马占相思),MS+6-BA 1.0 mg·L-1+蔗糖40 g·L-1(大叶相思),MS+蔗糖20 g·L-1(马大杂种相思),进行芽诱导时,最高诱导率分别为93.33%(马占相思),92.00%(大叶相思),97.33%(马大杂种相思)。
马占相思;大叶相思;马大杂种相思;外植体;芽诱导
含羞草科(Mimosaceae)金合欢属(AcaciaMill.)树种,通常又称为相思(Acacia)树种。我国自从引进相思类树种以来,经过大量的种植研究,筛选出了许多优良的树种、种源以及家系,并在生产中推广种植,表现出了良好的经济效益和生态效益。其中的马占相思(A.mangium)和大叶相思(A.auriculiformis)已在我国华南地区得到较大规模的种植发展;马大杂种相思(A.mangium×A.auriculiformis)由于具有其双亲(马占相思的速生、大叶相思的抗风性较好等)的优良特性,近年来在生产中也逐渐得到重视。但由于受相关技术研究落后的影响,目前生产中主要采用的是相思实生苗。而实生苗因具有遗传分化的特点,使得相思人工林的生长整齐度较差,经济效益受到一定程度的影响,从而影响了相思的大面积推广。
扦插技术和组培技术,在林木优质苗木生产中具有较为广泛的应用。采用扦插技术来生产大量优质苗木,首先需要较大面积的土地种植采穗圃,以提供用于扦插的穂条;但目前的土地资源十分宝贵,从而提高了苗木的生产成本;并且扦插技术容易受季节的影响,难以实现周年生产苗木;这些都使得扦插技术的应用受到限制。而组培技术,一旦建立,将可以解决扦插技术的这些难题,从而具有更好的推广应用价值。因此,建立高效的苗木快繁技术体系,为促进相思类树种的无性系化发展以及为满足生产需求提供大量的优质苗木等具有重要的意义。
关于相思组培技术的研究有较多报道,但绝大部分对外植体是否来源于优树缺乏重视。通过对成年优树的选择,进而建立其相应的高效组培技术体系,对加速相思良种选育进程及促进良种的广泛推广具有重要作用。
以成年优树进行组培,通常难度较大,主要体现在芽诱导较为困难,不同无性系的差异较大,极大地限制了相关组培技术体系的建立。黄骐[1]对4年生卷荚相思(A.cincinnata)优树的组培技术体系进行研究,获得了较高的增殖率(5.33左右)及生根率(86.00%),但芽诱导仍不理想。占爱瑶等[2]对5年生不同白桦(Betulaplapythylla)优树组培技术体系的研究表明,不同优树腋芽启动率差异较大(最高为75.0%,最低为24.40%)。李芳东等[3]对10年生百花泡桐(Paulowniafortuneii)的研究表明,受成熟效应的影响,许多优树很难获得成功,但先进行嫁接幼化后能成功建立其组培快繁体系。黄烈健等[4]通过研究,成功建立了3~5年生马占相思和马大杂种相思的组培技术体系,同时也指出:开展多年生优树的组培,芽诱导较为困难。
本研究通过对升汞和酒精消毒时间、外植体部位、外植体采集季节、外植体来源以及6-BA、蔗糖、培养基类型等对外植体芽诱导的影响开展系统研究,成功建立了马占相思、大叶相思、马大杂种相思16年生优树外植体的芽诱导体系,并对其进行了讨论,为进一步建立相应的高效组培技术体系奠定重要基础,同时也为相思类其它树种的组培技术体系的研究提供重要参考。
1 材料与方法
1.1 材料
通过比较树高、胸径、冠幅等因子,从中国林业科学研究院热带林业研究所马占相思、大叶相思、马大杂种相思16年生试验林中选取优良单株,以当年新生的腋芽饱满的枝条为研究材料。
1.2 试验方法
1.2.1 升汞和酒精消毒时间对外植体的影响
剪取马占相思、大叶相思、马大杂种相思优良单株的当年生腋芽饱满枝条,将采集的枝条剪去叶片,洗衣粉水浸泡30 min,刷净后流水冲洗2 h,剪成长1.0~2.0 cm带腋芽的茎段,均用0.1%的升汞和75%的酒精处理不同的时间,具体设置见表1。消毒后用无菌水冲洗4~6次,每种相思共9个处理。
表13种相思的升汞和酒精消毒时间
Table1MercuricchlorideandethylalcoholsterilizingtimeofthreeAcaciaspecies
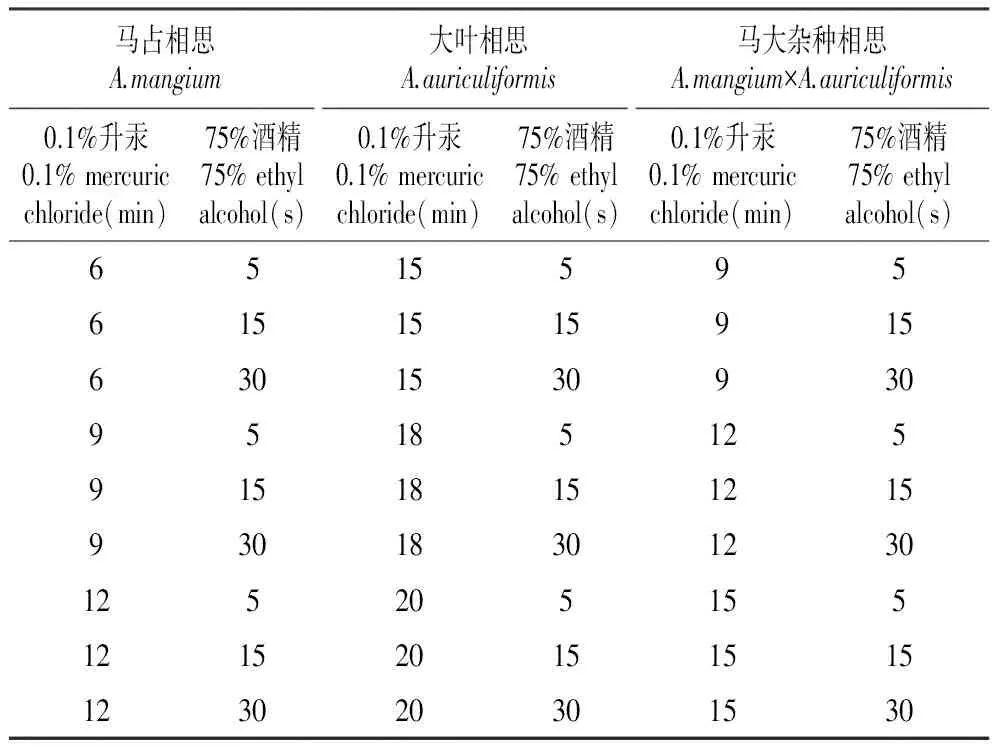
马占相思A.mangium大叶相思A.auriculiformis马大杂种相思A.mangium×A.auriculiformis0.1%升汞0.1%mercuricchloride(min)75%酒精75%ethylalcohol(s)0.1%升汞0.1%mercuricchloride(min)75%酒精75%ethylalcohol(s)0.1%升汞0.1%mercuricchloride(min)75%酒精75%ethylalcohol(s)651559561515159156301530930951851259151815121593018301230125205155121520151515123020301530
1.2.2 外植体部位对芽诱导的影响
分别将3种相思当年生腋芽饱满枝条材料的第1~2腋芽茎段(上段)、第3~5腋芽茎段(中段)、第7~8腋芽茎段(下段)剪成长1.0~2.0 cm带腋芽茎段,用1.2.1筛选出的最佳消毒处理,每种相思共3个处理。
1.2.3 外植体采集季节对芽诱导的影响
分别于2、5、8和11月采集3种相思当年生腋芽饱满枝条,参考1.2.1筛选出的最佳消毒处理以及1.2.2筛选出的最佳材料部位,每种相思共4个处理。
1.2.4 外植体类型对芽诱导的影响
类型1:3种相思16年生优良单株的当年生腋芽饱满枝条。
类型2:从3种相思16年生优良单株上采集枝条,先通过扦插繁殖,建立采穗圃,从一年生的采穗圃中采集腋芽饱满的枝条。采用上述试验筛选出的最佳消毒时间、材料部位以及采条时间,每种相思共2个处理。
1.2.5 6-BA、蔗糖、培养基类型对芽诱导的影响
将消毒后的3种相思外植体接种至芽诱导培养基中,考虑6-BA、蔗糖、培养基类型对3种相思芽诱导的影响,设置L9(33)的正交研究,各因素水平见表2,每种相思共9组处理,每个处理接种50个无菌茎段,重复3次,30 d后统计出芽率。
其中,改良MS培养基的配方为:以MS培养基为基础,大量元素减半,其余相同。
表23种相思芽诱导的6-BA、蔗糖、培养基类型水平
Table2Levelof6-BA,sucrose,basalmediumforbudinducingofthreeAcaciaspecies
1.2.6 培养条件
以上试验除特殊说明外,消毒后的外植体均接种至MS上进行芽诱导,每个处理接种50瓶,每瓶接种1个茎段,重复3次,15 d后统计污染率、褐化率、存活率、出芽率。培养基中均添加琼脂7 g·L-1,蔗糖30 g·L-1,控制pH值为5.5~6.5,在121℃高压灭菌15 min,培养温度为25℃±2℃,每日光照12 h,光照强度2 500 Lx。
1.2.7 数据处理
使用Excel,SPSS18.0对数据进行处理和方差分析,以最小显著差数法(LSD)评价差异的显著性。
污染率%=污染数÷接种数×100%
(1)
褐化率%=褐化数÷接种数×100%
(2)
存活率%=存活数÷接种数×100%
(3)
出芽率%=出芽数÷存活数×100%
(4)
其中,(1)+(2)+(3)=100%。
2 结果与分析
2.1升汞和酒精消毒时间对3种相思外植体的影响
本研究选择浓度为0.1%的升汞和75%的酒精对3种相思外植体进行消毒,结果见表3。3种相思的污染率随着升汞和酒精的处理时间增加呈下降趋势,而褐化率则随消毒剂的处理时间增加而增加;3种相思的出芽率受消毒剂的影响较大,消毒剂处理时间延长,外植体的出芽率有所下降。经方差分析表明:消毒时间对3种相思的污染率、褐化率、存活率、出芽率的影响均达到显著水平,其中马占相思受消毒剂的影响最为敏感,以升汞和酒精处理9 min和15 s效果为最佳,出芽率为78.00%;大叶相思耐受消毒剂的刺激,以升汞和酒精处理18 min和15 s效果为最佳,出芽率为79.33%;马大杂种相思以升汞和酒精处理15 min和30 s效果为最佳,出芽率为87.50%。
2.2 外植体部位对3种相思芽诱导的影响
不同外植体部位对3种相思的污染率、褐化率、存活率的影响趋势表现均一致(表4)。
第1~2个腋芽茎段(上段)作为外植体时,马占相思、大叶相思的污染率分别为15.33%、15.33%,均低于其它2个部位,而马大杂种相思(8.33%)则比中段(6.67%)略高;而褐化率,3种相思均表现为比其它2个部位高,且达到了显著差异水平,分别为19.33%、26.00%、18.33%;但出芽率均最高,分别为79.33%、86.67%、97.69%。
外植体选择枝条基部的第5~7个腋芽茎段(下段)时,与其它2个部位比较,3种相思均表现为:污染率最高,褐化率和出芽率最低。
表3不同升汞和酒精消毒时间对3种相思外植体的影响
Table3EffectsofmercuricchlorideandethylalcoholwithdifferentsterilizingtimeontheexplantsofthreeAcaciaspecies
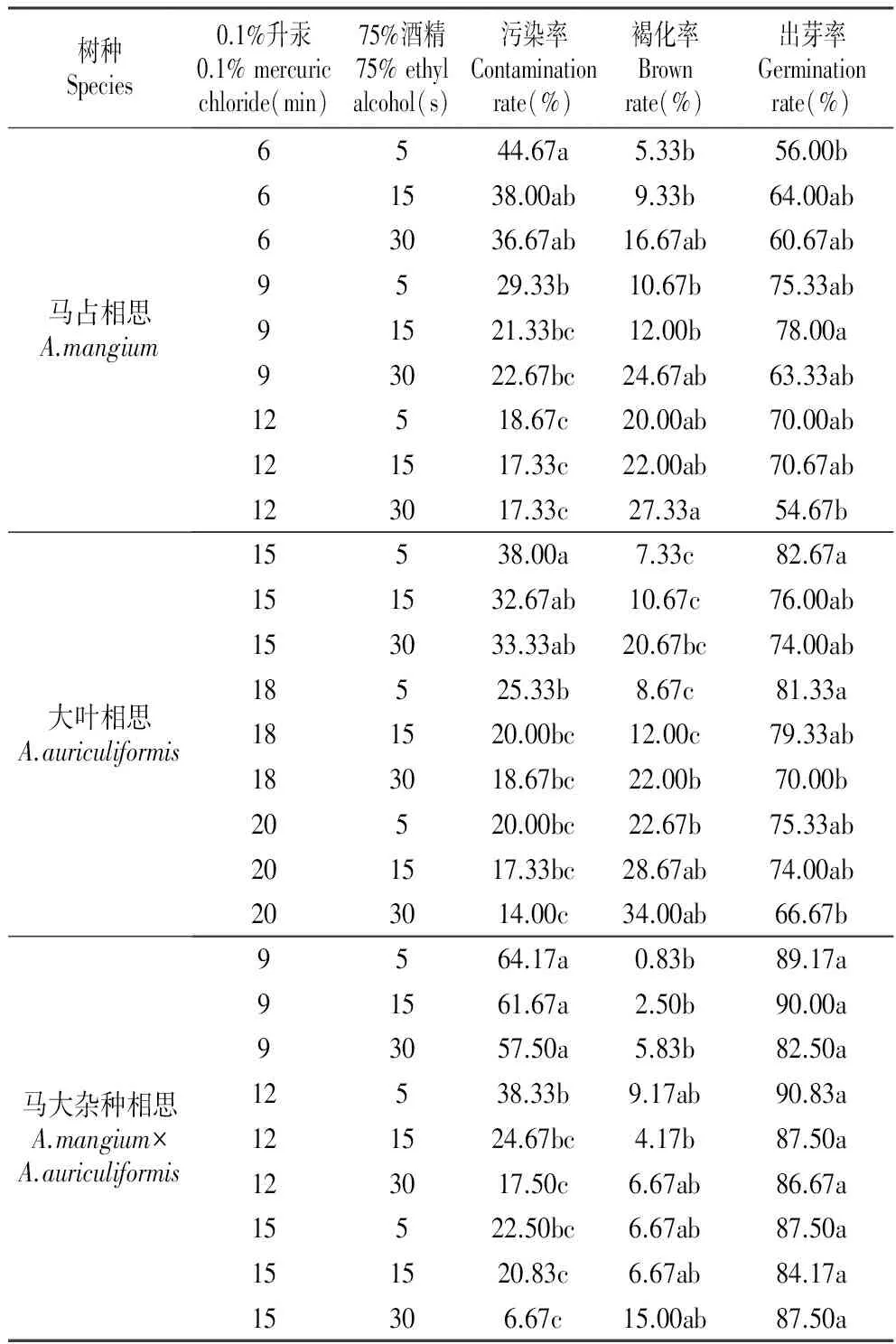
树种Species0.1%升汞0.1%mercuricchloride(min)75%酒精75%ethylalcohol(s)污染率Contaminationrate(%)褐化率Brownrate(%)出芽率Germinationrate(%)马占相思A.mangium6544.67a5.33b56.00b61538.00ab9.33b64.00ab63036.67ab16.67ab60.67ab9529.33b10.67b75.33ab91521.33bc12.00b78.00a93022.67bc24.67ab63.33ab12518.67c20.00ab70.00ab121517.33c22.00ab70.67ab123017.33c27.33a54.67b大叶相思A.auriculiformis15538.00a7.33c82.67a151532.67ab10.67c76.00ab153033.33ab20.67bc74.00ab18525.33b8.67c81.33a181520.00bc12.00c79.33ab183018.67bc22.00b70.00b20520.00bc22.67b75.33ab201517.33bc28.67ab74.00ab203014.00c34.00ab66.67b马大杂种相思A.mangium×A.auriculiformis9564.17a0.83b89.17a91561.67a2.50b90.00a93057.50a5.83b82.50a12538.33b9.17ab90.83a121524.67bc4.17b87.50a123017.50c6.67ab86.67a15522.50bc6.67ab87.50a151520.83c6.67ab84.17a15306.67c15.00ab87.50a
注:同一列中不同小写字母代表显著差异(P<0.05),下同。
Note:Different lowercase letter in same column stands for significant difference(P<0.05),the same to follows.
表4外植体部位对3种相思芽诱导的影响
Table4EffectsofmaterialpositiononthebudinducingofthreeAcaciaspecies
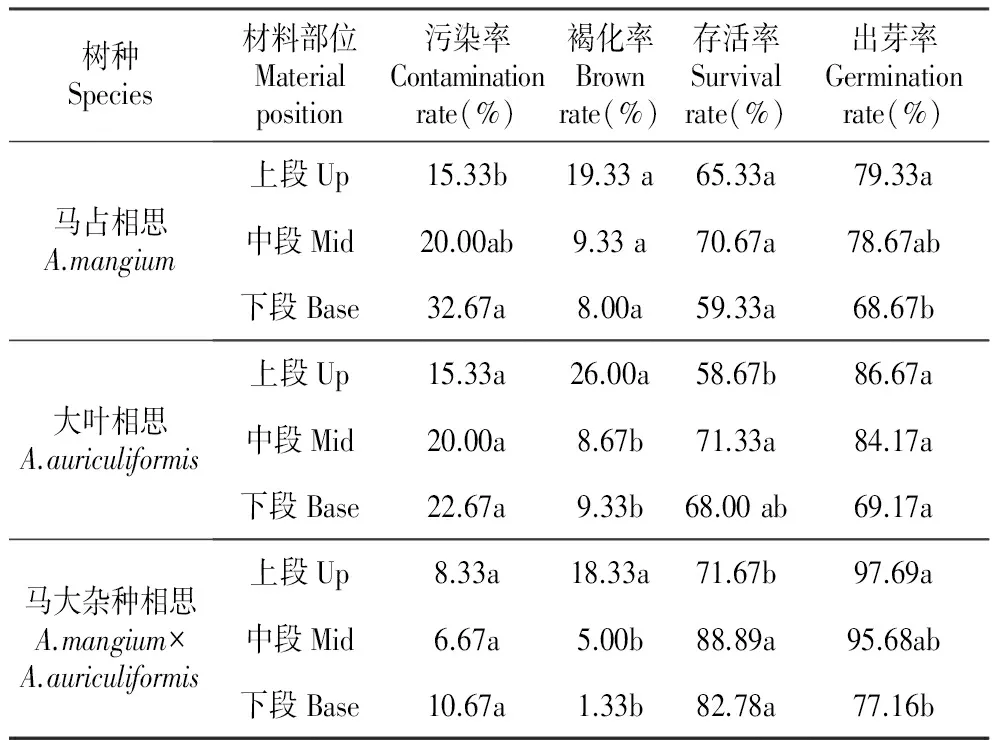
树种Species材料部位Materialposition污染率Contaminationrate(%)褐化率Brownrate(%)存活率Survivalrate(%)出芽率Germinationrate(%)马占相思A.mangium上段Up15.33b19.33a65.33a79.33a中段Mid20.00ab9.33a70.67a78.67ab下段Base32.67a8.00a59.33a68.67b大叶相思A.auriculiformis上段Up15.33a26.00a58.67b86.67a中段Mid20.00a8.67b71.33a84.17a下段Base22.67a9.33b68.00ab69.17a马大杂种相思A.mangium×A.auriculiformis上段Up8.33a18.33a71.67b97.69a中段Mid6.67a5.00b88.89a95.68ab下段Base10.67a1.33b82.78a77.16b
外植体选用枝条中部半木质化的茎段(即第3~5个腋芽茎段)时,3种相思的存活率均最高,分别为70.67%、71.33%、88.89%,而出芽率与第1~2个茎段的未达到显著水平,分别为78.67%、84.17%、95.68%。
综上所述,最佳外植体应当选择枝条的第3~5个腋芽茎段(中段)。
2.3 外植体采集季节对3种相思芽诱导的影响
由表5可知,3种相思在不同季节采集的外植体,污染率分别具有不同程度的差异。
表5外植体采集季节对3种相思芽诱导的影响
Table5EffectsofexplantsgatheredindifferentseasononbudinducingofthreeAcaciaspecies

树种Species采集季节Seasons污染率Contaminationrate(%)褐化率Brownrate(%)存活率Survivalrate(%)出芽率Germinationrate(%)马占相思A.mangium2月February28.67a16.67a54.67a80.67a5月May20.00ab13.33a66.67a78.67a8月August10.67b12.67a76.67a82.00a11月November24.00a15.33a60.67b68.00a大叶相思A.auriculiformis2月February25.33a16.00a58.67a88.33a5月May10.67b12.00a77.33a84.17a8月August6.67b10.00a83.33a87.50a11月November10.67b12.67a76.67b85.83a马大杂种相思A.mangium×A.auriculiformis2月February26.67a13.33a60.00b92.67a5月August9.33b7.33ab83.33a89.33a8月August5.33b4.00b90.67a90.67a11月November19.33a14.00a66.67b81.33b
8月份采集的外植体,污染率均较其他月份采集的低,分别为10.67%、6.67%、5.33%;褐化率则与其他月份采集的差异不大;出芽率则均较高,分别为82.00%、87.50%、90.67%。
2月气温开始回升,天气转暖,是植物开始萌动生长的时间,3种相思的出芽率虽然均较高,但污染率却最严重,分别为28.67%、25.33%、26.67%。
11月气温较低,干旱少雨,3种相思的出芽率均较低,而污染率均较高,分别为24.00%、10.67%、19.33%。5月采集的外植体,3种相思的污染率也较高。
因此,综合考虑,8月份是进行外植体采集的最佳时间。
2.4 外植体类型对3种相思芽诱导的影响
从表6中可以看出,3种相思直接以母株枝条(类型1)为外植体时,污染率均高于来自采穗圃中的枝条(类型2),分别高出6.67%、4.67%、10.00%;类型1的褐化率均高于类型2,存活率和出芽率均低于类型2。
表6外植体类型对3种相思芽诱导的影响
Table6EffectsofexplantstypeonthebudinducingofthreeAcaciaspecies
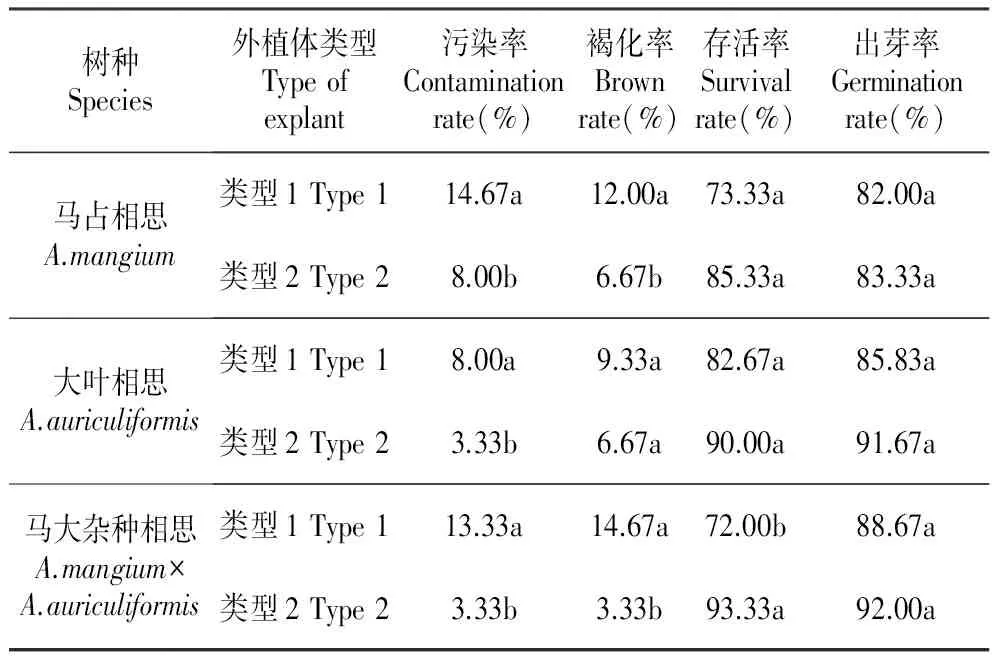
树种Species外植体类型Typeofexplant污染率Contaminationrate(%)褐化率Brownrate(%)存活率Survivalrate(%)出芽率Germinationrate(%)马占相思A.mangium类型1Type114.67a12.00a73.33a82.00a类型2Type28.00b6.67b85.33a83.33a大叶相思A.auriculiformis类型1Type18.00a9.33a82.67a85.83a类型2Type23.33b6.67a90.00a91.67a马大杂种相思A.mangium×A.auriculiformis类型1Type113.33a14.67a72.00b88.67a类型2Type23.33b3.33b93.33a92.00a
因此,母株枝条先通过扦插繁殖来建立采穗圃,通过选取采穗圃中的枝条(类型2)进行芽诱导时,污染率和褐化率显著降低,且出芽率有所提高。
2.56-BA、蔗糖、培养基类型对3种相思芽诱导的影响
3种相思的无菌茎段接入芽诱导培养基中,10 d后开始出现腋芽萌发现象,30 d左右,腋芽生长至2~3 cm。
由表7~8可知,6-BA对马占相思出芽率的影响达到了极显著差异水平,基本培养基类型对出芽率的影响达到了显著差异水平,而蔗糖浓度对其影响不大。通过对6-BA、培养基类型和蔗糖浓度进行多重比较(表9)发现,6-BA浓度选择0.5 mg·L-1时,马占相思的出芽率极显著高于其他两组。观察发现:不添加6-BA的培养基诱导的马占相思腋芽生长速度慢,且出芽率较低,但腋芽生长正常,叶片舒展,茎段粗壮;当添加0.5 mg·L-1的6-BA时,腋芽生长速度加快,芽的长势较为旺盛;6-BA的浓度增加至1.0 mg·L-1时,腋芽丛生生长较弱小,出现玻璃化现象。培养基类型以改良MS为最佳,芽诱导率可达84.67%,显著高于MS和1/2MS。蔗糖浓度为30 g·L-1时,芽诱导率最高为93.33%。
因此,马占相思以改良MS+6-BA 0.5 mg·L-1+蔗糖30 g·L-1为最佳芽诱导培养基,出芽率为93.33%。

表7 6-BA、蔗糖、培养基类型对3种相思芽诱导的影响
表8马占、大叶、杂种相思芽诱导方差分析
Table8VarianceanalysisofbudinducingofA.mangium,A.auriculiformisandA.maugium×A.auriculiformis
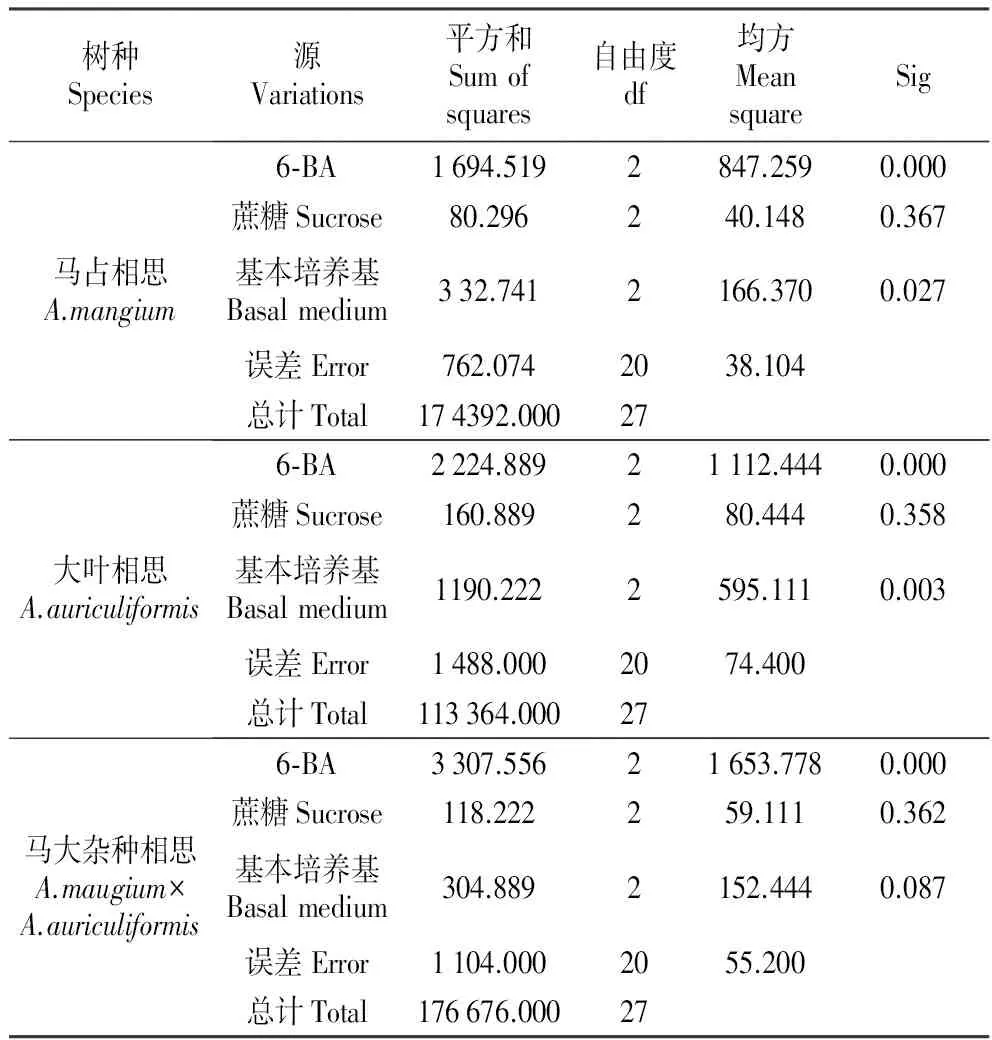
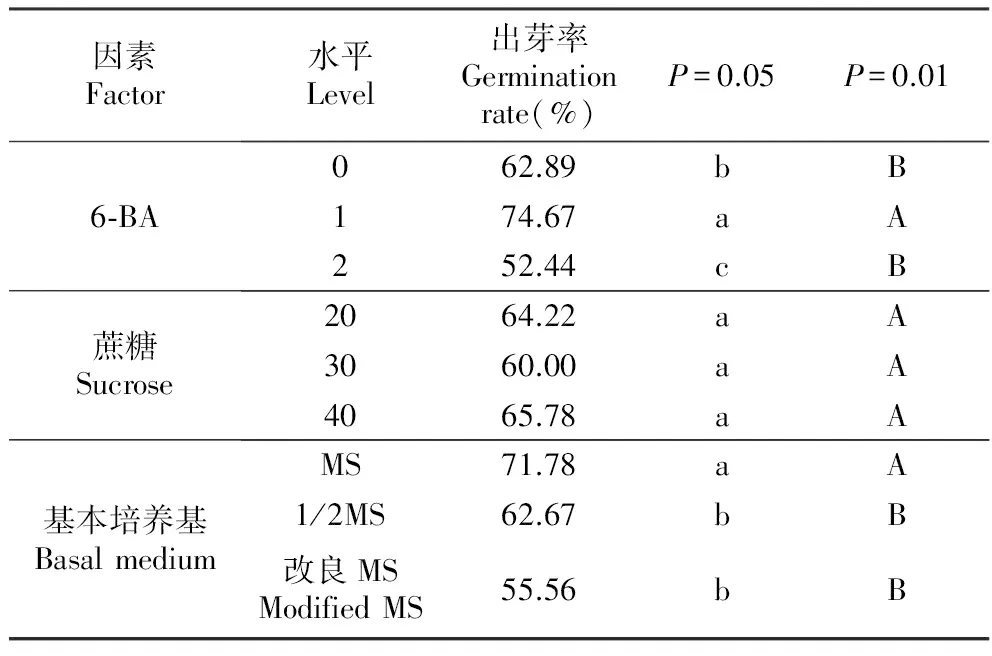
树种Species源Variations平方和Sumofsquares自由度df均方MeansquareSig马占相思A.mangium6⁃BA1694.5192847.2590.000蔗糖Sucrose80.296240.1480.367基本培养基Basalmedium332.7412166.3700.027误差Error762.0742038.104总计Total174392.00027大叶相思A.auriculiformis6⁃BA2224.88921112.4440.000蔗糖Sucrose160.889280.4440.358基本培养基Basalmedium1190.2222595.1110.003误差Error1488.0002074.400总计Total113364.00027马大杂种相思A.maugium×A.auriculiformis6⁃BA3307.55621653.7780.000蔗糖Sucrose118.222259.1110.362基本培养基Basalmedium304.8892152.4440.087误差Error1104.0002055.200总计Total176676.00027
注:显著差异(0.01 Notes:Significant difference(0.01 表9马占相思芽诱导3个因素的多重比较 Table9MultiplecomparisonofbudinducingofA.mangium 因素Factor水平Level出芽率Germinationrate(%)P=0.05P=0.016⁃BA076.22bB0.590.67aA1.072.22bB蔗糖Sucrose2081.78aA3079.78aA4077.56aA基本培养基BasalmediumMS77.11bB1/2MS77.33bB改良MSModifiedMS84.67aA 表7可知,培养基中不添加6-BA时,大叶相思的腋芽生长同样表现出生长缓慢的现象,与马占相思不同的是,在芽诱导基中添加1.0 mg·L-1的6-BA时,大叶相思的腋芽才能生长迅速,但浓度过高时(2.0 mg·L-1),腋芽的生长同样会出现玻璃化现象;选择改良MS和1/2MS培养基时,腋芽均表现出生长弱小的现象,而以MS培养基诱导的芽较为健壮。由表8可知,6-BA和培养基类型对大叶相思出芽率的影响都达到了极显著差异水平,而蔗糖浓度对出芽率的影响不显著。多重比较结果(表10)显示,6-BA为1.0 mg·L-1时,平均出芽率最高,为74.67%,显著高于其他处理;MS的出芽率,极显著高于1/2MS和改良MS。 大叶相思最佳芽诱导基为MS+6-BA 1.0 mg·L-1+蔗糖40 g·L-1,出芽率为92.00%。 表10大叶相思芽诱导多重比较 Table10MultiplecomparisonofbudinducingofA.auriculiformis 因素Factor水平Level出芽率Germinationrate(%)P=0.05P=0.016⁃BA062.89bB174.67aA252.44cB蔗糖Sucrose2064.22aA3060.00aA4065.78aA基本培养基BasalmediumMS71.78aA1/2MS62.67bB改良MSModifiedMS55.56bB 而与马占相思和大叶相思不同,马大杂种相思只有在不添加6-BA的芽诱导基中,腋芽才能生长旺盛、生长速度快;当添加少量的6-BA时,外植体基部会出现愈伤组织的大量生长,叶片卷曲,茎干矮小。由表8和11可知,只有6-BA对马大杂种相思出芽率的影响达到了极显著差异,培养基类型和蔗糖对其影响无显著差异。因此,马大杂种相思芽诱导的最佳培养基为MS+蔗糖20 g·L-1,出芽率为97.33%。 表11马大杂种相思芽诱导多重比较 Table11MultiplecomparisonofbudinducingofA.mangium×A.auriculiformis 因素Factor水平Level出芽率Germinationrate(%)P=0.05P=0.016⁃BA092.222aA0.2581.778bB0.565.333cC蔗糖Sucrose2079.556aA3082.444aA4077.333aA基本培养基BasalmediumMS83.778aA1/2MS75.556aA改良MSModifiedMS80.000aA 林木组培研究的相关报道较多[1~9],关于相思类树种的组培研究报道也有不少[4,10~13],但这些研究大部分是以较为容易进行芽诱导的外植体为初始材料来开展的研究,这虽然对成功建立相应的组培技术体系有很大的帮助,但对于生长周期较长的林木植物来说,通常只有在树龄较小时期采集的外植体才比较容易进行芽诱导,而此时的外植体由于树龄较小,长成大树以后的具体表现具有不确定性,采用该组培技术体系所生产的大量苗木,其在生产中被淘汰的几率较大,造成时间、人力以及财力的极大浪费,这对于林木的良种选育是十分不利的。 开展以成年优树来源的外植体为材料的组培技术体系研究,在有效保持优树特性的同时,对加速林木的良种选育进程具有十分重要的作用和意义。而成年优树来源的外植体,受成熟效应的影响,其芽诱导及增殖通常十分困难。 本课题组开展了多种相思类树种的组培技术研究[4,11~13],发现外植体的选择对芽诱导具有重要的影响,也是组培技术体系研究中最关键的环节。如何确定适宜的外植体、消毒处理和芽诱导培养基,需要根据树种的不同、外植体来源的不同,进行相应条件的优化,不能简单的照搬前人的研究结果;而一旦获得无菌芽,后期的增殖及生根体系,相同的树种基本是一致的。 3.1 消毒剂及消毒时间对芽诱导的影响 酒精和升汞是组培中最常使用的消毒剂,根据需要,通常要两种消毒剂配合使用,处理时间过长,会对组织细胞产生毒害作用,使外植体出现褐化现象,或者直接杀死外植体,使腋芽不能萌发;处理时间过短,会导致微生物污染,无法继续下一步研究[14]。因此,把握两种消毒剂的消毒时间对外植体存活率、褐化率和出芽率有决定性的影响。 不同树种的消毒处理时间不同,受其外植体的形态结构影响而有所不同。黄碧兰等[15]发现牛大力(Millettiaspeciosa)茎段表面被有绒毛,灭菌比较困难。本研究中,马占相思升汞消毒时间为9 min,大叶相思为18 min,马大杂种相思为15 min。观察3种相思的外植体发现:马占相思的新生茎段粗大,木质疏松,容易被长时间的消毒剂处理而杀死;大叶相思木质紧实,耐受消毒剂的刺激;马大杂种相思则介于其中,消毒处理时间也居中。 因此,在把握消毒剂种类及消毒时间的同时,要注意观察外植体的形态结构,不同物种区别对待。 3.2 外植体部位对芽诱导的影响 外植体污染率、褐化率和芽诱导率受外植体的木质化程度影响较大。汪长水[16]对卷荚相思的组培研究结果表明:木质化程度越高,维管束发育越完全,以枝条底部作为外植体时的内生菌生长旺盛,因此污染率高;而新生顶芽未木质化,内生菌含量少,污染率低,但材质娇嫩,容易被消毒剂杀死;枝条中上部半木质化的茎段污染率低,且耐受消毒剂的影响,出芽率高。张玮等[17]对花吊丝竹(Dendrocalamusminor)的研究结果表明,春季采集的外植体枝条尚未完全木质化,因此在消毒过程中易受消毒剂的毒害,冬季采集的外植体枝条木质化程度高,消毒后因茎段切口处易分泌出引起培养基褐化的物质;其次枝条的顶芽幼嫩,消毒时间过长容易杀死外植体。荣世清等[18]对马占相思的研究结果表明:新长出的形态幼嫩枝条和树瘤处不定芽茎段的污染率和褐化率都很低,其原因在于两种外植体的木质化程度均较低。 本研究结果也表明:3种相思均是选用当年生腋芽饱满枝条的中上部带腋芽(第3~5腋芽)茎段为外植体,木质化程度较低,污染率较低,出芽率较高,为最适应外植体。 3.3 采条季节对芽诱导的影响 黄琪[1]对卷荚相思的研究结果表明,连续数日晴热干燥天气后采集的外植体污染率较低,而阴雨天采集的外植体污染率很高。还有研究表明,采条季节应当尽量避开花期。范子南等[19]指出植物处于开花时期时,体内贮存养份较少,受消毒剂的影响大,因而存活率较低。续九如等[20]指出植物在7、8月处于旺盛生长期,这时期营养生长旺盛,内源激素含量高,受外源激素影响较小,因此出芽率高。赵建萍等[21]认为,冬季不宜进行采条组培,因为此时植物体已近休眠状态,此时获取的外植体培养后出芽率低。 本研究的材料均采集于位于广东省江门市的马占相思、大叶相思、马大杂种相思研究林中,该地区属亚热带海洋性气候,年平均气温21.8℃,8月夏季高温少雨。本研究的结果表明,2月份采集的枝条污染率高,而8月份高温少雨,采集的外植体污染率低。 3.4 外植体来源对芽诱导的影响 采集优树的枝条进行组培快繁能够及时地保存优良性状,是一种直接、快速、有效的外植体来源。然而,野外生长的母株通常受自然环境影响较大,微生物生长旺盛,污染率高。其次,多年生的相思优树一般树高可达10 m以上,枝条采集困难,且能够用于组培快繁的枝条有限。本研究结果表明:将有限的枝条先通过生根剂浸泡进行扦插繁殖后,建立采穗圃,对采穗圃进行精细化管理,定时喷洒广谱型抗菌剂,选取当年生腋芽饱满的枝条作为外植体,污染率、褐化率均得到有效的控制,同时提升了外植体的出芽率。 3.5 3种相思外植体芽诱导的比较 马大杂种相思为马占相思和大叶相思的杂交种,不仅具有双亲的特点,而且所表现的杂种优势使其在生产中逐渐得到了重视。本研究中,我们发现:(1)马占相思0.1%升汞处理9 min,大叶相思0.1%升汞处理18 min,马大杂种相思0.1%升汞处理15 min,马大杂种相思对升汞的耐受力表现为介于双亲中间,具有杂种的居中特性;(2)马占相思出芽率78%,大叶相思出芽率79.33%,马大杂种相思出芽率87.5%,马大杂种相思的出芽率表现为超双亲优势;(3)马占相思以改良MS+6-BA 0.5 mg·L-1+蔗糖30 g·L-1为最佳芽诱导培养基,出芽率为93.33%;大叶相思芽诱导的最佳培养基为MS+6-BA 1.0 mg·L-1+蔗糖40 g·L-1,出芽率为92.00%;马大杂种相思芽诱导的最佳培养基为MS+蔗糖20 g·L-1,出芽率为97.33%;马大杂种相思对芽诱导培养基中蔗糖及6-BA的需求均低于双亲,出芽率则为超双亲优势。 这一现象提示我们:在今后开展其他树种的杂种组培研究时,可以参考其亲本的相关指标进行适当调整,这样可以节约研究的工作量。 (1)3种相思以16年生优树枝条为材料时,马占相思采用0.1%升汞和75%酒精消毒处理9 min和15 s,存活率和出芽率分别为66.67%、78.00%;大叶相思采用0.1%升汞和75%酒精消毒处理18 min和15 s,存活率和出芽率分别为68.00%、79.33%;马大杂种相思采用0.1%升汞和75%酒精消毒处理15 min和30 s,存活率和出芽率分别为78.33%、87.50%。 (2)3种相思选择在8月夏季高温天气进行采条,选用当年生腋芽饱满枝条的中上部半木质化的带腋芽茎段(第3~5腋芽茎段)为外植体,消毒后的存活率和出芽率均得到提高。 (3)优树枝条通过扦插生根并建立采穗圃,然后采集外植体进行芽诱导,外植体的污染率、褐化率均比直接以母株为研究材料时的低,且出芽率高。其中,马占相思的存活率和出芽率分别提高至85.33%、83.33%,大叶相思的存活率和出芽率分别提高至90.00%、91.67%,马大杂种相思的存活率和出芽率分别提高至93.33%、92.00%。 (4)经过6-BA浓度、蔗糖浓度、基本培养基类型的L9(33)正交研究,结果表明:马占相思以改良MS+6-BA 0.5 mg·L-1+蔗糖30 g·L-1为最佳芽诱导培养基,出芽率为93.33%;大叶相思芽诱导的最佳培养基为MS+6-BA 1.0 mg·L-1+蔗糖40 g·L-1,出芽率为92.00%;马大杂种相思芽诱导的最佳培养基为MS+蔗糖20 g·L-1,出芽率为97.33%。 致谢感谢江门市新会区国家重点相思良种基地提供的试验条件,感谢广东省江门市新会区林业科学研究所的黄宏健同志在研究过程中给予的帮助。 1.黄骐.卷荚相思优树无性系快速繁殖技术[J].林业科技开发,2007,21(5):66-68. Huang Qi.Techniques of micropropagation of elite clone ofAcaciacincinnata[J].China Forestry Science and Technology,2007,21(5):66-68. 2.占爱瑶,由香玲,詹亚光.不同白桦优树组培快繁体系的筛选[J].东北林业大学学报,2009,37(11):17-20,23. Zhan Aiyao,You Xiangling,Zhan Yaguang.Selection of superior BirchTreesbyinvitro culture technique[J].Journal of Northeast Forestry University,2009,37(11):17-20,23. 3.李芳东,邓建军,张悦,等.白花泡桐优树组织培养幼化技术研究[J].中南林业科技大学学报,2010,30(8):22-28. Li Fangdong,Deng Jianjun,Zhang Yue,et al.Study on tissue culture rejuvenation technology of thePaulowniafortuneisuperior trees[J].Journal of Central South University of Forestry & Technology,2010,30(8):22-28. 4.黄烈健,陈祖旭,张赛群,等.马占相思优树组培快繁技术研究[J].林业科学研究,2012,25(2):227-230. Huang Liejian,Chen Zuxu,Zhang Saiqun,et al.Tissue culture technique ofAcaciamangiumelite trees[J].Forest Research,2012,25(2):227-230. 5.欧阳乐军,沙月娥,黄真池,等.广州一号桉树高效组培再生体系的建立[J].东北林业大学学报,2012,40(7):14-17,44. Ouyang Lejun,Sha Yuee,Huang Zhenchi,et al.Establishment of tissue culture regeneration system ofEucalyptusGuangzhou No.1[J].Journal of Northeast Forestry University,2012,40(7):14-17,44. 6.程云清,刘剑锋,王占武,等.鞍杂杨组培快繁技术[J].东北林业大学学报,2011,39(2):11-12,20. Cheng Yunqing,Liu Jianfeng,Wang Zhanwu,et al.Tissue culture and rapid propagation method forPopulus×xiaozuanicacv.Anza[J].Journal of Northeast Forestry University,2011,39(2):11 -12,20. 7.梁立东,杨玲,沈海龙.新西伯利亚银白杨组培不定芽生根质量的影响因子[J].东北林业大学学报,2010,38(1):20-23. Liang Lidong,Yang Ling,Shen Hailong.Influencing factors on rooting quality of tissue-cultured shoots ofPopulusbachofenii×P.pyramidalis[J].Journal of Northeast Forestry University,2010,38(1):20-23. 8.宗亦臣,常金财,郑勇奇.湿加松无性系组培快繁技术[J].东北林业大学学报,2011,39(4):11-13,26. Zong Yichen,Chang Jincai,Zheng Yongqi.Tissue culture and rapid propagation ofPinuselliottii×Piniuscaribaea[J].Journal of Northeast Forestry University,2011,39(4):11-13,26. 9.王颜波,常英英,梁立雄,等.欧洲黑杨‘N46’组培再生体系的建立[J].东北林业大学学报,2015,43(10):10-13. Wang Yanbo,Chang Yingying,Liang Lixiong,et al.Building an plant regeneration system forPopulusnigra‘N46’[J].Journal of Northeast Forestry University,2015,43(10):10-13. 10.施琼,黄烈健,胡峰,等.相思树种组织培养研究进展[J].福建林业科技,2013,40(2):199-205. Shi Qiong,Huang Liejian,Hu Feng,et al.Research advance on the tissue culture ofAcaciaspecies[J].Journal of Fujian Forestry Science and Technology,2013,40(2):199-205. 11.胡峰,施琼,黄烈健.黑木相思愈伤组织诱导及植株再生[J].植物学报,2014,49(5):603-610. Hu Feng,Shi Qiong,Huang Liejian.Establishment ofAcaciamelanoxyloncallus induction and shoot regeneration system[J].Chinese Bulletin of Botany,2014,49(5):603-610. 12.胡峰,施琼,黄烈健.厚荚相思(Acaciacrassicarpa)腋芽组培快繁技术体系研究[J].植物研究,2015,35(2):179-184. Hu Feng,Shi Qiong,Huang Liejian.Tissue culture system of axillary proliferation ofAcaciacrassicarpa[J].Bulletin of Botanical Research,2015,35(2):179-184. 13.施琼,胡峰,黄烈健,等.马大杂种相思腋芽高效组培增殖体系[J].林业科学,2014,50(6):55-60. Shi Qiong,Hu Feng,Huang Liejian,et al.An efficient axillary bud multiplication system ofAcaciamangium×A.auricliformis[J].Scientia Silvae Sinicae,2014,50(6):55-60. 14.毕方铖,谭晓风,张智俊,等.油茶离体培养诱导再生植株的研究[J].经济林研究,2004,22(2):5-9. Bi Fangcheng,Tan Xiaofeng,Zhang Zhijun,et al.Study on organogenesis and Induction of regeneration plant ofCamelliaoleifera[J].Nonwood Forest Research,2004,22(2):5-9. 15.黄碧兰,徐立,李志英,等.牛大力茎段组织培养技术研究[J].安徽农业科学,2008,36(32):13993-13994. Huang Bilan,Xu Li,Li Zhiying,et al.Study on tissue culture techniques for stem segment ofMillettiaspeciosaChamp[J].Anhui Agricultural Science,2008,36(32):13993-13994. 16.汪长水.卷荚相思组培快繁技术研究[J].福建林业科技,2009,36(3):92-97. Wang Changsui.Study on technology of tissue culture and rapid propagation ofAcaciacincinnata[J].Journal of Fujian Forestry Science and Technology,2009,36(3):92-94. 17.张玮,黄树燕,谢锦忠,等.花吊丝竹组培快繁育苗技术研究[J].林业科学研究,2010,23(6):914-919. Zhang wei,Huang Shuyan,Xie Jingzhong.Study on rapid propagation technology ofDendrocalamusminorvar.amoenus[J].Forest Research,2010,23(6):914-919. 18.容世清,曾少玲.马占相思工厂化组培育苗技术的研究[J].热带林业,1997,17(2):13-16. Rong Shiqing,Zeng Shaoling.Study on industrial tissue technology ofAcaciamangium[J].Tropical Forestry,1997,25(2):55-58. 19.范子南,肖华山,范晓红,等.金线莲的组织培养研究[J].福建师范大学学报:自然科学版,1997,13(2):82-87. Fan Zinan,Xiao Huashan,Fan Xiaohong,et al.Study on tissue culture ofAnoectochilusroxburghii[J].Journal of Fujian Teachers University,1997,13(2):82-87. 20.续九如,李春立,孙建设.毛叶枣组培快繁技术研究[J].北京林业大学学报,2003,25(3):28-32. Xu Jiuru,Li Chunli,Sun Jianshe.Micropropagation of ber(ZiziphusmauritianaLam.)[J].Journal of Beijing Forestry University,2003,3(25):28-32. 21.赵建萍,柏新富,蒋小满,等.北高丛越桔芽器官离体培养与快繁体系的建立[J].林业科学,2007,43(5):111-115. Zhao Jianping,Bo Xinfu,Jiang Xiaoman,et al.Rapid propagation of plantlets from sprout ofVacciniumcorymbosumin vitro[J].Scientia Silvae Sinicae,2007,43(5):110-116. 12th-Five-Year National Science and Technology Support Program of China(2012BAD01B0402) introduction:WANG Hong(1993—),female,master student,majoring inAcaciagenetic breeding. date:2016-03-22 BudInducingfrom16-yearEliteTreesExplantsofThreeAcaciaSpecies WANG Hong HUANG Lie-Jian*HU Feng (Research Institute of Tropical Forestry,CAF,Guangzhou 510520) The explants from 16-year elite trees ofAcaciamangium,A.auriculiformisandA.mangium×A.auriculiformiswere used to establish the efficient bud inducing technique, by studying the sterilization methods, position, gathered time and type of explants, the effects of 6-BA, sucrose, and basal medium.A.mangiumwas disinfectant sensitive, treatment with mercuric chloride 9 min and ethanol 15 s was the optimal, but longer time were need forA.auriculiformisandA.mangium×A.auriculiformis, treatment with mercuric chloride 18 min, ethanol 15 s and mercuric chloride 15 min, and ethanol 30 s, respectively. These threeAcaciaspecies shared common optimal position, gathered season and type: 3-5thnode of shoot as explants were optimal position. It was the optimal season to gather explants in August; Type 2 explant germinated from shoots of cutting orchard (established by cutting the shoots of mature elite) was the optimal type; The optimal bud inducing medium were modify MS+6-BA 0.5 mg·L-1+sucrose 30 g·L-1forA.mangium, MS+6-BA 1.0 mg·L-1+sucrose 40 g·L-1forA.auriculiformis, MS+ sucrose 20 g·L-1forA.mangium×A.auriculiformis, with the highest germination rate of 93.33%, 92.00% and 97.33%, respectively. Acaciamangium;A.auriculiformis;A.mangium×A.auriculiformis;explants;bud inducing “十二五”国家科技支撑计划项目(2012BAD01B0402) 王鸿(1993—),女,硕士研究生,主要从事相思遗传育种研究。 * 通信作者:E-mail:13802987948@163.com 2016-03-22 * Corresponding author:E-mail:13802987948@163.com Q813.1+2 A 10.7525/j.issn.1673-5102.2016.05.014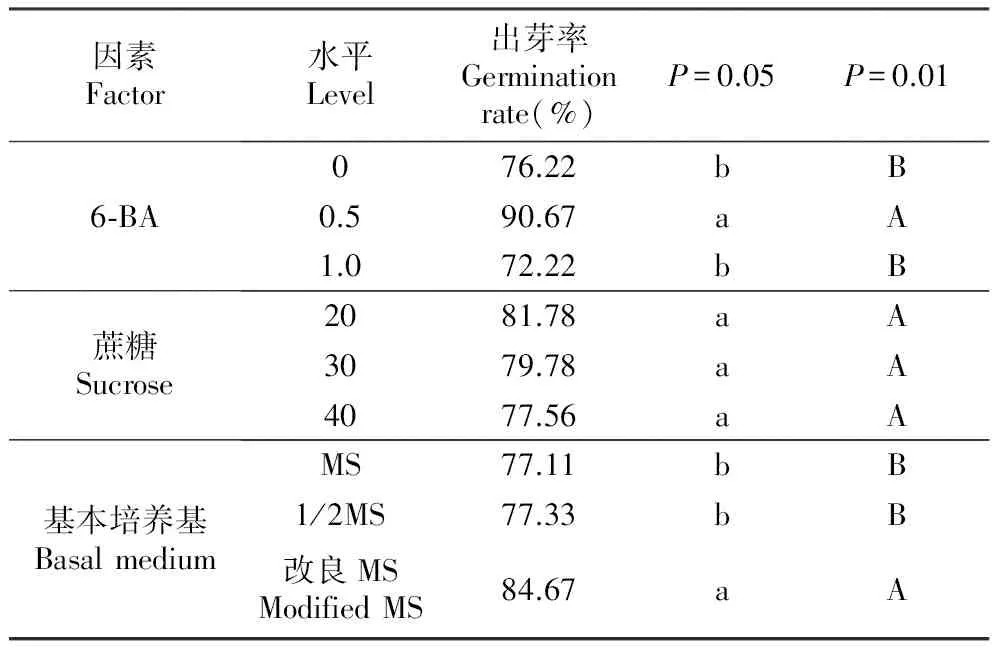

3 讨论
4 结论

