红松多酚物质的提取工艺及其抗炎活性初步研究
祖元刚 胡 艳 姜守刚*
(1.东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040; 2.生物资源生态利用国家地方联合工程实验室,哈尔滨 150040)
* 通信作者
* Corresponding author
红松多酚物质的提取工艺及其抗炎活性初步研究
祖元刚1,2胡 艳1,2姜守刚1,2*
(1.东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040;2.生物资源生态利用国家地方联合工程实验室,哈尔滨 150040)
选取超声波提取法对红松树皮中多酚类物质的提取工艺进行研究,以多酚提取率作为指标,采用单因素试验及正交试验,研究了物料比、乙醇浓度、提取时间、提取温度对红松多酚提取的影响。结果表明,超声波提取的最佳工艺条件是:物料比(g·mL-1)1∶30,乙醇浓度60%,提取时间2.0 h,提取温度80℃。本文也对红松多酚的抗炎作用进行了研究,并与杨树多酚、蓝莓多酚进行了比较,结果表明,在0.01~100 μg·mL-1范围内,3种多酚都有一定的抗炎作用,且抗炎作用大小顺序为:蓝莓多酚>红松多酚>杨树多酚。
红松多酚;超声波提取;抗炎活性;杨树多酚;蓝莓多酚
植物多酚,又称植物单宁,是一类广泛存在于植物体内的次生代谢产物,植物多酚在植物的皮、根、叶、果实等组织中含量丰富[1~2]。植物单宁的提取分离方法多种多样,比较常用的方法有超声波提取法、微波提取法、有机溶剂提取法、超临界流体萃取法等[3]。
红松(Pinuskoraiensis),又名海松,主要分布于小兴安岭地区,是我国重要的林业资源,红松中含有丰富的多酚类物质[4]。松多酚的提取方法有多种,目前很多学者将超声波法应用于松多酚的提取[5]。超声波提取植物多酚是利用超声波的热效应、空化效应、机械作用等加速植物细胞内物质的释放、扩散和溶解,加速了多酚类物质的浸出,进入溶剂[6]。与常规溶剂提取方法相比,超声波提取法更为省时、节能,且超声波提取法的工艺简单、能耗低、提取率高、氧化损耗小、提取物结构不易破坏,综合考虑各经济因素,其具有很大的工业化推广价值[7]。
植物多酚具有多种生理活性,如抗炎作用、抗氧化作用、抗癌作用、预防心血管疾病等[8]。炎症是机体防御的保护性反应,但过多的炎症可引起多种疾病。研究表明,多酚通过抗氧化应激途径,打断氧化应激,主要通过促进花生四烯酸的代谢,吞噬细胞在炎症灶积累,释放活性氧簇,减少多种炎症介质的释放,从而可达到抗炎的目的[9]。
红松多酚具有多种生物活性,其中研究最多的就是其抗氧化活性,对于松多酚的抗炎作用研究较少[10]。本文采用微波提取法提取,以红松树皮为原料,提取多酚类物质,并采用正交试验法优化红松多酚提取条件。在此基础上,本文也通过研究红松多酚对LPS诱导RAW264.7细胞产生NO的抑制作用对红松多酚的抗炎活性进行了初步的研究,并与杨树(Populus)多酚、蓝莓(Sementrigonellae)多酚进行比较。蓝莓多酚和杨树多酚在自然界中广泛存在,蓝莓多酚中的组成成分较多,主要有花青素、花色苷、没食子酸、绿原酸、槲皮素糖苷等[11],杨树多酚中的主要成分有绿原酸、丁香酸、水杨酸等[12]。
红松在我国的东北地区分布广泛,是我国重要的林业资源。但是除了红松种子外,红松的其他部分资源鲜少被利用,这在一定程度上造成了植物资源的浪费。本文以红松树皮为原料提取红松多酚,并研究了红松多酚的抗炎活性,这对红松资源的进一步开发利用具有重要的理论价值和实际意义。
1 材料
1.1 仪器
CO2细胞培养箱(CP-ST200A)购自长沙长锦科技有限公司,可见光分光光度计(722s)购自上海精密科学仪器有限公司,数控超声波清洗器(KQ-500DE)购自昆山市超声仪器有限公司,高速万能粉碎机(FW100)购自天津市泰斯特仪器有限公司,分析天平(ALC-1104)购自北京赛利多斯仪器系统有限公司,电热恒温鼓风干燥箱(DHG-9240)购自上海一恒科学仪器有限公司。
1.2 材料与试剂
红松树皮、杨树树叶、蓝莓均采自大兴安岭。
实验所用试剂均为分析纯,无水乙醇购自天津市天力化学试剂有限公司,碳酸钠购自天津市化学试剂一厂,没食子酸购自Alfa aesar公司,二甲基亚砜(DMSO)购自Amerseco公司,DMEM培养基、胎牛血清、青霉素链霉素溶液均购自Hyclone公司;胰蛋白酶购自Gibco公司,MTT(噻唑蓝)、一氧化氮检测试剂盒购自碧云天生物技术公司,地塞米松购自Sigma公司。
2 方法
2.1 多酚含量标准曲线
采用Folin-ciocalteu比色法测定多酚含量,具体操作如下:以没食子酸为标准品。分别吸取1 g·L-1的没食子酸1.0、2.0、3.0、4.0、5.0、6.0、7.0 mL,各自定容至100 mL,得到0.01、0.02、0.03、0.04、0.05、0.06、0.07 g·L-1的没食子酸溶液。分别从7个容量瓶中吸取1 mL溶液,加入到7支编好号的试管中,再往各试管中加入5 mL 10%的福林酚溶液,振荡摇匀,静置3~8 min后,加入4.0 mL 7.5%的碳酸钠溶液,振荡摇匀,在25℃水浴锅中反应1 h后测定在765 nm处的吸光值。以吸光度为纵坐标,没食子酸含量为横坐标,绘制标准曲线[5]。
2.2 多酚含量的测定
准确吸取1.0 mL样液于10 mL容量瓶中,加蒸馏水定容至10 mL,再加入5.0 mL 10%的福林酚溶液,振荡摇匀,静置3~8 min,加入4.0 mL的7.5%的碳酸钠溶液,振荡摇匀,25℃水浴锅中反应1 h,测定其在765 nm处的吸光值。将吸光度的数值代入上述的标准曲线方程中即可计算出样品中的多酚含量[2]。
2.3 红松多酚的提取
取一定量红松树皮,40℃烘干,粉碎机粉碎,过40目筛,超声波提取一段时间,4 000 r·min-1离心10 min,取上清液,测定多酚含量。
多酚提取率(%)=提取所得多酚总质量/红松树皮质量×100%[13]
(1)
2.4 红松多酚提取的单因素试验
选择物料比(W/V)、乙醇浓度、超声时间、提取温度作为4个因素,考察其对红松多酚提取率的影响。选取物料比(g·mL-1)为1∶10、1∶15、1∶20、1∶25、1∶30、1∶35、1∶40,乙醇浓度为20%、30%、40%、50%、60%、70%、80%,超声时间为0.5、1、1.5、2、2.5、3、3.5 h,提取温度为20℃、30℃、40℃、50℃、60℃、70℃、80℃。
2.5 红松多酚提取的正交试验
在单因素试验的基础上,选择物料比(A)、乙醇浓度(B)、超声时间(C)、提取温度(D)为试验因素,设计L9(34)正交试验,以红松多酚提取率为评价指标。
2.6 杨树多酚的提取
取一定量杨树树叶,40℃烘干,粉碎机粉碎,过40目筛,以料液比1∶40加入乙醇(50%),超声5 min,4 000 r·min离心10 min,取上清液,测定多酚含量[13]。
2.7 蓝莓多酚的提取
蓝莓打浆后冷冻干燥成粉,粉碎机粉碎,过40目筛,以料液比1∶25加入乙醇(50%),超声1 h,4 000 r·min-1离心10 min,取上清液,测定多酚含量[14]。
2.8红松多酚、杨树多酚、蓝莓多酚对小鼠巨噬细胞RAW264.7细胞活力的影响
采用MTT法测定红松多酚、杨树多酚、蓝莓多酚对小鼠巨噬细胞RAW264.7细胞活力的影响,RAW264.7细胞用DMEM培养基(89% DMEM培养液、10%胎牛血清、1%青霉素链霉素溶液)培养。将200 μL的RAW264.7细胞(5×104个细胞/mL)铺板至96孔板中,12 h后,分别加入空白培养基、红松多酚、杨树多酚、蓝莓多酚,各药物分为5个浓度,即0.01、0.01、0.1、1、10、100 μg·mL-1。48 h后,吸尽上清液,用生理盐水清洗3遍,加入5 μL的MTT,再加入200 μL的细胞培养液,在细胞培养箱中(37℃,5% CO2)孵育4 h。弃去上清液,加入150 μL二甲基亚砜,振荡均匀,用酶标仪490 nm波长处测定吸光度。
细胞活力(%)=实验组OD/空白组OD×100%[15~16]
(2)
2.9 NO含量标准曲线
采用Griess Reagent法测定NO含量,以DMEM培养基为溶剂,稀释NO检测试剂盒中的标准品,配制成50 μL的下列浓度的标准品溶液,即0、1、2、5、10、20、40、60、100 μmol·L-1。分别加入50 μL的Griess ReagentⅠ、Griess Reagent Ⅱ,振荡均匀,用酶标仪540 nm波长处测定吸光度。以吸光度为纵坐标,NO含量为横坐标,绘制标准曲线[17]。
2.10红松多酚、杨树多酚、蓝莓多酚对小鼠巨噬细胞RAW264.7分泌NO的影响
本实验分为18组,分别为空白对照组、LPS模型组、地塞米松阳性对照组、5个不同浓度的松多酚药物组、5个不同浓度的杨树多酚药物组、5个不同浓度的蓝莓多酚药物组。LPS模型组药物浓度为1 μg·mL-1,地塞米松阳性对照组药物浓度为5 μg·mL-1,红松多酚、杨树多酚、蓝莓多酚药物组的5个浓度分别为0.01、0.1、1、10、100 μg·mL-1。将200 μL的RAW264.7细胞(2.5×104个/mL)铺板至96孔板中,培养12 h后,除空白对照组外,其余各组加入LPS,1 h后加入相应药物,并使各组LPS终浓度为1 μg·mL-1。培养24 h后,吸取50 μL 96孔板中的上清液,分别加入50 μL的Griess ReagentⅠ、Griess ReagentⅡ,振荡均匀,室温反应5 min,用酶标仪540 nm波长处测定吸光度。将吸光度代入NO含量测定的标准曲线即可得NO浓度[18]。
3 结果与分析
3.1 多酚含量标准曲线的绘制
按照2.1的方法,以吸光度作为纵坐标,没食子酸浓度(μg·mL-1)为横坐标,绘制多酚含量标准曲线(图1)。经过计算可知,标准曲线公式为y=0.012 6x+0.012 3,其中R2=0.998 9。根据此标准曲线,可以测定红松多酚、杨树多酚、蓝莓多酚的含量。
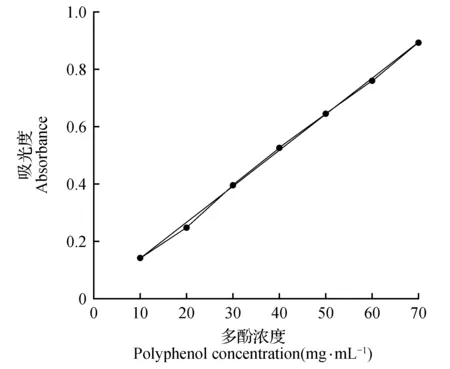
图1 多酚标准曲线Fig.1 Standard curve of polyphenol
3.2 红松多酚提取的单因素试验
3.2.1 选择物料比对红松多酚提取率的影响
准确称取5 g红松树皮粉末,分别按物料比(g·mL-1)为1∶10、1∶15、1∶20、1∶25、1∶30、1∶35、1∶40加入50%的乙醇,50℃下超声提取2 h。按照2.2中的方法测定多酚含量,计算多酚提取率,实验结果见图2a。由图2a可知,当物料比低于1∶25时,多酚提取率随着物料比的增大而提高,当物料比高于1∶25时,随着物料比的变化,多酚提取率基本上无变化。综合考虑经济因素等,选择1∶25为红松多酚最佳提取物料比。

图2 红松多酚提取的单因素试验结果Fig.2 Results of the single factor test of polyphenols extractionfrom Korean pine bark
3.2.2 乙醇浓度对红松多酚提取率的影响
准确称取5 g红松树皮粉末,按物料比1∶25分别加入20%、30%、40%、50%、60%、70%、80%的乙醇,50℃下分别超声提取2 h。按照2.2中的方法测定多酚含量,计算多酚提取率,实验结果见图2b。由图2b可知,当乙醇低于60%时,多酚提取率随着乙醇浓度的增加而提高,当乙醇高于60%时,随着物料比的变化,多酚提取率基本上无变化多酚提取率随着乙醇浓度的增加而降低。由此可知,应选择60%为红松多酚最佳提取乙醇浓度。
3.2.3 提取时间对红松多酚提取率的影响
准确称取5 g红松树皮粉末,按物料比1∶25,加入60%的乙醇,50℃下超声提取0.5、1、1.5、2、2.5、3、3.5 h。按照2.2中的方法测定多酚含量,计算多酚提取率,实验结果见图2c。由图2c可知,当提取时间低于2.5 h时,多酚提取率随着提取时间的增加而提高,当提取时间高于2.5 h时,随着提取时间的变化,多酚提取率基本上无变化。以此可知,应选择2.5 h为红松多酚最佳提取时间。
3.2.4 提取温度对红松多酚提取率的影响
准确称取5 g红松树皮粉末,按物料比1∶25,加入60%的乙醇,分别于20℃、30℃、40℃、50℃、60℃、70℃、80℃下超声提取2.5 h。按照2.2中的方法测定多酚含量,计算多酚提取率,实验结果见图2d。由图2d可知,多酚提取率随着提取温度的升高而提高。由于超声波清洗仪稳定工作需低于一定温度,且温度过高会影响多酚的生物活性[7],综合考虑各因素,选择80℃为红松多酚最佳提取温度。
3.3 红松多酚提取的正交试验
在单因素试验的基础上,以物料比、乙醇浓度、提取时间、提取温度作为正交因素,选取L9(34)正交表进行正交试验,优化红松多酚提取条件。各因素水平见表1,正交试验结果见表2。由表2可知,最佳提取条件为A3B2C1D3,即物料比为1∶30,乙醇浓度为60%,提取时间为2.0 h,提取温度为80℃,在该条件下,红松多酚的提取率12.02%。
表1红松多酚优化提取条件的正交试验因素与水平
Table1FactorsandlevelsoforthogonaltestforextractionofKoreanpinepolyphenol

试验编号TestnumberA物料比Materialratio(g·mL-1)B乙醇浓度Ethanolconcentration(%)C时间Time(h)D温度Temperature(℃)11∶20502.06021∶25602.57031∶25703.080
表2红松多酚优化提取条件的正交试验结果
Table2ResultoforthogonaltestforextractionofKoreanpinepolyphenol
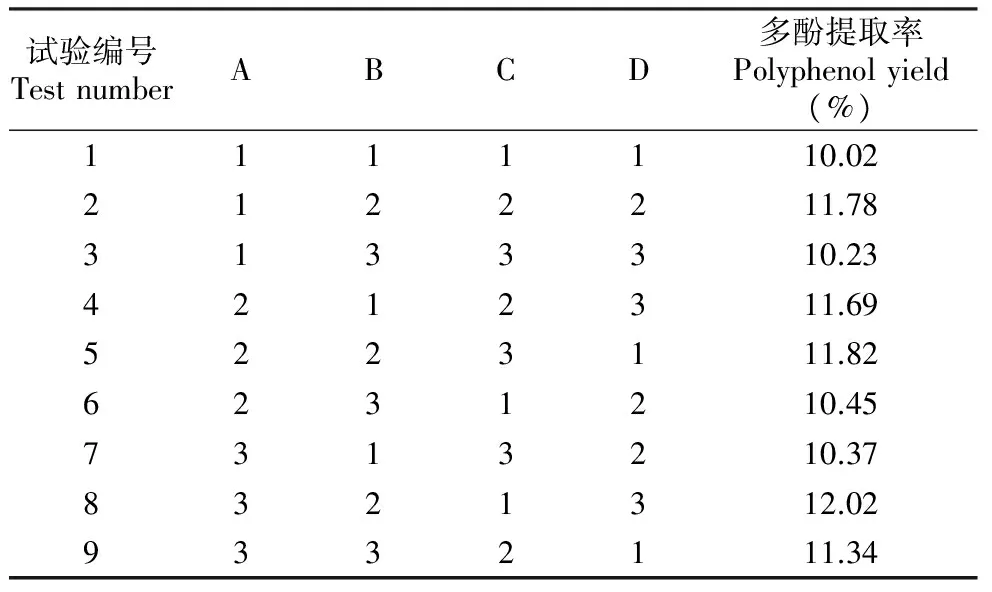
试验编号TestnumberABCD多酚提取率Polyphenolyield(%)1111110.022122211.783133310.234212311.695223111.826231210.457313210.378321312.029332111.34

图3 红松多酚、杨树多酚和蓝莓多酚对RAW264.7细胞活力的影响 a~c代表红松多酚、杨树多酚、蓝莓多酚对RAW264.7细胞活力的影响Fig.3 Effect of Korean pine polyphenol,polar polyphenol and blueberry polyphenol on viability of RAW264.7 cells a-c represent effect of Korean pine polyphenol,polar polyphenol and blueberry polyphenol on viability of RAW264.7 cells
3.4红松多酚、杨树多酚、蓝莓多酚对小鼠巨噬细胞RAW264.7细胞活力的影响
红松多酚、杨树多酚、蓝莓多酚对小鼠巨噬细胞RAW264.7细胞活力的影响结果如图3所示,由图3可知,经红松多酚、杨树多酚、蓝莓多酚处理后的RAW264.7细胞活力与空白组、LPS组无显著差异,且随着红松多酚、杨树多酚、蓝莓多酚浓度的增高,RAW264.7细胞活力基本不变。由此可知,在0.01~100 μg·mL-1范围内,红松多酚、杨树多酚、蓝莓多酚对RAW264.7细胞活力没有影响,对RAW264.7细胞没有毒性。
3.5 NO含量标准曲线的绘制
按照2.9的方法,以吸光度作为纵坐标,NO(μmmol·L-1)为横坐标,绘制NO含量标准曲线(图4)。经过计算可知,标准曲线公式为y=0.007 1x+0.078 2,其中R2=0.997 6。根据此标准曲线,可以测定小鼠巨噬细胞RAW264.7分泌NO的量。

图4 NO标准曲线Fig.4 Standard curve of NO
3.6红松多酚、杨树多酚、蓝莓多酚对LPS诱导小鼠巨噬细胞RAW264.7分泌NO的影响
红松多酚、杨树多酚、蓝莓多酚对LPS诱导小鼠巨噬细胞RAW264.7分泌NO的影响结果如图5所示,由图5可知,空白组RAW264.7细胞分泌的NO量明显低于其他添加了LPS的实验组,LPS模型组分泌的NO量最多,说明LPS诱导RAW264.7分泌更多的NO,此体外炎症模型建立成功。
红松多酚、杨树多酚、蓝莓多酚药物组小鼠巨噬细胞RAW264.7的NO分泌量低于LPS模型组,高于空白组,说明红松多酚、杨树多酚、蓝莓多酚能抑制小鼠巨噬细胞RAW264.7分泌NO。随着3种多酚添加浓度的增加,RAW264.7细胞NO的分泌量逐渐减少。比较可知,3种多酚对LPS诱导小鼠巨噬细胞RAW264.7分泌NO的抑制效果优于阳性对照药物地塞米松。在相同浓度下,蓝莓多酚对LPS诱导小鼠巨噬细胞RAW264.7分泌NO的抑制效果最佳,红松多酚次之,杨树多酚的抑制效果最差。红松多酚、杨树多酚、蓝莓多酚可以通过抑制NO的分泌,表现出一定的抗炎作用,且蓝莓多酚的抗炎作用最强,红松多酚的抗炎作用较强,杨树多酚的抗炎作用最小。

图5 红松多酚、杨树多酚和蓝莓多酚对RAW264.7细胞分泌NO的影响 a~c代表红松多酚、杨树多酚、蓝莓多酚对RAW264.7细胞分泌NO的影响Fig.5 Effect of Korean pine polyphenol,polar polyphenol and blueberry polyphenol on NO production in LPS-activated RAW264.7 cells a-c represent effect of Korean pine polyphenol,polar polyphenol and blueberry polyphenol on NO production in LPS-activated RAW264.7 cells
4 讨论
超声波提取技术是一种物理强化提取技术,它利用超声波对媒质产生独特的效应达到提取目的[9]。影响红松多酚超声波提取的因素主要有物料比、乙醇浓度、提取时间、提取温度,通过正交试验优化红松多酚超声波提取条件,得到的最佳提取条件为A3B2C1D3,即物料比为1∶30,乙醇浓度为60%,提取时间为2.0 h,提取温度为80℃,在该条件下,红松多酚的提取率12.02%。正交试验优化超声波提取红松多酚的提取条件,有助于提高红松多酚的提取率,对红松多酚的开发利用有重要意义。
研究结果表明,在0.01~100 μg·mL-1范围内,红松多酚、杨树多酚、蓝莓多酚对RAW264.7细胞活力没有影响,说明在该浓度范围内,红松多酚、杨树多酚、蓝莓多酚对RAW264.7细胞没有毒性。
多酚通过促进花生四烯酸的代谢,打断氧化应激途径,在致炎因子作用下,释放活性氧簇并引起脂质氧化反应,促进溶酶体的释放,减少炎症介质的释放,从而达到抗炎效果[19]。NO具有组织及细胞毒性,可增加毛细血管后微静脉浆细胞渗出,使细胞变性、组织粘连,从而加重炎症反应。降低巨噬细胞分泌NO水平,可以有效抑制炎症[20]。
在0.01~100 μg·mL-1范围内,红松多酚能抑制小鼠巨噬细胞RAW264.7分泌NO,表现出一定的抗炎活性。且与杨树多酚、蓝莓多酚相比,红松多酚对LPS诱导小鼠巨噬细胞RAW264.7分泌NO的抑制效果强于杨树多酚,次于蓝莓多酚,三种多酚的抗炎作用大小顺序为:蓝莓多酚>红松多酚>杨树多酚。本研究结果表明,红松多酚具有一定的抗炎活性,根据这一特性,可对其进行更深入的开发利用。
1.陈亮,李医明,陈凯先,等.植物多酚类成分提取分离研究进展[J].中草药,2013,44(11):1501-1507.
Chen L,Li Y M,Chen K X,et al.Research progress in extraction and isolation of plantpolyphenols[J].Chinese Traditional and Herbal Drugs,2013,44(11):1501-1507.
2.张亮亮,汪咏梅,徐曼,等.植物单宁化学结构分析方法研究进展[J].林产化学与工业,2012,32(3):107-116.
Zhang L L,Wang Y M,Xu M,et al.Research progress in analytical methods of vegetable tannins[J].Chemistry and Industry of Forest Products,2012,32(3):107-116.
3.钱彩虹,吴谋成.植物单宁制备方法研究进展[J].现代农业科学,2009,16(3):54-56.
Qian C H,Wu M C.The progress of tannin preparation methods[J].Modern Agricultural Sciences,2009,16(3):54-56.
4.王吉昌,王振宇,文攀,等.半制备液相—高效液相色谱技术测定红松树皮中多酚物质的研究[J].食品工业科技,2012,33(2):73-76.
Wang J C,Wang Z Y,Wen P,et al.Study on the polyphenols ofPinuskoraiensisbark determined bysemi-preparative liquid-high performance liquid chromatography[J].Science and Technology of Food Industry,2012,33(2):73-76.
5.苏晓雨,王振宇.红松子种皮提取物活性成分及抗氧化作用研究[J].林产化学与工业,2010,30(4):99-102.
Su X Y,Wang Z Y.Study on active component and antioxidant activities of extract fromPinuskoraiensisseed shell[J].Chemistry and Industry of Forest Product,2010,30(4):99-102.
6.孙希,金哲雄.植物多酚提取分离方法的研究进展[J].黑龙江医药,2015,28(1):80-83.
Sun X,Jin Z X.Research Progress in Methods for Extraction and Isolation of Plant Polyphenol[J].Heilongjiang Medicine Journal,2015,28(1):80-83.
7.林樱姬,赵萍,王雅.植物多酚的提取方法和生物活性研究进展[J].陕西农业科学,2009,(6):105-107.
Lin Y J,Zhao P,Wang Y.Research progress of extractible methods and biological activity of plant polyphenol[J].Sanxi Agricultural Science,2009(6):105-107.
8.耿中华.植物多酚的研究进展[J].广西轻工业,2008,(5):4-5,11.
Geng Z H.Research progress ofplant polyphenol[J].Guangxi Journal of Light Industry,2008,(5):4-5,11.
9.Torri E,Lemos M,Caliariv,et al.Anti-inflammatory and antinociceptive properties of blueberry extract(Vacciniumcorymbosum)[J].Journal of Pharmacy and Pharmacology,2007,59(4):591-596.
10.Yen G C,Duh D W,Hsu C L,et al.Protective effect of pine(PinusmorrisonicolaHay.) needle on LDL oxidation and its anti-inflammatory action by modulation of iNOS and COX-2 expression in LPS-stimulated RAW 264.7 macrophages[J].Food and Chemical Toxicology,2008,46(1):175-185.
11.Somerset S M,Johannot L.Dietary flavonoid sources inAustralianadults[J].Nutrition and Cancer,2008,60(4):442-449.
12.李春明.杨树中酚类物质含量季节动态的研究[D].哈尔滨:东北林业大学,2007.
Li C M.Studies on seasonal dynamics of phenolic compounds in polar[D].Harbin:Northeast Forestry University,2007.
13.苏晓雨,王振宇.红松种子壳多酚物质的提取及抗氧化特性[J].农业工程学报,2009,25(S1):198-203.
Su X Y,Wang Z Y.Polyphenol extraction fromPinuskoraiensisseed putamina and its antioxidant activities[J].Transactions of the CSAE,2009,25(S1):198-203.
14.韩彩静,王文亮,陈相艳,等.蓝莓多酚对小鼠巨噬细胞中NO、iNOS及COX-2分泌量的影响[J].中国食品学报,2015,15(2):15-20.
Han C J,Wang W L,Chen X Y,et al.Effect of Blueberry Polyphenol on NO,iNOS and COX-2 Production in RAW264.7 cells[J].Journal of Chinese Institute of Food Science and Technology,2015,15(2):15-20.
15.王松,罗猛,李楠,等.螺旋霉素的体外抗菌、抗炎活性研究[J].黑龙江医药,2011,24(5):696-699.
Wang S,Luo M,Li N,et al.Study on Antibacterial and Anti-inflammatory Activity of Spiramycininvitro[J].Heilongjiang Medicine Journal,2011,24(5):696-699.
16.Yao C M,Yang X W.Bioactivity-guided isolation of polyacetylenes with inhibitory activity against NO production in LPS-activated RAW 264.7 macrophages from the rhizomes ofAtractylodesmacrocephala[J].Journal of Ethnopharmacology,2014,151(1):791-799.
17.Cha B J,Parj J H,Shrestha S,et al.Glycosyl glycerides from hydroponicPanaxginsenginhibited NO production in lipopolysaccharide-stimulated RAW 264.7 cells[J].Journal of Ginseng Research,2015,39(2):162-168.
18.Zhao J H,Shen T,Yang X,et al.Sesquiterpenoids fromFarfugiumjaponicumand their inhibitory activity on NO production in RAW 264.7 Cells[J].Archives of Pharmacal Research,2012,35(7):1153-1158.
19.余应喜,范晶,张苜.白藜芦醇对脓毒症大鼠急性肺功能损伤的保护作用及对巨噬细胞炎症蛋白-2、IL-10、IL-18表达的影响[J].中国生物制品学杂志,2012,25(8):1003-1006.
Yu Y X,Fan J,Zhang M.Protective effect of resveratrol on rats with acute lung injury induced by sepsis in rat and itsinfluence on expressions of macrophage inflammatory protein-2, IL-10 and IL-18[J].Chinese Journal of Biologicals,2012,25(8):1003-1006.
20.范精华,刘康,刘保林.NO在炎症及免疫应答中的调节作用[J].中外医疗,2009,28(25):163,166.
Fan J H,Liu K,Liu B L.Adjust action of NO on inflammationand immune response[J].China Foreign Medical,2009,28(25):163,166.
The Twelfth Five-Year National Science and technology supportprogram in rural areas;The key technology research and demonstration of the definite cultivation of eucommia ulmoides and camptotheca acuminate precious ingredients and medicinal forest(2012BAD21B0501-11);The Fundamental Research Funds for the Central Universities;Preparation and preclinical medicine evaluation of paclitaxelnanoparticles(DL13CA11)
introduction:ZU Yuan-Gang(1954—),male,professor,doctor,study on botany.
date:2016-02-27
ExtractionandAnti-inflammatoryofKoreanPinePolyphenol
ZU Yuan-Gang1,2HU Yan1,2JIANG Shou-Gang1,2*
(1.Key Laboratory of Forest Plant Ecology,Northeast Forestry University,Harbin 150040;2.State Engineering Laboratory of Bio-Resources Eco-Utilization,Northeast Forestry University,Harbin 150040)
The ultrasonic extraction process was used to extract polyphenols in Korean pine bark, with the polyphenol yield as index. The optimum conditions were obtained through single factor test and orthogonal test with 4 factors of material ratio, ethanol concentration, extract time and extract temperature. The optimal ultrasonic extract conditions were material ratio(g·mL-1) of 1∶30, ethanol concentration of 60%, extract time of 2.0 h, and extract temperature of 80℃. For the anti-inflammatory effect of Korean pine polyphenol, polar polyphenol and blueberry polyphenol, in 0.01-100 μg·mL-1, the anti-inflammatory effect order was: blueberry polyphenol>Korean pine polyphenol>polar polyphenol.
korean pine polyphenol;ultrasonic extract;anti-inflammatory;polar polyphenol;blueberry polyphenol
十二五农村领域国家科技支撑计划;杜仲和喜树珍贵材用和药用林定向培育关键技术研究与示范;水溶性喜树碱抗肿瘤活性研究(2012BAD21B0501-11);中央高校基本科研业务费专项资金项目;纳米紫杉醇制备及临床前药学评价(DL13CA11)
祖元刚(1954—),男,教授,博士,主要从事植物学的研究。
2016-02-27
S791.247
A
10.7525/j.issn.1673-5102.2016.04.021

