解毒化瘀方对凝血酶合并缺氧诱导PC12细胞损伤ERK1/2信号通路表达的影响
邓奕辉,成绍武,易亚乔,覃弘宇,李银,李定祥*
(湖南中医药大学中西医结合心脑疾病防治湖南省重点实验室,细胞生物学与分子技术湖南省高校重点实验室,湖南长沙410208)
解毒化瘀方对凝血酶合并缺氧诱导PC12细胞损伤ERK1/2信号通路表达的影响
邓奕辉,成绍武,易亚乔,覃弘宇,李银,李定祥*
(湖南中医药大学中西医结合心脑疾病防治湖南省重点实验室,细胞生物学与分子技术湖南省高校重点实验室,湖南长沙410208)
目的探讨急性缺血性中风(AIS)瘀毒病机的分子机制及解毒化瘀方对凝血酶合并缺氧损伤的保护作用。方法(1)用凝血酶合并缺氧损伤PC12细胞,模拟急性缺血性中风的体外细胞模型。(2)将细胞分为空白组,模型组,解毒化瘀方含药血浆组和PD98059组(MEK抑制剂组),应用荧光定量实时RT-PCR方法检测MEK1、PAR-1及ERK1/2的mRNA表达,应用免疫荧光法检测ERK1/2、P-ERK1/2的蛋白表达。结果PCR结果提示:模型组MEK1、PAR-1及ERK1/2的mRNA表达与空白对照组相比显著升高(P<0.01),解毒化瘀方组和PD98059组MEK1、PAR-1及ERK1/2的mRNA表达较模型组显著降低(P<0.01),免疫荧光结果提示:解毒化瘀方组和PD98059组ERK1/2、P-ERK1/2的蛋白表达较模型组显著降低(P<0.01)。结论解毒化瘀方以凝血酶为作用的分子靶点,能够显著降低ERK1/2信号通路在缺血性中风体外细胞模型中的表达。
解毒化瘀方;急性缺血性中风;凝血酶;ERK1/2信号通路;黄连解毒汤
急性缺血性中风(acute ischemic stroke,AIS)是最常见脑血管疾病之一,占各类脑中风(stroke)的60%~80%[1],已经成为严重影响人类健康和社会经济的重大医学问题。近年来,有关急性缺血性中风的机制的主要学说有能量耗竭、兴奋性氨基酸毒性、梗死灶周边半暗带去极化、炎性细胞因子、钙离子超载、一氧化氮(NO)和自由基损伤、细胞凋亡等[2-3]。本研究在总结前期研究成果和继承传统中医理论的基础上,提出了AIS的主要病机为与凝血酶毒性相关的瘀血阻滞、毒损脑络,解毒化瘀法是该病有效治法的假说,并从ERK1/2信号转导通路来探讨解毒化瘀方神经保护作用的分子机制。
1 材料
1.1实验药物与试剂
解毒化瘀方(药物组成有黄连、黄芩、黄柏、栀子、红花、川芎、赤芍和地龙,由黄连解毒汤加味而成)饮片(购于湖南省中医药研究院附属医院);胰蛋白酶(Sango公司)、DMEM HIGH GLUCOSE(1X)培养基(美国HyClone试剂公司,批号NAC1362)、胎牛血清(美国HyClone试剂公司,批号NWK0489)、凝血酶(1000 U/20 mg)(中国Solarbio试剂公司批号106A069)、PD98059(Cayman产品,上海叶舟生物科技有限公司,产品编号,167869-21-8);一抗,美国圣克鲁斯公司;二抗(羊抗兔),康为世纪,货号CW0160。
1.2细胞及动物
PC12细胞(来源于大鼠的肾上腺嗜铬细胞瘤细胞,高分化,永生性,购自长沙赢润生物技术有限公司,编号2015032007);SD大鼠18只,雌雄各半,体质量为180~200 g(购自湖南斯莱克景达实验动物有限公司,合格证号2015032007)。
1.3主要仪器
ABI-7300 Real-time检测仪(美国ABI公司),逆转录试剂盒(立陶宛Fermentas公司,货号#K1622),XDS-1B倒置显微镜(日本奥林巴斯),普通二氧化碳培养箱(德国贺利氏),3131三气培养箱(Thermo),SP-756型紫外分光光度计(上海光谱仪器有限公司),ELX800酶标仪(美国罗氏公司)。
2 方法
2.1凝血酶合并缺氧诱导PC12细胞损伤模型的建立
PC12细胞以含10%胎牛血清、100 μ/mL青霉素、100 g/L链霉素的DMEM高糖培养基于37℃、5%CO2及饱和湿度下的培养箱中培养,2 d换液一次,待细胞成长融合后传代培养。细胞以1×105cells/mL接种于96孔培养板,每孔0.18 mL,培养24 h待细胞贴壁后再加终浓度为50 μg/L的神经生长因子(NGF)诱导分化72 h后[4],细胞神经元特性鉴定采用神经元特异性烯醇化酶(NSE)免疫荧光细胞化学方法。弃原培养液,将细胞分为,每组设8个复孔,分别加入0、50、100、150、200 μ/mL凝血酶10 μL和100 μL无血清培养基培养,置于三气培养箱中(5%CO2、1%O2、94%N2)模拟缺氧培养过程,按1、6、12、24 h时间点依次培养孵育后取出。干预浓度及时间前期已通过前期实验明确[5]。
2.2解毒化瘀方含药血浆的制备
处方饮片置于煎煮容器内,加相当于药材5倍量水浸泡1 h,煮沸45 min过滤,浓缩成每毫升含生药2 g的药液,冷却后装入无菌容器中,于4℃冰箱中保存备用。SD大鼠9只灌服解毒化瘀方水煎液(按生药36.6 g/kg灌胃,即成人临床用量的5倍),每天1次,连续7 d,于末次给药后2 h无菌条件下腹主动脉取血,取血后立即以3 000 r/min离心15 min,取上清液,组内血浆混合后0.22 μm过滤除菌后,-80℃冰箱保存备用。
2.3解毒化瘀方含药血浆对PC12细胞增殖的半数抑制浓度及作用时间的确定
采用MTT法测定,分为空白对照组(不含血浆),解毒化瘀方含药血浆组(终浓度分别为1%、5%、10%、15%)。PC12细胞培养于96孔板,待贴壁分化后以无血清DMEM培养液培养24 h,使细胞同步于G0期,分别加入浓度为0、1%、5%、10%、15%的含药血浆。作用24 h后,加10 μL 5 mg/mL的MTT于培养箱中培养4 h后,吸去上清加150 μL的DMSO,震荡10 min后于490 nm波长处检测光密度值(OD),计算各含药血浆抑制PC12细胞增殖的浓度(IC50)。
采用MTT法测定,分为无血浆对照组和含药血浆组(各含药血浆组终浓度为各含药血浆的增殖抑制半数浓度IC50),于37℃、5%CO2继续培养。分别于0、12、24、48 h后取出,加10 μL浓度为5 mg/mL的MTT于培养箱中溶液培养4h后,吸去上清加150 μL的DMSO,震荡10 min后于490 nm波长处检测光密度值(OD),以OD值反映PC12细胞的增殖活性。
2.4分组给药及指标检测
将细胞置于玻璃培养皿中并随机分为空白组(正常细胞组)、模型组(凝血酶150 μ/mL、在缺氧条件下作用12 h)、解毒化瘀方含药血浆组(含药血浆+模型细胞,简称血浆组)和PD98059组(MEK信号通路抑制剂+模型细胞,简称对照组)。取空白组和模型组细胞,加入PBS平衡液润洗(加入量以刚好没过玻片为准)2次后,加入4%多聚甲醛固定15 min,进行PCR及激光共聚焦检测。含药血浆组加入含10%浓度解毒化瘀方的培养液于三气培养箱中培养24 h后检测相关指标。PD98059组加入10 μL浓度为20 um的阻断剂,培养2 h后检测相关指标。平行重复3次实验取平均值。
2.4.1荧光定量实时PCR检测PAR-1及ERK1/2的mRNA的表达引物由Invitrogen Biotechnology CO.,LTD中国公司合成(见表1),按照合成单加入ddH2O,制成7.5 μmd/L溶液。RNA的提取:按照试剂盒说明书提取细胞RNA,紫外分光光度计测定RNA纯度,并进行RNA定量。PCR条件:95℃预变性10 min,95℃变性15 s,60℃复性45 s,60℃延伸1 min,40个循环。PCR产物分析:取PCR产物琼脂糖凝胶中电泳,紫外灯下观察条带,数据采用仪器自带软件分析(ABI Prism 7300 SDS Software),各标本重复3次,取平均值。
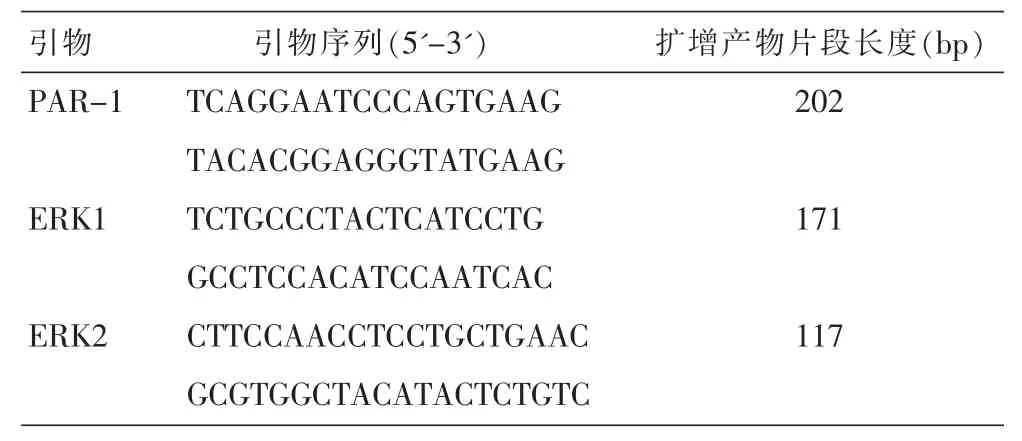
表1 引物序列和扩增序列长度
2.4.2免疫荧光法检测ERK1/2、P-ERK1/2蛋白的表达PC12细胞以1×104/mL接种于24孔板中,制作细胞爬片,吸取并弃上清加4%多聚甲醛固定15 min,加0.5%曲拉通作用10 min,再以牛血清蛋白封闭液封闭1 h,加一抗(1∶500)4℃孵育过夜,PBS润洗后加FITC羊抗兔荧光二抗(1∶100)室温孵育30 min,润洗后甘油封片于激光共聚焦显微镜下观察拍照。
2.5统计方法
数据均用SPSS 17.0进行统计,计量资料用“x±s”表示。多组间均数比较用单因素方差分析;组间两两比较方差齐者用LSD检验,方差不齐者用Dunnet T3检验。
3 结果
3.1解毒化瘀方含药血浆对PC12细胞增殖的半数抑制浓度和作用时间
随着解毒化瘀方含药血浆浓度的增高,各组IC50均在10%~15%的范围内,且各组间无差异(P>0.05),则可确定含药血浆作用浓度为10%。在12 h时间点,10%浓度含药血浆与对照组相比无统计学意义(P>0.05),24 h与48 h时均可抑制PC12的生长,与对照组相比具有统计意义(P<0.05)。因此,含药血浆的作用时间为24 h。
3.2各组凝血酶原(PAR-1)、MEK1、ERK1/2的m-RNA表达荧光定量实时PCR检测
结果显示,PC12细胞凝血酶原(PAR-1)、MEK1、ERK1/2 mRNA表达在模型组与空白组相比显著升高(P<0.01),解毒化瘀方含药血浆组的凝血酶原(PAR-1)、MEK1、ERK1/2的mRNA与模型组相比表达均降低(P<0.01),与PD98059对照组(MEK抑制剂组)比较差异无统计学意义。见表2。
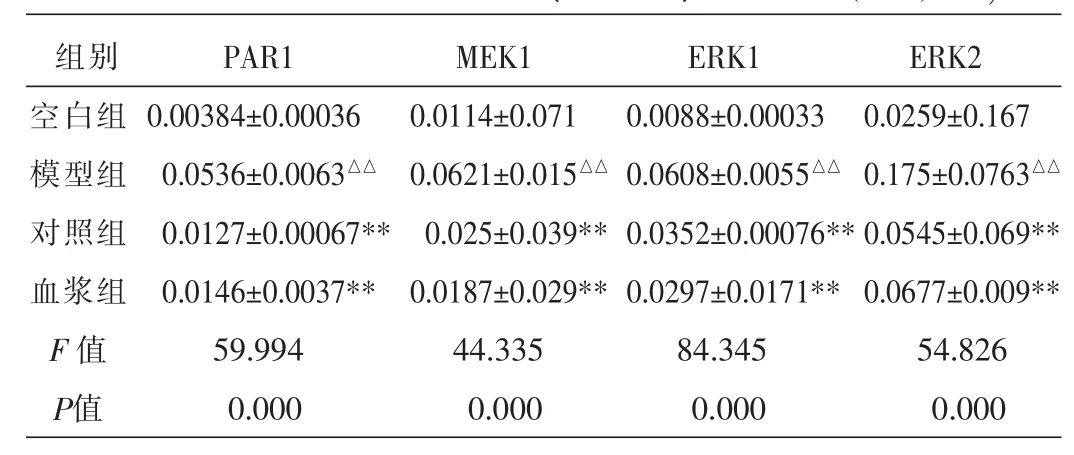
表2 各组PAR-1、MEK1、ERK1/2的mRNA表达(灰度值)(x±s,n=5)
3.3各组ERK1/2、P-ERK1/2蛋白的表达
与无血浆空白组比较,模型组P-ERK1/2与ERK1/2显著升高(P<0.01);与模型组比较PD98059组和解毒化瘀方含药血浆P-ERK1/2与ERK1/2表达明显下降(P<0.01),含药血浆组与PD98059组(MEK抑制剂组)比较差异无统计学意义(P>0.05)。结果见表3、图1-2。
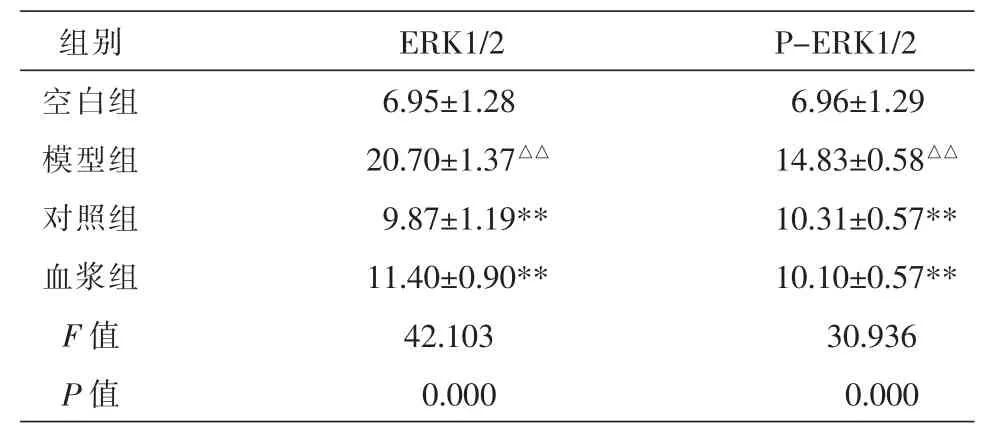
表3 免疫荧光相关信号通路ERK1/2、P-ERK1/2蛋白的表达(灰度值)(x±s,n=5)

图1 ERK1/2蛋白表达荧光图(×600)
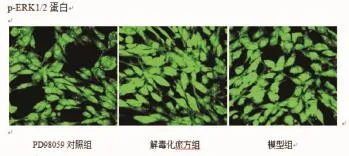
图2 P-ERK1/2蛋白表达荧光图(×600)
4 讨论
急性缺血性中风的基本病理生理过程由脑血管阻塞和随之发生的脑细胞损伤组成,而凝血酶在这个过程中起了关键作用。近年来,凝血酶在AIS发生发展中的作用受到了学术界的重视[6],凝血酶不仅是血液凝固血栓形成的关键水解酶,而且也通过与蛋白酶活化受体(protease-activated receptor,PAR)结合发挥对神经细胞的毒性作用,因此,以凝血酶为靶点来研究AIS具有重要价值[7]。PAR介导的凝血酶反应在脑损伤中具有双重作用,凝血酶在低浓度时诱导脑耐受性,在高浓度时对脑细胞产生毒性效应而加重对脑组织的损害,以上过程是通过信号转导来实现的。ERK1/2信号传导通路是一条可以被多种因素广泛激活的有丝分裂原活化蛋白激酶通路。MAPK具有诱导ERK磷酸化的作用,ERK1/2磷酸化可促进神经细胞存活,但持续的磷酸化能导致细胞的凋亡[8]。PD98059为ERK上游激酶MEK1特异性阻断剂,能够阻断ERK1/2信号通路的传导,可消除凝血酶诱导的ERK1/2激活作用,阻断凝血酶诱导的脑耐受;在体外用凝血酶处理也能活化ERK1/2,而用PD98059可以完全阻断用凝血酶预处理后的细胞保护作用[9]。
中医认为,缺血性中风多是在内伤积损的基础上,复因劳逸失度、情志不遂、饮酒饱食或外邪侵袭等触发,引起脏腑阴阳失调,气血逆乱。病理因素多为风、火、痰、气、瘀[10]。王永炎院士[11]认为本病为毒损脑络,导致脑络破损,经络、气血瘀滞不通,脑脉、神机失养,而出现神昏、肢体麻木、言语不利、半身不遂等症状。从临床发病特点看,缺血性中风可分为两个阶段,第一阶段发生在脑脉闭阻前,该阶段时程较长,是缺血性中风发病的基础。由于人体正气逐渐亏虚,而痰浊、瘀血等多种致病因素也因之缓慢形成,当正虚邪实达到一定程度后,在诱因的作用下导致脏腑阴阳失调、气血逆乱而致脑脉闭阻。第二个阶段发生在脑脉闭阻后,这个阶段时程较短,病情变化迅速。脑脉闭阻,脑髓失养,进而毒邪内生,损络伤髓,神明失养。脑脉闭阻多责之于瘀,络损髓伤、神明失养多责之于毒,因此可以认为AIS的基本病机为瘀血阻滞、毒损脑络,临床治疗当以化瘀解毒为法。
本实验结果显示,凝血酶合并缺氧PC12细胞的MEK1、PAR1和ERK1/2的mRNA表达明显升高,而采用解毒化瘀方含药血浆干预后能明显降低细胞MEK1、PAR1和ERK1/2的mRNA表达,含药血浆组和PD98059阻断剂组下降程度相当,表明解毒化瘀方能干预ERK信号通路的传导并有效降低凝血酶原的表达。免疫荧光结果表明,凝血酶合并缺氧可以使P-ERK1/2和ERK1/2的蛋白表达上调,加重细胞的损伤。解毒化瘀方含药血浆和PD98059均可减少P-ERK1/2和ERK1/2的蛋白表达,抑制神经细胞的凋亡。
我们可以推论ERK1/2信号通路参与了神经细胞凋亡的过程,是急性缺血性中风的一条重要信号转导通路。而凝血酶原很可能是其作用的有效靶点。通过阻断信号通路可以有效的降低细胞损伤。综上所述,解毒化瘀方对PC12细胞损伤具有保护作用,可为临床上对急性缺血性中风的治疗提供实验依据。
[1]中华医学会神经病学分会,脑血管病学组急性缺血性脑卒中诊治指南撰写组.中国急性缺血性脑卒中诊治指南2010[J].中国全科医生,2011,14(12B):4013-4017
[2]Brouns R,De Devn PP.The complexity of neurobiological processes in acute ischemic stroke[J].Clin Neurol Neurisurg,2009,111(6):483-495.
[3]McColl BW,Allan SM,Rothwell NJ.Systemic infection,inflammation and acute ischemic stroke[J].Neuroscience,2009,158(3):1049-1061.
[4]覃弘宇,李银,李定祥等.基于凝血酶合并缺氧诱导PC12细胞损伤的模型研究[J].重庆医学,2016,45(27):597-600
[5]Bo C,Beth F,Michael AW,et al.Thrombin Activity Associated with Neuronal Damage during Acute Focal Ischemia[J].J Neuroscience,2012,32(22):7622-7631.
[6]Bo C,Beth F,Michael AW,et al.Thrombin Activity Associated with Neuronal Damage during Acute Focal Ischemia[J].J Neuroscience,2012,32(22):7622-7631.
[7]Bo C.Thrombin in Ischemic Stroke Targeting.Translational Stroke Research[M].Springer New York,2012:189-204.
[8]李强,杨桂英,李峰,等.ERK信号通路在神经细胞凋亡中的双重作用[J].齐齐哈尔医学院报,2014,35(22):357-59.
[9]Chenguang Y.Distinct roles for ERK1 and ERK2 in pathophysiology of CNS[J].Front Biol,2012(7):267-276.
[10]徐瑾瑜,顾星,张秋雁.丹龙醒脑片治疗缺血性脑卒中的实验研究进展[J].湖南中医药大学学报,2014,34(2):62-63.
[11]李澎涛,王永炎,黄启福.“毒损脑络”病机假说的形成及其理论与实践意义[J].北京中医药大学学报,2001,24(1):1-6.
(本文编辑杨瑛)
Effect of Jiedu Huayu Fang on the Expression of ERK1/2 Signaling Pathway in PC12 Cells Injuried by Thrombin and HyPoxia
DENG Yihui,CHENG Shaowu,YI Yaqiao,QIN Hongyu,LI Yin,LI Dingxiang*
(Hunan Provincial Key Laboratory of Prevention and Treatment of Cardio-cerebral Diseases by Integrated Traditional Chinese and Western Medicine,the Key Laboratory of Cell Biology and Molecular Technology,Hunan University of Chinese Medicine,Changsha,Hunan 410208,China)
Objective To investigate the molecular mechanism of cerebral vascular occlusion and the mechanism of brain cell damage induced by acute ischemic stroke(AIS)and the protective effect of Jiedu Huayu Fang.Methods(1)PC12 cells were used to establish acute ischemic stroke in vitro.(2)The cells were divided into blank group,model group,Jiedu Huayu Fang serum group and PD98059 group(MEK inhibitor group).The mRNA expression of MEK1,PAR-1 and ERK1/2 was detected by Real-time PCR,and the protein expression of P-ERK1/2 and ERK1/2 was detected by immunofluorescence assay.Results PCR results indicated that the expression of MEK1,PAR-1 and ERK1/2 mRNA in the model group was significantly higher than that in the blank control group(P<0.01).The MEK1,PAR-1 and ERK1/2 mRNA expression in Jiedu Huayu Fang group and PD98059 group was much lower than that of model group(P<0.01).Immunofluorescence results show that:the ERK1/2,p-ERK1/2 protein expression of JieDuHuaYuFang group and PD98059 group was much lower than that of model group(P<0.01).ConclusionJiedu Huayu Fang,as the molecular targets of thrombin,can significantly reduce the expression of ERK1/2 signaling pathway in acute ischemic stroke.
Jiedu Huayu Fang;acute ischemic stroke;thrombin;ERK1/2 signaling pathway;Huanglian Jiedu Decoction
R285.5;R255.2
A
10.3969/j.issn.1674-070X.2016.10.005
2016-03-27
国家自然科学基金(81373508);湖南省自然科学基金(14JJ2113);湖南省教育厅项目(16K063);湖南省中医药科研基金(201606);中西医结合基础湖南省重点学科资助。
邓奕辉,女,教授,主任医师,医学博士,博士研究生导师,研究方向:中西医结合防治糖尿病血管并发症。
*李定祥,男,副教授,医学博士,硕士研究生导师,E-mail:ldxlzy@hotmail.com。

