MicroRNA-200b在卵巢癌组织及血浆中的表达及其对癌细胞侵袭迁移的影响
李伟宏
(河南省郑州市澍青医学高等专科学校,河南 郑州 450064)
MicroRNA-200b在卵巢癌组织及血浆中的表达及其对癌细胞侵袭迁移的影响
李伟宏
(河南省郑州市澍青医学高等专科学校,河南 郑州 450064)
目的观察microR NA-200b(简称miR-200b)在上皮性卵巢癌(EOC)患者卵巢组织以及血浆中的表达水平,探讨miR-200b对卵巢癌细胞侵袭迁移的影响。方法选取2014年12月-2015年12月郑州澍青医学高等专科学校附属医院经病理确诊为EOC患者36例(EOC组),另选取同期因子宫肌瘤或子宫腺肌病及其他非卵巢病变行手术切除者共20例作为对照组。采用实时荧光定量R T-PCR(qR T-PCR)法检测EOC患者和正常对照组卵巢组织中及血浆中miR-200b表达水平,人卵巢癌细胞SK-OV-3转染miR-200b抑制物后,采用transwell法观察细胞侵袭能力,并采用qR T-PCR和Western blot检测MMP-9的mR NA及蛋白表达水平。结果miR-200b在上皮性卵巢患者卵巢组织及血浆中的表达水平均显著高于正常对照组,差异有统计学意义(P <0.01);miR-200b抑制物可明显降低SK-OV-3细胞迁移能力,差异有统计学意义(P<0.01);且MMP-9的mR NA及蛋白水平均明显降低(P<0.01)。结论miR-200b在上皮性卵巢癌组织中高表达,miR-200b可能通过影响MMP-9来促进卵巢癌细胞的侵袭迁移。
microR NA-200b;上皮性卵巢癌;侵袭;MMP-9
卵巢癌是女性生殖道常见的恶性肿瘤之一,占女性生殖道肿瘤病死率的第一位[1]。上皮性卵巢癌(epithelial ovarian cancer,EOC)是最常见的卵巢肿瘤类型,由于早期诊断率低及对化疗药物较高的耐药性导致5年生存率低于20%[2]。寻找特异性和敏感性均较高的新的肿瘤标志物,并与多种筛查方法相结合有望提高对上皮性卵巢癌的早期诊断。本研究对上皮性卵巢癌患者病变组织及外周血中microRNA-200b(简称miR-200b)的表达进行检测,以便了解miR-200b在上皮性卵巢癌中的临床意义,并对miR-200b影响癌细胞侵袭迁移的机制进行初步探究。
1 资料与方法
1.1研究对象
选取2014年12月-2015年12月于郑州澍青医学高等专科学校附属医院经病理确诊为上皮性卵巢癌的患者36例(EOC组),年龄38~56岁,平均45岁;另选取同期因子宫肌瘤或子宫腺肌病及其他非卵巢病变行子宫全切除+单侧(或双侧)附件切除术者共20例作为对照组,术后病理检查证实为正常卵巢,年龄36~57岁,平均46岁。两组年龄差异无统计学意义。所有选择病例术前均未进行化疗、放疗或激素治疗。所有样本均经研究对象同意,并签署知情同意书。
1.2主要试剂
人卵巢癌细胞系SK-OV-3购自上海中国科学院细胞库,McCoy'5A细胞培养基购自Sigma公司,胎牛血清、双抗购自Gibco公司,RNA提取试剂盒Trizol购自Invitrogen公司,逆转录试剂盒、DNA Marker、PCR试剂盒、SYBR qRT-PCR试剂盒等均购自大连宝生生物工程有限公司。miR-200b、miR-200b抑制物及U6内参的引物由上海英骏生物技术有限公司设计合成;兔抗人MMP-9购自Cell signaling公司,HRP标记的羊抗兔二抗、兔抗人β-actin购自北京博奥森公司。
1.3组织和血浆标本总RNA提取及逆转录反应
两组患者手术中所取卵巢癌及正常卵巢组织,置入-80℃冰箱冷冻保存备用。此外,EOC组和对照组术前均于清晨空腹抽静脉血5 ml,加入EDTA抗凝剂,2h内于4℃下高速离心3000×g,5min。离心后提取上层血浆放入-80℃冰箱冷冻保存备用。
取约100 mg组织或200 u血浆,加入1 ml Trizol,充分匀浆,抽提总RNA,所得RNA溶于25μl的DEPC水中。经紫外分光光度计对提取的总RNA定量及检测纯度。进一步用Takara逆转录试剂盒进行逆转录,cDNA产物置入-20℃冰箱冷冻保存备用。引物序列如下:miR-200b:正向引物5'-GGG TAATACTGCCTGGTAA-3';反向引物5'-TTTGGCAC TAGCACATT-3'。U6:正向引物5'-CTCGCTTCGGC AGCACA-3';反向引物5'-AACGCTTCACGAATTT-3'。qRT-PCR扩增条件:50℃孵育2 min,95℃、Taq酶活化10min,95℃、15s,60℃、1min,共40个循环。运用目的基因Ct值与内参U6的Ct值之差ΔC(tCt目的基因–Ct管家基因)值,以2-ΔΔCt表示miR-200b的相对表达量,美国ABI PRISMR7300 Real-time PCR Systems进行检测及分析。
1.4细胞培养及转染
人卵巢癌细胞系SK-OV-3细胞培养于McCoy' 5A培养基[含有10%胎牛血清(FBS)、100 u/ml青霉素和100 u/ml链霉素],在37℃、5%二氧化碳CO2饱和湿度细胞培养箱内生长。按说明书将miR-200b抑制物与脂质体2000(美国Invitrogen公司)混合静置后转染SK-OV-3细胞,48 h后采用qRT-PCR检测其干扰效率。
1.5细胞侵袭实验
取对数生长期的SK-OV-3细胞及转染后SKOV-3细胞,调整细胞密度至3×105个/ml,按0.1ml/孔加到transwell小室的上层,上室预先用100μl Matrigel胶包被后紫外线照射2h。小室下层加入1ml含有10%胎牛血清的培养液。培养24 h后,对己穿至小室下层的细胞固定并用结晶紫染色后显微镜(Olympus)进行计数(随机选取5个视野),实验重复6次,设平行复孔。
1.6免疫印迹检测蛋白水平
收集SK-OV-3及转染miR-200b抑制物48 h后SK-OV-3细胞,蛋白裂解液处理并制备蛋白样品,根据蛋白定量结果调整每孔的上样量,将蛋白样品加在10%SDS-PAGE胶中进行电泳,电泳结束后用湿转法将蛋白转到PVDF膜上,5%脱脂奶粉室温震荡封闭2 h,一抗分别加兔抗人的MMP-9(1∶1 000稀释)、兔抗人β-actin(1∶3 000稀释),4℃孵育过夜后,HRP标记的羊抗兔二抗(1∶3 000稀释)室温孵育1 h,加ECL发光液进行化学发光显影,UVP凝胶成像仪(Gel Doc-It TS2 310 ImagingSystem)拍照检测。
1.7统计学方法
采用SPSS 20.0统计学软件进行数据分析,统计作图用Graph Pad Prism 5.0软件,计量资料主要为计量数据,均通过正态性检验;多组间比较为单因素方差分析+LSD多重比较,两组间差异比较用Student'st检验,P<0.05为差异有统计学意义。
2 结果
2.1EOC组和对照组的卵巢组织及外周血中miR-200b mRNA水平的比较
与对照组正常卵巢组织比较,EOC组卵巢组织中miR-200bmRNA的表达水平显著增高,差异有统计学意义(P<0.01)。EOC组患者外周血中miR-200b mRNA表达水平显著高于对照组,差异有统计学意义(P<0.01)。见表1。
表1 EOC组和对照组组织中miRNA-200b mRNA的表达水平(±s)
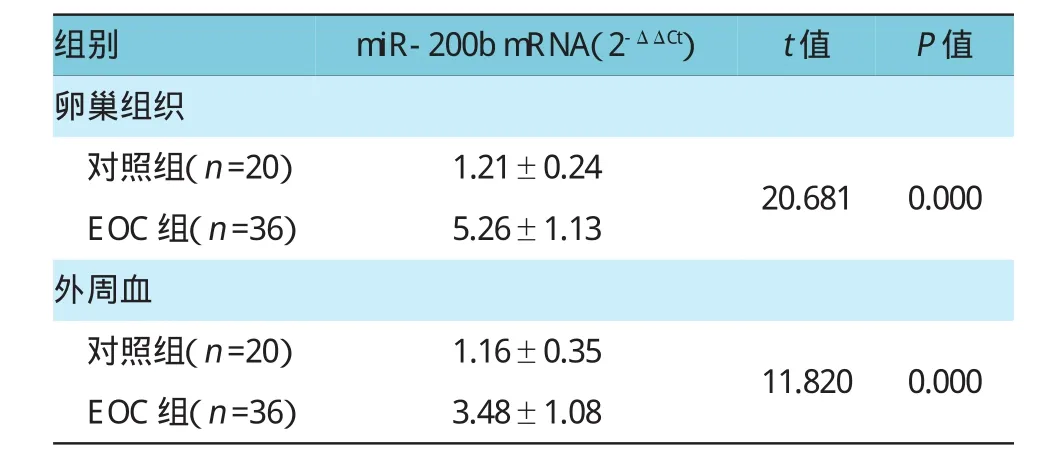
表1 EOC组和对照组组织中miRNA-200b mRNA的表达水平(±s)
组别miR-200bmRNA(2-ΔΔCt)t值P值卵巢组织对照组(n=20)1.21±0.24 EOC组(n=36)5.26±1.1320.6810.000外周血对照组(n=20)1.16±0.35 EOC组(n=36)3.48±1.0811.8200.000
2.2低表达miR-200b对SK-OV-3细胞侵袭功能的影响
与空白及空转对照比较,SK-OV-3细胞转染miR-200b抑制物后,其miR-200b mRNA水平显著降低,差异有统计学意义(P<0.01),说明抑制表达效果成功。细胞侵袭实验中,与对照组比较,SK-OV-3细胞转染miR-200b抑制物后,transwell小室下层细胞数量显著减少,差异有统计学意义(P<0.01),提示miR-200b可能与卵巢癌细胞侵袭能力密切相关。见表2。
表2 低表达miR-200b对SK-OV-3细胞侵袭功能的影响(n=6±s)
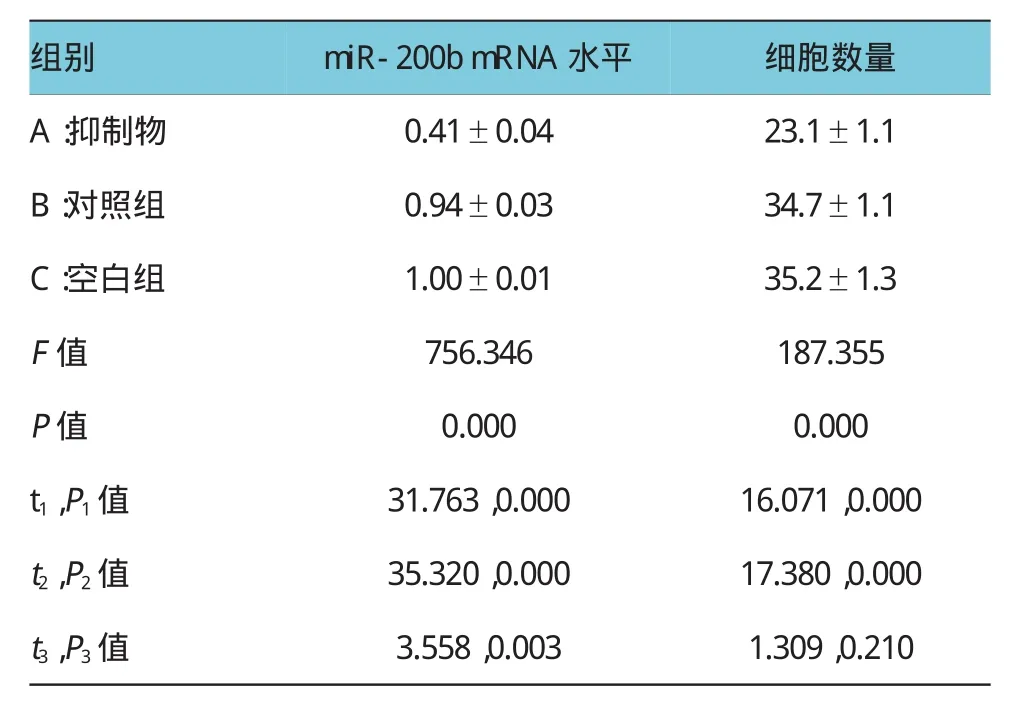
表2 低表达miR-200b对SK-OV-3细胞侵袭功能的影响(n=6±s)
注:t1,P1值:A vs B;t2,P2值:A vs C;t3,P3值:B vs C
组别miR-200bmRNA水平细胞数量A:抑制物0.41±0.0423.1±1.1 B:对照组0.94±0.0334.7±1.1 C:空白组1.00±0.0135.2±1.3 F值P值756.346 0.000 187.355 0.000 t1,P1值31.763,0.00016.071,0.000 t2,P2值35.320,0.00017.380,0.000 t3,P3值3.558,0.0031.309,0.210
2.3干扰miR-200b对SK-OV-3细胞MMP-9的mRNA和蛋白表达影响
为了探讨miR-200b影响SK-OV-3细胞侵袭的机制,本实验检测干扰miR-200b基因后SK-OV-3细胞中MMP-9的水平。结果发现,与对照组比较,干扰miR-200b的SK-OV-3细胞表达MMP-9的mRNA和蛋白水平均显著降低,提示miR-200b可能是通过促进MMP-9的表达来影响癌细胞的侵袭能力。见表3和附图。
表3 低表达miR-200b对SK-OV-3细胞MMP-9表达水平的影响(n=6±s)
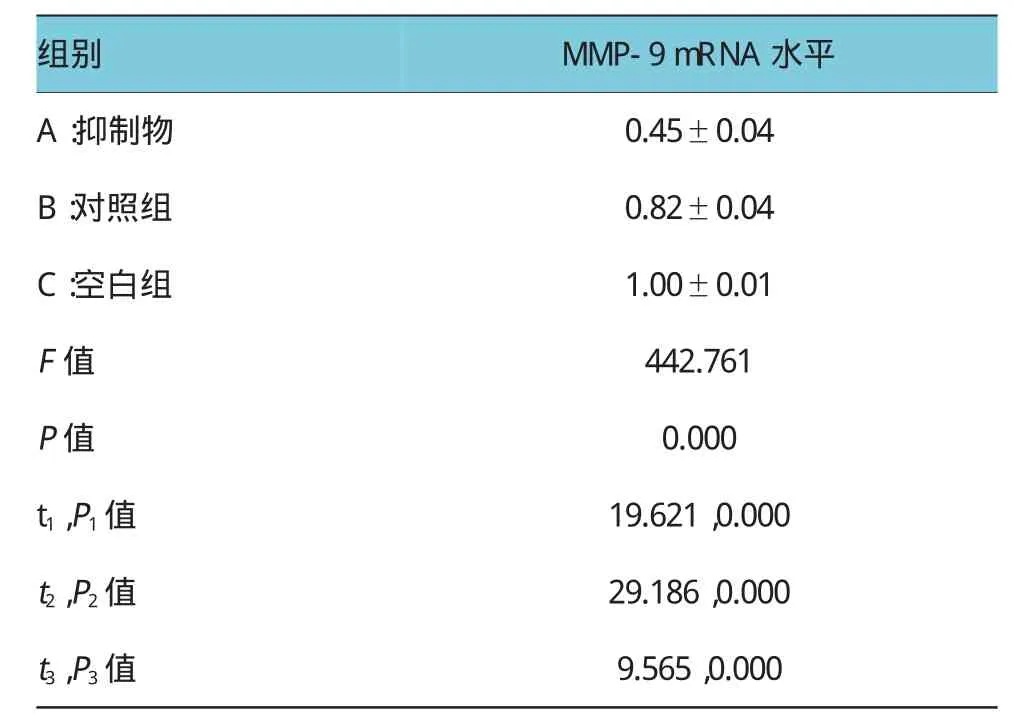
表3 低表达miR-200b对SK-OV-3细胞MMP-9表达水平的影响(n=6±s)
注:t1,P1值:A vs B;t2,P2值:A vs C;t3,P3值:B vs C
组别MMP-9mRNA水平A:抑制物0.45±0.04 B:对照组0.82±0.04 C:空白组1.00±0.01 F值P值442.761 0.000 t1,P1值19.621,0.000 t2,P2值29.186,0.000 t3,P3值9.565,0.000
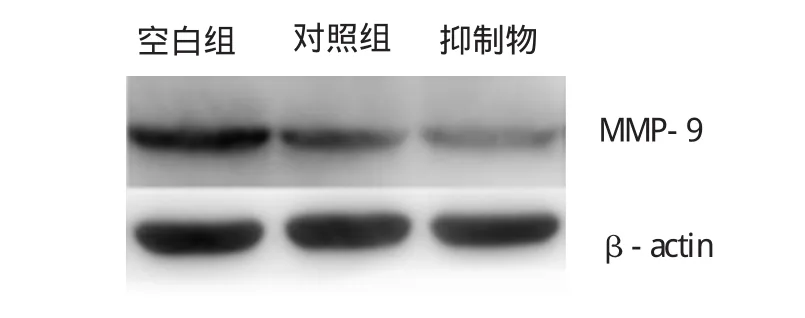
附图 低表达miR-200b对SK-OV-3细胞MMP-9蛋白表达的影响
3 讨论
上皮性卵巢癌(EOC)在卵巢恶性肿瘤中最为常见,发病隐匿,大多数患者确诊时已到晚期(Ⅲ期或Ⅳ期)而晚期患者的5年生存率低于20%,死亡率高居妇科恶性肿瘤之首[3]。上皮性卵巢癌的发生、发展是一个多种癌基因和抑癌基因的表达失衡的过程,在该过程中,miRNA通过差异表达在基因组上通过调节肿瘤相关的靶基因(如ZEB1、HSF1等),从而发挥着类似于致癌或抑癌的功能[4-6]。
miRNA是一种新近发现的非编码小分子RNA,参与调控细胞生长分化、能量代谢、凋亡等生理过程[7]。近年来发现,多数miRNAs定位在与肿瘤相关的染色体部位,miRNAs可以调控肿瘤相关基因,参与肿瘤细胞增殖、凋亡、侵袭或血管形成等过程,与人类肿瘤发生、发展有着密切关系[8]。miR-200家族在上皮性卵巢癌及多种恶性肿瘤中异常表达[9]。IORIO[10]对上皮性卵巢癌进行多种miRNA的筛查发现,上皮性卵巢癌中表达上调倍数最高的是miR-200家族,提示miR-200家族在上皮性卵巢癌的发病机制中起着类似癌基因的作用,可用于上皮性卵巢癌的早期诊断。miR-200家族有5个家族成员,miR-200a、miR-200b、miR-200c、miR-141和miR-429。本研究对上皮性卵巢癌患者和正常对照组的卵巢组织及外周血中miR-200b mRNA表达水平进行比较,实验结果发现,EOC患者卵巢组织和外周血中miR-200b的mRNA水平均显著高于正常对照组,与辛艳[11]、WYMAN等[12]的研究结果相一致,提示miR-200家族在上皮性卵巢癌的发病机制中发挥着重要的作用。
近年来,有研究发现细胞外基质(ECM)退化提示卵巢癌浸润正常组织并触发转移[13]。基质金属蛋白酶(MMPs)是能够降解基底膜和细胞外基质的主要成分,而MMP-9主要降解细胞外基质中Ⅳ型胶原,从而破坏肿瘤细胞侵袭的组织学屏障,促进细胞转移[14-15]。由于在侵袭试验中,低表达miR-200b的卵巢癌细胞穿过小室的能力明显降低。为进一步探讨miR-200b影响卵巢癌细胞侵袭能力的机制,本研究检测低表达miR-200b卵巢癌细胞中MMP-9的表达情况,结果表明,低表达miR-200b后,卵巢癌细胞MMP-9的mRNA和蛋白水平均显著降低,提示miR-200b调节卵巢癌细胞侵袭可能与MMP-9表达相关。
综上所述,上皮性卵巢癌患者高表达miR-200b可能通过影响上皮性卵巢癌细胞的侵袭功能参与上皮性卵巢癌的进展,血浆miR-200b可能成为预测上皮性卵巢癌预后的标志物。本研究为miR-200b与上皮性卵巢癌相互关系及其发病机制研究提供新的思路。
[1]TORRE L A,BRAY F,SIEGEL R L,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2]HALKIA E,SPILIOTIS J.The role of cytoreductive surgery and HIPEC in epithelial ovarian cancer[J].J BUON,2015,20(1):12-28.
[3]WANG B,LIU S Z,ZHENG R S,et al.Time trends of ovarian cancer incidence in China[J].Asian Pac J Cancer Prev,2014,15(1): 191-193.
[4]WANG X,MENG X,LI H,et al.MicroRNA-25 expression level is an independent prognostic factor in epithelial ovarian cancer[J]. Clin Transl Oncol,2014,16(11):954-958.
[5]JIN M,YANG Z,YE W,et al.MicroRNA-150 predicts a favorable prognosis in patients with epithelial ovarian cancer,and inhibits cell invasion and metastasis by suppressing transcriptional repressor ZEB1[J].PloS one,2014,9(8):e103965.
[6]CHEN Y F,DONG Z,XIA Y,et al.Nucleoside analog inhibits microRNA-214 through targeting heat-shock factor 1 in human epithelial ovarian cancer[J].Cancer Sci,2013,104(12):1683-1689.
[7]WEN K C,SUNG P L,YEN M S,et al.MicroRNAs regulate several functions of normal tissues and malignancies[J].Taiwan J Obstet Gynecol,2013,52(4):465-469.
[8]刘佳宇,赵妍蕊,张丽娜,等.上皮源性卵巢癌中4种miRNAs的表达及其临床意义[J].天津医药,2015,43(9):996-999.
[9]HUMPHRIES B,YANG C.The microRNA-200 family:small molecules with novel roles in cancer development,progression and therapy[J].Oncotarget,2015,6(9):6472-6498.
[10]IORIO MV,VISONE R,LEVA G,et al.MicroRNA signatures in human ovarian cancer[J].J Cancer Res,2007,67(18):8699-8707.
[11]辛艳.miRNa-200b在上皮性卵巢癌中作用的初探[D].哈尔滨医科大学,2014.
[12]WYMAN S K,PARKIN R K,MITCHELL P S,et al.Repertoire of microRNAs in epithelial ovarian cancer as determined by next generation sequencing of small RNA cDNA libraries[J]. PLoS One,2009,4(4):e5311.
[13]RAFII A,HALABI N M,MALEK J A.High-prevalence and broad spectrum of cell adhesion and extracellular matrix gene pathway mutations in epithelial ovarian cancer[J].J Clin Bioinforma,2012,2(1):15.
[14]ZOU M,ZHANG X,XU C.IL6-induced metastasis modulators p-STAT3,MMP-2 and MMP-9 are targets of 3,3'-diindolylmethane in ovarian cancer cells[J].Cell Oncol(Dordr),2016,39(1): 47-57.
[15]GHOSH S,BASU M,ROY S S.ETS-1 protein regulates vascular endothelial growth factor-induced matrix metalloproteinase-9 and matrix metalloproteinase-13 expression in human ovarian carcinoma cell line SKOV-3[J].J Biol Chem,2012,287(18): 15001-15015.
(张西倩编辑)
Expression of miRNA-200b in ovarian cancer tissue and plasma and its effects on cancer cell migration
Wei-hong Li
(Zhengzhou Shuqing Medical College,Zhengzhou,Henan 450064,China)
Objective To observe the expression ofmiRNA-200bin ovarian tissue and plasma of EOC patients,and to investigate effects of miRNA-200b on invasion and migration of ovarian cancer cells.Methods From December 2014 to December 2015,36 cases of diagnosed EOC patients(EOC group)in our hospital were selected as EOC group.And 20 cases of patients underwent surgical resection because of uterine leiomyoma or adenomyosis and other non ovarian lesions over the same period were selected as control group.RT-PCR(qRT-PCR)was used to detect the expression ofmiRNA-200bin ovarian tissue and plasma of two groups.AfterSK-OV-3cells interference miRNA-200binhibitor,cell invasion ability was observed with transwell method.The mRNA and protein levels of MMP-9 were detected by qRT-PCR and Western blot.Results The expression ofmiRNA-200bin ovarian tissues and plasma of the EOC group were significantly higher than the control group(P<0.001).After interference of miRNA-200binSK-OV-3cells,the cell invasion ability was reduced,and the mRNA and protein levels of MMP-9 were decreased.Conclusions The expressions of miRNA-200b in EOC are increased.ThemiRNA-200bmay facilitate the migration of ovarian cancer cells by affectingMMP-9.
miRNA-200b;epithelial ovarian cancer;invasion and metastasis;MMP-9
R 737.31
A
10.3969/j.issn.1005-8982.2016.20.009
1005-8982(2016)20-0040-04
2016-02-29

