基于定量聚合酶链式反应技术的多囊卵巢综合征与促卵泡激素的受体基因多态性的相关性研究
沈亚,丁家怡,徐丽,邵骏,金华,陈丽
(江苏省南通市妇幼保健院生殖中心,江苏 南通 226006)
基于定量聚合酶链式反应技术的多囊卵巢综合征与促卵泡激素的受体基因多态性的相关性研究
沈亚,丁家怡,徐丽,邵骏,金华,陈丽
(江苏省南通市妇幼保健院生殖中心,江苏 南通 226006)
目的多囊卵巢是造成不孕和子宫内膜癌等疾病的重要因素之一,该研究目的是探索多囊卵巢与相关单核苷酸的多态性位点相关性。方法该研究首先提出了一种改良的等位特异的定量聚合酶链式反应技术并对其进行了可靠性评估,随后对多囊卵巢患者和对照样本进行了卵泡刺激素受体基因两个单核苷酸的多态性位点进行了分型鉴定。结果该研究结果显示其提出的改良的定量聚合酶链式反应方法进行单核苷酸的多态性位点分型准确度高,区分度好,与Sanger测序法获得的结果完全一致,能够很好的用于单核苷酸的多态性等多态性位点的分型鉴定;该实验对152例多囊卵巢患者和152例对照样本中卵泡刺激素受体基因两个单核苷酸的多态性位点分型检测结果显示Thr307Ala和Asn680Ser两个位点的等位基因频率和基因型频率均呈现了与多囊卵巢之间的显著相关性。结论该研究结果表明卵泡刺激素受体基因的两个单核苷酸的多态性位点可能与多囊卵巢的发病密切相关,为深入探讨该疾病和进一步研究单核苷酸的多态性分型奠定了基础。
单核苷酸的多态性分型;等位特异聚合酶链式反应;定量聚合酶链式反应;多囊卵巢综合征;卵泡刺激素受体
多囊卵巢综合征(polycystic ovarian syndrome,PCOS)是育龄妇女常见的内分泌及生殖功能障碍性疾病,育龄期妇女的患病率为4%~12%[1-2]。临床表现,主要为闭经、多毛、肥胖、不孕等,并且伴有明显的代谢异常,如胰岛素血症、胰岛素抵抗等[3]。但是目前,PCOS的发病机制仍不清楚,因此进一步探讨PCOS密切相关的基因及其多态性信息对于更好的了解并预防治疗该疾病意义重大。
促卵泡激素(follicle-stimulating hormone,FSH)具有调节固醇类激素的合成以及促进卵泡发育成熟的作用。因此,许多学者和临床工作者认为其与多囊卵巢综合征的发病存在重要的关系[4]。从而围绕该基因开展一些探索研究,而且促卵泡激素的受体(follicle-stimulating hormone receptor,FSHR)也被认为是PCOS遗传的候选致病基因之一[5-6]。国内外已经有一些研究针对FSHR的多核苷酸多态性位点的多态性进行研究,但是研究结论至今并不一致[7-9]。FSHR的基因多态性到底与PCOS有没有相关性仍需要进一步探索研究。
尽管基因多态性的研究技术已经非常成熟,但是随着生物技术的发展进步,诸如单核苷酸多态性(single nucleotide polymorphism,SNP)检测这类技术仍然在不断地发展进步。近年来能够进行点突变定量检测的扩增受阻突变系统(amplification-refractory mutation system,ARMS)技术逐渐发展起来[10-11],它结合Taqman荧光探针定量聚合酶链式反应(polymerase chain reaction,PCR)技术能够高效准确地进行突变位点的检测和定性及定量分析,但是利用荧光探针的检测技术成本仍然较高,为此笔者借鉴ARMS的等位扩增技术,利用嵌入式荧光染料的定量PCR技术对SNP位点的检测技术进行了改良。并利用该改良的技术对FSHR基因的2个SNP位点Asn680Ser和Thr307Ala进行检测分析。在汉族人群中对其与多囊卵巢综合征之间的相关性进行进一步的探索研究,为更加确切的探查该疾病的发病机制提供了重要的基础数据。
1 材料与方法
1.1研究对象
选取2014年3月-2015年8月于南通市妇幼保健院就诊的PCOS患者共152例。PCOS的纳入标准[12]:①具有多囊卵巢综合征典型的临床特征:月经异常,不同程度的多毛或者肥胖;②B超或腹腔镜检测显示多囊卵巢及卵巢无排卵现象(一侧或双侧卵巢中小于10mm的卵泡数>10个);③近2个月内未使用类固醇类激素,月经周期第3天或闭经期黄体生成素与FSH的比值>2,同时睾酮值>2.2 nmol/L。上述标准符合两项且同时排除其他内分泌疾病者可诊断为PCOS。同时收集同期在该院就诊的对照样本152例。年龄与婚姻状况与PCOS组相匹配。所有研究对象均签署了参与本研究的知情同意书,本研究得到医院伦理委员会批准。
1.2样本收集与DNA提取
所有的研究对象均在就诊当日抽取外周血2ml,乙二胺四乙酸盐抗凝。基因组DNA的提取采用碘化钠方法,简述如下:取500μl抗凝血,加1 ml无菌水,轻轻颠倒混匀,10 000 r/min离心3 min,弃上清液,加入6 mol/L碘化钠NaI 100μl,混旋20 s,加入200μl氯仿异戊醇,混匀12 000 r/min离心5 min;转移上清液至新的离心管,加入90μl异丙醇,混匀,12 000 r/min离心5min。弃上清液,沉淀用75%的乙醇清洗2次,用50μl无菌水溶解,NanoDrop紫外分光光度计和Qubit荧光定量仪进行基因组DNA的质控分析。置入-20℃冰箱冷冻保存或立刻进行后续的实验研究。
1.3SNP检测方法的建立与验证
1.3.1引物的设计根据两个SNP位点及其旁侧序列,设计PCR引物和检测探针,进行定量PCR扩增。见表1。
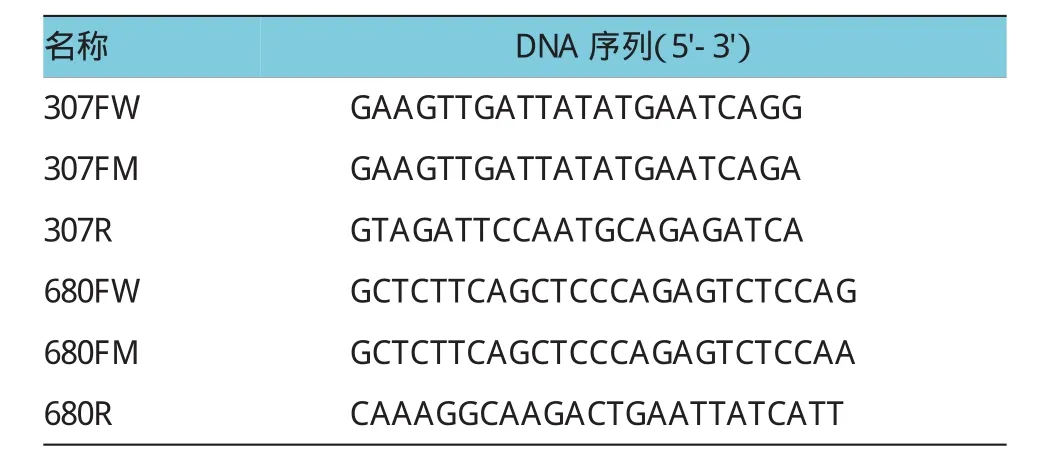
表1 引物序列信息
1.3.2SNP多态性位点检测的原理该检测方案为等位特异PCR与定量PCR两种技术的结合[13],定量PCR应用嵌入式荧光染料方法进行。具体方案为:根据目标SNP的位点设计一组扩增引物,包括2条正向引物和1条通用的反向引物,正向引物分为野生型和突变型两种,在正向引物靠近3'-末端的位置引入一个错配碱基(一般在靠近3'-端的第4个碱基),这样可以大大降低非特异性扩增,提高野生型和突变型的区分度。
1.3.3反应体系总体积为20μl,包含DNA模板(20 ng/μl)1μl,2×SYBRRFast qPCR Mix 10μl,正向引物和反向引物各1μ(l10 umol),用双蒸水补足至20μl。热循环参数为:95℃预变性5 min,93℃变性15s,62℃退火50s,共40个循环。反应结束后进行溶解曲线分析。最后根据在ABI 7500荧光定量PCR仪上读取Ct值和溶解曲线信息,分析确定每个样本的基因分型结果。
1.3.4检测结果的验证在SNP位点旁侧序列设计扩增引物,使产物中间部位涵盖目标SNP位点。普通PCR扩增后进行Sanger测序分析,以此验证利用改良方法检测该SNP位点的准确性。
1.3.5PCOS患者样本FSHR基因多态性的检测利用前期改良优化的检测技术分析收集到的152例PCOS患者样本和对照样本的SNP位点分析情况。
1.4统计学方法
采用SPSS 16.0统计软件进行数据分析,实验结果中等位基因及基因型频率用百分比表示。根据Hardy-Weinberg平衡定律计算各基因型个体数的期望值[14],组间基因型频率及等位基因频率的差异比较行χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1样本DNA的提取与质控
所有样本获得的基因组DNA都进行浓度测定和完整性质控。检测结果表明绝大多数样本提取的基因组都较完整,基本无降解拖带现象,DNA浓度均在80~120 ng/μl之间,完全符合后续基因多态性检测的要求。典型的样本基因组DNA的Nano Drop检测结果如下图所示,OD260与OD280的比值在1.8左右,OD260与OD230的比值都>1.5,纯度和浓度完全符合后续试验的要求。见图1。
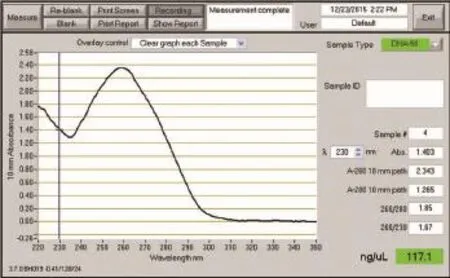
图1 基因组DNA的Nano Drop检测结果
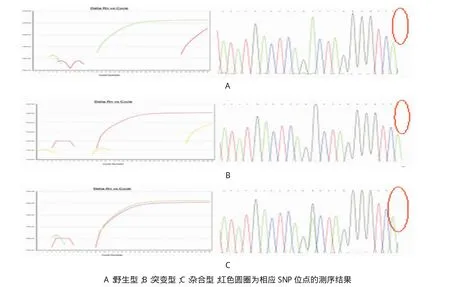
图2 定量PCR检测曲线和对应的Sanger测序结果
2.2SNP多态性检测方法的验证
如图2所示,首先利用Sanger法测序分析获得一个野生型样本,一个突变型样本和一个杂合型样本的确切结果。然后将已经明确分型结果的3个样本用改良的等位特异的定量PCR技术进行检测,并且对两种方法获得的结果进行比较。结果两者检测技术获得结果完全一致,从而表明本实验中改良的SNP检测技术具有很好的SNP位点的区分能力,可以准确的区分野生型、杂合型与突变型样本。对于野生型样本,当用野生型正向引物进行扩增时,其Ct值在15左右;而用突变型引物进行扩增时,其Ct值在35左右,相当于本底扩增水平,溶解曲线呈现典型的单一的尖峰。对于突变型和杂合型样本,该定量PCR检测结果同样呈现出了良好的鉴别能力,与Sanger测序获得的结果完全一致。
为了进一步确定该定量PCR检测技术对SNP位点的区分准确度。笔者随机选择80例对照样本进行SNP位点的检测分析,其中部分样本还进行Sanger测序分析,验证结果均呈现一致性。综合分析结果显示,本研究中等位特异的定量PCR的SNP分型结果具有很高的区分度,可以进行准确的多态性分型。3种SNP分型结果分别集中在图中的3个区域,相互之间存在明确的界限。野生型和突变型之间的扩增产物的Ct值最小差异均>8,而杂合型样本中2个产物的Ct值差异很小,其最大差异<5,相关样本的SNP分型结果均可以准确判读。见图3。
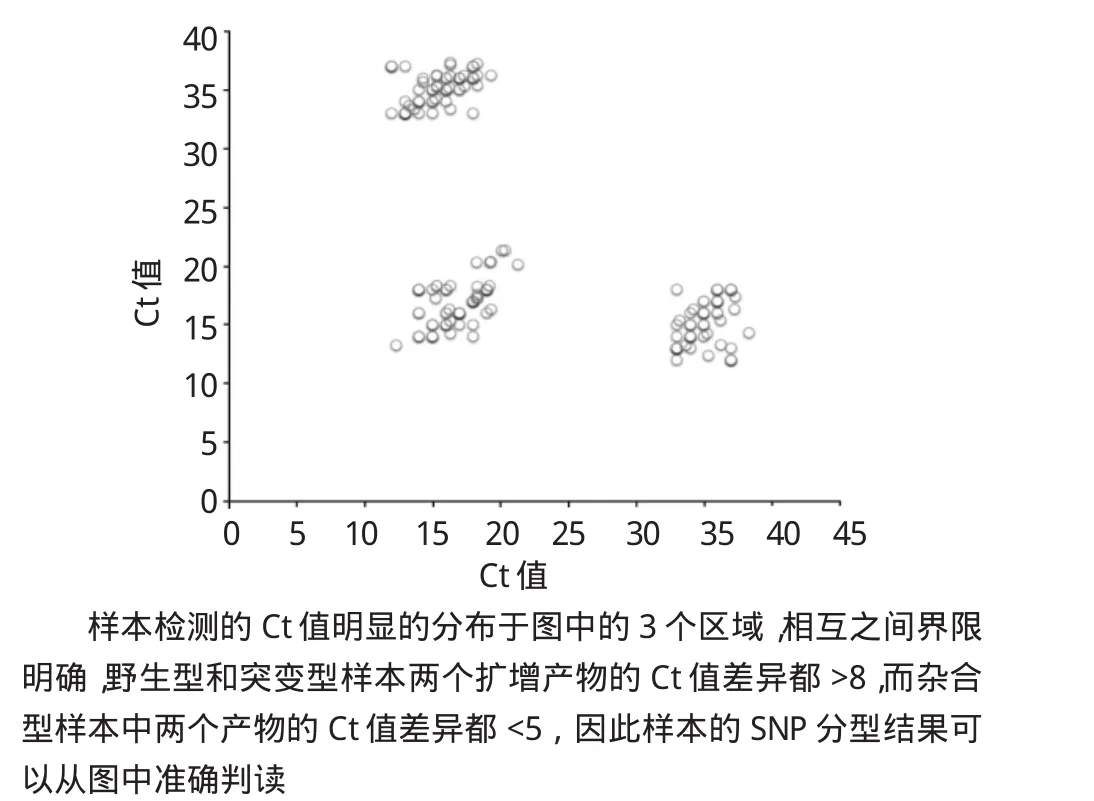
图3 利用定量PCR进行SNP分型的结果
2.3多囊卵巢综合征FSHR基因两个SNP位点的检测分析
利用上述改良的等位特异的定量PCR技术,设计带有错配碱基的扩增引物对152例多囊卵巢综合征样本和相应的对照样本进行2个SNP位点的分型检测。其中除有1例多囊卵巢样本因DNA浓度等问题没有获得理想的扩增曲线外,其余样本均获得了明确的分型结果。见表2。
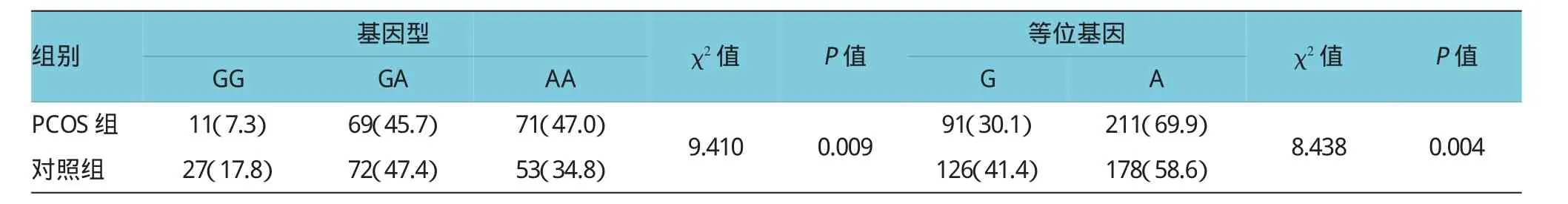
表2 PCOS组与对照组FSHR基因Asn680Ser多态性位点等位基因频率及各基因型频率的分布情况例(%)
经χ2检验,FSHR基因Asn680Ser多态性位点符合Hardy-Weinburg平衡。所有的303个研究对象等位基因型分布为GG(12.5%),GA(46.5%),AA(41%),PCOS组与对照组间等位基因型分布差异有统计学意义(P=0.009),等位基因频率在PCOS组和对照组比较差异有统计学意义(P=0.004)。
经χ2检验,Thr307Ala位点符合Hardy-Weinburg平衡。如上表所示,所有303个研究对象等位基因型分布为GG(12.5%)GA(37.6%)AA(49.9%),PCOS组和对照组间等位基因型分布差异有统计学意义(P=0.003),等位基因频率在PCOS组和对照组比较差异有统计学意义(P=0.001)。见表3。

表3 PCOS组与对照组FSHR基因Thr307Ala多态性位点等位基因频率及各基因型频率的分布情况例(%)
3 讨论
本研究中笔者采用一种改良的等位基因定量PCR扩增技术进行SNP的检测。应用嵌入式荧光染料方式进行定量PCR的信号检测,通用性好,操作简单,成本低廉,而且能够通过溶解曲线对特异性的扩增产物和引物二聚体进行区分,通过在引物序列中引入错配能够很好的获得多态性位点的分型结果。在等位基因特异性扩增中,靠近正向引物的3'-端附近区域引入1个或2个错配碱基,会在一定程度上降低扩增效率,但该引物设计可以更好的区分3'-末端的碱基差异,使纯合子样本中两种引物的扩增曲线很好的分开,能够实现准确的SNP分型。在本实验中靠近3'-端第4个碱基位置引入错配,达到了准确区分SNP不同分型的目的。为疾病相关SNP位点的分型鉴定打下了良好的基础。
SNP是人类可遗传的变异中最常见的一种,数量多、分布广、密度大、突变率低,对于疾病在基因中的定位具有重要的意义。本研究中笔者分析了300多例相关人群在FSHR基因上2个SNP位点的分型情况,结果显示这两个SNP位点的基因型和等位基因频率与多囊卵巢综合征之间差异均有统计学意义(P<0.05),从而提示FSHR基因多态性的差异与PCOS的发病可能存在相关性,这为PCOS的进一步深入研究和控制提供了基因水平重要的基础数据。
作为腺垂体分泌的一种糖蛋白激素,FSH在人类生殖中具有重要作用。FSH在靶细胞增殖和分化方面有不可替代的作用,间接影响卵子成熟。FSHR基因突变会造成明显的卵泡成熟障碍。研究发现,FSHR基因存在常见的SNPs,而且可能影响受体活性,进而导致卵巢功能的异常。其中FSHR基因启动子区和第10外显子的SNPs研究较多,特别是第10外显子307密码子的A~G多态以及680密码子的G-A多态[15-16]。多数研究证实,该基因外显子SNP位点的多态性与卵巢的功能存在密切相关性[17]。尽管多数报道的样本数量都在300以下,而且有关其与多囊卵巢综合征相关性的结论也不统一,但是毕竟确定结论是FSHR基因多态性与卵巢的储备,卵巢的反应性以及卵巢肿瘤等都存在相关性[18-19],是导致卵巢功能异常疾病的一个重要因素。该观点在本研究中的2个SNP位点分析结果与多囊卵巢综合征间比较差异有统计学意义得到进一步的证实。
总之,有关FSHR基因多态性与卵巢功能的相关性的研究还需要进一步探索,明确其与多囊卵巢综合征及其他卵巢功能异常发生的确切关联性,对于个性化治疗卵巢功能异常相关的疾病,预防并发症,减少治疗费用,具有重要的临床意义。
研究提出并验证一种快速、低成本、准确的基于定量PCR技术的SNP分析方法;对多囊卵巢综合征患者FSHR基因的分型检测结果表明,研究涉及的2个SNP位点与疾病的发生差异存在统计学意义。
[1]RASHIDI H,RAMEZANI T F,BAHRI K M,et al.To what extent does the use of the Rotterdam criteria affect the prevalence of polycystic ovary syndrome?A community-based study from the Southwest of Iran[J].Eur J Obstet Gynecol Reprod Biol,2013, 174(3):100-105.
[2]VILLACORTA L,CHANG L.The role of perivascular adipose tissue in vasoconstriction,arterial stiffness,and aneurysm[J].Horm Mol Biol Clin Investig,2015,21:137-147.
[3]NORMAN R J,DEWAILLY D,LEGRO R S,et al.Polycystic ovary syndrome[J].Lancet,2007,370:685-697.
[4]DU J,ZHANG W,GUO L,et al.Two FSHR variants,haplotypes and meta-analysis in Chinese women with premature ovarian failure and polycystic ovary syndrome[J].Mol Genet Metab, 2010,100(3):292-295.
[5]FU L,ZHANG Z,ZHANG A,et al.Association study between FSHR Ala307Thr and Ser680Asn variants and polycystic ovary syndrome(PCOS)in Northern Chinese Han women[J].J Assist Reprod Genet,2013,30(5):717-721.
[6]MUTHARASAN P,GALDONES E,PENALVER B B,et al.Evidence for chromosome 2p16.3 polycystic ovary syndrome susceptibility locus in affected women of European ancestry[J].J Clin Endocrinol Metab,2013,98(1):185-190.
[7]HARRISON C L,LOMBARD C B,MORAN L J,et al.Exercise therapy in polycystic ovary syndrome:a systematic review[J].Hum Reprod Update,2011,17(2):171-183.
[8]SHI Y,ZHAO H,CAO Y,et al.Genome-wide association study identifies eight new risk loci for polycystic ovary syndrome[J].Nat Genet,2012,44(9):1020-1025.
[9]DU T,DUAN Y,LI K,et al.Statistical genomic approach identifies association between FSHR polymorphisms and polycystic ovary morphology in women with polycystic ovary syndrome[J]. Biomed Res Int,2015,DOI:10.1155/2015/483726.
[10]NAGAI Y,MIYAZAWA H,HUQUN,et al.Genetic heterogeneity of the epidermal growth factor receptor in non-small cell lung cancer cell lines revealed by a rapid and sensitive detection system,the peptide nucleic acid-locked nucleic acid PCR clamp[J].Cancer Res,2005,65(16):7276-7282.
[11]ABD RAHIM MR,KHO S L,KUPPUSAMY U R,et al.Noninvasive dna sampling for molecular analysis of beta-thalassemia:amiable alternative sampling methods with accurate results for pediatric patients[J].Clin Lab,2015,61(9):1325-1330.
[12]ESPCW GROUP.Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome[J]. Human Reproduction,2004,19(1):19-25.
[13]BAI R K,WONG L J.Detection and quantification of heteroplasmic mutant mitochondrial DNA by real-time amplification refractory mutation system quantitative PCRanalysis:a single-step approach[J].Clin Chem,2004,50(6):996-1001.
[14]YOU X P,ZOU QL,LI J L,et al.Likelihood ratio test for excess homozygosity at marker loci on Xchromosome[J].PLoS One,2015,10:DOI:10.1371/journal.pone.0145032.
[15]WUNSCH A,SONNTAG B,SIMONI M.Polymorphism of the FSH receptor and ovarian response to FSH[J].Ann Endocrinol(Paris),2007,68(2-3):160-166.
[16]KEVENAAR ME,THEMMEN A P,RIVADENEIRA F,et al.A polymorphism in the AMH typeⅡreceptor gene is associated with age at menopause in interaction with parity[J].Hum Reprod,2007,22(9):2382-2388.
[17]GREB R R,GRIESHABER K,GROMOLL J,et al.A common single nucleotide polymorphism in exon 10 of the human follicle stimulating hormone receptor is a major determinant of length and hormonal dynamics of the menstrual cycle[J].J Clin Endocrinol Metab,2005,90(8):4866-4872.
[18]DE KONING C H,BENJAMINS T,HARMS P,et al.The distribution of FSH receptor isoforms is related to basal FSH levels in subfertile women with normal menstrual cycles[J].Hum Reprod,2006,21(2):443-446.
[19]HALUPCZOKJ,KLUBA-SZYSZKAA,BIDZINSKA-SPEICHERTB,etal.Ovarian hyperstimulation caused bygo nadotroph pituitary adenoma-review[J].Adv Clin Exp Med,2015, 24(4):695-703.
(张蕾编辑)
Association analysis of follicle-stimulating hormone receptor gene polymorphisms with polycystic ovarian syndrome
Ya Shen,Jia-yi Ding,Li Xu,Jun Shao,Hua Jin,Li Chen
(Department of Reproductive Center,Nantong Maternal and Child Health Hospital,Nantong,Jiangsu 226006,China)
Objective To investigate the relationship between polycystic ovary syndrome(PCOS)and Folliclestimulating hormone receptor.Methods Improved qPCR based SNP detection method was developed and used in genotyping of FSHR in PCOS.Validation was performed by Sanger sequencing.Results Results showed that it could be well genotyped by this qPCR based method,and all the results were consistent with Sanger sequencing.The distribution of the allele frequency and genotype frequency were significant differences between FSHR and PCOS,which indicated that the site of Thr307Ala and Asn680Ser might be closely related with PCOS.Conclusions It proves a novel method for SNP genotyping and the results denoted important foundation for SNP detection and PCOS investigation.
single nucleotide polymorphism genotype;allele specific polymerase chain reaction;quantitative polymerase chain reaction;polycystic ovarian syndrome;follicle-stimulating hormone receptor
R 588.6
A
10.3969/j.issn.1005-8982.2016.20.005
1005-8982(2016)20-0021-06
2016-01-06
丁家怡,E-mail:djy916@126.com;Tel:13806295506

