两株潜在益生菌安全性评价及其对凡纳滨对虾免疫力和抗WSSV能力影响❋
王晓琳, 马 甡, 单洪伟
(中国海洋大学海水养殖教育部重点实验室,山东 青岛 266003)
两株潜在益生菌安全性评价及其对凡纳滨对虾免疫力和抗WSSV能力影响❋
王晓琳, 马甡, 单洪伟❋❋
(中国海洋大学海水养殖教育部重点实验室,山东 青岛 266003)
本研究以2株潜在益生菌(芽孢杆菌(Bacillus. sp)BZ5株和溶藻弧菌(Vibrioalginolyticus)VZ5株)为研究对象。通过研究其溶血特性、常见抗生素的敏感性及感染菌体后凡纳滨对虾(Litopenaeusvannamei)的存活率,探讨了两菌株对凡纳滨对虾的安全性。注射和浸泡方式下,研究两菌株对凡纳滨虾的超氧化物歧化酶(SOD)、过氧化酶(POD)、抗菌酶活力变化的影响以及感染WSSV的凡纳滨对虾的存活率,探讨了两菌株对凡纳滨对虾免疫力和抗WSSV能力的影响。研究显示:芽孢杆菌BZ5株和溶藻弧菌VZ5株均未表现出溶血特征,且对多数常见抗生素敏感或中度敏感。在106cfu/mL浓度下,芽孢杆菌BZ5株和溶藻弧菌VZ5株未对凡纳滨对虾表现出明显的毒害作用。注射和浸泡方式下,芽孢杆菌组和溶藻弧菌组对虾的SOD、POD活力显著高于对照组(P<0.05),其中芽孢杆菌组对虾的SOD、POD活力显著高于溶藻弧菌组(P<0.05)。感染WSSV后,芽孢杆菌组和溶藻弧菌组对虾的半数致死时间比对照组分别延长了27.38%和21.43%(注射菌体)、24.73%和8.60%(浸泡菌体)。研究结果表明,芽孢杆菌BZ5株和溶藻弧菌VZ5株在提高对虾免疫力和抗WSSV能力方面具有较好的效果,在对虾养殖生产中有潜在的应用前景。
芽孢杆菌;溶藻弧菌;凡纳滨对虾;安全性评价;免疫力;抗WSSV能力
引用格式:王晓琳, 马甡, 单洪伟. 两株潜在益生菌安全性评价及其对凡纳滨对虾免疫力和抗WSSV能力影响[J]. 中国海洋大学学报(自然科学版), 2016, 46(10): 39-47.
WANG Xiao-Lin, MA Shen, SHAN Hong-Wei. Safety evaluation of two probiotics strains and their effects on the immunity and the ability of anti-WSSV ofLitopenaeusvannamei[J]. Periodical of Ocean University of China, 2016, 46(10): 39-47.
益生菌是一群当达到一定数量时能够对宿主产生积极影响的微生物[1]。目前,水产益生菌的种类主要包括光合细菌、乳酸菌(Lactobacilus. sp)、芽孢杆菌(Bacillus.sp)、硝化细菌等。其中,芽孢杆菌是一种公认的优良益生菌,因其具有促进养殖动物生长[2]、减少病害发生[3]、改善养殖环境[4-5]、提高养殖动物免疫力[6]等优点,在水产养殖中被广泛应用。此外,其他菌种也具有作为益生菌的潜能。溶藻弧菌(Vibrioalginolyticus)是海水中的常见菌,一些研究将其作为益生菌应用于水产养殖中,并取得了很好的效果[7]。
在前期工作中,我们分离得到了芽孢杆菌BZ5株和溶藻弧菌VZ5株2株潜在益生菌。研究发现,饲喂芽孢杆菌BZ5株能够有效提高对虾消化和抗WSSV能力,饲喂溶藻弧菌VZ5株能够更好的提高对虾免疫相关酶活力和抗WSSV能力[8]。此外,溶藻弧菌VZ5株还能够有效去除水体中的氨态氮和亚硝态氮[9]。
近年来,随着益生菌研究的不断发展,其所引发的安全性问题引起人们的广泛关注。益生菌通过被机体直接摄入而发挥作用,其在耐药性、感染能力等方面潜在的安全问题不容忽视[10]。目前,蜡状芽孢杆菌(B.cereus)、枯草芽孢杆菌(B.subtilis)、短乳杆菌(Lactobacillusbreris)、戊糖乳杆菌(L.pentosus)等一些从禽畜体内分离的益生菌株的安全性已有相关研究[11],但水产益生菌的安全性研究却很少。
本研究以芽孢杆菌BZ5株和溶藻弧菌VZ5株为研究对象,开展了两菌株的溶血活力、耐药性及对对虾的安全性研究,之后进一步研究了注射和浸泡2种方式下芽孢杆菌BZ5株和溶藻弧菌VZ5株对凡纳滨对虾免疫相关酶活力及抗WSSV能力的影响,旨在为两菌株在凡纳滨对虾养殖中应用的安全及功能提供参考,为对虾养殖中益生菌的开发及应用提供理论基础和技术支持。
1 材料与方法
1.1 实验材料
凡纳滨对虾(Litopenaeusvannamei)购于青岛市胶州市宝荣水产科技发展有限公司,体长为(7.0±0.5) cm。将对虾暂养于室内,水温(24±1) ℃,盐度30,持续充气,早晚各投喂1次,每天吸残饵粪便,换水1/5。暂养7 d后开始实验。
芽孢杆菌BZ5株和溶藻弧菌VZ5株由本研究室筛选于舟山市绿源水产养殖有限公司的凡纳滨对虾养殖池塘[12]。哈维氏弧菌2011053001由中国水产科学院黄海水产研究所海水养殖疾病控制与分子病理学实验室提供。
血琼脂培养基(BZW12005)购于南京便诊生物科技有限公司,抗菌药物药敏纸片(S1009)购于杭州微生物试剂有限公司。
注射感染实验和浸泡感染实验在水循环系统中进行,水族箱规格为50 cm×35 cm×35 cm,水体积大约为50 L。
WSSV病毒液WSSV病毒由中国海洋大学水产动物病害与免疫实验室提供。使用前,用配好的PBS缓冲液(136.9 mmol/L NaCl,2.7 mmol/L KCl,10.1 mmol/L Na2HPO4,1.8 mmol/L K2HPO4,pH =7.4)将WSSV病毒稀释1 000倍,备用。
1.2 实验设计
1.2.1 溶血实验将芽孢杆菌BZ5株和溶藻弧菌VZ5株培养24 h后点种于血琼脂培养基上,每种菌在同一个平板上点种3次(即3个重复),然后在37 ℃培养24 h后观察是否有溶血现象产生。以哈维氏弧菌2011053001作为阳性对照。
1.2.2 药敏实验采用抗菌药物药敏纸片琼脂扩散法进行实验。将芽孢杆菌BZ5株和溶藻弧菌VZ5株培养24 h后取 0.1 mL 菌液均匀涂布于LB固体培养基上,并贴上药敏纸片(20种抗生素),扩散 30 min 后,置于 30 ℃培养 24 h,培养结束后测量并记录待测菌株的抑菌圈直径。每种抗生素药物纸片做 4个重复。测试菌株对20种抗生素的药敏性参照CLSI 2011版本的标准进行。
1.2.3 注射感染实验实验分为4组,每组设4个平行,每个平行20尾虾。向对虾第四、五腹节分别注射50 μL生理盐水(生理盐水组)、50 μL(106cfu/mL)芽孢杆菌BZ5株活菌体(芽孢杆菌组)、50 μL(106cfu/mL)溶藻弧菌VZ5株活菌体(溶藻弧菌组)、50 μL(106cfu/mL)哈维氏弧菌2011053001株活菌体(哈维氏弧菌组),其中,生理盐水组和哈维氏弧菌组为对照组。
实验持续264 h。在实验前96 h,每隔12 h记录对虾死亡数量,评估注射菌体对对虾成活率的影响。在96 h时,向生理盐水组、芽孢杆菌组和溶藻弧菌组对虾注射50 μL WSSV病毒液,每隔12 h记录对虾死亡数量,评估注射菌体对对虾抗WSSV能力的影响。在整个实验过程中,分别在0、12、48、96、108、120、144和192 h取生理盐水组、芽孢杆菌组和溶藻弧菌组对虾血清,测定血清中SOD、POD和抗菌酶活力,评估注射菌体对对虾免疫相关酶活力的影响。
1.2.4 浸泡感染实验实验分为4个处理组,每组设4个平行,每个平行20尾虾。对照组:不添加菌液;芽孢杆菌组:向水体添加芽孢杆菌BZ5株菌体使水体中菌体密度维持在106cfu/mL;溶藻弧菌组:向水体添加溶藻弧菌VZ5株菌体使水体中菌体密度维持在106cfu/mL;哈维氏弧菌组:向水体添加哈维氏弧菌2011053001株菌体使水体中菌体密度维持在106cfu/mL。
实验持续23 d,在实验前16 d,记录对虾死亡数量,评估浸泡菌体对对虾成活率的影响。在16 d时,向生理盐水组、芽孢杆菌组和溶藻弧菌组对虾注射50 μL WSSV病毒液,每隔12 h记录对虾死亡数量评估浸泡菌体对对虾抗WSSV能力的影响。分别在0、1、2、4、8、16、17、18和20 d取生理盐水组、芽孢杆菌组和溶藻弧菌组的对虾血清,测定血清中SOD、POD和抗菌酶活力,评估浸泡菌体对对虾免疫相关酶活力的影响。
1.3 样品分析
1.3.1 血清采集采集血清前准备好抗凝剂(450 mmol/L NaCl,10 mmol/L KCl,10 mmol/L Na2-EDTA,10 mmol/L HEPES,pH=7.3)[13]。开始时将一次性注射器用抗凝剂润洗数次,然后按血清:抗凝剂=1∶1的比例从对虾靠近血窦的位置进行抽血,抽出的血清离心(5 000 r/min,10 min),取上清液保存于-80 ℃超低温冰箱中,待测。
1.3.2 相关酶活力测定SOD、POD均由南京建成生物有限公司购置的相关测定盒测定。抗菌酶活力采用改进的Hultmark等[14]的方法进行测定:将哈维氏弧菌用pH=6.4的1 mol/L磷酸钾盐缓冲液配成OD570 nm为0.4的菌液,移取3 mL菌液放入试管(放于冰水浴中)中,再向试管中加入50 μL待测血清,轻微震荡使液体混匀,立即放于570 nm波长下测其吸光值A1,再把试管放于37 ℃恒温水浴中30 min后立即取出放在冰水浴中停止反应,再于570 nm波长下测定吸光值A2。抗菌酶活力计算公式为[(A1-A2)/A2]1/2。
1.4 数据处理
实验数据用平均值±标准差(mean ± S.D.)表示,通过SPSS19.0软件对实验数据进行统计分析,采用单因子方差分析(One-way ANOVA) 和Duncan多重比较法进行差异显著性分析,取P<0.05 为差异显著。
2 结果与分析
2.1 溶血实验
菌株溶血实验结果如图1所示,哈维氏弧菌2011053001产生明显的溶血现象,而芽孢杆菌BZ5株和溶藻弧菌VZ5株没有明显的溶血现象,表明芽孢杆菌BZ5株和溶藻弧菌VZ5株不产生溶血素。
2.2 药敏实验
菌株药敏实验结果如表1所示,芽孢杆菌BZ5株对头孢氨苄、头孢唑啉、头孢拉定、头孢呋辛、头孢他啶、头孢曲松、头孢哌哃、丁胺卡那、苯唑西林、羧苄青霉素、四环素、多西林素、米诺环素、红霉素敏感,对青霉素G片、庆大霉素中度敏感;溶藻弧菌VZ5株对新霉素、红霉素、头孢呋辛、头孢他啶敏感,对头孢拉定、哌拉西林、头孢氨苄、头孢唑啉、头孢曲松、丁胺卡那、庆大霉素、卡那霉素中度敏感。
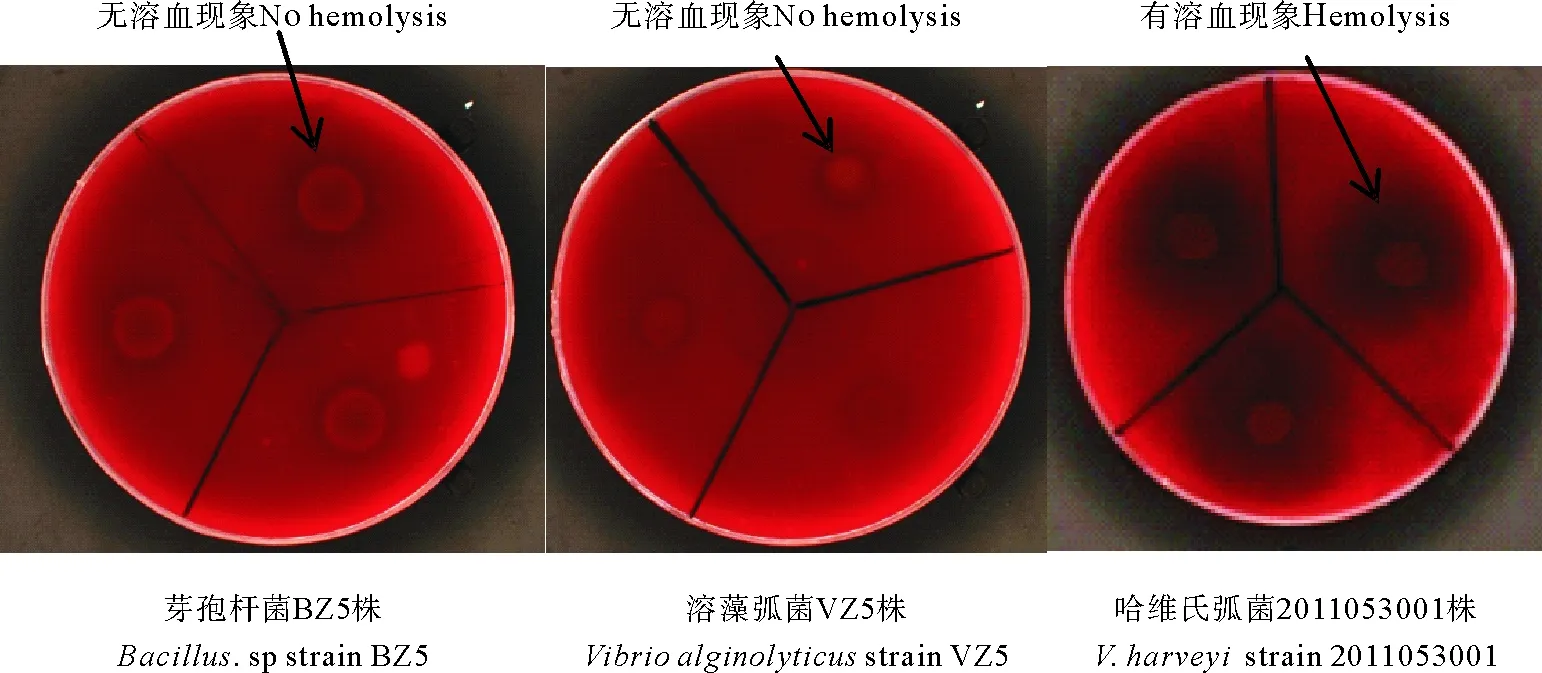
图1 不同菌株的溶血现象Fig.1 The hemolysis of the different bacteria strains表1 不同菌株的药敏实验结果Table 1 The results of the medicine sensitive of the different strains
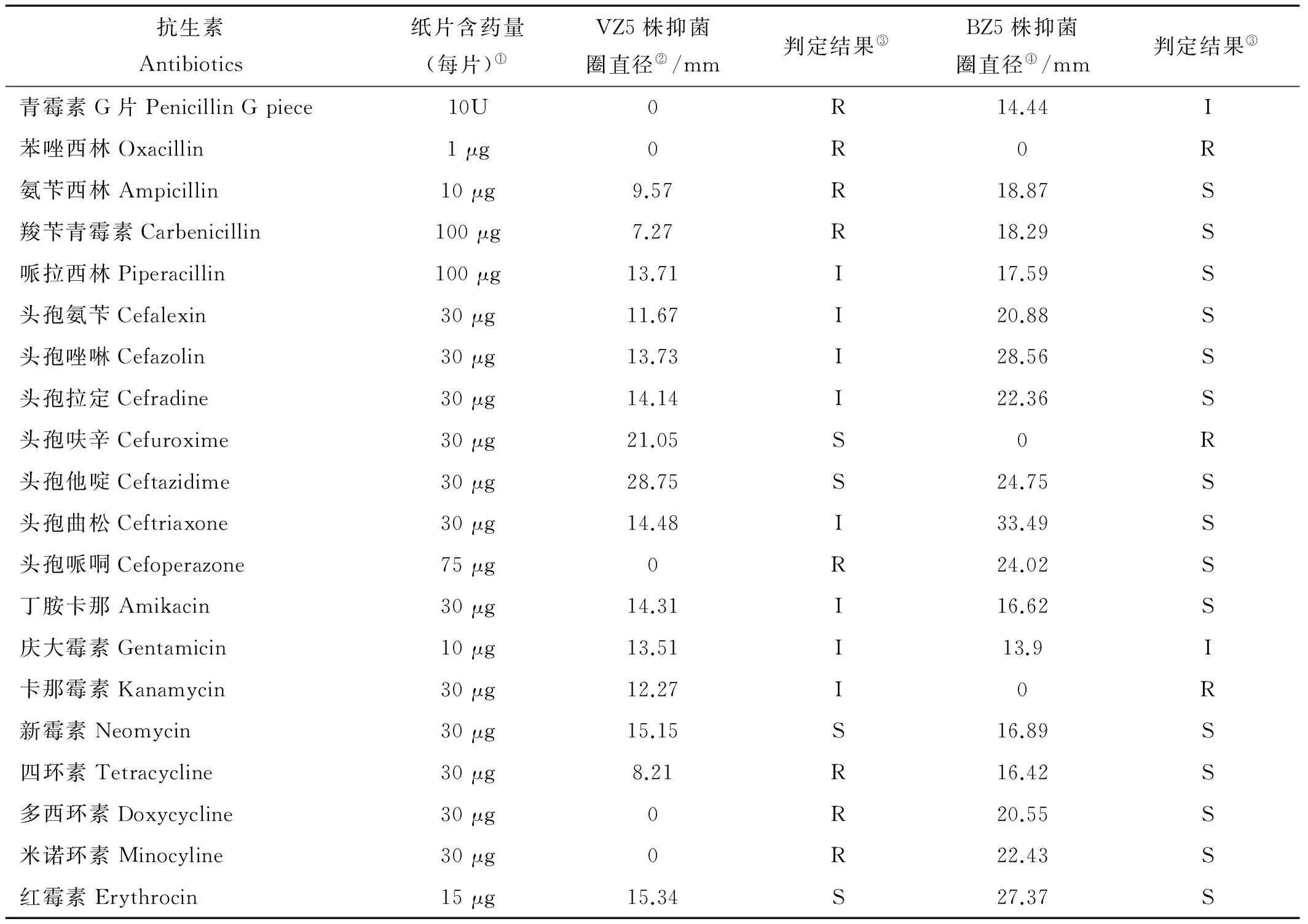
抗生素Antibiotics纸片含药量(每片)①VZ5株抑菌圈直径②/mm判定结果③BZ5株抑菌圈直径④/mm判定结果③青霉素G片PenicillinGpiece10U0R14.44I苯唑西林Oxacillin1μg0R0R氨苄西林Ampicillin10μg9.57R18.87S羧苄青霉素Carbenicillin100μg7.27R18.29S哌拉西林Piperacillin100μg13.71I17.59S头孢氨苄Cefalexin30μg11.67I20.88S头孢唑啉Cefazolin30μg13.73I28.56S头孢拉定Cefradine30μg14.14I22.36S头孢呋辛Cefuroxime30μg21.05S0R头孢他啶Ceftazidime30μg28.75S24.75S头孢曲松Ceftriaxone30μg14.48I33.49S头孢哌哃Cefoperazone75μg0R24.02S丁胺卡那Amikacin30μg14.31I16.62S庆大霉素Gentamicin10μg13.51I13.9I卡那霉素Kanamycin30μg12.27I0R新霉素Neomycin30μg15.15S16.89S四环素Tetracycline30μg8.21R16.42S多西环素Doxycycline30μg0R20.55S米诺环素Minocyline30μg0R22.43S红霉素Erythrocin15μg15.34S27.37S
注: R为耐药, I为中度敏感,S为敏感。
Note: R indicate resistant, I indicate intermediate, S indicate sensitive.
①Concentration(Piece);②Inhibition zone of VZ5;③Result;④ Inhibition zone of BZ5
2.3 感染实验
注射感染实验各组累计死亡率如表2所示,芽孢杆菌组和溶藻弧菌组与生理盐水组(阴性对照组)的对虾累计死亡率无显著性差异(P>0.05),2组对虾累计死亡率显著低于哈维氏弧菌组(阳性对照组)(P<0.05)。由此可见,向对虾体内注射106cfu/mL浓度的芽孢杆菌BZ5株和溶藻弧菌VZ5株菌体对对虾未显示明显毒害作用。
浸泡感染实验各组累计死亡率如表3所示,芽孢杆菌组和溶藻弧菌组死亡率与对照组无显著性差异(P>0.05),且显著低于哈维氏弧菌组(阳性对照组)(P<0.05)。由此可见,水体中芽孢杆菌BZ5株和溶藻弧菌VZ5株浓度达到106cfu/mL时对对虾无明显毒害作用。
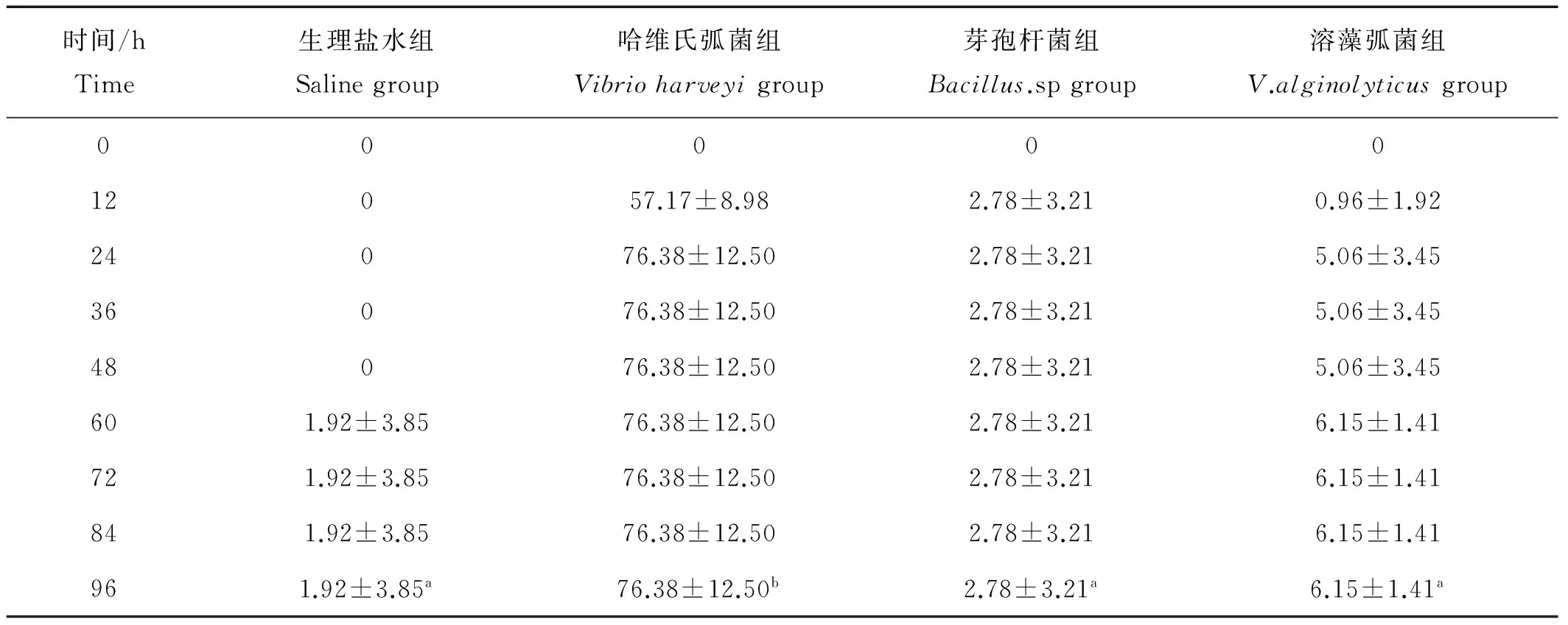
表2 注射感染实验中凡纳滨对虾的累计死亡率(Mean±S.D.)Table 2 The cumulative mortality rate of L. vannamei in injection test /%
注:最后一行不同上标字母为差异显著(P<0.05)。
Note: Different superscripts indicate significant difference in the last line (P<0.05).
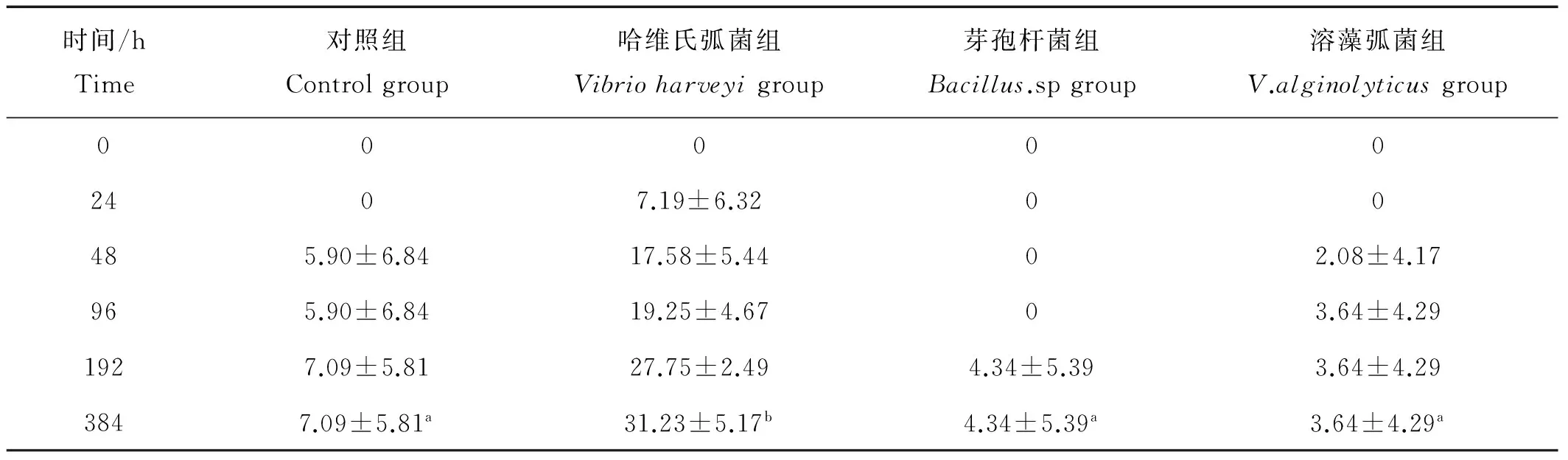
表3 浸泡感染实验中凡纳滨对虾的累计死亡率(mean±S.D.)Table 3 The cumulative mortality of L. vannamei in immersing tes /%
注:最后一行不同上标字母为差异显著(P<0.05)。
Note: Different superscripts indicate significant difference in the last line (P<0.05).
2.4 注射感染方式下两菌株对凡纳滨对虾免疫相关酶活力、抗WSSV能力的影响
各组对虾SOD活力变化如图2所示,整个实验过程中芽孢杆菌组和溶藻弧菌组凡纳滨对虾的SOD活力处于较高水平,显著高于对照组(P<0.05)。对照组对虾SOD活力处于较低水平,感染WSSV后略有上升。前96 h,芽孢杆菌组SOD活力最大值比对照组提高131.06%,感染WSSV后,芽孢杆菌组SOD活力略有下降,但仍高于其他二组。溶藻弧菌组SOD活力变化趋势与芽孢杆菌组相同,但是SOD活力水平总体上低于芽孢杆菌组。实验表明,注射芽孢杆菌BZ5株和溶藻弧菌VZ5株可显著提高凡纳滨对虾SOD活力,其中芽孢杆菌BZ5株的效果优于溶藻弧菌VZ5株。
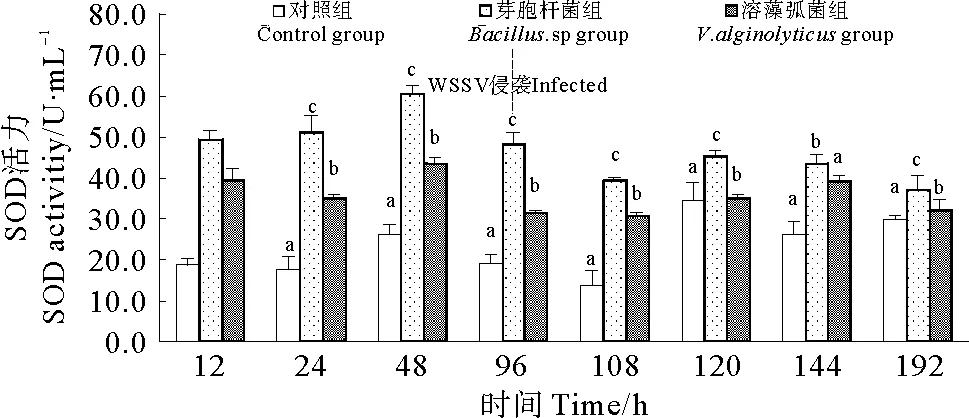
(不同字母代表差异显著(P<0.05), 下图同。Different letters indicate significant difference (P<0.05).The same case in the following figures.)
图2注射不同菌株对虾SOD活力变化
Fig.2The variation of SOD activity ofL.vannameiinjected by different strains
各组对虾POD活力变化如图3所示,整个过程中芽孢杆菌组和溶藻弧菌组凡纳滨对虾的POD活力显著高于对照组(P<0.05)。在前96 h,芽孢杆菌组和溶藻弧菌组对虾POD活力最大值分别比对照组提高95.35%和21.77%。在感染WSSV后,各组POD活力均下降。实验表明,注射芽孢杆菌BZ5株和溶藻弧菌VZ5株可显著提高凡纳滨对虾POD活力,整体上讲,芽孢杆菌BZ5株效果显著高于溶藻弧菌VZ5株。
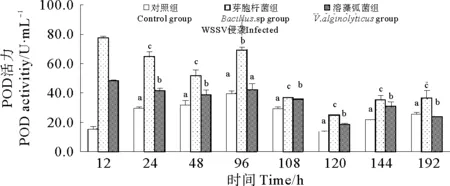
图3 注射不同菌株对虾POD活力变化Fig.3 The variation of POD activity of L. vannameiinjected by different strains
各组对虾抗菌酶活力如图4所示,前96 h,芽孢杆菌组和溶藻弧菌组凡纳滨对虾的抗菌酶活力显著性高于对照组(P<0.05),但两组之间无显著性差异(P>0.05)。感染WSSV后,芽孢杆菌组和溶藻弧菌组凡纳滨对虾的抗菌酶活力下降,与对照组差异不显著。
感染WSSV后各组对虾累计死亡率如图5所示,各组半数致死时间LT50:对照组84 h,溶藻弧菌组102 h,芽孢杆菌组107 h。芽孢杆菌组和溶藻弧菌组半数致死时间分别比对照组延长了27.38%和21.43%。在120 h时对照组累计死亡率达到100%,而芽孢杆菌组为66.67%,溶藻弧菌组为78.79%。结果表明,注射芽孢杆菌BZ5株和溶藻弧菌VZ5株可以增强凡纳滨对虾抗WSSV能力,降低死亡率,其中,芽孢杆菌BZ5株效果更加明显。
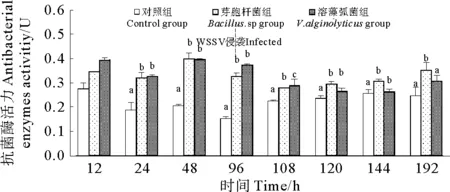
图4 注射不同菌株对虾抗菌酶活力变化Fig.4 The variation of antibacterial enzymes activity ofL. vannamei injected by different strains
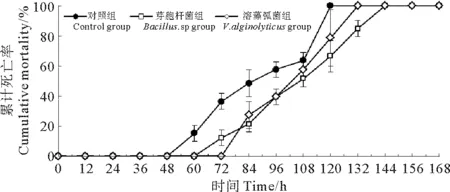
图5 注射方式下感染WSSV对虾的累计死亡率Fig.5 Cumulative mortality of L. vannameiinfected with WSSV in injection test
2.5 浸泡方式下两菌株对凡纳滨对虾免疫相关酶活力、抗WSSV能力的影响
各组对虾SOD活力如图6所示,芽孢杆菌组和溶藻弧菌组对虾的SOD活力显著高于对照组(P<0.05),在前期,芽孢杆菌提高对虾SOD活力效果更加明显。感染WSSV后,芽孢杆菌组和溶藻弧菌组对虾SOD活力差异不显著,但是仍然显著高于对照组(P<0.05)。实验表明,水体中添加芽孢杆菌BZ5株和溶藻弧菌VZ5株能够显著提高凡纳滨对虾SOD活力。
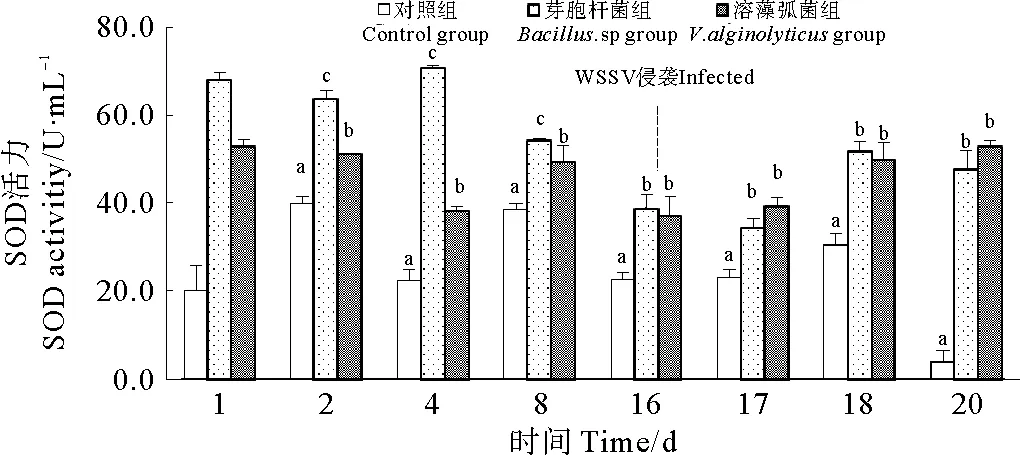
图6 浸泡不同菌株对虾SOD活力变化Fig.6 The variation of SOD activity of L. vannameiimmersed by different strains
各组对虾POD活力如图7所示,芽孢杆菌组和溶藻弧菌组对虾的POD活力显著高于对照组(P<0.05),但2组之间差异不显著(P>0.05)。实验表明,水体中添加芽孢杆菌BZ5株和溶藻弧菌VZ5株能够显著提高凡纳滨对虾POD活力。
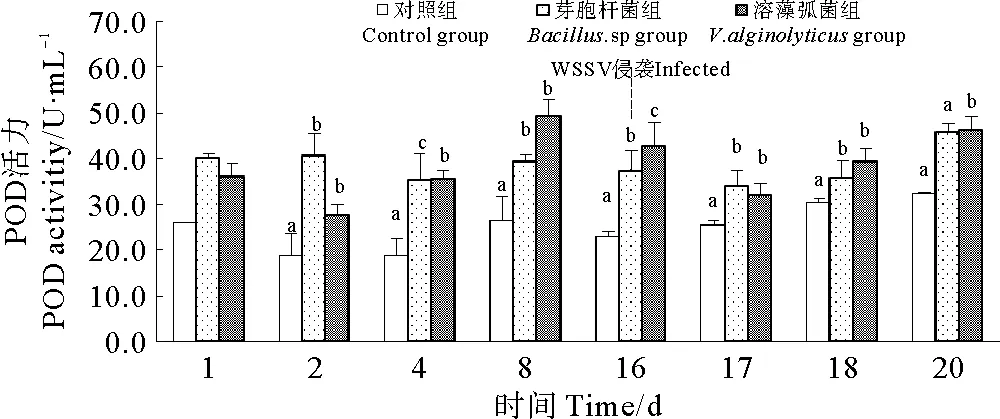
图7 浸泡不同菌株对虾POD活力变化Fig.7 The variation of POD activity of L. vannameiimmersed by different strains
各组对虾抗菌酶活力如图8所示,芽孢杆菌组和溶藻弧菌组的抗菌酶活力显著高于对照组(P<0.05)。在前期,芽孢杆菌组和溶藻弧菌组对虾的抗菌酶活力差异不显著(P>0.05)。感染WSSV后,芽孢杆菌组抗菌酶活力显著高于溶藻弧菌组(P<0.05)。实验表明,水体中添加芽孢杆菌BZ5株和溶藻弧菌VZ5株能够显著提高凡纳滨对虾的抗菌酶活力,且芽孢杆菌BZ5株的效果更好。
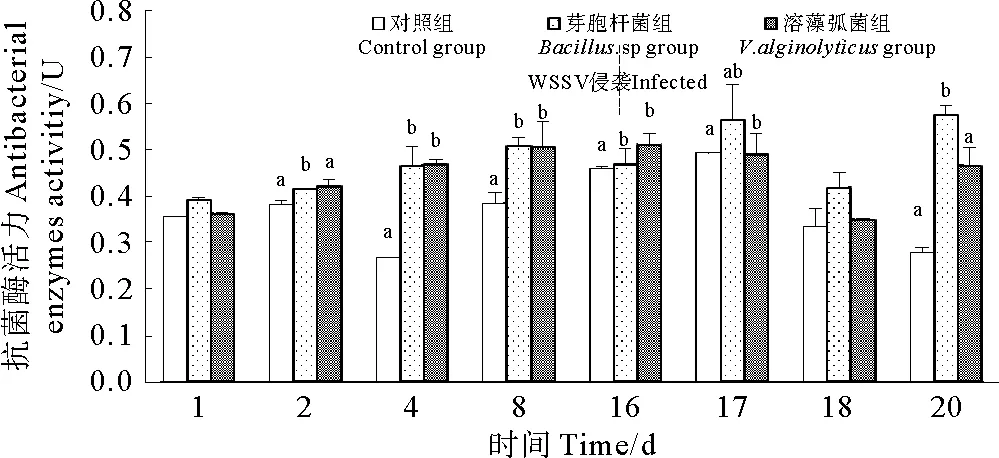
图8 浸泡不同菌株对虾抗菌酶活力变化Fig.8 The variation of antibacterial enzymes activity ofL. vannamei immersed by different strains
感染WSSV后各组对虾累计死亡率如图9所示,各组半数致死时间LT50:对照组93 h,溶藻弧菌组101 h,芽孢杆菌组116 h。芽孢杆菌组和溶藻弧菌组半数致死时间分别比对照组延长了24.73%和8.60%。结果表明,浸泡芽孢杆菌BZ5株和溶藻弧菌VZ5株可以提高凡纳滨对虾抗WSSV能力,其中,芽孢杆菌BZ5株效果更好。
3 讨论
芽孢杆菌作为水产益生菌已被人们广泛接受并应用,溶藻弧菌作为水产益生菌的相关报道较少。一些学者研究结果表明,溶藻弧菌能够感染对虾,是对虾养殖过程中的条件致病菌[15]。然而,溶藻弧菌作为益生菌应用于对虾苗种生产能够有效提高对虾幼体的抗病力[16]。本研究结果表明,溶藻弧菌VZ5株为非毒力菌株,对凡纳滨对虾不具备致病性,是一株潜在的水产益生菌。溶藻弧菌具有很强的遗传多样性,即使来自相同生物的溶藻弧菌菌株也具有明显的差异性[17-18]。因此,不同溶藻弧菌菌株明显的基因差异可能导致不同菌株的毒力差异,从而形成毒力菌株和非毒力菌株[19]。
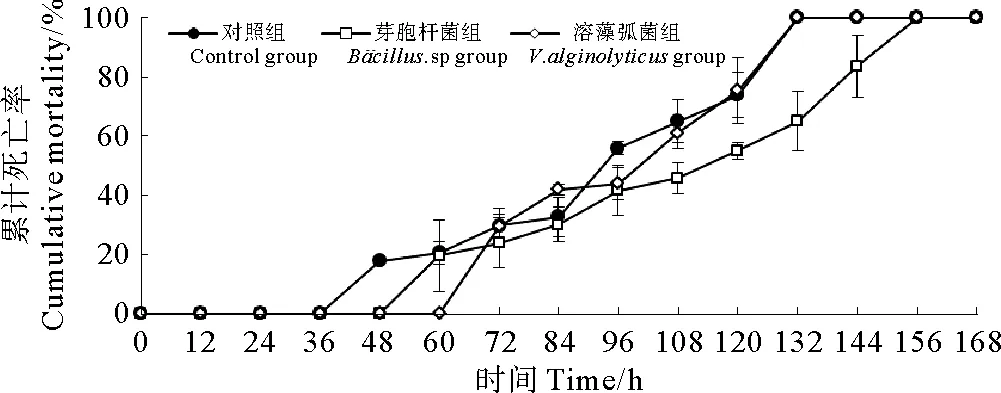
图9 浸泡方式下感染WSSV的凡纳滨对虾的累计死亡率Fig.9 Cumulative mortalityof L. vannameiinfected with WSSV in immersion test
溶血实验是体外安全性评价的一个重要方面,益生菌的溶血性被认为是体外安全性评价的指标之一[20]。Zheng等实验表明,有些芽孢杆菌菌株广泛含有溶血素和肠毒素基因等毒素基因,对养殖动物甚至对人类有潜在的致病性[21]。本研究中,芽孢杆菌BZ5株和溶藻弧菌VZ5株都未表现出溶血特征,说明这2株菌株不产生溶血素,对红细胞无潜在的致病性,可以作为潜在的益生菌进行进一步的安全性评估。
为了使所筛选的益生菌在环境中使用安全,所筛选的菌株应该对大部分抗生素敏感,从而避免其在环境中无限制生长。目前,很多学者主要采用纸片扩散法来评价益生菌对广谱抗生素的耐药性。本实验采用纸片扩散法测试了芽孢杆菌BZ5株和溶藻弧菌VZ5株对20种常见抗生素的耐药性,发现两菌株对大部分抗生素敏感或者中度敏感,因此可以在对虾养殖中使用。
小规模浸泡实验是评价潜在益生菌株对养殖动物安全性的良好方式[22]。胡修贵[23]通过向凡纳滨对虾虾体注射菌液的方式证明巨大芽孢杆菌等3株菌株在107cfu/mL浓度下时对凡纳滨对虾无显著毒害作用,安健等[24]通过向健康小鼠和草鱼注射菌液的方式评价了解淀粉芽孢杆菌对小鼠和草鱼的安全性。本研究中的注射感染实验和浸泡感染实验的结果表明,106cfu/mL浓度的芽孢杆菌BZ5株和溶藻弧菌VZ5株对凡纳滨对虾无明显的毒害作用,进而进一步确定这2株菌株在凡纳滨对虾养殖中使用的安全。
对虾血清中SOD、POD及抗菌酶在对虾防御反应中起到重要作用,可以清除多余的氧自由基,从而防止细胞损伤、延缓细胞衰亡,是反映对虾免疫能力的重要指标[25]。本实验中,无论是体内注射还是水体中添加,芽孢杆菌BZ5株和溶藻弧菌VZ5株都可以不同程度地提高凡纳滨对虾的SOD、POD及抗菌酶的活力,表明两菌株的使用能够有效提高对虾的免疫水平。一般认为,益生菌进入水产动物肠道后,其表面抗原或代谢物充当免疫原不断刺激动物的免疫防御系统,同时其通过与致病菌争夺营养和附着位点,保护机体免受侵染,从而增强机体的非特异性免疫和抗病力[26]。注射方式下,菌体进入对虾机体,刺激对虾免疫防御系统,从而增强了机体的非特异性免疫。浸泡方式下,菌体有可能从环境进入肠道,定殖,从而起到保护机体,增强机体非特异性免疫的效果。本研究中,芽孢杆菌BZ5株的效果更好,可能是由于其分泌的物质能够更有效的刺激对虾非特异性免疫系统,从而更有效的提高对虾的免疫水平。具体的作用机制还有待于进一步的研究。
各组凡纳滨对虾的半致死时间为芽孢杆菌组>溶藻弧菌组>对照组,说明芽孢杆菌BZ5株与溶藻弧菌VZ5株能够提高对虾的抗WSSV能力,这与已有类似研究结果相似, 胡毅等[27]和刘君等[28]等分别证实应用芽孢杆菌能够提高对虾非特异免疫功能和抗WSSV感染能力。本研究中芽孢杆菌BZ5株对感染WSSV的凡纳滨对虾的免疫保护作用优于溶藻弧菌VZ5株。综合两菌株对凡纳滨对虾免疫相关酶活力的影响,推测可能是芽孢杆菌BZ5株能够更有效刺激凡纳滨对虾非特异免疫系统,从而增强了凡纳滨对虾抵御WSSV的能力。
4 结语
本研究结果表明,芽孢杆菌BZ5株与溶藻弧菌VZ5株对凡纳滨对虾不具备致病性,可应用于凡纳滨对虾养殖生产中。注射和浸泡方式下,芽孢杆菌BZ5株和溶藻弧菌VZ5株能够有效提高凡纳滨对虾的SOD、POD、抗菌酶活力和抗WSSV能力,其中芽孢杆菌BZ5株效果更好。由于溶藻弧菌是条件致病菌,加之自然界中细菌的变异以及菌株之间的基因转移普遍存在,因此,溶藻弧菌VZ5株在使用时应严格控制添加量和使用周期,或者以灭活的形式使用。
致谢:感谢中国水产科学院黄海水产研究所海水养殖疾病控制与分子病理学实验室以及中国海洋大学水产动物病害与免疫实验室为本研究所提供的病原菌株和WSSV。
[1]FAO/WHO working group. Report of a joint FAO/WHO expert consultation on evaluation of health and nutritional properties of probiotics in food including powder milk with live lactic acid bacteria[R]. Córdoba, Argentina: FAO/WHO, 2001.
[2]刘波, 刘文斌, 王恬. 地衣芽孢杆菌对异育银鲫消化机能和生长的影响[J]. 南京农业大学学报, 2005, 28(4): 80-84.
Liu B, Liu W B, Wang T. Effects ofBacilluslicheniformison digestive performance and growth OfAllogynogeneticcrucian[J]. Journal of Nanjing Agricultural University, 2005, 28(4): 80-84.
[3]Gupta A, Gupta P, Dhawan A. Dietary supplementation of probiotics affects growth, immune response and disease resistance ofCyprinuscarpiofry[J]. Fish & Shellfish Immunology, 2014, 41: 113-119.
[4]Devaraja T N, Yusoff F M, Shariff M. Changes in bacterial populations and shrimp production in ponds treated with commercial microbial products[J]. Aquaculture, 2002, 206(3/4): 245-256.
[5]叶乐, 杨莺莺, 吴开畅, 等. 益生菌在凡纳滨对虾育苗中的应用[J].南方水产, 2006, 2(4): 13-18.
Ye L, Yang Y Y, Wu K C, et al. Effect of probiotics on breeding ofLitopeuaeusvannamei[J]. South China Fisheries Science, 2006, 2(4): 13-18.
[6]Li K, Zhang T, Tian Y, et al. Beneficial effects ofBacilluslicheniformison the intestinal microflora and immunity of the white shrimp,Litopenaeusvannamei[J]. Biotechnology letters, 2007, 29(4): 525-530.
[7]Austin B, Stuckey L F, Robertson P A W, et al. A probiotic strain ofVibrioalginolyticuseffective in reducing diseases caused byAeromonassalmonicida,VibrioanguillarumandVibrioordalii[J]. Journal of Fish Diseases, 1995, 18(1): 93-96.
[8]许玉洁, 单洪伟, 马甡. 芽孢杆菌和溶藻弧菌对凡纳滨对虾消化酶、免疫相关酶活力及抗病力的影响[J]. 中国海洋大学学报(自然科学版), 2015, 45(5): 46-53.
Xu Y J, Shan H W, Ma S. Effects ofBacillussp. andVibrioalginolyticuson the activities of digestive and immune enzymes disease resistance ofLitopenaeusvannamei[J]. Periodical of Ocean University of China, 2015, 45(5): 46-53.
[9]单洪伟, 高磊, 马甡, 等. 不同C∶N条件下一株溶藻弧菌对不同种类氮源的吸收特性[J]. 中国水产科学, 2013, 20(5): 1066-1075.
Shan H W, Gao L, Ma S, et al. Nitrogen source assimilation of aVibrioalginolyticusstrain under different C/N ratios[J]. Journal of Fishery Sciences of China, 2013, 20(5): 1066-1075.
[10]郭晓奎, 袁杰利. 益生菌安全性的现状与对策[J]. 中国微生态学杂志, 2009, 21(6): 576-577.
Guo X K, Yuan J L. Current situation and counterm easures on the safety of probiotic[J]. Chinese Journal of Microecolog, 2009, 21(6): 576-577.
[11]刘淑英, 孟军, 汪勇沛, 等. 动物微生态制剂菌种的毒性试验[J]. 上海畜牧兽医通讯, 2009(2): 2-3.
Liu S Y, Meng J, Wang Y P, et al. Toxicity test of probiotics strains for animal[J]. Shanghai Journal of Animal Husbandry and Veterinary Medicine, 2009(2): 2-3.
[12]高磊. 碳氮比调节在对虾养殖中的作用及优化[D]. 青岛: 中国海洋大学, 2012.
Gao L. The Effection and Optimization of Adjusting C/N Ratio in the Shrimp Culture System[D]. Qingdao: Ocean university of China, 2012.
[13]Vargas-Albores F, Guzman M A, Ochoa J L. An anticoagulant solution for haemolymph collection and prophenoloxidase studies of penaeid shrimp (Penaeuscaliforniensis)[J]. Comparative Biochemistry and Physiology Part A: Physiology, 1993, 106(2): 299-303.
[14]Hultmark D, Steiner H, Rasmuson T, et al. Insect immunity: purification and properties of three inducible bactericidal proteins from hemolymph of immunized pupae ofHyalopheracecropia[J]. Eur Biochen, 1980, 10(6): 7-16.
[15]Lee K K, Yu S R, Chen F R, et al. Virulence ofVibrioalginolyticusisolated from diseased tiger prawnPenaeusmonodon[J]. Current Microbiol, 1996, 32(4): 229-231.
[16]Gomez-Gil B, Roque A, Velasco-Blanco B. Culture ofVibrioalginolyticusC7b, a potential probiotic bacterium, with the microalgaChaetocerosmuelleri[J]. Aquaculture, 2002, 211: 43-48.
[17]Ripabelli G, Sammarco M L, McLauchlin J, et al. Molecular characterisation and antimicrobial resistance ofVibriovulnificusandVibrioalginolyticusisolated from mussels (Mytilusgalloprovincialis)[J]. Systematic and Applied Microbiology, 2003, 26(1): 119-126.
[18]George M R, John K R, Iyappan T, et al. Genetic heterogeneity amongVibrioalginolyticusisolated from shrimp farms by PCR fingerprinting[J]. Letters in Applied Microbiology, 2005, 40(5): 369-372.
[19]欧阳吉隆, 周永灿, 吴学贵, 等. 海南地区溶藻弧菌遗传多样性的RAPD分析[J]. 海洋科学, 2011, 35(7): 30-36.
Ou-Yang J L, Zhou Y C, Wu X G, et al. RAPD analysis of genetic diversity ofVibrioalginolyticusisolated from Hainan province[J]. Marine Sciences, 2011, 35(7): 30-36.
[20]Baumgartner A, Kueffer M, Simmen A, et al. Relat-edness ofLactobacillusrhamnosusstrains isolated from clinical specimens and such from food-stuffs, humans and technology[J]. LWT-Food Science and Technology, 1998, 31: 489-494.
[21]Zheng W D, Cao H P, Yang X L. Grass carp (Ctenopharyngodonidellus) infected with multiple strains ofAeromonashydrophila[J]. African J Micro Res, 2012, 6(21): 4512-4520.
[22]Verschuere L, Rombaut G, Sorgeloos P, et al. Probiotic bacteria as biological control agents in aquaculture[J]. Microbiology and Molecular Biology Reviews, 2000, 64(4): 655-671.
[23]胡修贵. 生物絮团中细菌的分离鉴定及其特性研究[D]. 青岛: 中国海洋大学, 2013.
Hu X G. Isolation and Identification of Bacteria from Bio-Floc and Their Characteristics Analysis[D]. Qingdao: Ocean University of China, 2013.
[24]安健, 曹海鹏, 陈百尧, 等. 解淀粉芽胞杆菌的安全性分析[J]. 动物医学进展, 2013(1): 16-19.
An J, Cao H P, Chen B Y, et al. Safety analysis ofBacillusamyloliquefaciens[J]. Progress in Veterinary Medicine, 2013(1): 16-19.
[25]Parrilla-Taylor D P, Zenteno-Savín T, Magallón-Barajas F J. Antioxidant enzyme activity in pacific white leg shrimp (Litopenaeusvannamei) in response to infection with white spot syndrome virus[J]. Aquaculture, 2013, 380-383: 41-46.
[26]Rengpipat S, Rukpratanporn S, Piyatiratitivorakul S, et al. Immunity enhancement on black tiger shrimp (Penaeusmonodon) by a probiont bacterium (BacillusS11)[J]. Aquaculture, 2000, 191: 271-288.
[27]胡毅, 谭北平, 麦康森, 等. 饲料中益生菌对凡纳滨对虾生长、肠道菌群及部分免疫指标的影响[J]. 中国水产科学, 2008, 15(2): 244-251.
Hu Y, Tan B P, Mai K S, et al. Effects of dietary probiotic on growth,immunity and intestinal bacteria of juvenileLitopenaeusvannamei[J]. Journal of Fishery Sciences of China, 2008, 15(2): 244-251.
[28]刘君, 宋晓玲, 刘莉, 等. 2株消化道优势菌对凡纳滨对虾免疫酶活性和抗白斑综合征病毒感染力的影响[J].水产学报, 2012, 36(3): 444-450.
Liu J, Song X L, Liu L, et al. Effects of digestive tract probiotics on immune enzyme activity and anti-WSSV ability ofLitopenaeusvannamei[J]. Journal of Fisheries of China, 2012, 36(3): 444-450.
责任编辑朱宝象
Safety Evaluation of two Probiotics Strains and Their Effects on the Immunity and the Ability of Anti-WSSV ofLitopenaeusVannamei
WANG Xiao-Lin, MA Shen, SHAN Hong-Wei
(The Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003, China)
Probiotics are widely used in aquaculture due to their excellent performance in promoting the growth and immunity of cultured aquatic animals, decreasing epidemic disease infection, and improving the culture environment. With the extension of their applications, safety problems aroused wide attentions. The purpose of this study was to evaluate the safety ofBacillussp. BZ5 andV.alginolyticusVZ5 and reveale their effects on the immune-related enzyme activity and the ability of anti-WSSV ofL.vannamei. This study included hemolysis, drug sensitivity, injection and immersion tests. In hemolysis test, strain BZ5 and VZ5 were cultured in Luria-Bertan medium with a salinity of 30 for 24 h, and then inoculated in blond agar for observation of hemolysis. In drug sensitivity test, a sensitive degree of strain BZ5 and VZ5 to 20 kinds of common antibiotics were recorded. In injection test, strain BZ5 and VZ5 (50 μL, 106cfu/mL) were injected to shrimp muscle. In immersion test, shrimp were immersed in culture environment containing 106cfu/mL of BZ5 and VZ5. The WSSV was injected to the shrimp muscle at the 4thof injection test and the 16thof immersion test. Cumulative mortality and immune-related enzyme activity of shrimp were recorded during the injection test and immersion test. Strain BZ5 and VZ5 did not cause a hemolysis phenomenon, and were sensitive or moderately sensitive to most of the common antibiotics. BZ5 and VZ5 did not show toxic effect onL.vannameiat 106cfu/mL (invivoinjection and immersion in bacterium solution). In some studies,Vibrioalginolyticuswas reported as a pathogen of shrimp. This may be related to the genetic diversity ofV.alginolyticusstrains resulting in greatly different virulence. The activity of SOD, POD of shrimp inBacillusSp. group andV.alginolyticusgroup were significantly higher than those of the control (P<0.05), and those in theBacillusSp. group were significantly higher than those inV.alginolyticusgroup (P<0.05). The strain BZ5 showed better performance because its metabolites could more efficiently stimulate the non-specific immune system of shrimp. Ininvivoinjection test, the median lethal time (LT50) of shrimp inBacillussp. group andV.alginolyticusgroup was extended by 27.38% and 21.43%, respectively compared with the control. In immersed test, the median lethal time (LT50) of shrimp inBacillussp. group andV.alginolyticusgroup were extended by 24.73% and 8.60%, respectively compared with the control. In conclusion, the results indicated that strain BZ5 and VZ5 were safe when used in shrimp culture, and have potential application in improving the immunity and ability of anti-WSSV ofL.vannamei. It is noted thatVibrioalginolyticuswas a kind of conditional pathogen, and the variation of bacteria and the gene transfer between strains were widespread. Therefore, the application amount of strain VZ5 should be strictly controlled or used in inactivation form.
Bacillus. sp;Vibrioalginolyticus;Litopenaeusvannamei; safety evaluation; immunity; ability of anti-WSSV
山东省自然科学基金项目(ZR2014CP005);公益性行业(农业)科研专项项目(201103034)资助
2015-10-03;
2016-01-18
王晓琳(1988-),女,硕士生,主要从事水产益生菌的相关研究。E-mail: wangxiaolin1225@126.com
❋❋通讯作者:E-mail: shanhongwei@ouc.edu.cn
S968.22
A
1672-5174(2016)10-039-09
10.16441/j.cnki.hdxb.20150344
Supported by Shandong Provincial Natural Science Foundation(ZR2014CP005); Special Fund for Agroscientific Research in the Public Interest (201103034)

