64Cu-ATSM乏氧分子影像探针及其荷人乳腺癌小动物PET/ CT显像的初步研究
孙 筠,李自立,许晓平,何思敏,薛杨波,程竞仪,章英剑
1. 上海市质子重离子医院核医学科,上海 201321;
2. 复旦大学附属肿瘤医院核医学科,复旦大学上海医学院肿瘤学系,上海 200032
64Cu-ATSM乏氧分子影像探针及其荷人乳腺癌小动物PET/ CT显像的初步研究
孙 筠1,2,李自立1,2,许晓平1,2,何思敏1,2,薛杨波1,2,程竞仪1,2,章英剑1,2
1. 上海市质子重离子医院核医学科,上海 201321;
2. 复旦大学附属肿瘤医院核医学科,复旦大学上海医学院肿瘤学系,上海 200032
目的:64Cu有半衰期较长、化学反应温和的优势,本研究合成新型乏氧分子影像学探针64Cu-ATSM,并与18F-氟硝基咪唑(18F-fluoromisonidazole,18F-FMISO)进行初步比较。方法:使用SIEMENS Eclipse HP 11 MeV小型医用回旋加速器系统,Comecer ALCEO EDL、PRF、TADDEO放射性模块和定制铂金靶盘进行64Ni电镀、64Cu纯化和64Cu-ATSM合成。用伽马能谱仪和高效液相色谱(high performance liquid chromatography,HPLC)进行放射核纯度、放化纯度和稳定性检测。在荷人乳腺癌MDB-MA-231模型中进行小动物PET/CT显像并与自制的18F-FMISO进行比较。结果:实现了64Cu-ATSM的自动化生产,产率60%,放射性核纯度>99%,放化纯度>95%,标记物稳定性>6 h。与18F-FMISO一样能反映肿瘤乏氧情况,且注射1 h后T/M值即能达5.28。结论:成功用11 MeV SIEMENS回旋加速器和Comecer ALCEO模块合成了64Cu-ATSM,荷人乳腺癌小动物PET/CT乏氧显像靶/本比高。
64Cu-ATSM;18F-氟硝基咪唑;乏氧显像;乳腺癌
64Cu (T1/2=12.7 h,β+= 653 keV [17.8%]),β+衰变产生湮灭辐射后生成的一对511 keV光子可用于正电子发射断层成像(positron emission tomography, PET)[1],其正电子射程4.7 mm,影像分辨率和放射防护需求类似18F。64Cu外层轨道上电子的排布(3p63d9)决定了其易与含N、S、O等原子的配体形成较为稳定的配合物[2]。与18F分子影像学探针标记反应相比,64Cu与螯合物的反应一般在水相中完成,不需高温加热,且反应迅速。64Cu半衰期达12.7 h,可支持更远的运输距离。因此,64Cu标记的分子影像学探针目前受到越来越多的关注[3-5]。
肿瘤乏氧是放疗抵抗的重要原因,已成为正确实施个体化放疗的生物靶点之一[6]。乏氧是实体肿瘤生长过快和血管结构异常的共同结果,是肿瘤进展、局部控制失败及细胞存活和转移因子激活的重要因素。分析肿瘤细胞乏氧对肿瘤的活性诊断、疗效分析及预后评价具有重要意义[7]。本研究报道使用SIEMENS小型医用回旋加速器系统、Comecer ALCEO放射性模块和定制铂金靶盘进行64Cu-diacetyl-bis(N4-methylthiosemicarbazone)(ATSM)合成及其在荷人乳腺癌小动物PET/CT乏氧显像中与18F-氟硝基咪唑(18F-fluoromisonidazole,18FFMISO)对照的初步结果。
1 资料和方法
1.1仪器和试剂
1.1.1仪器设备
采用SIEMENS Eclipse HP 11 MeV小型回旋加速器及其固体靶系统和为该加速器设计定制的铂金靶盘;Comecer ALCEO 固体靶系统:EDL电化学/溶解/转移/沉积模块、PRF电化学纯化模块、TADDEO放射性药物合成模块;AMETEK GEMC5060P4伽马能谱仪;AGILENT HPLC 1260,配有四元梯度泵、可变波长检测器、流式γ放射性检测器(Gabi Star,德国RAYTEST公司)、Poroshell 120 EC-C18分析柱(4.6 mm×50 mm,2.7 μm)、真空脱气机和ChemStation色谱控制和分析软件;Millipore超纯水制备系统;SIEMENS Inveon小动物PET/CT。上述仪器设备均为本科室拥有。
1.1.2试剂
64Ni (99.9%)购于深圳爱索特国际同位素有限公司;H2-ATSM购于ABX公司;氯化铵(≥99.999 5%)购于FLUKA公司;AG 1-X8树脂,氯型,300~1 200 μm,购于BIO-RAD公司;28%氢氧化铵(≥99.999 5%)购于SIGMA-ALDRICH公司;无水乙醇[高效液相色谱(high performance liquid chromatography,HPLC)级]购于ALADDIN公司;60%硝酸(超纯)购于MERK公司;37%盐酸(trace medal,99.999%)购于OURCHEM公司;浓硝酸(≥90%)购于SIGMA-ALDRICH公司。
1.2肿瘤模型制备
BALB/c雌性裸鼠,4~6周龄,体重20~25 g,购于复旦大学上海医学院实验动物部,于此饲养至实验开始。雌激素受体(estrogen receptor,ER)阴性人乳腺癌MDB-MA-231细胞在DMEM培养基中,于37oC、5% CO2细胞培养箱中常规培养,在细胞对数生长期传代培养。用磷酸缓冲液(phosphate buffered saline,PBS)洗涤细胞,0.25%胰酶消化,离心(1 000 r/min,5 min),DMEM培养基吹打混匀,流式细胞仪计数调整细胞密度,准备接种。在每只BALB/c雌性裸鼠右腋下皮下注射5×106个细胞,饲养于独立通风笼(individual ventilated cage,IVC)中3周,每2 d用游标卡尺测量肿瘤长径,待肿瘤长径长至0.8~1.0 cm时用于显像。
1.3实验方法
1.3.164Cu的制备和纯化
64Ni用60%硝酸加热溶解后,氢氧化铵调pH值,使用Comecer ALCEO EDL电化学/溶解/转移/沉积模块,通过电沉积方法将64Ni层镀于铂金靶盘中央表面。
基于64Ni (p,n)64Cu反应,以富集64Ni为靶材,通过SIEMENS Eclipse HP回旋加速器,以能量11 MeV、束流强度30 μA的质子轰击64Ni 30 min。轰击结束后,冷却1 h,将靶盘固定于Comecer ALCEO EDL电化学/溶解/转移/沉积模块,经Comecer ADDEO PRF电化学纯化模块,分别用6、4 、0.5 mol/L盐酸溶解靶层,再用AG 1-X8树脂进行64Cu分离纯化,制备64CuCl2。
1.3.264Cu-ATSM的合成
64Cu-ATSM的合成路线见图1。将分离纯化后得到的64CuCl2溶液转移至合成模块的反应器中,真空条件下120 ℃蒸发至干。向反应器中加入1.5 mL 1 mol/L CH3COONa,同时向反应器中加入200 μL二甲基亚砜 (dimethyl sulfoxide,DMSO)溶解的20 μg前体H2-ATSM,鼓泡2 min。将反应完全的溶液转移至乙醇/水处理过的C-18柱,用10 mL无菌注射用水清洗C-18柱,去除没完全反应的H2-ATSM,然后用0.7 mL药用无水乙醇冲洗C-18柱,并过0.22 μm无菌滤膜,再用生理盐水稀释得到注射用64Cu-ATSM。
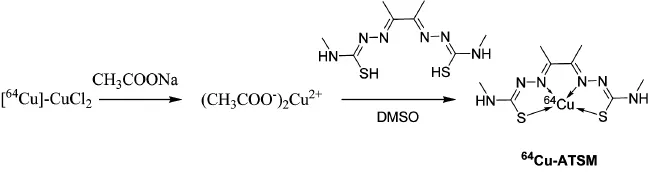
图1 64Cu-ATSM合成路线
1.3.364Cu-ATSM质量分析
用伽马能谱仪分析核纯度,用分析型Radio-HPLC检测放化纯度和稳定性。HPLC流动相是0.05 mol/L CH3CN/NaH2PO4(1∶1,V/V),pH=3,流速为1 mL/min,分析柱为Poroshell 120 EC-C18柱,采用276 nm UV检测器和放射性检测器。HPLC连续上样,检测64Cu-ATSM 6 h内的放化纯度,检验其稳定性。同时,目测其外观颜色和澄清度,利用精密pH试纸测pH值。
1.3.464Cu-ATSM乏氧成像
取3只荷人乳腺癌MDB-MA-231裸鼠,分别自尾静脉注射64Cu-ATSM (约550 μCi),于注射后1、2、3 h在异氟烷(异氟烷/氧气,1.5%/98.5%,V/V)麻醉状态下进行,同时行小动物PET/CT扫描,3D模式采集10 min静态图像。有序子集最大期望值算法(ordered subsets expectation maximization,OSEM) 3D/MAP法重建,并行衰减校正,获得荷瘤裸鼠体内64Cu-ATSM分布融合图像。在肿瘤部位和对侧肌肉勾画感兴趣区(region of interest,ROI),工作软件自动产生对应的最大标准摄取值(maximum standardized uptake value,SUVmax),然后计算肿瘤/肌肉(tumor/muscle,T/M)吸收比值。
在注射64Cu-ATSM 后第4天,3只荷瘤裸鼠注射18F-FMISO (制备方法见文献[8])进行小动物PET/ CT扫描成像异比较。
2 结 果
本研究实现了SIEMENS Eclipse HP 11 MeV小型回旋加速器固体靶系统和Comecer ALCEO EDL、PRF和TADDEO放射性模块的衔接,并为此设计定制了铂金靶盘,实现了使用11 MeV质子轰击生产64Cu,在64Cu制备过程中实现了电镀、溶解、纯化和放射性药物合成的自动化。
其中,通过电沉积方法成功将60 μg64Ni镀于铂金靶盘中央表面,置于回旋加速器靶托,以30 μA、11 MeV质子轰击30 min后,溶解靶盘上含64Cu的64Ni固体层,纯化得到小动物研究用的3.06 mCi64CuCl2。
64Cu的放射性核纯度(图2)仅见1 346 keV的β+特征峰及其湮灭辐射后产生的511 keV γ峰,与文献报道一致[9],可确认产物为64Cu,且无明显放射性杂质(图3)。
根据图1的合成路线,合成出1.83 mCi64Cu-ATSM,产率为60%。Radio-HPLC分析结果提示放化纯度>95% (图3),且在6 h内保持稳定。其注射液为澄清液体,pH=6。
人乳腺癌MDB-MA-231移植瘤成像结果(图4)显示,64Cu-ATSM、18F-FMISO均可显示癌灶乏氧情况,肉眼判断效果相似(图4)。半定量计算结果显示,注射后1、3 h,T/M值分别为5.28、1.88和4.48、3.69,提示64Cu-ATSM可成像时间较早,随时间延长,18F-FMISO与其差距缩小。
3 讨 论
目前已发现的64Cu制备方法有3种:① 通过热中子捕获反应63Cu (n,γ)64Cu获得,但比活度低;② 通过快中子反应64Zn (n, p)64Cu获得,比活度高,但需进入反应堆快中子通量阱,而这在大多数反应堆设备中难以实现;③ 通过本研究所述64Ni (p, n)64Cu核反应。目前大多数研究在15MeV及以上的医用回旋加速器中生产64Cu[10-11]。本研究证明,在低至11 MeV的常规医用回旋加速器中也可生产出高纯度的64Cu。
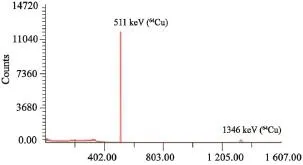
图2 纯化后的CuCl2伽马能谱
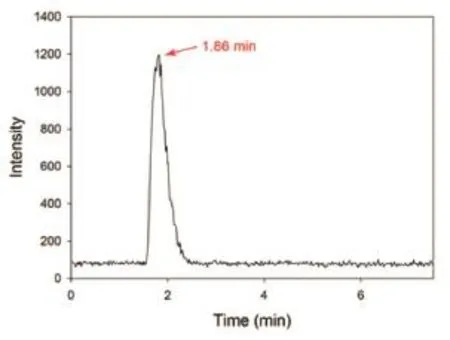
图3 64Cu-ATSM HPLC图谱
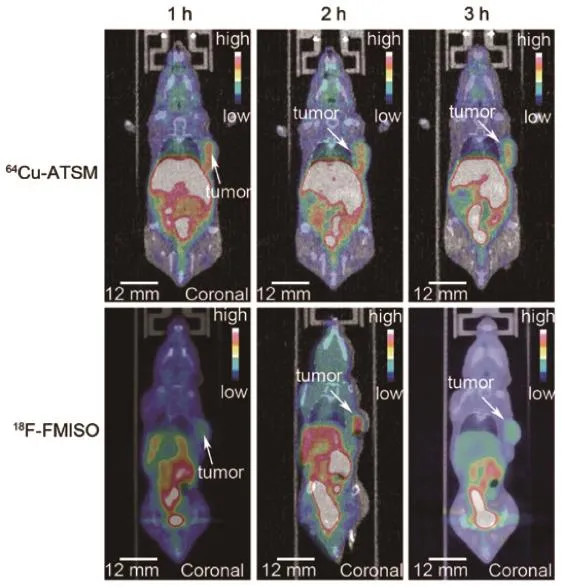
图4 64Cu-ATSM与18F-FMISO microPET/CT乏氧显像比较
本研究使用11 MeV质子轰击30 min,束流强度30 μA,产出3.06 mCi64CuCl2,产量为0.204 mCi/μA·h,远低于12 MeV、50 μA轰击的产量0.6~3 mCi/μA·h[12],提示质子轰击时间、能量和束流强度是影响产量的重要因素。质子通过非线性方式释放能量,增加64Ni厚度,更充分地吸收质子能量可进一步提高产量。国内文献[10]报道,用37~70 μA束流强度、15 MeV质子打靶生产大剂量64Cu时需轰击 2.5~10h。综合考虑以上因素,下一步将调整电镀质量、提高束流强度、延长轰击时间以生产临床所需64CuCl2产量。
本研究发现,64Cu-ATSM T/M值在注射后1 h达5.28,高于18F-FMISO,这种差异可能是由于肌肉组织中64Cu-ATSM摄取较少。分子影像学探针在靶区的快速集聚有利于提高检查通量,本研究小动物乏氧影像初步结果提示优于文献[11]报道的64Cu BMS181321,最佳显像时间可望缩短至1 h,有助于缩短患者乏氧成像的等待时间。
本研究在国际上首次实现了SIEMENS Eclipse HP 11 MeV小型回旋加速器固体靶系统和Comecer ALCEO EDL、PRF、TADDEO放射性固体靶药物模块的衔接,定制的铂金靶盘可很好地用于64Ni电镀,实现了64Cu制备过程中电化学、溶解、纯化和放射性药物合成的自动化。实验性生产的64CuCl2具有极高的放射核纯度。64Cu-ATSM产率为60%,放化纯度高,可显示荷人乳腺癌MDBMA-231肿瘤的乏氧情况,肉眼判断效果与18FFMISO相似,且1 h的T/M值显著高于18F-FMISO,有助于缩短患者乏氧成像的等待时间。
[1] ANDERSON C J, FERDANI R. Copper-64 radiopharmaceuticals for PET imaging of cancer: advances in preclinical and clinical research [J]. Cancer Biother Radiopharm, 2009, 24(4): 379-393.
[2] 马磊, 刘宇, 柴之芳.64Cu放射性药物化学 [J]. 化学进展, 2012, 24(9): 1720-1728.
[3] WU N, KANG C S, SIN I, et al. Promising bifunctional chelators for copper 64-PET imaging: practical64Cu radiolabeling and high in vitro and in vitro complex stability [J]. J Biol Inorg Chem, 2016, 21(2): 177-184.
[4] KANG C S, WU N, CHEN Y, et al. Transferrin conjugates of triazacyclononane-based bifunctional NE3TA chelates for PET imaging: Synthesis, Cu-64 radiolabeling, and in vitro and in vivo evaluation [J]. J Inorg Biochem, 2016, 154: 60-66.
[5] NEDROW J R, LATOCHE J D, DAY K E, et al. Targeting PSMA with a Cu-64 labeled phosphoramidate inhibitor for PET/CT imaging of variant PSMA-expressing xenografts in mouse models of prostate cancer[J]. Mol Imaging Biol, 2016, 18(3): 402-410.
[6] VORDERMARK D, HORSMAN M R. Hypoxia as a biomarker and for personalized radiation oncology [J]. Recent Results Cancer Res, 2016, 198: 123-142.
[7] 程竞仪, 耿道颖, 章英剑. 肿瘤乏氧和乏氧分子影像进展 [J]. 肿瘤影像学, 2014, 23(3): 172-177.
[8] 王明伟, 张勇平, 郑宇佳, 等.18F-FMISO的自动化合成改进及其肿瘤乏氧Micro-PET/CT显像 [J]. 核技术,2013, 36(10): 38-43.
[9] KIM J Y, PARK H, LEE J C, et al. A simple Cu-64 production and its application of Cu-64 ATSM [J]. Appl Radiat Isot, 2009, 67(7-8): 1190-1194.
[10] 陈玉清, 梁积新, 李光, 等. 阴离子交换法从辐照后的Ni靶中分离64Cu [J]. 同位素, 2012, 25(3): 144-148.
[11] 罗政, 朱华, 林新峰, 等. 新型核素64Cu标记硝基咪唑类肿瘤乏氧显像剂及正电子发射断层扫描显像研究 [J].高等学校化学学报, 2015, 36(1): 87-92.
[12] OBATA A, KASAMATSU S, MCCARTHY D W, et al. Production of therapeutic quantities of64Cu using a 12 MeV cyclotron [J]. Nucl Med Biol, 2003, 30(5): 535.
Preliminary research of preparation of64Cu-ATSM and its small animal scanning
SUN Yun1,2, LI Zili1,2, XUXiaoping1,2, HE Simin1,2, XUE Yangbo1,2, CHENG Jingyi1,2, ZHANG Yingjian1,2 (1. Department of Nuclear Medicine,Shanghai Proton and Heavy Ion Center, Shanghai 201321, China; 2. Department of Nuclear Medicine, Fudan University Shanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032,China)
Correspondence to: CHENG Jingyi E-mail: jingyi.cheng@sphic.org.cn
Objective: To investigate the synthesis and application of64Cu-ATSM in hypoxia imaging of xenografted MDBMA-231 breast cancer. Methods:64CuCl2was prepared by SIEMENS Eclipse HP 11 MeV cyclotron, Comecer ALCEO EDL, PRF and TADDEO pharmaceutical modules, and the modified platinum target plate. And then the prepared64CuCl2and synthesized64Cu-ATSM were monitored by energy spectroscopy and high performance liquid chromatography (HPLC) for detection of radioactive purity, radiochemical purity and stability.64Cu-ATSM was intravenously injected into MDB-MA-231 cells xenografted nude mouse and then imaged by microPET/CT. The results were compared with that of18F-fluoromisonidazole (18F-FMISO) injected 4 d after64Cu-ATSM imaging. Results: The automatic production of64Cu-ATSM with a productivity of 60% without radioactive and radiochemical impurity was achieved.64Cu-ATSM was stable at 6 h after synthesis. Both64Cu-ATSM and18F-FMISO could demonstrate the hypoxic degree of MDB-MA-231 cell xenografted tumor. And the tumor/muscle (T/M) ratio of64Cu-ATSM was 5.28, which was significantly higher than that of18F-FMISO (1.88). Nevertheless, three hours after injection, the T/M ratios of the two probes were similar. Conclusion: The synthesized64Cu-ATSM could image the hypoxic condition of MDB-MA-231 xenografted tumor.
64Cu-ATSM;18F-fluoromisonidazole; Hypoxia; Breast cancer
R445.5
A
1008-617X(2016)03-0267-05
国家自然科学基金青年基金(No:21501029、21401025);上海市科委项目(No:15ZR1438600、14DZ2251400)
程竞仪 E-mail:jingyi.cheng@sphic.org.cn
(2016-08-22
2016-09-07)

