解淀粉芽孢杆菌LJ02抑菌气体分析
郝象瑢,卢志军,王婧,李娟,王远宏,通信作者
解淀粉芽孢杆菌LJ02抑菌气体分析
郝象瑢1,卢志军2,王婧1,李娟1,王远宏1,通信作者
(1. 天津农学院园艺园林学院,天津300384;2. 北京市植物保护站,北京100029)
利用气相色谱-质谱联用(GC-MS)探讨解淀粉芽孢杆菌()LJ02菌株在LB固体培养中产生挥发性气体的种类,并以5种病原真菌为指示菌,用平板对扣法和分格平板法检测LJ02菌株产生的挥发性气体的抑菌活性,确定对黑腐皮壳菌()抑制作用的有效气体成分。结果表明:解淀粉芽孢杆菌LJ02产生的挥发性气体对多种果类致病菌,特别是对黑腐皮壳菌()、草莓灰霉病菌()、枣浆胞病菌(spp.)有显著抑制效果,抑菌率在50%以上。LJ02菌株在代谢过程中可产生多种挥发性气体,其中4-乙基苯酚、2-丙基环己酮2种气体对黑腐皮壳菌()有强烈的抑制效果。
解淀粉芽孢杆菌;挥发性气体;气质联用
生物防治因其具有专一性强、不易产生抗药性、无毒、无污染等优点,成为重要的病害防治手段。目前用于病害防治的生防菌主要包括直接筛选的真菌、细菌以及通过自然突变或诱发突变的无致病力菌株。解淀粉芽孢杆菌作为重要的生防细菌资源已被广泛应用于果树病害和水果采后病害的防治。如解淀粉芽孢杆菌X-23能有效控制梨果腐烂菌[1];解淀粉芽孢杆菌TS-1203可以抑制苹果腐烂病[2]。微生物在生长代谢过程产生的挥发性气体(volatile organic compounds,VOCs)也是重要的生防因子[3]。Fernando等人最先报道了假单孢属()的14种细菌VOCs的生防能力,其中包括苯并噻唑、环己醇、正癸、二甲基三硫、2-乙基-1-己醇和壬醛等物质,这些气体可以抑制真菌菌丝的生长和孢子的萌发[4];解淀粉芽孢杆菌PPCB004菌株也能够产生抑制青霉菌的羟基丁酮气体[5]及防治多种采后病害、维护果实品质的甲基环丙烯气体[6];解淀粉芽孢杆菌NJN-6菌株产生的11种VOCs可以完全抑制香蕉枯萎病菌菌丝的生长和孢子的萌发[7]。
20世纪80年代中期,国外学者将拮抗菌用于水果采后保鲜的半商业化试验。利用微生物产生的抗生素、细菌素、溶菌酶、蛋白酶、过氧化氢和有机酸等次级代谢产物抑制或杀死果蔬中的病原菌;或通过拮抗菌与病原微生物争夺竞争位点,来阻止水果储存期间中VC、糖含量以及SOD活力的下降[8]。研究表明,VOCs还可用于水果保鲜,目前广泛应用于生产的VOCs多数为植物精油提取物,如肉桂精油[9]、丁香提取物[10]等。
本文对本实验室于2008年从黄瓜根际土壤中分离出的一株解淀粉芽孢杆菌——LJ02菌株进行研究,通过试验验证LJ02菌株代谢产生的VOCs对病原真菌的抑制作用、VOCs的组成成分及其各组分的抑菌能力,以期为开发生物农药、水果生物保鲜剂提供参考。
1 材料与方法
1.1 供试菌株
水果腐烂病原真菌:黑腐皮壳菌(、草莓灰霉()、枣浆胞病(spp.)、枣黑点病菌()、草莓根腐病菌()均保存于天津农学院植物病理实验室。
1.2 供试材料
PDA培养基:用于真菌培养及抑菌活性检测;LB培养基:用于解淀粉芽孢杆菌LJ02的培养与保存;11种VOCs标品(均能很好的溶于乙醇)购于上海梯希爱化成工业发展有限公司。
1.3 LJ02菌株产VOCs的抑菌活性评价
抑菌活性测定采用平板对扣法[11]。在PDA培养基中接入各类病原菌饼(Φ=5 mm),取100 μL LJ02发酵液均匀涂布于LB平板,将其倒扣于病菌培养皿上,并用透明胶带密封,置于26 ℃培养5 d,十字法测量病原菌菌落直径,计算解淀粉芽孢杆菌TJ02挥发性气体对病原真菌的抑菌率。以不接LJ02的LB平板为对照。
抑菌率=(对照菌落直径-处理菌落直径)/对照菌落直径×100%
1.4 气质联用(GC-MS)分析LJ02菌株VOCs成分
将SPME萃取头(50/30 μm,DVB/CAR/ POMS,美国Supelco公司)在40 ℃下平衡15 min后,插入顶空萃取瓶中,拔出纤维头,使其置于样品瓶顶空部位的中间部位。吸附40 min后,收回纤维头,将萃取头立即插入GC色谱仪的进样口中,在250 ℃下解吸附5 min后,进行GC-MS分析。
气质联用仪型号:Agilent 7890A/5975C。用HP-5MS型毛细管柱(30.0 m×0.25 mm×0.25 μm)分离VOCs,进样口温度:250 ℃,载气:氮气。柱流速1.2 mL/min;进样量:1 µL,不分流进样。升温程序:40 ℃维持3 min,再以3 ℃/min的速率升温至160 ℃保持2 min,再以8 ℃/min升至220 ℃,保持3 min。
质谱条件:离子源温度230 ℃,四极杆温度150 ℃;电子轰击EI源,电子能量70 eV,全扫描质谱范围(m/z)为:20~420 u(atomic mass unit,原子质量单位)。数据分析与处理采用计算机自动谱库NIST08自动检索,将对照组检测到的峰图进行扣除,对气体成分进行分析。
1.5 LJ02菌株产生的VOCs抑菌机制
1.5.1 LJ02菌株产生的VOCs主要成分抑菌检测
对LJ02菌株产生的VOCs进行分析,选择11种气体标品(正辛烷、苯乙烯、2-戊基呋喃、3,5,5-三甲基乙酸己酯、6-甲基-2-庚酮、2-丙基环己酮、癸醚、4-乙基苯酚、二丁基羟基甲苯、2-戊基噻吩、甲苯)进行抑菌活性测定。具体操作如下:在PDA平板中央接种黑腐皮壳菌饼(Φ=5 mm),距离菌饼15 mm处放置灭菌硬币(1角),其上有灭菌滤纸片(Φ=8 mm),在滤纸片上加入50 μL气体标品(标品浓度),对照组取50 μL乙醇。在26 ℃条件中培养5 d后,测量菌落的直径,判定这11种气体对黑腐皮壳菌是否有抑制作用,计算抑菌率。
1.5.2 主要抑菌气体的作用浓度检测
采用分格平板法检测。分格培养皿左侧铺满PDA培养基,中央接种黑腐皮壳菌菌饼(Φ= 5 mm),右侧放置灭菌的滤纸片,将对黑腐皮壳菌有明显抑制作用的2种气体标品,设置不同梯度各取50 μL加到滤纸片上。其中,4-乙基苯酚的浓度梯度为1.3、2.5、5.0、7.5、10.0 mg/mL;2-乙基环己酮浓度梯度为1、200、400、600、800 μL/mL;对照组加入50 μL乙醇。放置于24 ℃下培养,3 d后测量病原菌的直径,计算抑制率。
1.5.3 人工混合抑菌气体的作用浓度检测
将有抑制作用的2种挥发性气体按照GC-MS测定出来的峰面积比,进行人工合成混合性抑菌气体(4-乙基苯酚∶2-乙基环己酮=1∶32)。在二分格培养皿的左侧铺满PDA 培养基,中央接种黑腐皮壳菌菌饼(Φ=5 mm),右侧放置灭菌的滤纸片,分别加入50 μL混合性挥发性物质,体积浓度梯度分别为0、50、100、150、200、250、300 μL/mL,放置在26 ℃下培养观察。3 d后测量菌落的直径,计算抑制率。
2 结果与分析
2.1 LJ02菌株产生VOCs抑菌能力检测结果
LJ02菌株产生VOCs对5种病原真菌均有抑制效果,对黑腐皮壳菌、草莓灰霉病菌、枣浆胞病抑制效果显著,抑菌率在50%以上(表1)。

表1 LJ02产生VOCs对病原真菌的抑制作用
2.2 GC-MS对LJ02菌株产生VOCs的鉴定
由LJ02菌株产生VOCs的总离子流图(图1)表明,该菌株可产生34种挥发性物质(峰面积>1),主要有:苯类、烷类、烯类、呋喃类、醇类、酸类、酮类、酯类等。从每一类物质中选取可能具有抑制作用的11种气体进行后续抑菌能力检测,这11种气体种类及出峰时间如下:甲苯(2.998 min)、正辛烷(4.586 min)、苯乙烯(8.741 min)、2-戊基呋喃(12.719 min)、6-甲基-2-庚酮(11.352 min)、2-乙基环己酮(16.663 min)、4-乙基苯酚(17.562 min)、乙酸-3,5,5-三甲基己酯(18.496 min)、癸醚(23.651 min)、2-戊基噻吩(25.839 min)、二丁基羟基甲苯(27.728 min)。
2.3 各种挥发性气体的抑菌活性
通过对上述11种挥发性成分的抑菌效果测定,发现正辛烷、苯乙烯、2-戊基呋喃、3,5,5-三甲基乙酸己酯、6-甲基-2-庚酮、癸醚、2-戊基噻吩、二丁基羟基甲苯和甲苯9种气体均不能有效抑制黑腐皮壳菌(的生长;4-乙基苯酚、2-丙基环己酮2种气体对黑腐皮壳菌(有强烈的抑制效果,其对黑腐皮壳菌的抑菌活性如表2和表3所示。由表2可知,4-乙基苯酚用量为10 mg时,抑菌率可达92.58%。由表3可知,当滴加100 μL 800 μL/mL的2-丙基环己酮时,抑菌率可达94.39%。

表2 4-乙基苯酚对黑腐皮壳菌的抑制作用
注:不同字母代表差异显著(<0.05),下同
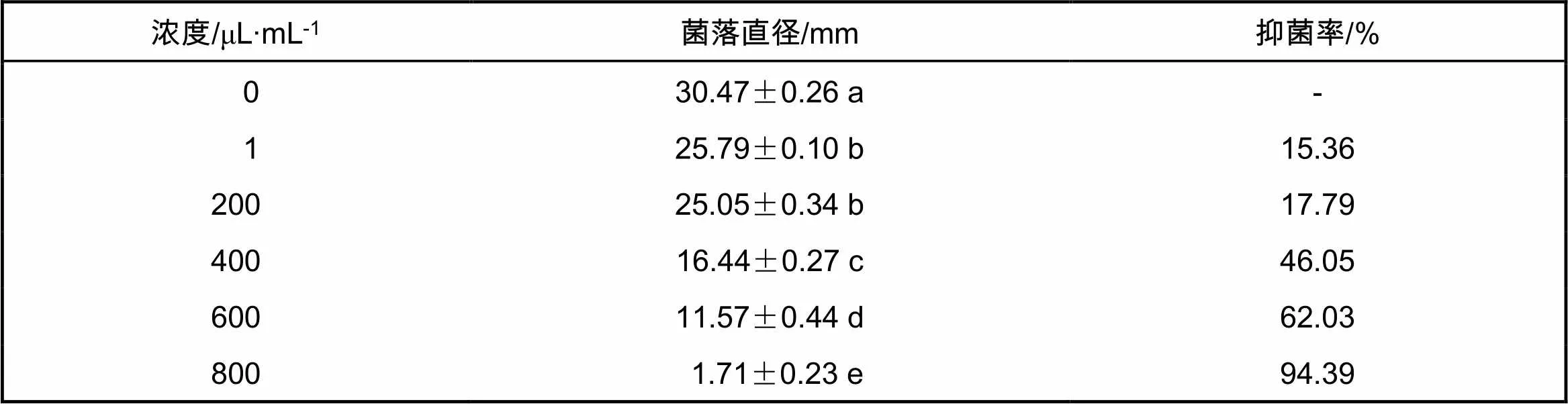
表3 2-丙基环己酮对黑腐皮壳菌的抑制作用
2.4 人工合成的混合挥发性物质的抑菌活性
黑腐皮壳菌正常生长时,菌丝细长,透明,节点明显。当有抑菌物质产生作用时,菌丝弯曲,浅棕色,节点模糊,节间距离增长(图2)。将4-乙基苯酚、2-丙基环己酮2种物质按照GC-MS测定的峰面积比例(1:32)混合,用不同浓度处理黑腐皮壳菌,26 ℃培养3 d,结果如表4所示。当浓度为450 μL/mL时,能完全抑制黑腐皮壳菌菌丝的生长。

图2 混合气体对黑腐皮壳菌菌丝的抑制
(注:左图为对照组,右图为处理组)
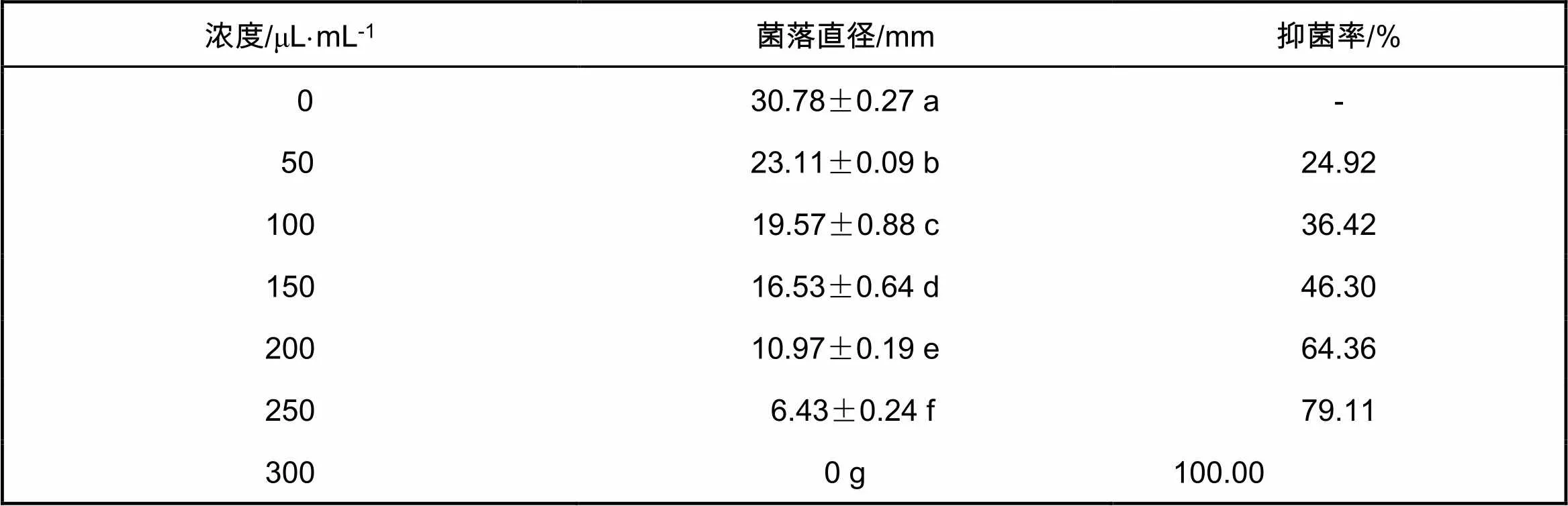
表4 人工合成的挥发性气体对黑腐皮壳菌的抑制作用
3 讨论
随着收集方法、检测手段的完善以及物质结构研究水平的提高,芽孢杆菌挥发性物质的生防功能愈加明确。利用GC-MS是研究检测挥发性油脂和生物代谢产生VOCs最常用的方法,该方法具有高度的灵敏性和抗干扰能力,可以快速直接鉴定混合气体中已知化合物的种类和结构,现已应用于农药残留检测、环境和生物分析中[12]。本文通过GC-MS分析得出,解淀粉芽孢杆菌LJ02菌株在代谢过程中可产生34种VOCs。
芽孢杆菌次级代谢过程中产生的VOCs具有显著的抑菌能力。Chaurasia发现一株拮抗枯草芽孢杆菌产生的VOCs能导致病原真菌菌丝和孢子的畸形[13];枯草芽孢杆菌JA菌株产生的VOCs对灰霉病原菌孢子及菌丝生长有明显抑制作用[14];CL-8芽孢杆菌产生的VOCs对立枯丝核菌()有抑制作用[15]。本文通过平板倒扣法得出,LJ02菌株产生的VOCs对5种病原真菌均有抑制作用,特别是对黑腐皮壳菌、草莓灰霉病菌、枣浆胞病的抑制效果显著,抑菌率在50%以上;由对峙培养结果分析,4-乙基苯酚、2-丙基环己酮这2种成分可能是菌株LJ02抑菌活性最重要的抑菌气体成分,其他成分虽然没有直接的抑菌能力,但不排除其具有对靶标菌抑菌能力的协同增效作用,具体情况还需进行后续试验研究。
另外,将抑菌气体用于水果保鲜是一种新型的保鲜机制。采后水果仍在继续生命代谢活动,产生的乙烯会加速果实的后熟与腐烂,缩短保质期[16]。因此,抑制其呼吸作用将利于贮藏期水果的新鲜度[17]。气调保鲜包装通过改变包装盒内的气体组成来抑制果蔬的新陈代谢速度和微生物的生长,从而延长果实的贮藏期[18]。其中,Almenar等人发现,将不同浓度的2-壬酮充入气调袋中可以明显抑制灰霉菌的生长[19]。本研究发现,LJ02菌株在代谢过程中产生的4-乙基苯酚、2-丙基环己酮两种挥发性气体均对黑腐皮壳菌有抑制效果,且混合型气体按照峰面积比例混合后,仅需450 μL/mL便可完全抑制该病原的生长。未来可利用该混合气体的抑菌特性,将这两种气体与不同的氧气、二氧化碳和氮气混合充入调节包装内进行气调保鲜,从而抑制采后水果保藏期间致病微生物的生长。
参考文献:
[1]罗萍. 梨储藏期病害生防菌及防腐保鲜的研究[D]. 雅安:四川农业大学,2009.
[2]陈臻. 两株生防菌株对苹果树腐烂病菌拮抗作用的研究[D]. 兰州:甘肃农业大学,2013.
[3] 张鹏鹏. 几株植物根际促生细菌释放的挥发性物质对拟南芥及病原菌的影响[D]. 泰安:山东农业大学,2013.
[4] Fernando W G D,Ramarathnam R,Krishnamoorthy A S,et al. Identification and use of potential bacterial organic antifungal volatiles in biocontrol[J].,2005,37(5):955-964.
[5] Arrebola E,Jacobs R,Korsten L. Iturin A is the principal inhibitor in the biocontrol activity of,PPCB004 against postharvest fungal pathogens[J].,2010,108(2):386-395.
[6] Osman M S,Sivakumar D,Korsten L. Effect of biocontrol agentand 1-methyl cyclopropene on the control of postharvest disease and maintenance of fruit quality[J].,2011,30(2):173-178.
[7] Yuan J,Raza W,Shen Q,et al. Antifungal activity of Bacillus amyloliquefaciens NJN-6 volatile compounds againstf. sp.[J].,2012,78(16):5942-5944.
[8]励建荣,朱丹实. 果蔬保鲜新技术研究进展[J]. 食品与生物技术学报,2012,31(4):337-347.
[9]薛琼,刘跃军,向贤伟,等. 肉桂精油微囊化及其在果蔬保鲜中的应用[J]. 包装工程,2016(5):50-54.
[10]闫训友,杜洪利,朱爱红,等. 丁香提取物对鲜切鸭梨保鲜效应的研究[J]. 食品工业科技,2016(4):347-350.
[11]Leelasuphakul W,Hemmanee P,Chuenchitt S. Growth inhibitory properties of,strains and their metabolites against the green mold pathogen(Sacc.)of citrus fruit[J].,2008,48(1):113-121.
[12]陈晓水,侯宏卫,边照阳,等. 气相色谱-串联质谱(GC-MS/MS)的应用研究进展[J]. 质谱学报,2013,34(5):308-320.
[13] Chaurasia B,Pandey A,Palni L M,et al. Diffusible and volatile compounds produced by an antagonisticstrain cause structural deformations in pathogenic fungi in-vitro[J].,2005,160(1):75-81.
[14]陈华,郑之明,余增亮. 枯草芽孢杆菌JA脂肽类及挥发性物质抑菌效应的研究[J]. 微生物学通报,2008,35(1):1-4.
[15]吴艳,闫豫君,赵思峰,等. 组合芽孢杆菌抑菌物质特性及其抑菌效果研究[J]. 西北农业学报,2007,16(5):266-270.
[16] Sisler E C,Serek M. Compounds controlling the ethylene receptor[J].,1999,40(1):1-7.
[17] Kittur F,Saroja N,Habibunnisa,et al. Polysaccharide- based composite coating formulation for shelf life extension of fresh banana and mango[J].,2001,213(4):306-311.
[18]李家政. 果蔬自发气调包装原理与应用[J]. 包装工程,2011(15):33-38.
[19] Almenar E,Del V V,Catala R,et al. Active package for wild strawberry fruit(L.)[J].,2007,55(6):2240-2245.
Study on Volatile Organic CompoundsInhibition ofLJ02
HAO Xiang-rong1, LU Zhi-jun2, WANG Jing1, LI Juan1, WANG Yuan-hong1,Corresponding Author
(1. College of Horticulture and Landscape, Tianjin Agricultural University, Tianjin 300384, China; 2. Beijing Plant Protection Station, Beijing 100029, China)
The paper used GC-MS to identify the kinds of volatile products in LB solid-state cultivation ofLJ02, and took 5 kinds of pathogenic fungi as indicator bacteria with two-sealed-base-plates method and two compartment plate method to detect the antibacterial activity of volatile gas produced by LJ02 strain and determined which active gas ingredients had inhibitionwith. The results showed that the volatile products in LB solid state cultivation ofLJ02 had significant inhibitory effect on most of the fruit-causing fungus, especially,andspp., the inhibitory rate reaching above 50%.LJ02 in metabolic process can produce a variety of volatile gases, including 4-ethylphenol, 2-propylcyclohexanone have strong inhibitory effect on.
;volatile organic compounds; GC-MS
S432.1
A
1008-5394(2016)03-0023-04
2016-05-03
国家自然科学基金项目“葡萄根癌病生防菌E26中双组分杂合组氨酸激酶AvhS的生防功能解析”(31171892)
郝象瑢(1990-),女,山西孝义人,硕士在读,主要从事植物病害生物防治和生防微生物分子生物学研究。E-mail:haoxiangrong0505@163.com。
王远宏(1974-),男,河南郑州人,教授,博士,主要从事植物病害生物防治和生防微生物分子生物学研究。E-mail:wangyh@tjau.edu.cn。

