基于近红外光的腹部出血检测系统的开发*
王红珂,张言,钱诚,薛莉,刘玉冰,李韪韬
(南京航空航天大学自动化学院生物医学工程系,南京211100)
1 引 言
腹部闭合性损伤以及由此导致的腹部出血是一种在平时和战场环境下常见的急性疾病。患者死亡的主要原因是腹腔内部大量出血而造成的失血性休克[1]。腹部闭合性损伤及腹腔出血大多由于损伤部位隐蔽、发病急速、患者行动不便、诊断需要时间等原因,往往诊断困难、误诊率高。因此,临床上急需一种简单、方便并能准确、快速的诊断方法。其中腹腔诊断性穿刺术是临床上一种常用的诊断方法,其简单易行、准确率高。但腹腔穿刺术并不适合所有患者,有一定的适应证和禁忌证[2]。B超对实质性脏器损伤的诊断具有明显的优势并能够对损伤部位、程度、范围进行判断,具有方便、快速、无创的特点,但对胰腺损伤的检测灵敏度较低[3]。CT对闭合性损伤的定性和诊断的准确性可达90%以上,其准确性优于超声检查[4]。但是,在CT诊断的过程中容易产生呼吸伪影,且在费用上要比其它检测手段昂贵许多[5]。腹腔镜探查术具有创伤小、安全、准确的优点,还可以避免不必要的开腹手术,但对腹腔内有较大出血和肠道胀气严重的患者并不适用[6]。目前,腹部闭合性损伤的临床诊断主要以 CT和超声联合检查为主[7]。但是,上述诊断方法都无法实现在野战和灾难环境下实时、快速、准确、无创地检测腹部创伤。
现代近红外光谱技术(near infrared spectroscopy,NIRS)是一项新的无损检测技术,它可以对物体进行快速、准确、无创地检测。近红外光对物体的穿透力强,可以对生物体进行无损非侵入检测,已成为近年来临床医学诊断和生物组织研究的热点之一[8-9]。由于生物组织的不同成分对近红外光具有不同的吸收和散射特性,因此,近红外光谱可以区分不同组织成分和其相关变化[10]。临床上,NIRS在腹部的无创检测及相关实验研究还处于探索或评估阶段。但是随着计算机技术、光学技术、光谱技术和电子技术的不断发展,NIRS技术将更加完善,其在无损监测人体组织和血液代谢中将具有更加广阔的前景。NIRS技术作为一种检测方法,可以对物体内部的信息进行实时、无创的检测,并可以通过分析获得的复杂光谱就能得到被测物体内部的相关信息。
本研究采用近红外光作为检测手段,设计并开发出了一套针对腹部出血的无创检测系统。通过建立的腹部出血实验模型,对红光和近红外光在腹部组织的传输规律进行了研究。研究结果为腹部损伤及出血的无创检测找到了一种新的方法。
2 近红外光检测系统
2.1 检测原理
光子与生物组织的相互作用主要包括生物组织对光子的吸收和散射作用。在近红外波长范围内,其相互作用主要表现为散射作用,因为生物组织中水的成分占有很大比例。水的吸收谱主要在300 nm以下和1 000 nm以上的波长范围内,而血红蛋白和黑色素仅对400~650 nm的可见光有强烈的吸收[11-13]。由于生物组织对近红外光具有低吸收、高散射的特性,因此,近红外光谱区的光对生物组织有较好的穿透能力,其穿透深度可达数个厘米。通过测量生物组织的光学特性参数,便可得到生物组织深层的生理信息[14]。
通常,将波长范围在700~900 nm称为“光学窗口”。此波长范围内,随着波长的逐渐增加,氧合血红蛋白、还原血红蛋白对光的吸收逐渐减弱,而当波长大于900 nm时水的吸收大大增加。因此,可以选择波长在“光学窗口”范围内的近红外光作为检测光源。利用血液中的血红蛋白和体液(主要成分是水)对光子的不同吸收,便可检测损伤腹部的出血情况。另一方面,近红外光谱技术还具有安全可靠、连续实时及无损的特点,可以应用于对腹部的检测。
2.2 检测系统设计方案
检测系统主要由探头、检测装置、数据采集卡和计算机等组成,见图1。系统工作时,检测装置控制光源的时序和发光频率,光源发出的光子照射在待测样品上,经过组织对光子的吸收和散射等作用,一部分光子被探测器检测并传输到检测装置的输入通道。然后,信号经过放大、滤波等处理后送至数据采集卡,经过数据采集卡的A/D转换后送至计算机。上位机采用Labview进行编程,编写了数据采集与控制的用户界面和程序,主要实现了采集数据的波形显示、保存和实时分析。
检测装置是整个系统的重要组成部分,主要包括:输入通道、输出通道、光源驱动模块、锁相放大模块、MCU(microprocessor control unit,MCU)控制模块和信号处理模块等。其中输入和输出通道主要用于完成采集信号的传输;光源驱动模块实现光源的驱动;MCU是整个检测装置的核心;信号处理模块主要实现信号的放大和去噪声。
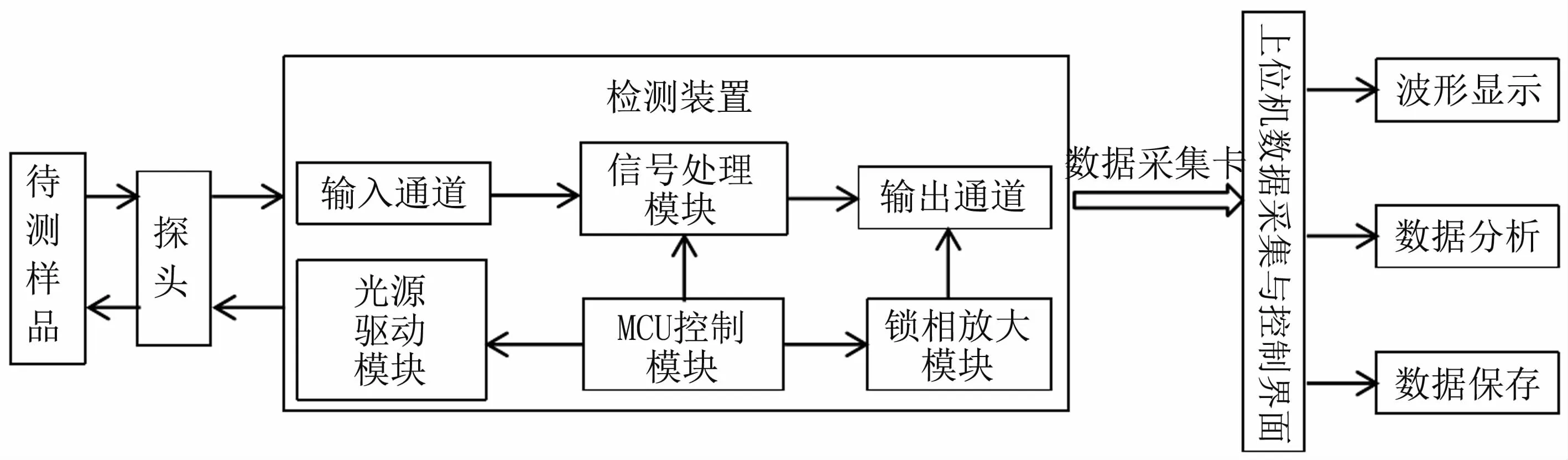
图1 检测系统结构示意图Fig 1 Schematic of the detection system
2.3 探头
探头主要包括1个光源和两个探测器,见图2。光源采用日本epitex公司生产的型号为L760/850-04A的双波长发光二极管,其发光波长分别为760 nm和850 nm,工作电流为80 mA。探测器采用美国B-B公司生产的OPT101型光电探测器。光源和两个探测器的中心间距分别为2.1 cm和3.1 cm。同时,为了减少外界背景光对探测器的影响,整个探头用一个黑色的柔性橡胶作为基底,并在上面嵌入1个双波长发光二极管和2个光电探测器。
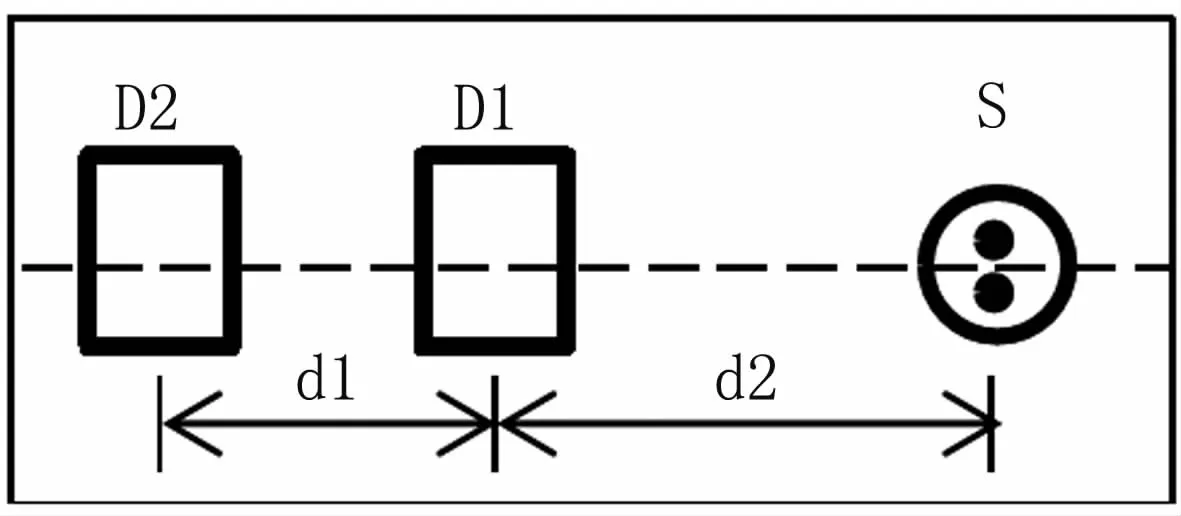
图2 探头结构示意图Fig 2 Diagram of the detector structure
2.4 光源驱动模块
为保证从腹部组织漫反射出来的光强信号的稳定性,系统采用恒流源驱动方式来驱动激励光源。该恒流源驱动电路主要由电源基准芯片MAX6126、电子模拟开关芯片MAX4066,采样电阻和其它元器件构成。光源驱动时,电压基准芯片实时采集采样电阻两端的电压,同时将采集电压信号反馈到电压基准芯片内部,然后根据采样电压值调节输出电压。采样电阻的阻值由所需要的驱动电流的大小和电压基准芯片的输出电压来确定。光源的驱动电流可以通过采样电阻值来改变。
2.5 锁相放大模块
由于所要检测的是微弱光强信号且信号中常常混有噪声,因此,系统采用锁相放大电路来去除噪声。锁相放大电路不仅具有很高的检测灵敏度而且信号处理比较简单,常用来检测微弱信号。如图3所示,锁相放大模块主要包括带通滤波器、锁相放大器和低通滤波器三个部分。在本检测系统中,调制输入信号的频率为20 Hz,并在锁相放大器前加入带通滤波器从而实现对输入信号的滤波,参考信号由微控制器提供。信号经锁相放大后通过一个低通滤波器来实现信号的整流与滤波。
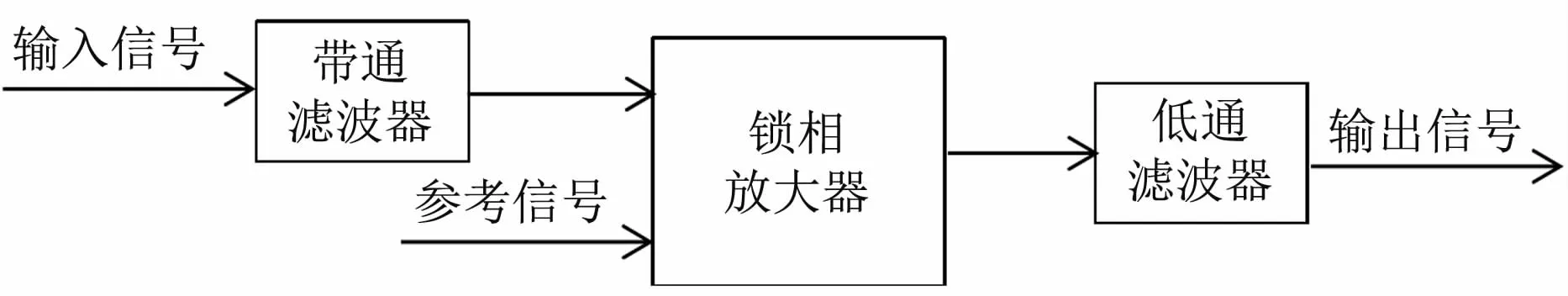
图3 锁相放大模块结构图Fig 3 Diagram of the lock-in am p lifier modules
2.6 数据采集卡与软件设计
数据采集卡采用美国NI公司生产的型号为PCI6221板卡。该采集卡分辨率为16位,最高采集速度为250 k/s,具有16路输入通道,可以满足系统的采集需求。检测系统的控制和信号采集程序采用Labview编程。数据采集卡将采集到的信号经过A/D转换后送至上位机进行保存和显示。信号采集系统的控制面板(见图4)主要包括采样频率、采样数、采集通道的设置,波形显示和数据存储路径选择。在实时信号采集时,首先需要设置数据采集卡的相关参数,然后进行实时采集和波形显示。图5为采集系统的程序框图,可以通过数据采集卡自带的软件包,也可以通过采集面板来观察采集信号的波形。
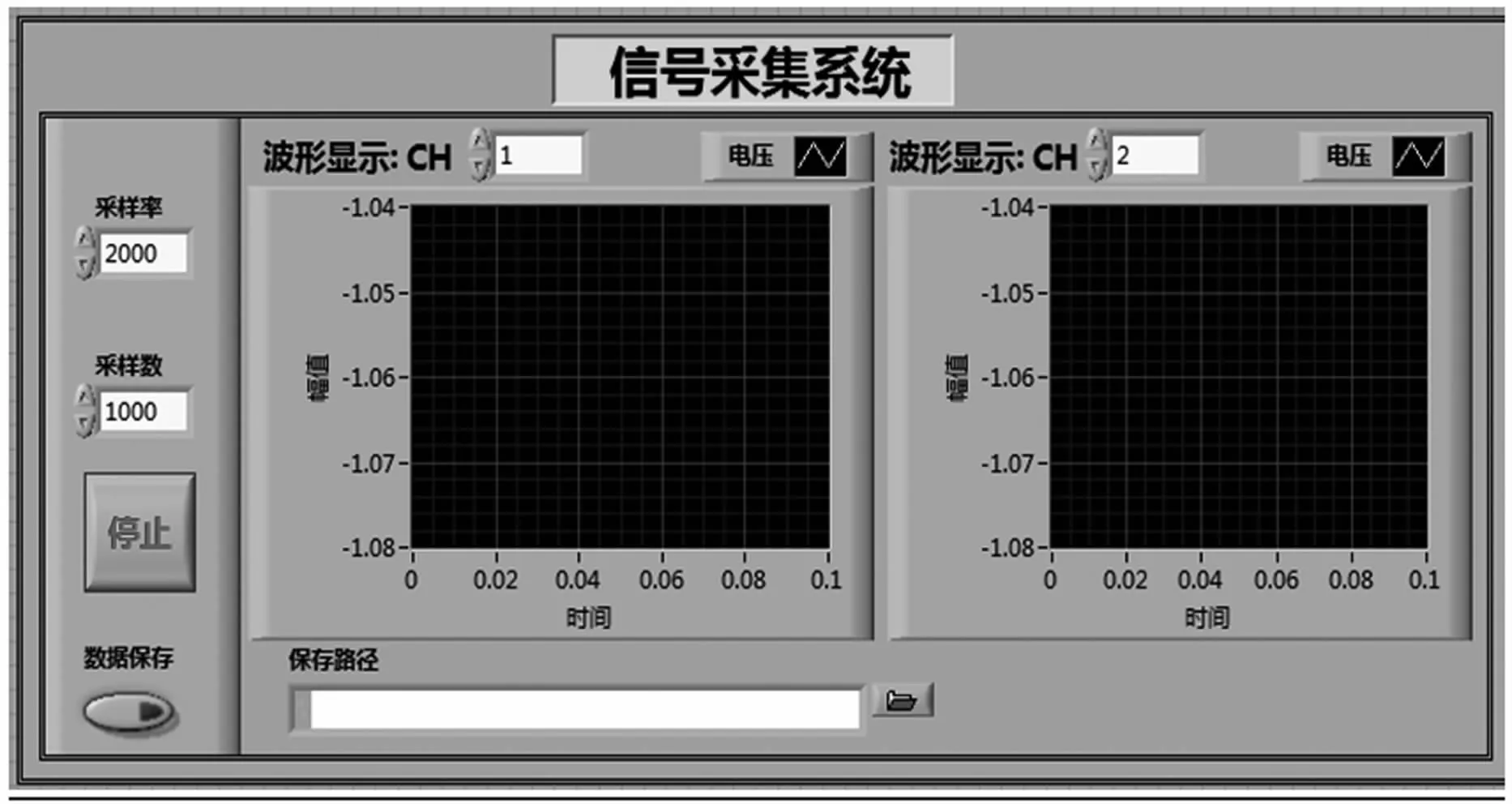
图4 信号采集系统控制面板Fig 4 Signal acquisition system control panel
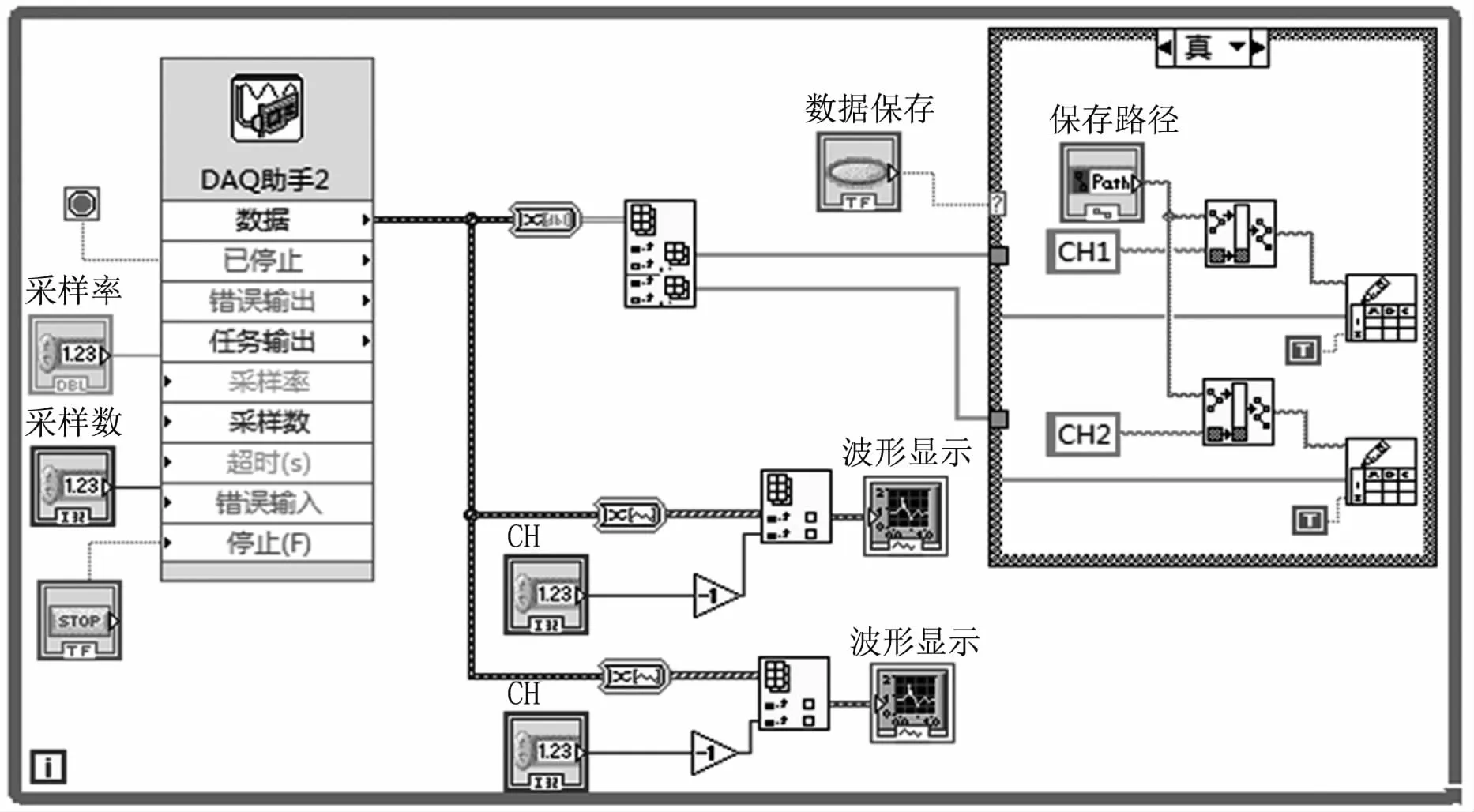
图5 采集系统程序框图Fig 5 Program chart of the signal acquisition system
3 实验及结果分析
3.1 腹部出血模型构建
人体的腹部结构主要由皮肤、皮下组织、腹肌、腹膜外脂肪和腹膜等组成。由于人体腹部结构比较复杂,所以在实验时需要建立适当的组织模型。在本实验中,腹部组织用新鲜的鸡脯肉来模拟,用Phantom模型来模拟正常腹部和腹部出血时的两种不同情况,通过改变鸡肉的厚度来探究光子在腹部组织中的检测深度和传播规律。图6为模型实验装置的示意图。
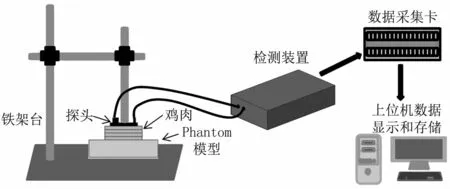
图6 模型实验装置示意图Fig 6 The schematic of the experiment device
实验Phantom模型配置步骤如下:(1)分别量取100 ml和150 ml水倒入烧杯中并将其编号为a和b;(2)将水加热至沸腾后向沸水中加入15 g凝胶并充分搅拌均匀;(3)溶液温度降至50℃后,向编号为a和b的烧杯中分别加入50 m l牛奶和0.1 m l墨汁并再次充分搅拌均匀;(4)将冷却后的混合物放入冰箱中,待液体凝固则模型配置完成。两个模型的整体厚度均为3cm,编号为a和b的模型分别作为实验模型1和实验模型2。
模型配好后,利用一台双光源、双检测通道的检测生物组织光学特性的ISSOXImeter系统测得模型1的光学参数为:μa=0.0359,μs=14.4648;模型2的光学参数为:μa=0.2079,μs=-20.2259,其中μa和μs分别为组织的吸收系数和散射系数,单位为1/cm。模型2的散射系数小于零,可以认为它是一个吸收体。
3.2 实验方法和步骤
用新鲜的鸡脯肉模拟腹部组织,配置的Phantom模型1和模型2分别模拟正常腹部和有出血的损伤腹部。当光照射到腹部组织时,光子经过腹部组织的吸收和散射作用,一部分光子被探头检测到。通过分析这些携带腹部组织信息的光强信号便可初步判断腹部的出血情况。
实验时,首先按照要求连接好检测系统,并进行调试;调试完成后将新鲜的鸡脯肉切成半径为4 cm,厚度依次为 0.5、1、1.5、2、2.5、3、3.5 cm的圆片;将Phantom模型放在实验台上并在模型上面放置鸡脯肉;将探头用铁架台固定,调整高度使其紧贴在鸡肉表面;观察输出信号波形并保存。将探头放置在鸡脯肉表面的不同位置,重复上述步骤三次。
3.3 实验结果及分析
当用850 nm的光作为激励源,鸡肉厚度依次从0.5 cm到3.5 cm变化时,探测器D1所检测到的光强曲线见图7(a)。Phantom 1和Phantom 2分别表示正常腹部和损伤有积血的腹部所检测到的光强曲线。图7(b)表示二者的差值曲线。从图中可以看出:随着鸡肉厚度的增加,正常腹部的光强信号呈现出一条不规则的曲线,并在一定的幅值范围内波动;损伤腹部的检测光强信号随着鸡肉厚度的增加,信号值逐渐增加,且当鸡肉厚度大于2.5 cm后,光强幅值则几乎不随厚度的变化而变化。因此,正常腹部检测到的光强信号是一条幅值波动的但均值一定的曲线;损伤有出血的腹部,由于血液对光子的吸收,其检测到的光强信号随腹部组织厚度的增加而增大。当鸡肉厚度大于2.5 cm时,检测光强将不再随厚度的变化而变化。可以说明,此检测装置在850 nm光的腹部检测中,其最大检测深度为2.5 cm。当厚度大于2.5 cm时,腹腔内部的积血不再对入射光子有明显的吸收作用。
图8(a)表示用760 nm的光作为激励源,鸡肉厚度依次从0.5 cm到3.5 cm变化时,探测器D1所检测到的光强曲线。图8(b)表示二者差值的变化曲线。从图7(b)和图8(b)可以看出:在此检测装置中,波长为760 nm和850 nm的光在腹部的最大检测深度均为2.5 cm,760 nm光的检测线性度明显好于850 nm。
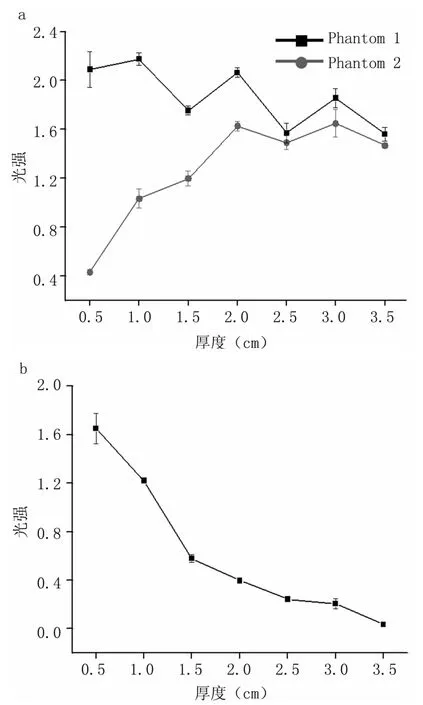
图7 波长为850 nm光的检测光强曲线Fig 7 The detected light intensity curve of the light with a wavelength of 850 nm

图8 波长为760 nm光的检测光强曲线Fig 8 The detected light intensity curve of the light with a wavelength of 760 nm
4 结论与讨论
腹部出血模型实验结果表明:此基于近红外光技术的检测系统可以明显区分出正常腹部和损伤有出血的腹部;用760 nm和850 nm波长的光作为激励光源时,其检测的最大深度均为2.5 cm,760 nm光的检测线性度要好于850 nm。
但是人体的腹部组织比较复杂,出血部位通常比较隐蔽。因此,在腹部损伤及出血检测时,还需要做进一步的改进和优化。一方面,通过改进探头来提高检测灵敏度和分辨率。可以:(1)适当范围内,采用大功率的激光二极管作为检测光源;(2)采用更为灵敏的雪崩二极管作为探测器;(3)采用多光源、多检测器的检测方案;另一方面,采用其他检测手段辅助检测。首先,采用B超初步判定出血的大致位置,然后利用近红外光技术进行精确定位,并确定出血位置、程度和出血范围。

