婴幼儿供肾儿童肾移植50例临床应用分析
汪笑宇,赵闻雨,张雷,朱有华,曾力(第二军医大学长海医院器官移植科,上海200433)
儿童慢性肾病(CKD)主要由肾脏先天畸形及遗传性疾病造成,许多急性肾损伤患儿随着年龄的增长也会最终发展为CKD[1-2]。肾移植是治疗儿童CKD的最佳方法,早期移植可以避免透析引起的患儿生理及心理发育障碍,显著提高患儿的生存质量和生存率[3]。然而供肾短缺严重阻碍了我国儿童肾移植的发展,为了缓解供肾短缺的现状,第二军医大学长海医院器官移植中心自2012年起在儿童肾移植中应用心脑死亡婴幼儿供肾,取得了良好的效果。2012年2月-2015年12月本中心共成功实施了50例婴幼儿供肾儿童肾移植手术,现将供、受者的临床资料进行回顾性分析,报告如下。
1 资料和方法
1.1 移植术式选择与分组:婴幼儿供肾移植采用经腹膜外途径,分为单肾移植和双肾整块移植两种手术方式。根据婴幼儿供者的体重选择移植术式,对于供者体重>5 kg的供肾,一般采用单肾移植,而对于供者体重≤5 kg的供肾则采用双肾整块移植。在本中心实施的50例婴幼儿供肾儿童肾移植中,根据移植术式的不同分为单肾移植组(37例)和双肾整块移植组(13例)。
1.2 一般资料
1.2.1 供者:婴幼儿供者共35例,均为病情危重患儿,原发疾病主要包括严重先天性畸形〔先天性膈肌麻痹、先天性胆道闭锁、先天性心脏病心力衰竭(心衰)、永存动脉干、脑发育不全、内脏转位、先天性肺发育不全〕、中枢神经系统肿瘤 (脑胶质瘤、小脑母细胞瘤、髓母细胞瘤、室管膜瘤)、病毒性脑炎、颅脑外伤、腹泻致休克、溺水、机械性窒息等,目前,上述疾病均无有效的治疗方法,患儿父母均同意在患儿心脑死亡后捐献器官(DCD中国三类)。供肾由当地器官获取组织(OPO)通过双肾联合膀胱瓣整块切取的方式获取,经中国器官分配和共享系统(CORTS)分配给本中心。
单肾移植组共22例供者,男性12例,女性10例;年龄5~84个月,平均年龄为(23.9±20.4) 个月;体重为5.5~20 kg,平均体重为(10.6±4.0)kg,除7例以单肾分配给本中心外,其余15例均为双肾移植;双肾整块移植组共13例供者,男性10例,女性3例;年龄为(32.8±19.6)天(4~60天);体重为(3.6±0.7)kg (2.5~5.3 kg)。由于在选择供体时,年龄小、体重轻的供者一般采用双肾整块移植,所以双肾整块移植组的供者年龄、体重均显著低于单肾移植组。
1.2.2 受者:单肾移植组37例受者中,男性18例,女性19例;年龄为 (10.7±3.4) 岁 (4.2~17.9岁);体重为(27.1±8.7)kg (15~44.5 kg),术前26例患儿接受腹膜透析,8例接受血液透析,3例患儿未进行透析,平均透析时间为(17.4±18.1)个月(0~72个月)。双肾整块移植组的13例儿童受者中,男性6例,女性7例;年龄为(9.4±2.4)岁(4.6~11.6岁);体重为(25.2±6.5)kg (14~37 kg),术前8例患儿接受腹膜透析,4例接受血液透析,1例未进行透析,平均透析时间为(11.0±10.3)个月(0~32个月)。所有受者均为初次移植,原发疾病主要包括遗传性肾病、先天性肾发育不良、慢性肾小球肾炎、局灶性节段性肾小球硬化、肾病综合征、多囊肾、膀胱输尿管反流等。供、受者ABO血型相同或相容,受者群体反应性抗体(PRA)均为阴性,供、受者淋巴细胞毒交叉配合试验均为阴性。
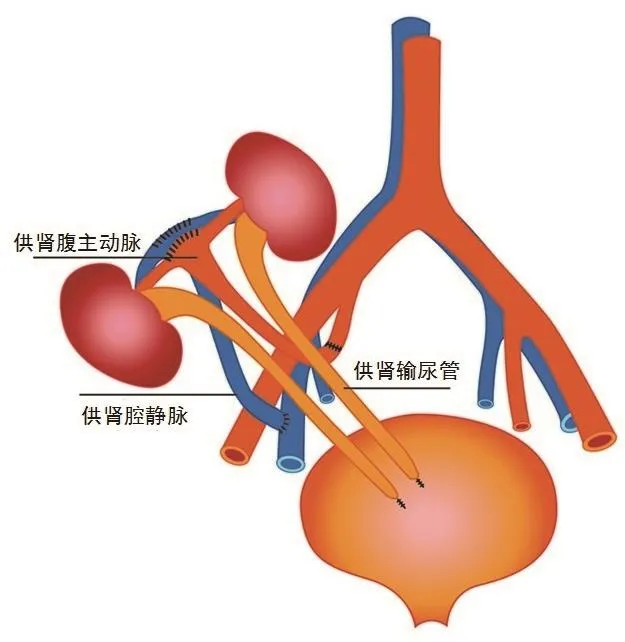
图1 双肾整块移植手术示意图
1.2.3 手术情况:单肾移植术式与常规成人肾移植相同。双肾整块移植术式(图1):将供肾置于受者右侧髂窝,供肾腹主动脉和腔静脉在肾蒂平面以上近心端分别予以缝合封闭;供肾腔静脉远心端与受者髂外静脉端侧吻合,供肾腹主动脉远心端与受者髂内动脉端端吻合;在初期的手术中,输尿管吻合采用的是将包含供肾双侧输尿管开口的整块膀胱瓣与受者膀胱黏膜吻合,但3例受者中有2例在术后1周内出现尿瘘,再次手术时发现尿瘘是由于膀胱瓣缺血坏死引起,因此,在随后的手术中将双侧输尿管膀胱瓣剪开分离后各自修整缩小,并分别与受者膀胱黏膜吻合,同时留置输尿管支架管(F3或F4)。围术期所有受者均给予普通肝素抗凝治疗,24小时持续静脉泵入肝素的用量为5~10 U / (kg·h),维持5~7天,术后3天开始给予阿司匹林抗凝治疗,维持3~6个月。
1.2.4 免疫抑制治疗:所有受者均采用抗CD25单克隆抗体诱导治疗,分别于术中、术后第7天和14天给予,剂量为1 mg / (kg·d)。术中静脉滴注甲泼尼龙10 mg / (kg·d),随后每日递减,术后1周内撤除皮质激素。采用他克莫司〔0.3 mg / (kg·d)〕 +麦考酚钠肠溶片 〔540 mg / (1.73 m2·d)〕 维持治疗。
1.2.5 统计学分析:采用SPSS 13.0统计软件进行数据处理,符合正态分布的计量资料以均数±标准差(±s)表示,两样本均数的比较采用独立样本秩和检验,两样本率的比较采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 术后并发症
2.1.1 血管并发症:单肾移植组中,1例(2.7%)患者在术后7天出现移植肾血管栓塞,导致移植肾失功,切除移植肾;双肾整块移植组中,4例(30.8%)患儿于术后1周内出现移植肾血管栓塞,发生率显著高于单肾移植组(P=0.003),其中3例为双侧移植肾血管栓塞导致移植肾失功,切除移植肾,1例为单侧移植肾血管栓塞导致一侧移植肾失功,对侧移植肾功能恢复良好。
2.1.2 输尿管并发症:单肾移植组中,1例(2.7%)于术后3个月出现移植肾输尿管狭窄,经手术治疗后恢复;双肾整块移植组中,2例(15.4%)于术后1周内出现尿瘘,发生率显著高于单肾移植组(P=0.085),经手术治疗后,1例患者恢复良好,另1例出现一侧输尿管梗阻,引起一侧移植肾积水并逐渐丧失功能,对侧移植肾功能恢复良好。
2.1.3 肾功能延迟恢复:单肾移植组中,17例(45.9%)术后发生肾功能延迟恢复(DGF),经透析治疗过渡后恢复;双肾整块移植组中,2例(15.4%)术后发生DGF,发生率低于单肾移植组,但差异无统计学意义(P=0.061),2例受者经透析治疗过渡后恢复。
2.1.4 排斥反应:单肾移植组中,4例(10.8%)术后发生急性排斥反应,3例经甲泼尼龙(MP)冲击治疗后逆转,1例MP冲击无效,经静脉滴注兔抗人胸腺细胞免疫球蛋白(rATG)后逆转;双肾整块移植组中,2例(15.4%)术后发生急性排斥反应(AR),其发生率与单肾移植组类似,差异无统计学意义(P=0.614),经MP冲击治疗后逆转。
2.2 人、肾存活及移植肾功能情况:单肾移植组术后随访16.5个月(3~31个月),随访截止时受者均存活,1例因移植肾血管栓塞而切除移植肾,恢复透析,1例术后5个月因原发病复发,导致移植肾失功,恢复透析,其余受者移植肾功能恢复良好,人和肾存活率分别为100%和94.6%,末次随访时血肌酐为(67.9±23.1)μmol/L(41~121 μmol/L)。双肾整块移植组术后随访20.9个月(4~44个月),随访截止时受者均存活,3例因双侧移植肾血管栓塞而切除移植肾,恢复透析,另有2例分别由于单侧血管栓塞和单侧输尿管梗阻而导致一侧移植肾丢失,但对侧移植肾存活,人和肾存活率分别为100%和76.9%,移植肾存活率低于单肾移植组,但差异无统计学意义(P=0.056),其余受者移植肾功能恢复良好,末次随访时血肌酐为(56.2±18.7)μmol/L(37 ~ 89 μmol/L),低于单肾移植组,但差异无统计学意义(P=0.092)。
3 讨 论
研究表明,婴幼儿供肾作为一种边缘供肾,如应用于儿童受者,会显著增加围术期并发症的发生率,常导致移植肾丢失,因此不建议应用于儿童肾移植[4]。然而,随着近年来手术技术、围术期治疗和免疫抑制药物的不断进步,婴幼儿供肾儿童肾移植的预后已获得显著改善[5-7]。与成人供肾相比,婴幼儿供肾具有以下优势:① 移植肾可无张力地放置于儿童受者髂窝,而不影响腹膜透析的进行;② 儿童供、受者无论是体内环境还是血管条件均较匹配,有利于患儿术后肾功能的恢复;③ 移植肾可随儿童受者的生长发育而同步生长,满足儿童不同生长发育阶段的需要。
与成人已发育成熟的肾脏不同,不同年龄阶段儿童供者的肾脏在体积大小、血管直径、发育情况等方面差异较大。对于婴儿供肾来说,由于单个肾脏的肾功能不足、血管纤细吻合困难等原因,常需将双侧供肾整块移植给儿童受者;而幼儿供肾的单肾功能已能满足儿童受者的需要,血管直径也能满足吻合需要,因此可单肾移植给儿童受者。然而对于双肾整块移植还是单肾移植的实施标准目前尚不统一,儿童供者的年龄、体重、移植肾的大小均可作为判断标准。在成人受者移植中,国际上比较公认的标准是:对于供者体重>10 kg的儿童供肾可进行单肾移植,而供者体重<10 kg的儿童供肾则进行双肾整块移植[8-9]。但这一标准并不适用于儿童受者,本中心的经验是:对于体重>5 kg的婴幼儿供者,一般单肾移植给2例儿童受者,而对于体重<5 kg的供者,则双肾整块移植给1例儿童受者。但这一标准并不绝对,各移植中心可以根据供肾的实际情况(如供肾大小、血管条件等)结合受者的情况(年龄、身高、体重等),并根据本中心的手术技术和经验选择合适的手术方法。
婴幼儿供肾移植的预后虽已获得较大改善,但血管和输尿管并发症仍具有较高的发生率。其中血管栓塞是引起围术期移植肾功能丢失的最主要原因,一旦发生极难逆转,常导致移植肾切除。血管纤细、低血压、高凝状态和排斥反应等均是血管栓塞的危险因素[10]。本研究显示,双肾整块移植中血管栓塞的发生率显著高于单肾移植。引起双肾整块移植中血管栓塞高发的原因主要包括:① 因肝移植常需保留较长的腹主动脉和腔静脉,导致供肾腹主动脉和腔静脉在肾蒂平面以上的近心端长度不足,缝闭近心端时易影响供肾动、静脉开口;② 供肾动、静脉纤细,吻合口易狭窄;③ 供肾活动度大,易造成血管扭曲。因此,预防血管栓塞是婴幼儿供肾移植围术期治疗的关键,其中对于双肾整块移植,肝肾分离时需保留供肾足够的腹主动脉和腔静脉近心端长度,血管吻合时应采用可吸收缝线,而在完成血管吻合后供肾应妥善固定。此外,维持患儿有效血容量和血压稳定,保证移植肾血液灌注对于预防血管栓塞也非常重要。目前,对于围术期是否应给予抗凝治疗及应给予何种抗凝治疗方案尚存较大争议[11-12]。本中心的经验是对于婴幼儿供肾移植,围术期应给予普通肝素抗凝,维持部分凝血活酶时间(APTT)为术前的1.5倍左右,但需注意避免抗凝过度导致的出血性并发症,术后1周左右转为口服阿司匹林序贯治疗。
输尿管并发症也是造成早期婴幼儿供肾移植失败的重要原因。在婴幼儿供肾移植中,由于输尿管较短及输尿管末端血供较差等原因,尿瘘的发生率仍较高。而在双肾整块移植中,有研究人员将包含双侧输尿管开口的整块供者膀胱瓣与受者膀胱黏膜吻合[13],但本研究发现这种吻合方式常导致膀胱瓣缺血坏死,因此,建议将双侧输尿管膀胱瓣剪开分离后各自修整缩小,在保证血供的情况下分别与受者膀胱黏膜吻合。此外,由于输尿管纤细、吻合口缝合过密及凝血块堵塞等原因,移植早期输尿管梗阻也时有发生。因此,建议常规留置输尿管支架管,术后2~4周拔除。
虽然与成人供肾相比,婴幼儿供肾的发育尚不完善,肾小球滤过率(GFR)也较低,术后移植DGF的发生率较高,但其有较大的储备潜能[14]。本研究发现,在移植术后1周内有部分儿童受者表现为少尿,常需透析治疗,临床上诊断为DGF,但与成人供肾移植中的DGF表现为肌酐不降甚至升高不同,婴幼儿供肾移植中受者肌酐仍缓慢下降,在术后1周左右,尿量则显著增加,肌酐也下降较快。这提示在婴幼儿供肾移植中的部分DGF可能并不是由肾小管坏死引起的,而是由于来自低体重婴幼儿供者的肾脏功能尚不能满足较大体重儿童受者的需要,但随着其储备潜能的发挥,通过提升GFR,可逐渐适应受者的需要。
本研究中还采用了儿童受者术后早期撤除皮质激素的治疗方案。既往研究表明,儿童长期应用激素会引起生长发育障碍、高血压、糖尿病、高脂血症、骨质疏松等不良反应[15]。通过优化和改进儿童肾移植免疫抑制方案,特别是抗体类生物制剂的应用,早期撤除激素并不增加排斥反应的风险,但能显著改善儿童受者的生长发育状况。因此,目前在儿童肾移植中越来越倾向于早期撤除激素。
总之,婴幼儿供肾在儿童肾移植中的应用可有效缓解我国移植器官短缺的问题,减少尿毒症患儿等待移植的时间,改善其生理和心理发育,提高其生活质量,值得进一步深入研究。

