混合盐碱胁迫下裸燕麦的种子萌发和幼苗逆境生理特征
刘建新 王金成 王瑞娟 贾海燕
(1.陇东学院生命科学与技术学院,庆阳 745000; 2.甘肃省高校陇东生物资源保护与利用省级重点实验室,庆阳 745000)
混合盐碱胁迫下裸燕麦的种子萌发和幼苗逆境生理特征
刘建新1,2王金成1,2王瑞娟1,2贾海燕1,2
(1.陇东学院生命科学与技术学院,庆阳 745000;2.甘肃省高校陇东生物资源保护与利用省级重点实验室,庆阳 745000)
为了解裸燕麦新品种‘定莜6号’对混合盐碱胁迫的生理响应,根据种植区土壤盐分的组成,采用砂培法研究了不同浓度混合盐碱处理对种子萌发和幼苗逆境生理特征的影响。结果表明,随着处理浓度增大,裸燕麦种子萌发率、萌发指数、活力指数及幼苗含水量和生物量明显下降,叶片超氧阴离子、过氧化氢和丙二醛含量及质膜相对透性显著增大;Na+含量增加,K+含量和K+/Na+降低,质膜H+-ATP酶、过氧化物酶、抗坏血酸过氧化物酶活性和可溶性蛋白质含量先升后降,超氧化物歧化酶活性及谷胱甘肽、有机酸和脯氨酸含量升高,过氧化氢酶活性和抗坏血酸含量降低,游离氨基酸含量先降后升,可溶性糖含量呈升—降—升趋势变化。表明盐碱胁迫下活性氧代谢失调和Na+、K+平衡破坏是裸燕麦生长受抑的重要原因,有机酸和脯氨酸可能是裸燕麦适应盐碱的主要渗透调节物质。
裸燕麦;混合盐碱胁迫;种子萌发;活性氧代谢;渗透调节物质
土壤盐碱化是影响农业发展和生态环境的全球性问题。在世界1.5×109hm2的盐碱地中有23%的盐土和37%的碱土[1]。中国2.6×107hm2的盐碱地中耕地约6.6×106hm2[2]。盐碱土中的致害盐类除以NaCl和Na2SO4为主的中性盐外,还有以Na2CO3和NaHCO3为主的碱性盐。通常将中性盐胁迫称为盐胁迫,而将碱性盐胁迫称为碱胁迫。盐、碱胁迫下,植物共同遭受离子毒害和渗透胁迫,但碱胁迫还要受高pH胁迫。因而,碱胁迫通常比盐胁迫具有更强的生态破坏力。有研究证明,盐胁迫和碱胁迫实质上是两种既相关但又有本质区别的不同性质的胁迫[3]。目前,有关植物耐盐性的研究多集中在NaCl和Na2CO3胁迫[2~3],混合盐碱胁迫涉及较少[4~5]。事实上,生长在盐渍化土壤的植物盐胁迫和碱胁迫通常相伴发生。因此,研究混合盐碱胁迫比单一盐或碱胁迫更接近实际,从而能更好地筛选和培育耐盐碱作物以开发和利用盐碱土资源。
裸燕麦(Avenanuda)是禾本科燕麦属的一个亚种,具有抗寒、耐贫瘠和耐盐碱等特性[5],并具有独特的营养和保健功效[6],被称为是盐碱地改良的先锋作物。中国是裸燕麦的发源地,至今已有2500多年的种植历史,主要分布于内蒙古、河北、山西、甘肃等省区,年种植面积约55万hm2[7]。目前,对燕麦的相关研究主要集中在适应性栽培[8],种质资源遗传分析和评价[9],产量和品质提高[10]及产品开发[11]等方面。在燕麦适应盐碱机制方面,王波和宋凤斌[12]研究表明,皮燕麦比裸燕麦具有更强的盐碱耐性。王波等[13]报道,燕麦通过积累脯氨酸和可溶性糖进行渗透调节并通过气孔排盐适应盐碱胁迫。范远等[14]研究表明,燕麦能够在一定程度上适应苏打碱土的盐碱胁迫,适应能力随胁迫水平的增加而降低,并认为燕麦根部生物量的减少和抽穗期较强的离子选择吸收能力可能有利于地上部的生长和产量构成。盐碱胁迫下,燕麦叶绿体超微结构破坏和光合能力降低[15~16],Na+、K+平衡破坏和产量下降[17]。‘定莜6号’是甘肃省定西市旱作农业科研推广中心以1633-112-1作母本、蒙燕146作父本杂交选育的适合在西北地区种植的燕麦新品种,具有抗旱性强、丰产性好和品质优等特点。为了解其盐碱耐性及其生理机制,根据甘肃种植地土壤盐分组成,将两种中性盐NaCl和Na2SO4及两种碱性盐NaHCO3和Na2CO3按不同比例混合,研究不同浓度混合盐碱胁迫对种子萌发和幼苗抗逆生理特性的影响,旨在为高产栽培和耐盐品种筛选提供参考。
1 材料与方法
1.1 供试材料与混合盐碱溶液配比
试验于2013年4~8月在甘肃省高校陇东生物资源保护与利用省级重点实验室生物科技园进行。裸燕麦品种‘定莜6号’种子由甘肃省定西市旱作农业科研推广中心提供。根据甘肃省中部裸燕麦种植地盐分组成[18],选定两种中性盐NaCl和Na2SO4及两种碱性盐NaHCO3和Na2CO3,按12∶8∶9∶1的摩尔质量比配成盐碱混合液进行处理,处理浓度分别为25、50、75、100、125 mmol·L-1,以蒸馏水为对照(CK,pH6.32,电导率0.16 mS·cm-1)。不同浓度处理溶液pH、电导率和各离子组成见表1。

表1 盐碱溶液的pH、电导率和离子组成
1.2 种子萌发试验
挑选饱满均一的裸燕麦种子经3% NaClO表面消毒10 min后置于铺有双层滤纸的培养皿中(直径11 cm),每皿100粒,分别加入浓度为25、50、75、100、125 mmol·L-1的混合盐碱溶液8 mL,置培养箱20℃萌发,每天补充适量相应溶液,以蒸馏水为对照,重复4次。每12 h统计发芽数,处理6 d后统计萌发率,用直尺测量发芽种子的胚根和胚芽长度,计算萌发指数和活力指数。
萌发指数(GI)=∑Gt/Dt
(1)
式中:Gt为第t天的种子发芽数,Dt为相应发芽天数。
活力指数(VI)=GI×S
(2)
式中:S为胚芽长度。
1.3 幼苗耐盐碱试验
经消毒、催芽后选露白一致的裸燕麦种子播种在装有珍珠岩的底部带孔塑料盆(口径20 cm,高14 cm)中,浇水后置培养室培养,昼/夜温度(26±6)℃/(20±4)℃,相对湿度60%~80%,光照强度496~710 μmol·m-2·s-1。幼苗2叶1心期疏苗,每盆保留一致壮苗约100株,3叶1心期分别用浓度为25、50、75、100、125 mmol·L-1的混合盐碱溶液(Hoagland溶液配制)进行根部浇灌处理,Hoagland溶液为对照(CK),浇灌于每天19:00进行,浇灌量为珍珠岩持水量的2倍(约1 000 mL)以洗掉积盐保持处理浓度的恒定。重复5次,随机排列。处理4 d后取倒数第2~3片成熟叶液氮速冻后-70℃保存,及时测定相关生理指标。
1.4 测定指标与方法
1.4.1 植株生物量和组织含水量测定
幼苗耐盐碱试验中,各处理取幼苗30株,洗净、吸干表面水分,称鲜重后置105℃杀青30 min,70℃烘干至恒重,称干重。
计算组织含水量(%)=(鲜重-干重)/干重×100
(1)
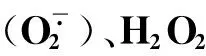

1.4.3 抗氧化酶活性测定
超氧化物歧化酶(SOD)活性测定采用氮蓝四唑光还原法[19];过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)活性测定采用紫外吸收法[19];过氧化物酶(POD)活性测定采用分光光度法[19]。
1.4.4抗坏血酸(AsA)和谷胱甘肽(GSH)含量测定
称取0.20 g叶片,分别用2.0 mL 15%偏磷酸和5%三氯乙酸溶液研磨,将匀浆液15 000 g离心20 min,上清液定容至2.0 mL。按Arakawa等[21]的方法测定上清液AsA含量;采用Ellman[22]的方法测定GSH含量。
1.4.5 渗透调节物质含量测定
采用李合生[23]的考马斯亮蓝G-250法、蒽酮比色法、茚三酮染色法、磺基水杨酸法和酸碱滴定法分别测定可溶性蛋白质、可溶性糖、游离氨基酸、脯氨酸和有机酸含量。
1.4.6Na+、K+含量和质膜H+-ATP酶活性测定
Na+、K+按赵旭等[24]的方法浸提,FP640型火焰光度计测定含量。质膜H+-ATP酶活性测定采用陈海燕等[25]的方法。
1.5 数据处理
数据以平均值±标准差表示,SPSS16.0方差分析,Duncan法多重比较(P<0.05)。
2 结果与分析
2.1 混合盐碱胁迫对裸燕麦种子萌发的影响
从表2可见,随着处理浓度增大,裸燕麦萌发种子胚根和胚芽长度明显下降,胚根和胚芽长分别比CK下降27.8%~96.2%和21.5%~94.0%;种子萌发率、萌发指数和活力指数显著降低,与CK相比,分别降低了0.34%~65.7%、0.24%~81.9%和21.7%~98.9%。种子萌发率反映种子生活力,萌发指数反映种子发芽的速率和整齐度,活力指数说明萌发苗的健壮程度。由此表明混合盐碱胁迫抑制裸燕麦的种子萌发和壮苗形成。
2.2混合盐碱胁迫对裸燕麦幼苗生长和组织含水量的影响
从表3可知,随着混合盐碱浓度增大,燕麦植株鲜重、干重和组织含水量明显下降,分别比CK下降了15.6%~80.1%、13.4%~70.9%和25.4%~317.7%,植株干重和组织含水量间呈极显著正相关关系(r=0.926**),说明混合盐碱胁迫下组织含水量的下降是造成裸燕麦生物量降低的重要因素。
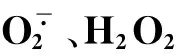

2.4混合盐碱胁迫对裸燕麦幼苗叶片抗氧化系统的影响
由表5可见,混合盐碱胁迫强度提高,裸燕麦叶片SOD活性和GSH含量逐渐增大,CAT活性明显下降,POD和APX活性呈先升后降变化。ASA含量在25~75 mmol·L-1浓度处理下与CK差异不显著,100和125 mmol·L-1浓度处理时明显低于CK,下降幅度分别为CK的31.1%和66.7%。
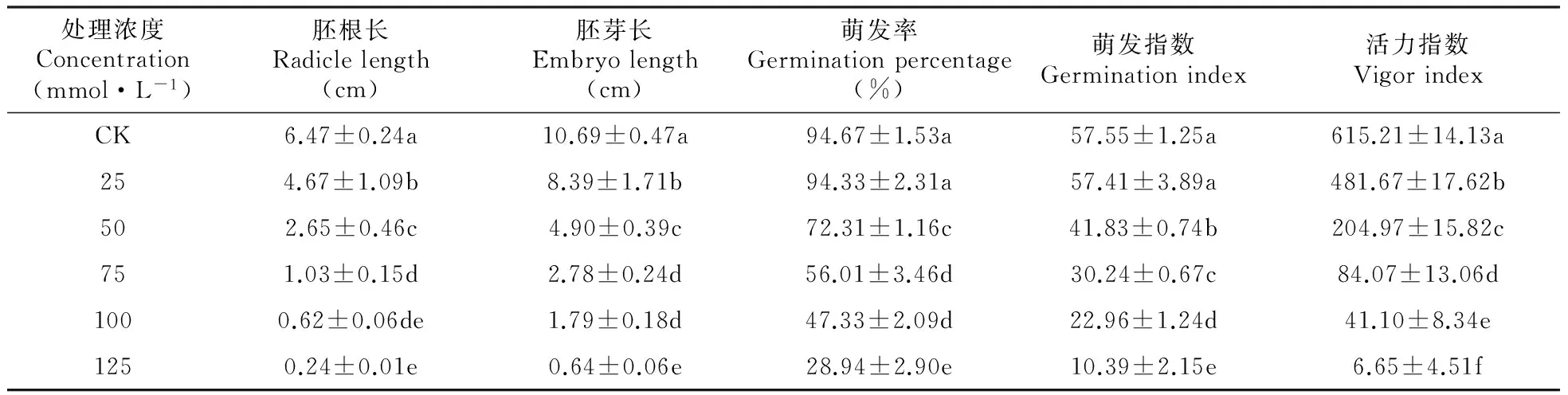
表2 混合盐碱胁迫对裸燕麦种子萌发的影响
注:同列不同字母表示差异显著,下同。
Noet:Different letters in same column means significant difference atP<0.05,the same as below.
表3混合盐碱胁迫对裸燕麦幼苗鲜重、干重和组织含水量的影响
Table3Effectsofcomplexsaline-alkalistressonfreshanddryweightsandplantwatercontentinA.nudeseedlings

处理浓度Concentration(mmol·L-1)鲜重Freshweight(mg·plant-1)干重Dryweight(mg·palnt-1)组织含水量Plantwatercontent(%)CK286.40±22.58a28.68±2.13a898.6±12.5a25241.84±19.73a24.85±1.83a873.2±12.0a50153.30±12.59b16.58±2.05b824.6±14.1b75115.72±10.14bc13.53±1.22bc755.3±8.5c10083.31±15.03cd10.79±0.82cd672.1±5.0d12556.96±14.26d8.35±0.79d580.9±16.1e
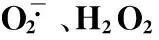
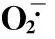

处理TreatmentO·2含量O·2content(nmol·g-1DW·min-1)H2O2含量H2O2content(mg·g-1DW)MDA含量MDAcontent(nmol·g-1DW)质膜相对透性Relativemembranepermeability(%)CK11.09±0.44e38.71±2.78d68.34±6.43d14.92±0.74e2538.81±6.39d48.22±1.01c81.77±5.12d16.26±0.52e5043.30±3.06d52.35±0.62bc135.45±3.28c31.85±0.74d7559.88±2.74c55.82±2.78b166.49±6.21b57.93±2.57c10092.48±4.91b62.03±3.13a182.10±4.85b76.77±1.91b125140.64±5.73a64.79±1.39a218.03±7.52a94.89±2.77a
表5混合盐碱胁迫对裸燕麦幼苗叶片SOD、CAT、POD、APX活性和AsA、GSH含量的影响
Table5Effectsofcomplexsaline-alkalistressonactivitiesofSOD,CAT,POD,APXandcontentsofAsA,GSHinleavesofA.nudeseedlings

处理TreatmentSOD活性SODactivity(U·g-1DW)CAT活性CATactivity(U·g-1DW)POD活性PODactivity(U·g-1DW)APX活性APXactivity(U·g-1DW)AsA含量AsAcontnet(mg·g-1DW)GSH含量GSHcontent(μg·g-1DW)CK579.0±16.02e108.23±5.46a13.89±2.83d82.16±6.21d23.03±2.13a12.99±3.54c25681.4±25.81d66.61±7.09b20.42±4.02d116.32±4.87c25.08±1.21a13.55±2.86c50887.2±21.26c79.02±6.55b94.06±10.79c154.62±5.42b23.75±3.83a22.32±3.62b751212.7±32.60b69.13±3.28b292.94±9.12a189.39±2.88a24.24±0.58a31.85±1.93a1001301.0±20.30a47.25±4.86c148.77±10.46b105.97±7.18c15.86±0.83b34.36±4.63a1251376.9±46.51a30.77±2.38d150.08±8.20b45.04±5.71e7.67±1.68c3.67±1.93a
2.5混合盐碱胁迫对裸燕麦幼苗叶片渗透调节物质积累的影响
由表6可知,随着混合盐碱浓度增大,裸燕麦叶片可溶性蛋白质含量先升高后降低,游离氨基酸含量先降低然后逐渐升高。25 mmol·L-1浓度处理显著提高了可溶性糖含量,50和75 mmol·L-1处理时分别比CK下降了19.9%和11.1%,而100和125 mmol·L-1浓度却增加了29.6%和7.8%。有机酸和脯氨酸含量随处理浓度提高呈显著递增趋势。
表6混合盐碱胁迫对裸燕麦幼苗叶片可溶性蛋白质、可溶性糖、游离氨基酸、脯氨酸和有机酸含量的影响
Table6Effectsofcomplexsaline-alkalistressoncontentsofsolubleprotein,solublesugar,freeaminoacid,ProlineandorganicacidinleavesofA.nudeseedlings
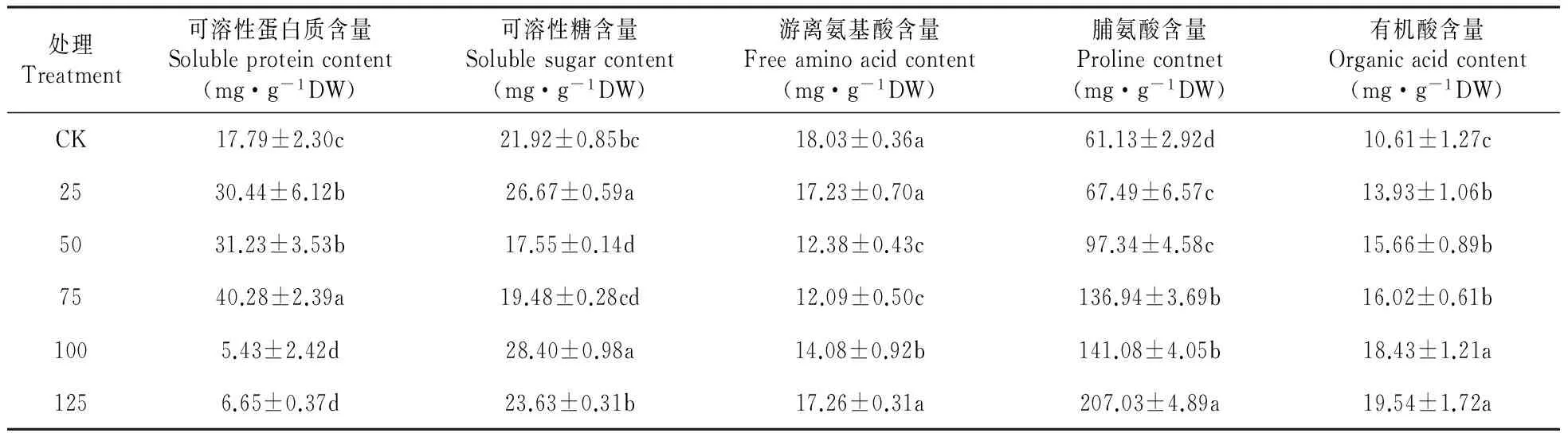
处理Treatment可溶性蛋白质含量Solubleproteincontent(mg·g-1DW)可溶性糖含量Solublesugarcontent(mg·g-1DW)游离氨基酸含量Freeaminoacidcontent(mg·g-1DW)脯氨酸含量Prolinecontnet(mg·g-1DW)有机酸含量Organicacidcontent(mg·g-1DW)CK17.79±2.30c21.92±0.85bc18.03±0.36a61.13±2.92d10.61±1.27c2530.44±6.12b26.67±0.59a17.23±0.70a67.49±6.57c13.93±1.06b5031.23±3.53b17.55±0.14d12.38±0.43c97.34±4.58c15.66±0.89b7540.28±2.39a19.48±0.28cd12.09±0.50c136.94±3.69b16.02±0.61b1005.43±2.42d28.40±0.98a14.08±0.92b141.08±4.05b18.43±1.21a1256.65±0.37d23.63±0.31b17.26±0.31a207.03±4.89a19.54±1.72a
2.6混合盐碱胁迫对裸燕麦幼苗叶片K+、Na+含量和质膜H+-ATP酶活性的影响
随着混合盐碱浓度提高,裸燕麦叶片K+含量明显降低,Na+含量显著升高,从而导致K+/Na+不断降低(表7)。质膜H+-ATP酶活性随处理浓度增加呈先升后降变化,75 mmol·L-1处理时活性出现最高值,125 mmol·L-1时其活性显著低于CK,下降幅度达43.6%。
表7混合盐碱胁迫对裸燕麦幼苗叶片K+、Na+含量和质膜H+-ATP酶活性的影响
Table7Effectsofcomplexsaline-alkalistressonK+,Na+contentsandplasmamembraneH+-ATPaseactivityinleavesofA.nudeseedlings
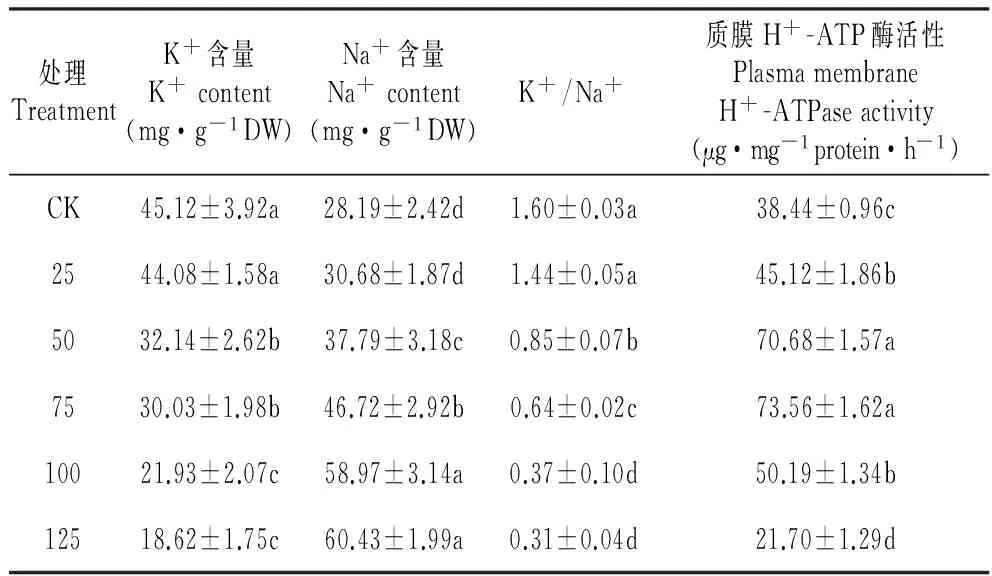
处理TreatmentK+含量K+content(mg·g-1DW)Na+含量Na+content(mg·g-1DW)K+/Na+质膜H+-ATP酶活性PlasmamembraneH+-ATPaseactivity(μg·mg-1protein·h-1)CK45.12±3.92a28.19±2.42d1.60±0.03a38.44±0.96c2544.08±1.58a30.68±1.87d1.44±0.05a45.12±1.86b5032.14±2.62b37.79±3.18c0.85±0.07b70.68±1.57a7530.03±1.98b46.72±2.92b0.64±0.02c73.56±1.62a10021.93±2.07c58.97±3.14a0.37±0.10d50.19±1.34b12518.62±1.75c60.43±1.99a0.31±0.04d21.70±1.29d
3 讨论
3.1混合盐碱胁迫对裸燕麦种子萌发和幼苗生长的影响
种子萌发是植物完成生活史的重要阶段,形成壮苗是作物高产优质的前期。甘肃中部土壤较高的盐碱含量对裸燕麦生长发育影响很大,尤其是播种时期正值春季返盐季节,盐碱胁迫成为裸燕麦壮苗形成和产量提高的重要限制因素。本试验模拟种植地土壤盐碱组成,探讨了混合盐碱胁迫对‘定莜6号’裸燕麦新品种种子萌发和幼苗生长的影响。结果表明,盐碱胁迫不仅抑制裸燕麦种子的萌发进程,还影响壮苗的形成(表2)。根据武俊英等[26]燕麦种子发芽耐盐适宜范围和耐盐半致死浓度分别是发芽率达对照75%以上和50%时相应盐浓度的标准,将混合盐碱浓度与萌发率反正弦转换值进行线性回归(回归方程为y=79.403-0.376x,y为萌发百分率的反正弦转换值,x为混合盐碱浓度,F=99.24**)确定‘定莜6号’裸燕麦种子萌发适宜的混合盐碱浓度大约为0~50 mmol·L-1,半致死浓度为90 mmol·L-1左右。对3叶1心期‘定莜6号’裸燕麦幼苗进行混合盐碱胁迫后植株生长的影响结果表明(表3),随着混合盐碱胁迫浓度增大,植株含水量和生物量明显下降,植株含水量和生长量显著相关(P<0.05),说明盐碱胁迫下水分亏缺是裸燕麦幼苗生长受抑的主要因素之一,这与王波和宋凤斌[12]的结果一致。多数研究以生长量下降50%时的盐浓度作为耐盐阈值[27]。若以干重和混合盐碱浓度线性回归(回归方程为y=27.621 4-0.167 9x,y为干重,x为混合盐碱浓度,r=0.976**)确定‘定莜6号’幼苗耐受的混合盐碱浓度,其阈值为80 mmol·L-1左右。这个阈值远低于胀果甘草(Glycyrrhizainflata)幼苗适宜生长的最高盐浓度278.17 mmol·L-1[28]及青山杨(Populuspseudo-cathayana×P.deltoide)耐受盐度200 mmol·L-1[29],但与同为禾本科的狼尾草(Pennisetumamericanum×P.purpureum)耐盐阈值接近[27]。胀果甘草在低盐浓度(<100 mmol·L-1NaCl)下的盐适应机制以耐盐方式为主;高盐浓度(≥200 mmol·L-1)时将Na+主要累积在下部叶片并通过脱落的方式带走体内盐分,盐适应机制以避盐方式为主。狼尾草的耐盐方式为拒盐[27],裸燕麦适应盐碱的机制可能以气孔排盐方式为主[13]。
3.2混合盐碱胁迫对裸燕麦幼苗活性氧代谢的影响

3.3混合盐碱胁迫对裸燕麦渗透调节物质积累和离子平衡的影响
积累渗透溶质进行渗透调节和维持离子的平衡是植物适应盐胁迫的重要策略[24]。盐胁迫引起胞质Na+升高,Na+通过跨质膜转运或跨液泡膜区隔化至液泡中使胞质免受伤害[33],胞质中则积累可溶性糖和脯氨酸等低分子量物质来维持细胞的渗透平衡[34]。而Na+的跨膜转运需要H+-ATP酶提供驱动力[35]。另外,植物在盐胁迫下大量积累Na+的同时会抑制K+的吸收。因此,维持K+、Na+平衡是衡量植物耐盐性的重要指标[14,17,24]。本试验表明,裸燕麦幼苗叶片Na+含量随混合盐碱胁迫浓度增大而增加,K+含量和K+/Na+却下降(表6),说明盐碱胁迫破坏了K+、Na+平衡。25~100 mmol·L-1混合盐碱胁迫不同程度提高了裸燕麦质膜H+-ATP酶活性(表6),这可能为裸燕麦降低胞质Na+积累提供了驱动力,从而减轻单盐毒害和维持胞质pH稳态[25];125 mmol·L-1混合盐碱胁迫导致质膜H+-ATP酶活性显著下降,这可能是活性氧积累造成质膜损伤所致[36]。可溶性蛋白质有较强的持水力,其中大多数是参与代谢反应的酶类,可溶性蛋白质可保护细胞表面,调节细胞与外界渗透压的平衡,缓解盐离子的毒害[37]。裸燕麦幼苗在25~75 mmol·L-1混合盐碱胁迫下可溶性蛋白质含量明显提高可能在其盐碱胁迫适应中发挥了重作用;100和150 mmol·L-1盐碱胁迫下可溶性蛋白含量降低可能是其盐碱耐性下降的重要因素。可溶性糖、脯氨酸和有机酸是主要的有机渗透调节物质[27~29]。本试验中,25 mmol·L-1混合盐碱胁迫即引起裸燕麦幼苗叶片有机酸和脯氨酸含量显著提高,并随处理浓度增大含量明显提高,完全符合敏感胁变指标的特点。因此,有机酸和脯氨酸可能是裸燕麦适应盐碱重要的渗透溶质。另外,有机酸还可能在保障燕麦体内正负电荷平衡、维持细胞pH稳定中发挥着重要作用[38]。脯氨酸除作为渗透调节物质外,还具有保护代谢酶类的作用[39]。然而,脯氨酸是否为逆境下一种有效的渗透调节物质,目前尚未定论。本试验结果与杨春武等[39]以小冰麦为材料的研究结果一致,而与吴成龙等[40]以菊芋为材料的结果不同。我们认为,脯氨酸在裸燕麦幼苗适应混合盐碱胁迫中可能既是重要的渗透调节物质也发挥了保护酶类的作用。裸燕麦幼苗叶片可溶性糖含量在25和100 mmol·L-1混合盐碱胁迫下显著高于对照,可能发挥了渗透调节作用;在50、75和125 mmol·L-1浓度下的可溶性糖含量及不同处理浓度下的游离氨基酸含量与对照差异不显著或明显降低,没有发挥渗透调节功能。这与枸杞对NaCl胁迫的响应类似[30],但与菊芋对碱的胁变反应不同[40]。不同植物种类耐盐碱机理可能存在差异。对于盐碱胁迫下裸燕麦脯氨酸合成的途径及积累有机酸的分子机理尚需进一步探讨。
4 结论
随着混合盐碱胁迫浓度提高,裸燕麦种子萌发和幼苗生长受抑显著增强。本实验条件下,‘定莜6号’裸燕麦种子萌发适宜的混合盐碱浓度<50 mmol·L-1,幼苗能够耐受的混合盐碱浓度阈值为80 mmol·L-1左右。混合盐碱胁迫下,活性氧代谢失调引发的膜脂氧化损伤及K+、Na+代谢平衡破坏可能是裸燕麦生物量下降的重要因素,有机酸和脯氨酸可能在裸燕麦适应混合盐碱胁迫中发挥着重要的渗透调节作用。
1.Kenneth K T.Agricultural Salinity Assessment and Management[M].New York:American Society of Civil Engineers,1990:1-17.
2.薛延丰,刘兆普.不同浓度NaCl和Na2CO3处理对菊芋幼苗光合及叶绿素荧光的影响[J].植物生态学报,2008,32(1):161-167.
3.杨春武,李长有,尹红娟,等.小冰麦(Triticumaestivum-Agropyronintermedium)对盐胁迫和碱胁迫的生理响应[J].作物学报,2007,33(8):1255-1261.
4.麻莹,曲冰冰,郭立泉,等. 盐碱混合胁迫下抗碱盐生植物碱地肤的生长及其茎叶中溶质积累特点[J].草业学报,2007,16(4):25-33.
5.范远,任长忠,李品芳,等.盐碱胁迫下燕麦生长及阳离子吸收特征[J].应用生态学报,2011,22(11):2875-2882.
6.Drzikova B,Dongowski G,Gebhardt E.Dietary fibre-rich oat-based products affect serum lipids,microbiota,formation of short-chain fatty acids and steroids in rats[J].British Journal of Nutrition,2005,94(6):1012-1025.
7.林叶春,曾昭海,任长忠,等.局部根区灌溉对裸燕麦光合特征曲线及叶绿素荧光特性的影响[J].作物学报,2012,38(6):1062-1070.
8.吴娜,曾昭海,任长忠,等.播期对裸燕麦生物学特性和产量的影响[J].麦类作物学报,2008,28(3):496-501.
9.彭远英,颜红海,郭来春,等.燕麦属不同倍性种质资源抗旱性状评价及筛选[J].生态学报,2011,31(9):2478-2491.
10.吴娜,卜洪震,曾昭海,等.灌溉定额对夏播裸燕麦产量和品质的影响[J].草业学报,2010,19(5):204-209.
11.吴斌,张宗文.燕麦葡聚糖合酶基因AsCSLH的克隆及特征分析[J].作物学报,2011,37(4):723-728.
12.王波,宋凤斌.燕麦对盐碱胁迫的反应和适应性[J].生态环境,2006,15(3):625-629.
13.王波,张金才,宋凤斌,等.燕麦对盐碱胁迫的生理响应[J].水土保持学报,2007,21(3):86-89.
14.范远,任长忠,李品芳,等.盐碱胁迫下燕麦生长及阳离子吸收特征[J].应用生态学报,2011,22(11):2875-2882.
15.王波,宋凤斌,任长忠,等.盐碱胁迫对燕麦叶绿体超微结构及一些生理指标的影响[J].吉林农业大学学报,2005,27(5):473-477,485.
16.王 波,张金才,宋凤斌,等.盐碱胁迫对燕麦光合特性的影响[J].中国农学通报,2007,23(5):235-238.
17.萨如拉,刘景辉,刘伟,等.盐碱胁迫对燕麦幼苗Na+、K+含量及产量的影响[J].西北农业学报,2014,23(3):50-54.
18.缑倩倩,韩致文,屈建军,等.秦王川灌区农田土壤盐分离子特征分析[J].土壤,2014,46(1):100-106.
19.高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006:208-223.
20.Sergiev I,Alexieva V,Karanov E.Effect of spermine,atrazine and combination between them on some endogenous protective systems and stress markers in plants[J].Comptes Rendus de I’ Academie Bulgare des Sciences,1997,51(2):121-124.
21.Arakawa N,Tsutsumi K,Sanceda NG,et al.A rapid and sensitive method for the determination of ascorbic acid using 4,7-diphenyl-1,10-phenanthroline[J].Agricultural and Biological Chemistry,1981,45(5):1289-1290.
22.Ellman G L.Tissue sulfhydryl groups[J].Archives of Biochemistry and Biophysics,1959,82(1):70-77.
23.李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:134-260.
24.赵旭,王林权,周春菊,等.盐胁迫对四种基因型冬小麦幼苗Na+、K+吸收累积的影响[J].生态学报,2007,27(1):205-213.
25.陈海燕,崔香菊,陈熙,等.盐胁迫及La3+对不同耐盐性水稻根中抗氧化酶及质膜H+-ATPase的影响[J].作物学报,2007,33(7):1086-1093.
26.武俊英,刘景辉,翟利剑,等.不同品种燕麦种子萌发和幼苗生长的耐盐性[J].生态学杂志,2009,28(10):1960-1965.
27.王殿,袁芳,王宝山,等.能源植物杂交狼尾草对NaCl胁迫的响应及其耐盐阈值[J].植物生态学报,2012,36(6):572-577.
28.陆嘉惠,吕新,梁永超,等.新疆胀果甘草幼苗耐盐性及对NaCl胁迫的离子响应[J].植物生态学报 2013,37(9):839-850.
29.闫永庆,王文杰,朱虹,等.混合盐碱胁迫对青山杨渗透调节物质及活性氧代谢的影响[J].应用生态学报,2009,20(9):2085-2091.
30.毛桂莲,许兴,杨涓.NaCl和Na2CO3对枸杞的胁迫效应干旱地区农业研究[J].干旱地区农业研究,2004,22(2):100-104.
31.Vandenabeele S,Vanderauwera S,Vuylsteke M,et al.Catalase deficiency drastically affects gene expression induced by high light inArabidopsisthaliana[J].The Plant Journal,2004,39(1):45-58.
32.Asada K.Ascorbate peroxidase-a hydrogen peroxide-scavenging enzyme in plants[J].Physiologia Plantarum,1992,85(2):235-241.
33.Parida A K,Das A B.Salt tolerance and salinity effects on plants:A review[J].Ecotoxicology and Environmental Safety,2005,60(3):324-349.
34.Munns R,Tester M.Mechanisms of salinity tolerance[J].Annual Review of Plant Biology,2008,59(1):651-681.
35.Petrov V V,Ibragimov R I.Effect of point substitutions of Asp-714 and Asp-720 residues on the structure and function of the H+-ATPase of the yeast plasma membrane[J].Applied Biochemistry and Microbiology,2014,50(5):508-515.
36.Kerkeb L,Donaire J P,Rodriguez-Rosales M P.Plasma membrane H+-ATPase activity is involved in adaptation of tomato call to NaCl[J].Physiologia Plantarum,2001,111(4):483-490.
37.刘开力,韩航如,徐颖洁,等.外源一氧化氮对水稻根部脂质过氧化的缓解作用[J].中国水稻科学,2005,19(4):333-337.
38.杨春武,李长有,张美丽,等.盐、碱胁迫下小冰麦体内的pH及离子平衡[J].应用生态学报,2008,19(5):1000-1005.
39.Santa-Cruz A,Acosta M,RusA,et al.Short-term salt tolerance mechanisms in differentially salt tolerant tomato species[J].Plant Physiology and Biochemistry,1999,37(1):65-71.
40.吴成龙,周春霖,尹金来,等.碱胁迫对不同品种菊芋幼苗生物量分配和可溶性渗透物质含量的影响[J].中国农业科学,2008,41(3):901-909.
EffectsofComplexSaline-alkaliStressonSeedGerminationandStress-resistancePhysiologicalCharacteristicsofNakedOatSeedlings
LIU Jian-Xin1,2WANG Jin-Cheng1,2WANG Rui-Jian1,2JIA Hai-Yan1,2
(1.College of Life Science and Technology,Longdong University,Qingyang 745000;2.Provincial Key Laboratory for Protection and Utilization of Longdong Bio-resources in Gansu Province,Qingyang 745000)
We studied the effects of salt-alkaline mixed stress on seeds germination, seedlings growth and leaf physiological characteristics of stress-resistance for the physiological response of a new naked oat(Avenanude) cultivar ‘Dingyou No 6’ to complex saline-alkali stress.A.nudeseeds and seedlings were cultivated in sands with different complex saline-alkali solution addition according to soil salinity composition of the planting areas. Germination rate, germination index, vigor index of seeds, water content and dry weight of seedlings were significantly decreased, while the contents of superoxide anion, hydrogen peroxide and malondialdehyde and relative plasma membrane permeability in leaves were increased evidently with increasing of the complex saline-alkaline stress. The complex saline-alkaline stress increased significantly Na+contents, but reduced K+contents and K+/Na+. The activities of plasma membrane H+-ATPase, peroxidase, ascorbate peroxidase and soluble protein content in leaves of the seedlings exhibited a humped-curve, while superoxide dismutase activities and the contents of glutathione, organic acid and proline were significantly increased. Catalase activity and ascorbic acid content were decreased evidently, free amino acid content first decreased and then increased, and soluble sugar content demonstrated a rose at first, and then dropped at last rose again. The imbalance of active oxygen metabolism and the disturbance of Na+and K+homeostasis in leaves resulted in the inhibition of naked oat seedlings growth, and the organic acid and proline are two possible osmotic adjusting substances of naked oats that are adapted to complex salt-alkaline stress.
Avenanude;complex saline-alkali stress;seed germination;active oxygen metabolism;osmotic adjusting substance
甘肃省庆阳市科技计划项目(kz2014-19)资助
刘建新(1964—),男,教授,主要从事植物逆境生理与细胞信号转导研究。
2015-07-19
Q945.78;S512.1
A
10.7525/j.issn.1673-5102.2016.02.011

