薄壳山核桃根系水浸提液对2种作物种子萌发及幼苗生长的影响
张 权 姚小华* 滕建华 邵慰忠 傅松玲
(1.中国林科院亚热带林业研究所,富阳 311400; 2.浙江省金华市东方红林场,金华 321025; 3.浙江省建德市林业技术推广中心,建德 311600; 4.安徽农业大学林学与园林学院,合肥 230036)
* 通信作者:E-mail:yaoxh168@163.com
薄壳山核桃根系水浸提液对2种作物种子萌发及幼苗生长的影响
张 权1姚小华1*滕建华2邵慰忠3傅松玲4
(1.中国林科院亚热带林业研究所,富阳 311400;2.浙江省金华市东方红林场,金华 321025;3.浙江省建德市林业技术推广中心,建德 311600;4.安徽农业大学林学与园林学院,合肥 230036)
为探讨薄壳山核桃根系水浸提液对小麦、大豆的影响,采用蒸馏水浸提法收集薄壳山核桃根系化感物质,并运用室内生物测定法检测不同浓度(0.025、0.05和0.1 g·mL-1)根系水浸提液对小麦、大豆种子萌发和幼苗生长的影响。结果表明:各浓度处理的根系水浸提液对小麦、大豆萌发及幼苗生长的化感抑制作用较为显著,且具有显著的浓度效应(浓度低抑制作用弱,浓度高抑制作用强);薄壳山核桃根系水浸提液对小麦、大豆种子发芽率、发芽指数、发芽势和活力指数的抑制作用分别依次为:活力指数>发芽势>发芽指数>发芽率和活力指数>发芽势>发芽率>发芽指数;薄壳山核桃根系水浸提液各浓度处理对小麦、大豆幼苗根长、苗高、鲜质量和干质量的化感效应均为:根长>苗高>鲜质量>干质量,其中薄壳山核桃根系水浸提液对2种受体植物幼苗根长均有显著的抑制作用,而对幼苗干、鲜质量的影响则因受体植物种类的不同而不同;薄壳山核桃根系水浸提液对2种受体植物的综合化感效应顺序为:小麦>大豆;生长7 d的幼苗体内,SOD活性降低,MDA含量、POD活性和CAT活性与对照相比均随浓度的增加而增加。综合分析认为:小麦对薄壳山核桃根系水浸提液更为敏感。
薄壳山核桃;水浸提液;小麦;大豆;化感作用
化感作用又叫他感作用,是植物在自然界中长期进化的一种化学生态防御机制[1],它能够影响植物的萌芽、生长、繁殖和分布,对于优势种群的形成、群落的演替、植被的恢复、杂草的控制和作物病虫害的防治起着重要的作用[2~3]。研究表明化感作用不仅可以在种间进行,也可在种内进行,在农林业生产实践和研究中发现,许多作物的连作障碍和人工林的衰退是因为作物或林木释放的化学物质对其自身毒害的结果[4]。通常化感物质可通过挥发、淋溶、根系分泌、植物残体腐释、种子萌发、花粉传播等途径进入环境[5~7]。近年来,植物化感作用的研究已成为热点,研究者多采用生物测定等方法探讨化感作用物质种类、机理及其影响因素,其中对胡桃科植物的研究多集中在核桃属植物,对山核桃属植物的研究较少,张博[8]在研究山核桃属植物化感作用时发现,山核桃属2个树种的叶片水浸提液能够抑制刺槐(RobiniapseudoacaciaLinn.)、萝卜(RaphanussativusLinn.)、黑麦草(LoliummultiflorumLam.)种子的萌发及幼苗的生长。
薄壳山核桃(Caryaillinoensis)为胡桃科(Julandaceae)山核桃属(CaryaNutt)植物,是世界著名的干果树种,我国至今已有110年的种植历史[9]。近年来由于人们对土地利用率的不断重视,农林复合[10]已成为必然趋势,然而化感作用是农林复合生态系统中普遍存在的一种现象,如何利用植物间的化感作用合理配置栽种模式,避免自毒作物的连作和相克植物的搭配,是农林复合系统能否高产、高效和稳定的关键。本文以薄壳山核桃为供体,通过小麦(TriticumaestivumL.)、大豆(Glycinemax(L.) Merr)种子萌发及幼苗生长试验初步研究薄壳山核桃根系水浸提液的化感作用,旨在为薄壳山核桃林下种植模式的选择提供理论依据,避免相克植物套种。
1 材料与方法
1.1 根系水浸提液制备
薄壳山核桃根系于2014年12月采集于金华市东方红林场,洗净、风干、粉碎后过20目筛,以20 g干粉:200 mL蒸馏水的比例在20℃室温下浸泡24 h后,再用超声波震荡浸提30 min,然后离心过滤得到0.1 g·mL-1的浸提母液;将母液用蒸馏水稀释成0.05和0.025 g·mL-1浓度后,保存于4℃冰箱中待用。
1.2 化感作用测定
将小麦、大豆种子用1%的高锰酸钾浸泡15 min进行消毒,用蒸馏水反复冲洗干净,然后用温水浸种24 h,并用滤纸吸干种子表面多余水分。种子萌发采用培养皿室内模拟法,在直径为9 cm的培养皿中铺3层滤纸,每皿放小麦、大豆种子各30粒,并加入不同浓度供试浸提液15 mL,每个浓度处理重复3次,设蒸馏水作为对照,在20℃光照培养箱内培养(光照时间12 h·d-1)。处理1 d后统计各处理种子的发芽数(以芽长≥1 mm为准),每天统计一次,7 d后计算种子的发芽率(GR)、发芽势(GE)、发芽指数(GI)、活力指数(VI)和化感效应指数(RI),计算公式如下[11~14]:
发芽率(GR%)=(7 d内正常发芽的种子数/供试种子总数)×100%
(1)
发芽势(GE%)=(前3 d内正常发芽的种子数/供试种子总数)×100%
(2)
发芽指数:
GI=∑(Gt/Dt)
(3)
式中,Gt表示在第t天种子的发芽数;Dt代表相应的发芽天数。
活力指数:
VI=GI×S
(4)
式中,S为第7 d测得的整株鲜质量(g);GI为发芽指数。
化感效应指数:
RI=1-C/T(T≥C)或
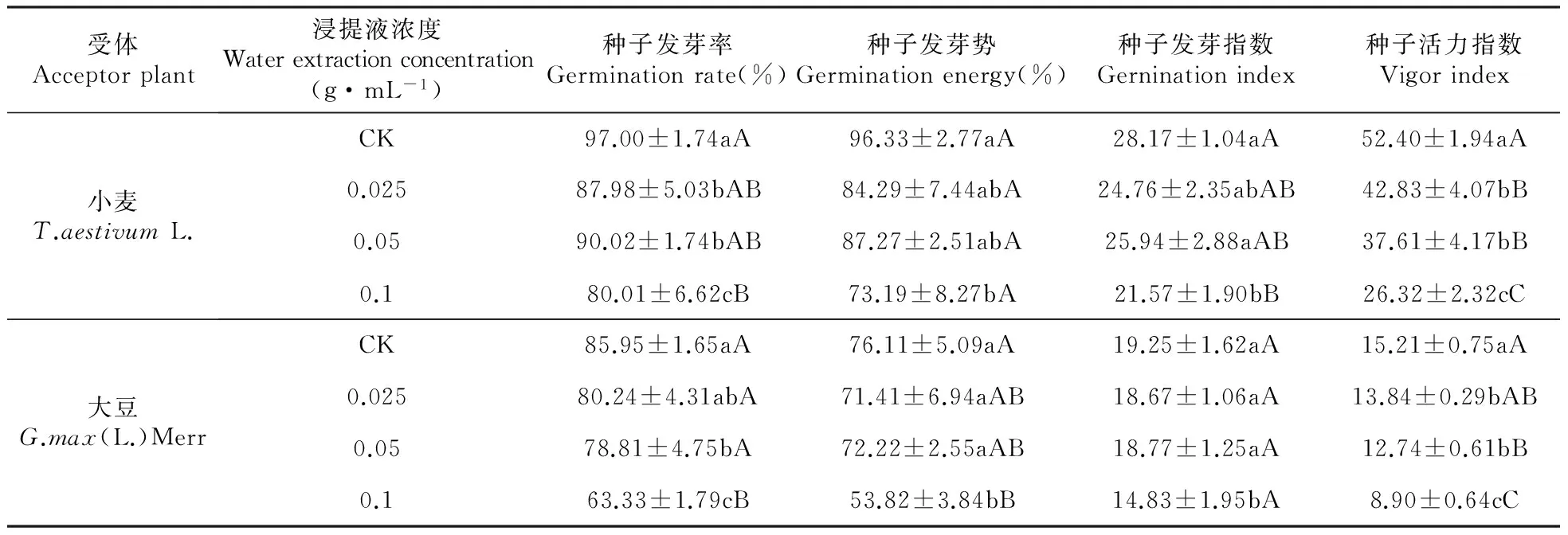
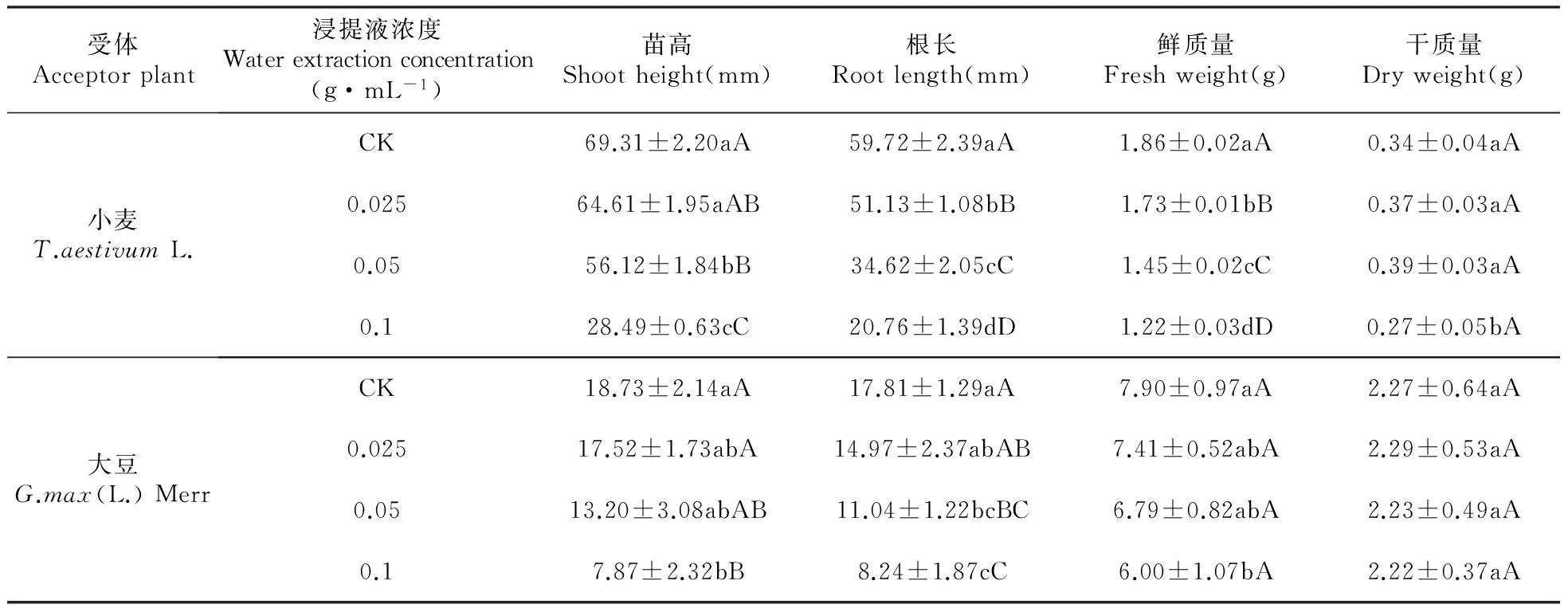
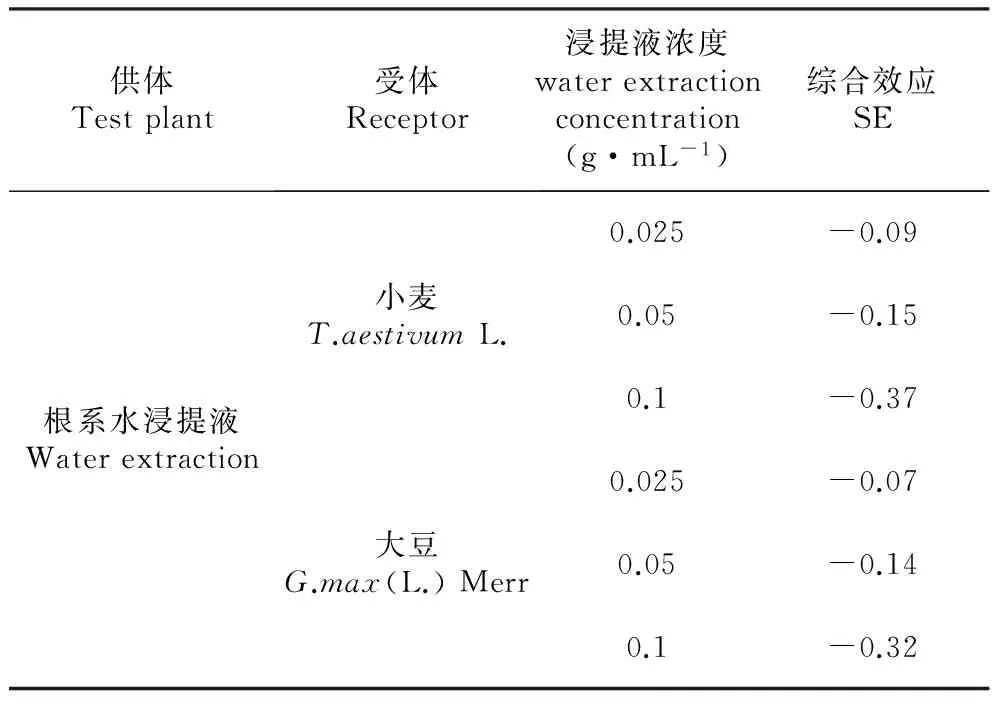
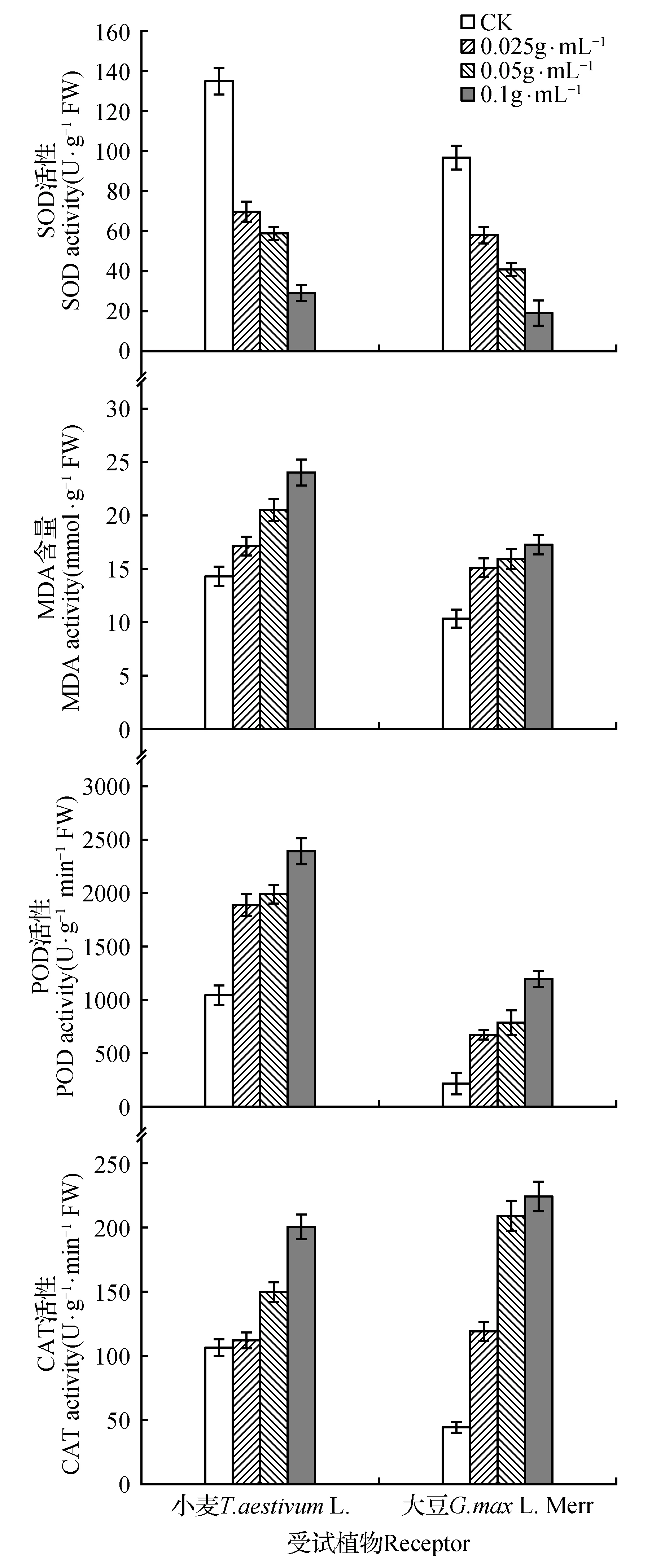
RI=T/C-1(T (5) 式中:C为对照值,T为处理值。当RI>0时为促进作用,当RI<0时为抑制作用,RI绝对值的大小代表化感作用的强弱。 另外,还常用综合效应(SE)反应化感效应的强弱,其是指同一处理下对同一受体各测试项目化感效应指数(RI)的算术平均值[15]。本试验中的计算公式为: SE=(RI种子发芽率+RI种子发芽势+RI种子发芽指数+RI种子活力指数+RI幼苗根长+RI幼苗苗高+RI幼苗鲜质量+RI幼苗干质量)/8 (6) 第7 d时,用直尺测定每株幼苗的苗高和根长,并采用氮蓝四唑法、硫代巴比妥酸法、愈创木酚法和紫外吸收法测定幼苗的生理指标(SOD、MDA、POD、CAT)[16~17](测定幼苗根长时,从每个培养皿中随机挑选10株幼苗进行测量,取平均值,有须根的测量最长根),用电子天平称量整株鲜质量及干质量(105℃杀青0.5 h后,70℃烘干至恒重)。最后用综合效应SE对小麦和大豆所受的化感作用进行综合评价[18~20]。 1.3 数据分析 采用Excel2003和SPSS19.0系统软件进行数据的方差分析,用LSD(P<0.05)方法进行多重比较,以分析不同浓度的薄壳山核桃根系水浸提液对小麦、大豆种子萌发和幼苗生长的影响。 2.1薄壳山核桃根系水浸提液对2种种子萌发的化感作用 由表1和图1可以看出,薄壳山核桃根系水浸提液对小麦、大豆种子的萌发均表现出一定的化感抑制作用,且这种抑制作用在测试浓度范围内具有浓度依赖性[20],即浓度较高时,抑制作用增强,浓度较低时,抑制作用减弱。在薄壳山核桃根系水浸提液对小麦种子萌发的影响中,各浓度处理下的小麦种子发芽率均与对照组有显著差异(P<0.05),浓度为0.1 g·mL-1处理时小麦种子发芽率降低最多,为17.52%,与对照相比达到了极显著差异(P<0.01);对于小麦种子发芽势和发芽指数而言,浓度为0.1 g·mL-1的根系水浸提液处理组与对照组相比分别减少了24.02%和23.43%,均达到了显著差异(P<0.05),其它各浓度处理与对照组均无显著性差异;薄壳山核桃根系水浸提液各处理组的小麦种子活力指数与对照组相比均为极显著差异(P<0.01),且随着处理浓度的增大小麦种子活力指数有减小的现象。薄壳山核桃根系水浸提液对大豆种子发芽率、发芽指数和活力指数的化感抑制作用均随着处理浓度的增加而增强,在0.1 g·mL-1浓度处理下大豆种子发芽率、发芽指数和活力指数与对照相比,分别减少了26.32%、2.49%和16.24%,其中种子发芽率和活力指数均达到了极显著差异(P<0.01);薄壳山核桃根系水浸提液对大豆种子发芽势的影响中,当处理浓度为0.025和0.05 g·mL-1时,虽然表现出不同于"随着处理浓度增加而增强"的整体现象,但随着浓度(当浓度为0.1 g·mL-1时)的增加也表现为抑制作用增强的现象。综合图1来看,各浓度薄壳山核桃根系水浸提液对小麦种子萌发的抑制作用较高,其化感效应指数为-2.20。在小麦、大豆种子萌发时,薄壳山核桃根系水浸提液对其活力指数的抑制作用最强,其化感效应指数分别为-0.96和-0.67。 表1薄壳山核桃根系水浸提液对小麦、大豆种子发芽率、发芽势、发芽指数和活力指数的影响 Table1EffectsofwaterextractionfromrootsofC.illinoensisongerminationrate,germinationenergy,germinationindex,andvigorindexofT.aestivumL.andG.max(L.)Merr 受体Acceptorplant浸提液浓度Waterextractionconcentration(g·mL-1)种子发芽率Germinationrate(%)种子发芽势Germinationenergy(%)种子发芽指数Gerninationindex种子活力指数Vigorindex小麦T.aestivumL.CK97.00±1.74aA96.33±2.77aA28.17±1.04aA52.40±1.94aA0.02587.98±5.03bAB84.29±7.44abA24.76±2.35abAB42.83±4.07bB0.0590.02±1.74bAB87.27±2.51abA25.94±2.88aAB37.61±4.17bB0.180.01±6.62cB73.19±8.27bA21.57±1.90bB26.32±2.32cC大豆G.max(L.)MerrCK85.95±1.65aA76.11±5.09aA19.25±1.62aA15.21±0.75aA0.02580.24±4.31abA71.41±6.94aAB18.67±1.06aA13.84±0.29bAB0.0578.81±4.75bA72.22±2.55aAB18.77±1.25aA12.74±0.61bB0.163.33±1.79cB53.82±3.84bB14.83±1.95bA8.90±0.64cC 注:同列数据后标不同小写字母者表示在5%水平的差异(P<0.05);标不同大写字母者表示在1%水平的差异(P<0.01)。下同。 Note:Small letters indicate the significant differences at 5% probability level(P<0.05) and capital letters indicate the significant differences at 1% probability level(P<0.01). The same as below. 图1 薄壳山核桃根系水浸提液对小麦、大豆种子发芽率、发芽势、发芽指数和活力指数的化感效应Fig.1 Allelopathic effects of water extraction from roots of C.illinoensis on germination rate,germination energy,germination index,and vigor index of T.aestivum L. and G.max(L.) Merr 图2 薄壳山核桃根系水浸提液对小麦、大豆苗高、根长、鲜质量和干质量的化感效应Fig.2 Allelopathic effects of water extraction from roots of C.illinoensis on shoot height,root length,fresh weight and dry weight of T.aestivum L. and G.max(L.) Merr 2.2薄壳山核桃根系水浸提液对2种植物幼苗生长的化感作用 由表2和图2可知,薄壳山核桃根系水浸提液对小麦、大豆的幼苗生长均有一定的化感抑制作用。随着浸提液浓度的增加,对小麦幼苗苗高的抑制作用增强,在0.1 g·mL-1处理下,小麦幼苗苗高受到的抑制作用最大,为58.89%,与对照相比达到了极显著差异(P<0.01);小麦幼苗的根长和鲜质量在各浓度处理下与对照相比均达到了极显著差异(P<0.01),且表现出显著的浓度依赖性;小麦幼苗干质量随浸提液浓度的增大而表现为化感作用增强的现象,在0.1 g·mL-1处理浓度下受到显著(P<0.05)的抑制作用,抑制率为20.59%。薄壳山核桃根系水浸提液各处理浓度对大豆幼苗的苗高、根长和鲜质量均表现为抑制作用,在0.025 g·mL-1处理浓度下抑制作用最低,分别为6.46%、15.95%和6.20%,在0.1 g·mL-1处理浓度下抑制作用最高,抑制率分别为57.98%、53.73%和24.05%,其中对大豆幼苗苗高和根长的抑制作用与对照相比均达到了极显著差异水平(P<0.01);综合看来,薄壳山核桃根系水浸提液各浓度处理对小麦幼苗生长的化感抑制作用较大,其化感效应指数为-2.90,在小麦、大豆幼苗生长过程中,薄壳山核桃根系水浸提液对其根长的抑制作用最高,其化感效应指数分别为-1.22和-1.08。 2.3薄壳山核桃根系水浸提液对2种植物的综合效应 薄壳山核桃不同浓度根系水浸提液对小麦和大豆的综合效应如表3所示,由表3知,薄壳山核桃根系水浸提液各浓度处理下的小麦、大豆的综合效应表现一致,均为抑制作用,且这种抑制作用与浓度的大小呈正相关性,即在低浓度下(0.025 g·mL-1),抑制作用弱,高浓度下(0.1 g·mL-1)抑制作用强,在0.025 g·mL-1处理浓度下,小麦、大豆的综合效应分别为-0.09和-0.07,在0.1 g·mL-1处理浓度下,小麦、大豆的综合效应分别为-0.37和-0.32。综合各浓度处理下小麦、大豆的综合效应可知,在相同浓度下薄壳山核桃根系水浸提液对小麦的抑制作用较强。 表2薄壳山核桃根系水浸提液对小麦、大豆苗高、根长、鲜质量和干质量的影响 Table2EffectsofwaterextractionfromrootsofC.illinoensisonshootheigh,rootlength,freshweight,anddryweightofT.aestivumL.andG.max(L.)Merr 受体Acceptorplant浸提液浓度Waterextractionconcentration(g·mL-1)苗高Shootheight(mm)根长Rootlength(mm)鲜质量Freshweight(g)干质量Dryweight(g)小麦T.aestivumL.CK69.31±2.20aA59.72±2.39aA1.86±0.02aA0.34±0.04aA0.02564.61±1.95aAB51.13±1.08bB1.73±0.01bB0.37±0.03aA0.0556.12±1.84bB34.62±2.05cC1.45±0.02cC0.39±0.03aA0.128.49±0.63cC20.76±1.39dD1.22±0.03dD0.27±0.05bA大豆G.max(L.)MerrCK18.73±2.14aA17.81±1.29aA7.90±0.97aA2.27±0.64aA0.02517.52±1.73abA14.97±2.37abAB7.41±0.52abA2.29±0.53aA0.0513.20±3.08abAB11.04±1.22bcBC6.79±0.82abA2.23±0.49aA0.17.87±2.32bB8.24±1.87cC6.00±1.07bA2.22±0.37aA 表3薄壳山核桃不同浓度根系水浸提液对小麦、大豆的综合化感效应 Table3Syntheticeffects(SE)ofwaterextractionfromrootsofC.illinoensisonT.aestivumL.andG.max(L.)Merr 供体Testplant受体Receptor浸提液浓度waterextractionconcentration(g·mL-1)综合效应SE根系水浸提液Waterextraction小麦T.aestivumL.0.025-0.090.05-0.150.1-0.37大豆G.max(L.)Merr0.025-0.070.05-0.140.1-0.32 2.4薄壳山核桃根系水浸提液对2种植物幼苗生理指标的影响 由图3可以看出,在各浓度薄壳山核桃根系水浸提液处理下,小麦、大豆幼苗的SOD活性与对照相比均有不同程度的降低,在低浓度(0.025 g·mL-1)处理下降低最小,分别降低了47.90%和39.71%,在高浓度(0.1 g·mL-1)处理下降低最大,分别降低了78.23%和79.41%。在各处理浓度下,小麦、大豆幼苗的MDA含量均随浓度的增加而增加;在相同浓度处理下,小麦幼苗体内的MDA含量高于大豆幼苗体内含量,表明薄壳山核桃根系水浸提液使小麦幼苗膜脂过氧化程度严重而对小麦幼苗产生较大的伤害。在薄壳山核桃根系水浸提液各处理浓度下,小麦、大豆幼苗的POD、CAT活性均随着处理浓度的增加而增加,其中在相同处理浓度下小麦幼苗POD活性高于大豆幼苗,而小麦幼苗CAT活性小于大豆幼苗。 图3 薄壳山核桃不同浓度根系水浸提液对小麦、大豆幼苗生理指标的影响Fig.3 Effects of water extraction from roots of C.illinoensis on physiology indexes of T.aestivum L. and G.max(L.) Merr 不同浓度薄壳山核桃根系水浸提液(0.025、0.05和0.1 g·mL-1)对小麦、大豆的发芽及幼苗生长均有不同程度的抑制作用,且随着浓度的增大抑制作用增强。在相同浓度的处理中,薄壳山核桃根系水浸提液对小麦、大豆的抑制作用不同,这可能是因为化感作用对受体植物具有专一性和选择性[21],而且不同受体植物的遗传学和生物学特性不同,导致其对相同浓度下的薄壳山核桃根系水浸提液的化感反应不同。 薄壳山核桃根系水浸提液各浓度处理对小麦、大豆种子萌发的化感抑制作用中,小麦种子发芽率、发芽指数、发芽势和活力指数对其化感物质的敏感顺序为:活力指数>发芽势>发芽指数>发芽率,大豆种子发芽率、发芽指数、发芽势和活力指数对其化感物质的敏感顺序为:活力指数>发芽势>发芽率>发芽指数。小麦、大豆种子萌发时的活力指数对薄壳山核桃根系水浸提液的敏感性均较高,这说明化感物质可能首先影响种子的活力,当浓度达到一定程度后,可延迟种子的发芽时间,甚至使种子失活。 薄壳山核桃根系水浸提液各浓度处理对小麦、大豆幼苗根长、苗高、鲜质量和干质量的化感效应影响顺序均为:根长>苗高>鲜质量>干质量,其中对根长的影响最高,这可能是因为作为吸收营养物质主要器官的根系,首先与水浸提液中的化感物质接触[22],致使根系受到损伤,使得根系吸收营养物质的能力下降,从而影响植株的生长,使植物矮小瘦弱。 SOD(超氧化物歧化酶)、POD(过氧化物酶)和CAT(过氧化氢酶)是植物体内的主要抗氧化保护酶,在保护细胞膜系统和避免活性氧对有机体的毒害中起着重要的作用,所以这些酶活性的高低反应了植物体自我解毒的能力[23]。MDA(丙二醛)是膜脂过氧化的主要产物,常以其含量的高低作为判断膜脂过氧化的主要指标[24~25]。试验中薄壳山核桃根系水浸提液各浓度处理导致小麦、大豆幼苗的SOD活性降低,而对小麦、大豆幼苗的MDA含量、POD活性和CAT活性均有不同程度的增加,且与浓度高低呈正相关性。其中SOD活性降低将导致其体内的活性氧积累,引发膜脂过氧化,从而导致有害物质MDA含量的增加。POD能使组织中所含的某些碳水化合物转化成木质素,增加植物的木质化程度,因此可以把POD作为组织老化的一种生理指标[26~27]。试验中各浓度处理下的小麦、大豆幼苗POD活性均随着浓度的增大而增高,这可能是因为,在根系水浸提液的胁迫下,促使小麦、大豆提前进入衰老期,其通过加快生长发育进程来尽快使自身度过难关,有学者发现减产的水稻根系中POD的活性有增加的现象。试验中虽然CAT活性增加,但由于体内毒素积累使得自身的动态平衡还是了遭到破坏。 1.Rice E L.Allelopathy[M].2nd edition.New York:Academic Press,1984. 2.李美,高兴祥,高宗军,等.艾蒿对不同植物幼苗的化感作用初探[J].草业学报,2010,19(6):114-119. 3.白丽荣,时丽冉,徐振华,等.火炬树浸提液对几种农作物的化感作用[J].种子,2010,29(6):91-93. 4.黄建贝.核桃调落叶分解对小麦生长的影响[D].雅安:四川农业大学,2013. 5.温都日呼,王铁娟,韩文娟,等.4种植物水浸提液对乌丹蒿的化感作用研究[J].植物研究,2013,33(1):86-90. 6.杨建,谢小龙,胡延萍,等.唐古特大黄药材提取物对小麦和垂穗披碱草种子萌发和幼苗生长的影响[J].植物研究,2009,29(3):320-324. 7.李寿田,周健民,王火焰,等.植物化感作用研究概况[J].中国生态农业学报,2002,10(4):68-70. 8.张博,何开跃,郭丽君,等.山核桃属2个树种叶片水浸提物的化感作用及其化感物质的含量比较[J].江苏林业科技,2014,41(1):1001-7380. 9.常君,姚小华,王开良,等.薄壳山核桃丰产栽培与加工利用[M].北京:金盾出版社,2013. 10.Manoel B A,Roseane C S,Liziane M L,et al.Allelopathy,an alternative tool to improve cropping systems.A review[J]. Agronomy for Sustainable Development,2011(31):379-395. 11.慕小倩,何红花,董志刚.2种杂草水提液对小麦种子萌发及幼苗生长的影响[J].西北植物学报,2008,28(6):1165-1171. 12.郑光华.种子生理研究[M].北京:科学出版社,2004. 13.梁静,程智慧,徐鹏,等.白三叶腐解液对5种草坪草的化感作用研究[J].草地学报,2011,19(2):257-263. 14.余婷.白三叶(TrifoliumrepensL.)根系分泌物的化感作用研究[D].杨凌:西北农林科技大学,2013. 15.董强,杨顺义,王琰,等.黄花棘豆水浸提液对4种受体植物的化感作用的研究[J].湖南农业科学,2010(9):7-10. 16.李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000. 17.叶玉娟.含笑属三种植物的化感作用研究[D].南京:南京林业大学,2009. 18.沈慧敏,郭鸿儒,黄高宝.不同植物对小麦、黄瓜和萝卜幼苗化感作用潜力的初步评价[J]. 应用生态学报,2005,16(4):740-743. 19.MacRobbie E A.Signalling in guard cells and regulation of ion channel activity[J].Journal of Experinental Botany,1997,48:515-528. 20.董红云,李亚,汪庆,等.外来入侵植物牛膝菊和野茼蒿水浸提液化感作用的生物测定[J].植物资源与环境学报,2010,19(2):48-53. 21.Inderjit. Experimental complexities in evaluating the allelopathic activities in laboratory bioassays:a case study[J]. Soil Biology and Biochemistry,2006,38(2):256-262. 22.Chon S U,Coutts J H,Nnlson C J. Effects of light,growth media,and seedling orientation on bioassays of alfalfa auto toxicity[J]. Agronomy Joumal,2000,92:715-720. 23.Viator R P,Johnson R M,Grimm C C,et al. Allelopathic,autotoxic,and hormetic effects of postharvest sugarcane residue[J].Agronomy Journal,2006,98:1526-1531. 24.Smirnoff N.Antioxidant systems and plant respone of the environment[M].Oxford:Bios Scientific press,1995:217-243. 25.杨伟,龚荣高,廖明安.紫茎泽兰叶水浸液对芹菜和白菜种子萌发的化感作用[J].广东农业科学,2014:1004-874X. 26.王晓玲.胡桃醌类物对苦荞麦生长及保护酶活性的影响[D].太原:山西大学,2012. 27.尹永强,胡建,邓明军.植物叶片抗氧化系统及其对逆境胁迫的影响研究进展[J].中国农学通报,2007(23):105-110. EffectsofWaterExtractionfromRootsofCaryaillinoensisonSeedGerminationandSeedlingGrowthofTwoCrops ZHANG Quan1YAO Xiao-Hua1*TENG Jian-Hua2SHAO Wei-Zhong3FU Song-Ling4 (1.Research Institute of Subtropical Forestry,Chinese Academy of Forestry,Fuyang 311400;2.Dongfanghong Forest Farm of Jinhua City,Jinhua 321025;3.Jiande Forestry Extension Center of Zhejiang,Jiande 311600;4.School of Forestry and Landscape Architecture,Anhui Agricultural University,Hefei 230036) In order to probe the impact of water extraction from roots ofCaryaillinoensisforTriticumaestivumL. andGlycinemax(L.) Merr, we studied the effects of different levels(0.025, 0.05 and 0.1 g·mL-1) of water extraction from roots ofC.illinoensison the seeds and seedling growth ofT.aestivumL. andG.max(L.) Merr with indoor bio-assay. The water extract prominently inhibited the seed germination and seedling growth ofT.aestivumL. andG.max(L.) Merr with concentration effect(weak inhibition in low concentration, high inhibition in high concentration). The descending order of inhibition of water extract for germination rate, germination energy, germination index and vigor index ofT.aestivumandG.max(L.) Merr were vigor index, germination energy, germination index, germination rate, and vigor index, germination energy, germination rate, germination index, respectively. The descending order of allelopathic effects of water extract on shoot height, root length, fresh weight and dry weight ofT.aestivumandG.max(L.) Merr were both root length, shoot height, fresh weight, dry weight. The water extract prominently decreased the seedling root length, but had different impacts on the dry and fresh weight of receptor due to the different species. The order of the synthesis effects of water extraction from roots ofC.illinoensison two crops isT.aestivumL.>G.max(L.) Merr. The activity of SOD in the 7 d seedings was decreased, but the content of MDA, the activity of POD and CAT were increased with the increasing of concentration. Comprehensively, the inhibition of the water extraction from roots ofC.illinoensisis higher forT.aestivumL. than forG.max(L.) Merr. Caryaillinoensis;water extraction;TriticumaestivumL.;Glycinemax(L.) Merr;allelopathic effect 国家“十二五”科技支撑“华东区长核桃高效生产关键技术研究与示范”(2013BAD14B0104);农业技术引进项目上“薄壳山核桃优质苗木繁殖技术引进”(2006-4-82);浙江省重大科技专项“薄壳山核桃资源评价及新品种选育”(2012C12904-13) 张权(1989—),男,硕士研究生,主要从事园林植物与观赏园艺的研究。 2015-11-03 S664.1 A 10.7525/j.issn.1673-5102.2016.02.0082 结果与分析


3 讨论

