多拉菌素产生菌的诱变及其发酵研究
朱皖宜, 任 敏, 王冬梅, 朱鹏飞, 翟志华, 林青平,张 睿, 朱 杰, 陈颖瑛, 李慧娟, 凌青云
(江苏凌云药业, 常州 213200)
多拉菌素产生菌的诱变及其发酵研究
朱皖宜, 任敏, 王冬梅, 朱鹏飞, 翟志华, 林青平,张睿, 朱杰, 陈颖瑛, 李慧娟, 凌青云
(江苏凌云药业, 常州 213200)
用实验室保藏的阿维链霉菌Streptomycesarermitilis13#为出发菌种,经过诱变选育获得高产突变株,并研究该菌株及工业化发酵工艺。经连续诱变,结合配方改良和发酵罐上工艺优化,获得的高产突变株其生产能力比出发株提高了127%,采用连续或间歇流加补糖的方式可延长产素周期,适合工业化生产。此突变株及发酵工艺的确定为产业化生产提供了参考。
多拉菌素;诱变;发酵
多拉菌素(又名朵拉克汀,英文名doramectin)是以阿维链霉菌Streptomycesavermitilis衍生的第3代抗寄生虫药物(图1),与其他市售的同类产品比较,其抗寄生虫范围广,抗虫活性强、效果好、残留低、对环境友好,是目前最有开发潜力的兽用抗寄生虫新药[1]。

图1 多拉菌素的化学结构Fig 1 The chemical structure of doramectin
对于我国这样一个农业大国来说,大力开发和使用无公害生物农药,无疑有着广阔的市场和光明的前景。
对多拉菌素产生菌的出发株13#进行连续诱变筛选,获得一株产量有显著提高的突变株1692#;又对该株进行了发酵配方和发酵工艺的优化,突变株的产素能力、遗传稳定性有了大幅提升,研制的发酵工艺符合工业化生产要求。
1 材料和方法
1.1出发菌株和试剂
阿维链霉菌Streptomycesarermitilis13#为出发菌种(实验室保存);标准品(Ehrenstorfer公司)。
1.2仪器和设备
摇瓶机:ZP-96(常州);发酵罐:50 L(上海);HPLC:Shimadzu LC-10Avp(日本)。
1.3培养基
固体培养基(%):蔗糖0.5 ,脱脂奶粉 0.1,酵母抽提物0.4,磷酸二氢钾0.1,微量元素1,琼脂粉1.5,pH 7.0。
种子培养基(%):蔗糖0.5,玉米淀粉2,黄豆饼粉2,硫酸镁0.1, 磷酸二氢钾0.1, CaCO30.2,pH 7.0。
发酵培养基(%):玉米淀粉14,淀粉酶0.03,葡萄糖1,丙三醇0.15,黄豆饼粉3,酵母粉0.5,磷酸二氢钾0.1,硫酸镁0.3,丙酸钠0.3, 微量元素1,CaCO30.3,环己甲酸钠0.15, pH 7.4。
1.4突变株的筛选
挑取适量的菌体制成孢子悬浮液,放入含有玻璃珠的烧瓶中,振荡1 min,取其5 mL孢子悬浮液以紫外线等诱变剂进行诱变处理(致死率控制在90%左右)[2],经连续稀释,涂布在含有一定剂量的化学药物的固体平板上进行物理、化学的单一、复合诱变的培养,未经诱变的孢子悬浮液适当稀释后涂布于未加诱变剂的平板上培养作为对照。
以紫外线等诱变剂诱变处理后的孢子悬浮液,再经摇床培养30~60 min, 经连续稀释,其余的步骤同上。
单孢子分离长出的单菌落再随机斜面传代,摇瓶发酵培养后检测效价。再对挑选出的突变菌株进行摇瓶复筛实验,最终挑选出产量高、杂质含量低、遗传稳定性良好的优良菌株[3]。
摇瓶的初筛与复筛:按常规菌种选育的摇瓶筛选程序进行[4]。
1.5工艺流程
菌种库→斜面→种子罐→发酵罐。
1.6效价测定(HPLC法)
色谱柱:C18反相色谱柱(4.6 mm×150 mm,5 μm);
流动相:甲醇∶水=90∶10, 流速:1 mL/min,检测波长:245 nm,进样量10 μL。
1.7发酵罐的工艺优化
在50 L发酵罐上,考察验证并调节突变株的发酵代谢途径及发酵工艺的优化。
将成熟的斜面孢子用10 mL无菌水洗下,将孢子悬浮液接种于15 L种子罐,种子罐装液量为10 L,在28℃、通气量1 vvm、搅拌转速100~200 r/min条件下培养40 h,种子液以5%接种量接种到50 L发酵罐中培养,发酵罐装液量为35 L。
1.7.1单批发酵
在50 L发酵罐中,发酵产程开始后,控制通气量0.8 vvm、DO 30%。每天检测DR产量、残糖、菌浓、氨基氮和pH值。
1.7.2流加补料
在50 L发酵罐中进行分批补料实验。根据单批实验的结果,在残糖量低于2.5%时流加30%糖液,直到菌丝老化,停止发酵。在发酵过程中,控制通气量0.8 vvm、DO 30%。每天检测DR产量、残糖、菌浓、氨基氮和pH值。
2 结果
2.1诱变选育
经UV、SP等的复合诱变,有效地改变菌种对诱变剂的敏感度,并结合配方优化,发酵产物呈阶梯状递升,产素能力提高了127%,选育流程及系谱图(图2)。突变株在固体上的菌落形态也发生很大的改变:出发株呈光秃型、淡黄色、花瓣状、菌体生长缓慢;突变株锯齿边缘、多皱褶、褐色素、菌体生长快速、孢子量有了很大的改观,产率加大,并具有稳定的遗传特性(见图3)。

图2 系谱图
Fig 2 Family tree
注:UV为紫外线;SP为丙酸钠;NS为自然分离

图3 菌株和突变株的菌落形态Fig 3 Colony morphology of original and mutant strains
2.2发酵罐上工艺验证
在50 L发酵罐中进行发酵工艺验证。经过试验比较,调整碳源的合理配比。优化前工艺发酵中还原糖浓度较低,DR合成速率较低,并且难以支持较长的产素期;优化后基础培养基中糖的比例调整为14%淀粉和1%葡萄糖,葡萄糖在菌体对数生长期内被快速利用[5],待菌体生长进入稳定期流加补入液化淀粉保持还原糖的浓度促进合成代谢产物(见图4)。
在实际优化实验中,采用流加补液化淀粉的方式控制还原糖浓度在2.5%左右,可提高产素速率,结果如图4所示,同时周期可延长到15~20 d[6]。在这一期间,DR产量增加迅速,弥补了发酵后期碳源的缺乏,提高了产量。从pH值的变化来看,发酵采用流加补糖工艺后,pH值全程稳定,维持比较稳定的发酵产程环境。

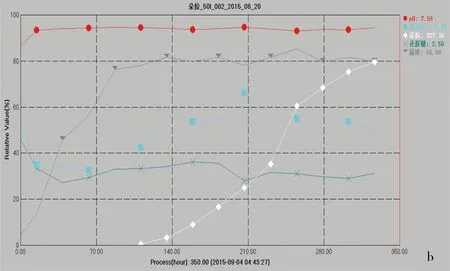
图4 发酵曲线Fig 4 Fermentation curve
A:优化前; b:优化后。● pH值; □ 氨基氮; ◇朵拉; ×还原糖;▼菌浓
3 讨论
原实验室保存的菌种由于产率低,不具备工业化生产的意义[7]。经过诱变筛选和配方优化,获得的突变株其生产能力比出发株提高了127%,单位产量和遗传稳定性有了大幅提升。有效的物理、化学复合诱变是短期内筛选顺利的关键。复合诱变技术的利用,获取的突变株数目较多。
菌落形态由初始的半光秃型突变为产孢能力较强的灰褐孢型,从而促进了菌体在发酵过程中的生长,改善了对氧的利用率,提高了单位产量;发酵罐实验中维持适当的还原糖浓度能促进DR的合成,产量攀升加快。配方和发酵工艺的不断优化保证了突变株良好的表现[8]。
葡萄糖是微生物生长的优质碳源,但在抗生素生产中却会抑制产物的合成。葡萄糖的阻遏机理已经在很多品种的生物合成途径中有了合理的解释[9]。发酵生产的实践已经证明用缓慢利用的多糖组成的碳源,有利于产物的形成[10]。选择最适碳源对提高代谢产物产量是非常重要的。
另外发酵前期的过早高黏度和菌浓直接影响了产物的合成和代谢过程中的溶氧,通过配方优化和流加补碳源工艺后,黏度和菌浓下降、溶氧上升,产率呈阶梯状增进,取得了良好的效果,突变株的产素能力有了大幅提升。
[1]张颖,李坤林.多拉菌素的研究进展及应用[J]. 动物保健,2006(8):36-37.
[2]朱皖宜,罗红瑜,张赛萍,等.尼莫克丁产生菌的诱变育种[J],生物学杂志,2008,25(2):62-66.
[3]朱皖宜, 陈华,邱海潇, 等. 格尔德霉素高产菌株的抗性筛选及其发酵的研究[J]. 中国抗生素杂志, 2014, 39(2): 106-145.
[4]俞俊棠,唐孝宣.生物工艺学(上册)[M]. 上海:华东化工学院出版社,1991:82.
[5]IKEDA H,KOTAKI H,TANAKA H, et al. Involvement of glucose catabolism in avemermectin production byStreptomycesavermiltilis[J].Antimsicrob Angents Chemother, 1998, 32(2):282-284.
[6]储炬,李友荣.现代工业微生物发酵调控学[M].北京:化学工业出版社,2002:223.
[7]唐文力,张祝兰.MW+NTG复合诱变组合抗性突变筛选埃波霉素高产菌[C].宜昌:2015年中国微生物学会学术年会论文摘要集,2015:229.
[8]熊宗贵.发酵工艺原理[M].北京:中国医药科技出版社,2000:55.
[9]岑沛霖,蔡谨.工业微生物学[M].北京:化学工业出版社,2000:335.
[10]白秀峰.发酵工艺学[M].北京:中国医药科技出版社,2003:137.
Mutation breeding of doramectin mutant strain and study on fermentation
ZHU Wan-yi, REN Min, WANG Dong-mei, ZHU Peng-fei, ZHAI Zhi-hua, LIN Qing-ping,ZHANG Rui, ZHU Jie, CHEN Ying-ying, LI Hui-juan, LING Qing-yun
(Jiangsu Lingyun Pharmaceutical Company, Changzhou 213200, China)
The mutant strain 1692#was obtained from an original strainStreptomycesarermitilis13#using strain mutation screening method. Within the optimizing of the fermentation medium composition and the fermentation process, the production of the mutant strain was 127% higher than that of the original one. The mutant strain and the optimized fermentation process would provided a reference for the industrialized production of doramectin.
doramectin; mutation; fermentation
2015-10-28;
2015-11-23
朱皖宜,高级工程师, 研究方向为工业微生物育种, E-mail:zwyhz@hotmail.com
Q933
B
2095-1736(2016)05-0106-03
doi∶10.3969/j.issn.2095-1736.2016.05.106

