脱落酸对采后番茄愈伤次生代谢物质合成的影响
陶晓亚,李家寅,韩雪源,黄 斯,茅林春
(浙江大学食品科学与营养系,馥莉食品研究院,浙江省农产品加工重点实验室,浙江杭州 310058)
脱落酸对采后番茄愈伤次生代谢物质合成的影响
陶晓亚,李家寅,韩雪源,黄斯,茅林春*
(浙江大学食品科学与营养系,馥莉食品研究院,浙江省农产品加工重点实验室,浙江杭州 310058)
为研究脱落酸(abscisic acid,ABA)对采后番茄愈伤次生代谢物质合成的影响,以绿熟期樱桃番茄为材料,对果实损伤处理后,分别用ABA及其合成抑制剂氟啶酮(fluridone,FLD)抽真空渗透处理,黑暗条件下贮藏愈伤,每天取样测定相关生理指标。测定了果实失重率,伤口部位的总酚、类黄酮含量及相关酶活性,丙二醛(MDA)含量。结果表明:与对照相比,ABA处理减缓果实失重率升高,可有效促进伤口部位总酚、类黄酮的积累,提高与此相关的苯丙氨酸解氨酶(PAL)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性,降低丙二醛(MDA)含量,减少伤口部位氧化损伤,加速伤口愈合;FLD处理则起相反作用,加剧伤口部位氧化损伤,减缓伤口愈合进程。以上结果说明,ABA对采后番茄愈伤次生代谢物质合成具有促进作用。
脱落醛,采后,番茄,愈伤,次生代谢物质,酶活性
果蔬采后易受机械损伤,这将导致果蔬品质下降,经济价值降低[1]。在生物化学方面,机械损伤将诱发一系列胁迫生理反应以促进伤口愈合,例如受苯丙氨酸解氨酶(PAL)调控的苯丙烷类代谢速度加快,诱导伤口及邻近部位合成更多的酚类和类黄酮等次生代谢物质[2-4]。另一方面,植物受损伤胁迫时,细胞膜会发生膜质过氧化,造成氧化损伤。这将增加植物体内与抗氧化相关的酶如超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的含量。SOD和CAT是果蔬中最主要的活性氧清除剂,能有效地清除自由基,减轻过量自由基对果蔬的毒害作用。
脱落酸(abscisic acid,ABA)是一种植物衰老相关激素,具有抑制种子萌发、促进气孔关闭、促进衰老等作用。而其在逆境胁迫下,能诱导植物产生抗性,是植物的抗逆诱导因子,被称为植物的“胁迫激素”[5]。当植物处于干旱、损伤等不利环境时,体内ABA含量大增,启动自我修复机制,阻止有害物质的进一步侵害[6]。目前,关于ABA促进损伤愈合的研究主要集中在马铃薯块茎方面,而其对采后果蔬愈伤及次生代谢物质合成的研究鲜有报道。本实验采用ABA及其合成抑制剂氟啶酮(fluridone,FLD)处理损伤的番茄果实,研究ABA对果实愈伤过程总酚和类黄酮物质含量及相关酶活性的影响,以期为加速采后番茄伤口愈合提供理论依据。

表1 番茄果实伤口部位ABA含量
注:不同字母代表相同处理组不同贮存时间的样品差异显著(p<0.05)。
1 材料与方法
1.1材料与仪器
绿熟期樱桃番茄“新太阳”采自浙江省萧山市温室,于采后2 h内运回实验室,挑选形状、大小一致,无机械损伤的番茄果实作为实验材料;ABA(≥ 90%)、没食子酸(>99%)、聚乙烯吡咯烷酮(PVP)、l-苯丙氨酸(≥ 98.5%)、甲硫氨酸(≥ 99%)上海Aladdin试剂有限公司;芦丁(≥ 98%)、考马斯亮蓝G-250(≥ 85%)、氮蓝四唑(NBT,≥ 98%)、核黄素(97.5%~102.0%)上海国药集团;FLD(99.8%)德国Fluka Analytical;牛血清白蛋白(>98%)上海生工生物工程股份有限公司;其余试剂均为分析纯。
Agilent 6460 HPLC-MS美国Agilent 科技有限公司;UV-1750紫外可见分光光度计日本岛津公司;UNIVERSAL 320R台式高速离心机德国Hettich Lab Technology;SHZ-D III循环水式多用真空泵杭州明远仪器有限公司;HWS型恒温恒湿箱宁波东南仪器有限公司。
1.2实验方法
1.2.1样品处理用0.5%次氯酸钠溶液清洗果实表面,无菌去离子水冲洗后室温晾干备用。参考Dean和Kolattukudy[7]的方法进行损伤处理:用经75%酒精擦拭消毒的手术刀在果实赤道处对称切除2个直径约10 mm、厚度1~2 mm的薄片。将损伤后的果实随机分成3组,分别用1.0 mmol/L ABA、0.1 mmol/L FLD和无菌去离子水(对照)抽真空处理(0.07 MPa,5 min)。室温自然晾干后于黑暗条件下(20 ℃,90% RH)贮藏愈伤。每天取样时用已消毒的打孔器切取愈伤组织(10 mm×3 mm),液氮迅速冷冻,于-80 ℃冰箱中保存待用。处理方法和药品浓度均根据预实验结果确定。
1.2.2ABA含量测定参考Chen等[8]的方法提取ABA,采用HPLC-MS测定ABA含量。进样柱型号规格:ZORBAX Eclipse XDB-C18(2.1 mm× 150 mm×3.5 μm)。流动相A为甲醇,B为0.1%甲酸,洗脱体系:0~1.5 min,40% A;1.5~8 min,40% A升至100% A;8~10 min,100% A降至40% A;10~17 min,40% A。柱温:35 ℃,流速:300 μL/min,进样量:10 μL。
1.2.3总酚和类黄酮含量测定称取约1 g样品,加入6 mL 40%的乙醇溶液充分研磨后,60 ℃水浴保温1 h,9000×g离心15 min,上清液用于测定总酚和类黄酮含量。
总酚含量测定参考Toor和Savage[9]的方法,结果以每100 g样品中相当于没食子酸的毫克数表示,即mg/100 g。类黄酮含量测定采用Zhishen等[10]的方法,结果以每100 g样品中相当于芦丁的毫克数表示,即mg/100 g。
1.2.4损伤番茄果实失重率测定
失重率(%)=(m0-mt)/m0×100
式中,m0:果实初始质量;mt:果实检测时的质量。
1.2.5酶活性测定称取约1 g样品,分别加入4 mL经4 ℃预冷的0.1 mol/L硼酸硼砂缓冲液(pH8.7,含3 g/L PVP,1 mmol/L EDTA)和50 mmol/L PBS(pH7.8,含1 mmol/L EDTA,2 g/L PVP),冰浴研磨,所得匀浆于4 ℃下9000×g离心15 min,上清液分别用于PAL、SOD和CAT活性测定。
PAL活性测定方法参考Yingsanga等[11],以波长290 nm处吸光度值每小时增加0.01为1 U,表示为U/mg(蛋白)。
可溶性蛋白含量测定参考Bradford[12]。
SOD活性测定参考Stewart和Bewley[13],以抑制NBT光化还原50%的酶量为一个酶活力单位U,以U/g(FW)表示。
CAT活性测定参考曹建康等[14],以1 min内吸光度值减少0.01为一个酶活力单位U,以U/g(FW)表示。
1.2.6丙二醛(MDA)含量测定MDA含量测定参考曹建康等[14]的方法。
1.2.7数据处理以上实验均重复三次。采用SPSS Statistics 20进行统计分析。
2 结果与分析
2.1番茄伤口部位ABA含量变化
ABA组番茄伤口部位ABA含量在愈伤期间始终高于对照组,表明真空渗透处理方法是卓有成效的,可以保证整个愈伤过程中伤口部位ABA含量维持在较高水平。FLD组ABA含量在愈伤前2 d与对照组无明显差异(p>0.05),从第3 d开始明显低于对照组(p<0.05),表明FLD可以抑制果实伤口部位合成新的ABA。
2.2ABA对番茄果实失重率的影响
愈伤可减少伤口表面水分蒸发,愈合程度越高,水分蒸发越慢,失重率越小,因此,可用失重率来反映损伤愈合程度。随贮存时间增加,三组处理番茄果实失重率逐渐上升,但处理组间上升程度有差异(图1)。贮存第1 d,ABA组与对照组无显著差异(p>0.05),贮存第2 d,FLD组与对照组差异不大(p>0.05),贮存后期,三组处理差异显著(p<0.05)。ABA组始终低于对照组,FLD组始终高于对照组,因此采用ABA处理番茄伤口后,可以明显促进愈伤,抑制水分蒸发,降低失重率。
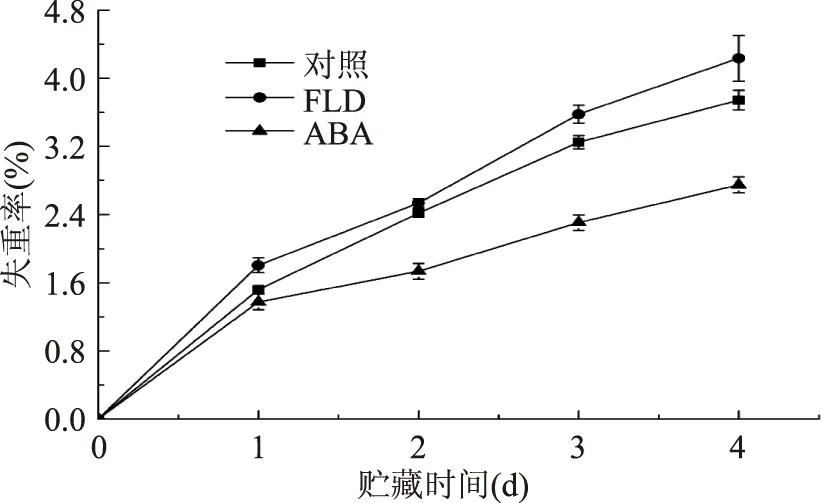
图1 损伤番茄果实失重率变化Fig.1 Changes of weight loss in wounded tomato fruit
2.3ABA对番茄伤口处总酚和类黄酮含量的影响
番茄果实愈伤过程总酚含量总体表现为升高、降低、升高(图2)。损伤后ABA组总酚含量立即升高,第2 d达到最大值,是愈合前的1.23倍,愈合后期含量基本稳定,始终高于对照组。FLD组和对照组则稍有降低,之后升高,第2 d达到最大值,分别是愈合前的1.08倍和1.15倍,两者变化趋势基本一致,FLD组始终低于对照组,两者有明显差别(p<0.05)。愈合后期,各处理组果实总酚含量无显著差异(p>0.05)。
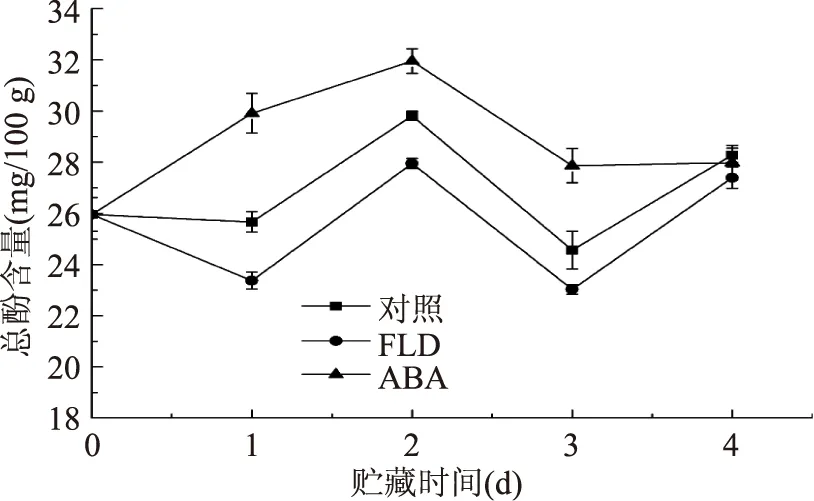
图2 番茄果实伤口部位总酚含量Fig.2 Total phenol content in wound tissues of tomato fruit
番茄伤口部位类黄酮含量随愈合时间延长逐渐增加(图3)。ABA组类黄酮含量始终高于对照组,FLD组则始终低于对照组。愈合第1 d,FLD组与对照组无显著差异(p>0.05),愈合第2 d,ABA组与对照组无显著差异(p>0.05)。愈合第3、4 d,ABA和FLD组与对照组相比,分别增加5.69%、5.84%,降低8.21%、13.25%。
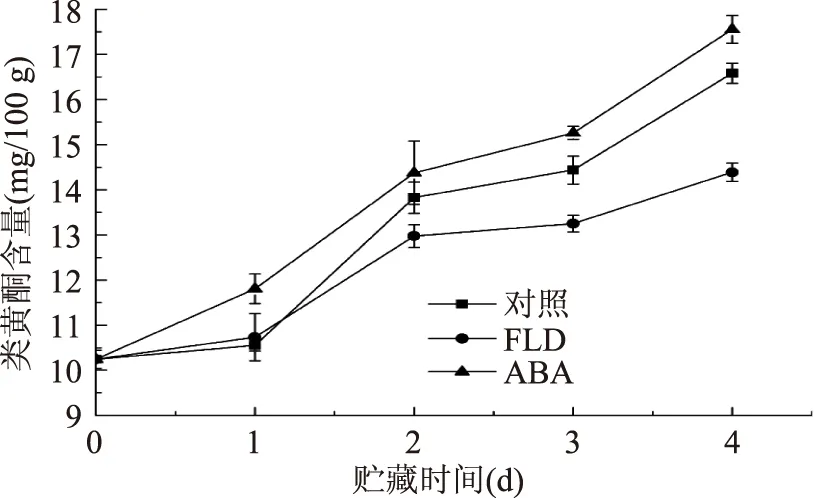
图3 番茄果实伤口部位类黄酮含量Fig.3 Flavonoids content in wound tissues of tomato fruit
2.4ABA对PAL活性的影响
愈伤可诱导PAL产生,其活性可作为植物抗逆能力的重要指标[15]。图4显示,在番茄愈伤期间PAL活性先升高后降低。愈合第1 d,ABA和FLD组与对照组相比,酶活性分别增加了110.68%、降低了17.42%。愈合第3 d,ABA组和对照组酶活性达到最大值,分别是愈合前的5.17倍、3.79倍,而FLD组是愈合前的2.33倍。ABA组PAL活性明显高于对照组(p<0.05),FLD组初期与对照组差异不显著(p>0.05),后期明显低于对照组(p<0.05)。

图4 番茄果实伤口部位PAL活性Fig.4 PAL activity in wound tissues of tomato fruit
2.5ABA对SOD、CAT活性的影响
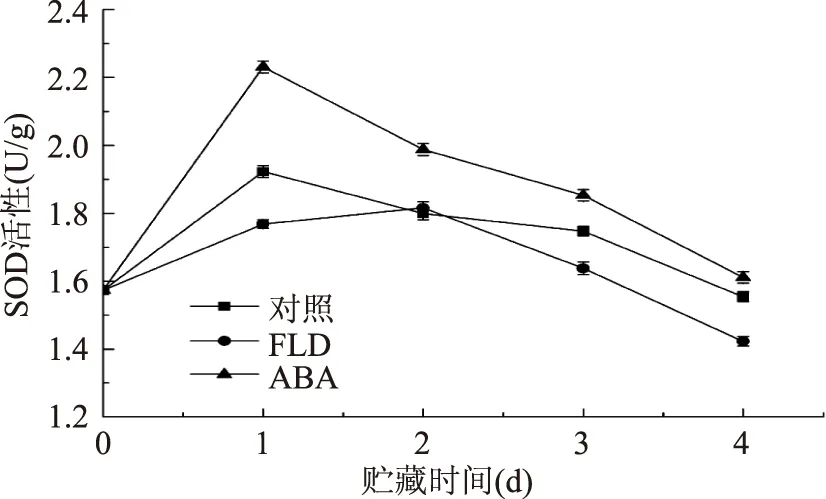
图5 番茄果实伤口部位SOD活性Fig.5 SOD activity in wound tissues of tomato fruit
SOD对果蔬细胞清除活性氧起重要作用,其活性高低反映果蔬的抗逆能力。图5显示随贮存时间增加SOD活性先升高后降低。贮存第1 d,对照组与ABA组SOD活性达到最大值,三个处理组差异显著(p<0.05),与第0 d相比,对照组、FLD组和ABA组分别增加了22.19%、12.37%和41.77%。随贮存时间延长,三组处理SOD活性逐渐降低,ABA组始终高于对照组,FLD组始终低于对照组,愈合后期三组处理之间差异显著(p<0.05)。
图6反映了不同处理番茄果实损伤部位CAT活性变化情况。损伤后ABA组CAT活性立即升高,之后缓慢下降,但始终高于对照组,对照组和FLD组则呈现先降低后升高再降低的变化趋势,FLD组始终低于对照组。愈合初期,三个处理组CAT含量差异显著(p<0.05),愈合第1 d,对照组、FLD组和ABA组分别是愈合前的0.92倍、0.82倍和1.14倍。愈合后期,对照组和FLD组差异不显著(p>0.05),ABA组与对照组相比,始终差异显著(p<0.05)。
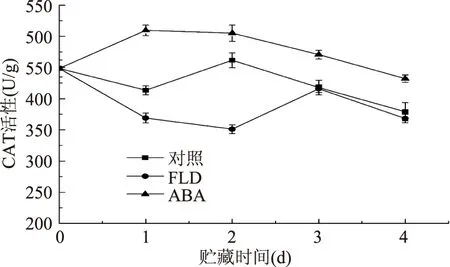
图6 番茄果实伤口部位CAT活性Fig.6 CAT activity in wound tissues of tomato fruit
2.6ABA对伤口处MDA含量的影响
机械损伤导致活性氧大量积累而促进膜质过氧化,MDA是膜质过氧化的最终产物,其积累量可以反映果实在逆境下受伤害的程度[16]。由图7可知,番茄愈伤过程MDA含量呈现先上升后下降的变化趋势。愈合第1 d,三组处理MDA含量无显著差异(p>0.05),随愈合时间延长,MDA含量逐渐降低且差距逐渐加大。愈合第2 d,与对照组相比,FLD组MDA含量下降缓慢,与第1 d无明显差别(p>0.05),ABA组则下降最快,但与对照组差别不大(p>0.05)。愈合第3、4 d,三组处理MDA含量有明显差异(p<0.05),FLD组高于对照组,ABA组则低于对照组,但都高于第0 d。

图7 番茄果实伤口部位MDA含量Fig.7 MDA content in wound tissues of tomato fruit
3 讨论
ABA组番茄伤口部位ABA含量始终保持较高水平,FLD组则始终保持较低水平,这是因为FLD能有效抑制ABA合成前体类胡萝卜素的形成,阻碍ABA合成[17]。
PAL是苯丙烷代谢的限速酶,调控代谢产物总酚和类黄酮等次生代谢物质的合成。本实验中,愈合部位总酚和类黄酮含量的整体变化趋势与PAL活性变化结果基本一致。ABA处理使这两种次生代谢物质含量增加,PAL活性升高,增强果实对逆境的抵抗能力。这与对马铃薯块茎研究的相关报道相一致[18-20]。而FLD处理则起相反作用[18],当ABA合成受阻时,损伤处诱导的PAL活性降低,施加ABA后,该诱导作用部分恢复[21]。此外,也有报道称ABA处理能提高锁阳茎PAL活性[22]。
SOD可催化超氧化物的歧化反应,是清除活性氧反应的第一个抗氧化酶,CAT可清除过氧化氢,两者对植物防御氧化损伤起重要作用[23]。本实验结果表明,在损伤初期,SOD活性快速增加,这可能是由于损伤打破了番茄组织细胞中酶和底物的空间区域化分布,使得两者结合,酶活性增加[24]。之后活性逐渐降低,这可能是因为随愈合时间增加,活性氧毒性逐渐减弱,果实抗性逐渐增强。与对照相比,ABA处理能显著提高番茄伤口部位SOD与CAT活性,增强果实对损伤胁迫的抵抗能力,加速伤口清除自由基,减缓氧化损伤,提高番茄果实对损伤的抗性,这与段园园[22]等对锁阳茎CAT活性研究结果基本一致。膜质过氧化终产物MDA是反映果蔬受伤害程度的一个重要指标。本实验中,损伤使得伤口表面细胞膜遭到破坏,诱导伤口部位MDA含量迅速上升,膜质过氧化加剧,随着伤口逐渐愈合,MAD含量也呈下降趋势。与此对比,ABA处理能减轻伤口处细胞膜系统的受伤害程度,这可能与ABA促进伤口部位SOD和CAT活性升高有关。
4 结论
与对照相比,ABA处理减缓果实失重率升高,可有效促进伤口部位总酚、类黄酮的积累,提高与此相关的苯丙氨酸解氨酶(PAL)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性,降低丙二醛(MDA)含量,减少伤口部位氧化损伤,加速伤口愈合;FLD处理则起相反作用,加剧伤口部位氧化损伤,减缓伤口愈合进程。以上结果说明,ABA对采后番茄愈伤次生代谢物质合成具有促进作用。
[1]潘永贵,施瑞城. 采后果蔬受机械伤害的生理生化反应[J]. 植物生理学通讯,2000,36(6):568-572.
[2]Miller A R. Physiology,biochemistry and detection of bruising(mechanical stress)in fruits and vegetables[J]. Postharvest News and Information(United Kingdom),1992,3(3):53-58.
[3]彭丽桃,杨书珍. 适度加工果蔬生理特性及质量控制措施[J]. 农业工程学报,2002,18(3):178-185.
[4]Diallinas G,Kanellis A K. A phenylalanine ammonia-lyase gene from melon fruit:cDNA cloning,sequence and expression in response to development and wounding[J]. Plant Molecular Biology,1994,26(1):473-479.
[5]Mantyla E,Lang V,Palva E T. Role of abscisic acid in drought-induced freezing tolerance,cold acclimation,and accumulation of LT178 and RAB18 proteins in Arabidopsis thaliana[J]. Plant Physiology,1995,107(1):141-148.
[6]郝格格,孙忠富,张录强,等. 脱落酸在植物逆境胁迫研究中的进展[J]. 中国农学通报,2009,25(18):212-215.
[7]Dean B B,Kolattukudy P E. Synthesis of suberin during wound-healing in jade leaves,tomato fruit,and bean pods[J]. Plant Physiology,1976,58(3):411-416.
[8]Chen J,Mao L,Mi H,et al. Detachment-accelerated ripening and senescence of strawberry(Fragaria×ananassaDuch. cv. Akihime)fruit and the regulation role of multiple phytohormones[J]. Acta Physiologiae Plantarum,2014,36(9):2441-2451.
[9]Toor R K,Savage G P. Antioxidant activity in different fractions of tomatoes[J]. Food Research International,2005,38(5):487-494.
[10]Zhishen J,Mengcheng T,Jianming W. The determination of flavonoid contents in mulberry and their scavenging effects on superoxide radicals[J]. Food Chemistry,1999,64(4):555-559.
[11]Yingsanga P,Srilaong V,Kanlayanarat S,et al. Relationship between browning and related enzymes(PAL,PPO and POD)in rambutan fruit(NepheliumlappaceumLinn.)cvs. Rongrien and See-Chompoo[J]. Postharvest Biology and Technology,2008,50(2):164-168.
[12]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72(1):248-254.
[13]Stewart R R C,Bewley J D. Lipid peroxidation associated with accelerated aging of soybean axes[J]. Plant Physiology,1980,65(2):245-248.
[14]曹建康,姜微波,赵玉梅. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社,2007.
[15]Stadnik M J,Buchenauer H. Inhibition of phenylalanine ammonia-lyase suppresses the resistance induced by benzothiadiazole in wheat toBlumeriagraminisf. sp. tritici[J]. Physiological and Molecular Plant Pathology,2000,57(1):25-34.
[16]陈少裕. 膜脂过氧化与植物逆境胁迫[J]. 植物学报,1989(4):211-217.
[17]Gamble P E,Mullet J E. Inhibition of carotenoid accumulation and abscisic acid biosynthesis in fluridone-treated dark-grown barley[J]. European Journal of Biochemistry,1986,160(1):117-121.
[18]Lulai E C,Suttle J C,Pederson S M. Regulatory involvement of abscisic acid in potato tuber wound-healing[J]. Journal of Experimental Botany,2008,59(6):1175-1186.
[19]吴觉天. 采后ABA和BTH处理对马铃薯块茎快速愈伤的作用及部分机理[D]. 兰州:甘肃农业大学,2014.
[20]Soliday C L,Dean B B,Kolattukudy P E. Suberization:inhibition by washing and stimulation by abscisic acid in potato disks and tissue culture[J]. Plant Physiology,1978,61(2):170-174.
[21]Lulai E C,Suttle J C. Signals involved in tuber wound-healing[J]. Plant Signaling & Behavior,2009,4(7):620-622.
[22]段园园,岳鑫,陈贵林. 脱落酸对锁阳茎切口愈合及抗氧化酶活性的影响[J]. 植物生理学报,2012,48(3):298-302.
[23]Faize M,Burgos L,Faize L,et al. Involvement of cytosolic ascorbate peroxidase and Cu/Zn-superoxide dismutase for improved tolerance against drought stress[J]. Journal of Experimental Botany,2011,62(8):2599-2613.
[24]申琳,生吉萍,罗云波. 运输中的机械损伤对贮藏初期苹果活性氧代谢的影响[J]. 中国农业大学学报,1999,4(5):107-110.
Effect of abscisic acid on secondary metabolite production during wound-healing in postharvest tomato fruit
TAO Xiao-ya,LI Jia-yin,HAN Xue-yuan,HUANG Si,MAO Lin-chun*
(Department of Food Science and Nutrition,Fuli Institute of Food Science,Zhejiang Key Laboratory of Agro-Food Processing,Zhejiang University,Hangzhou 310058,China)
The effect of abscisic acid(ABA)on wound-healing,secondary metabolite production and related enzyme activities in postharvest mature green cherry tomato fruit was investigated in this study. Tomato fruit were treated under vacuum with ABA and fluridone(FLD)solution after wounding and allowed to heal in the dark. Weight loss of fruit,total phenol,flavonoids and MDA content,and enzyme activities(PAL,SOD,CAT)in wound tissues were determined every day during storage time. The results indicated that weight loss and MDA content were reduced in ABA-treated tomato fruit compared with control. ABA promoted wound-healing process by enhancing total phenol and flavonoids contents as well as PAL,SOD and CAT activities in wound tissues of tomato fruit. However,FLD treatment had the opposite effects. In conclusion,ABA promoted the synthesis of secondary metabolite production during wound-healing in postharvest tomato fruit.
ABA;postharvest;tomato;wound-healing;secondary metabolite production;enzyme activities
2016-01-20
陶晓亚(1990-),女,硕士,研究方向:果蔬采后损伤及修复,E-mail:taoxiaoya00@163.com。
茅林春(1962-),男,博士,教授,研究方向:农产品贮藏保鲜,E-mail:linchun@zju.edu.cn。
国家自然科学基金资助项目(31372113)。
TS255.3
A
1002-0306(2016)16-0330-05
10.13386/j.issn1002-0306.2016.16.058

