丙酮酸脱氢酶竞争性抑制剂调控裂殖壶菌脂肪酸合成的研究
程钰蓉,孙志杰,崔 球
(1.山东省能源生物遗传资源重点实验室,中国科学院青岛生物能源与过程研究所,山东青岛 266100;2.青岛单细胞油脂工程实验室,山东青岛 266100;3.中国科学院大学,北京 100040;4.生物燃料重点实验室,中国科学院青岛生物能源与过程研究所,山东青岛 266100)
丙酮酸脱氢酶竞争性抑制剂调控裂殖壶菌脂肪酸合成的研究
程钰蓉1,2,3,孙志杰1,*,崔球1,2,4,*
(1.山东省能源生物遗传资源重点实验室,中国科学院青岛生物能源与过程研究所,山东青岛 266100;2.青岛单细胞油脂工程实验室,山东青岛 266100;3.中国科学院大学,北京 100040;4.生物燃料重点实验室,中国科学院青岛生物能源与过程研究所,山东青岛 266100)
本研究以合成乙酰辅酶A的丙酮酸脱氢酶复合体为扰动目标,通过应用底物特异竞争抑制剂——氟化丙酮酸(FP)来扰动乙酰辅酶A的合成,在考察扰动后裂殖壶菌的碳消耗、菌体生长、油脂合成、脂肪酸成分的基础上,分析了工业生产二十二碳六烯酸(DHA)菌株——裂殖壶菌中的乙酰辅酶A在普通脂肪酸合成途径(FAS途径)和类聚酮合酶途径(PKS途径)的分配比例变化。结果发现裂殖壶菌可转化利用FP;1 mmol/L FP在抑制总油脂合成的同时也显著改变了乙酰辅酶在FAS和PKS途径中的分配比率;降低了生物质合成,增强了二氧化碳生成量。表明裂殖壶菌的FAS途径对乙酰辅酶A的亲和力可能高于PKS途径;通过降低乙酰辅酶A供给量并不能提高总脂肪酸中多不饱和脂肪酸(DHA和DPA)的含量。这一结果解释了FAS途径和PKS途径的碳流分配调控机制,对于选育DHA高产菌株以及工业发酵过程优化具有重要意义。
氟化丙酮酸,二十二碳六烯酸,丙酮酸脱氢酶复合体,乙酰辅酶A,裂殖壶菌
二十二碳六烯酸(docosahexaenoic acid,DHA,C22∶6 n-3)又称“脑黄金”,在人体中具有重要的生理和保健功能[1-3]。裂殖壶菌(Aurantiochytrium)由于其具有DHA含量高、生长快、易于大规模培养等优势,是目前工业生产DHA使用的主要菌株。但由于缺乏精确的分子靶向调控工具和深入的脂肪酸代谢调控机制的了解[4],目前提高裂殖壶菌发酵生产DHA产量主要依赖于培养基组分优化以及控制发酵条件[1,5-6]。了解裂殖壶菌脂肪酸合成和油脂积累调控机制有利于优化DHA工业发酵工艺和菌株的代谢工程改造。
线粒体中的丙酮酸脱氢酶复合体(pyruvate dehydrogenase complex,PDC)将丙酮酸转化为乙酰辅酶A,而后三羧酸转运体系再将线粒体内的乙酰辅酶A转运至胞质中进行脂肪酸的合成。已有大量研究发现调节PDC活性可以改变细胞内脂肪酸含量[7-8]。目前研究表明,裂殖壶菌具有非常复杂而特殊的脂肪酸合成途径,其饱和脂肪酸(包括棕榈酸和油酸)是由生物界普遍利用的脂肪酸合成途径(FAS途径)合成,而多不饱和脂肪酸(DHA和DPA)却是由特殊的类聚酮合酶途径(PKS途径)合成[9-10]。虽然,目前已知乙酰辅酶A是这两个途径的共同碳源前体分子,但研究人员对于乙酰辅酶A在这两种途径中的分配调节机制尚不清晰[11]。
因此,本研究以乙酰辅酶A在FAS和PKS途径中的分配调控机制为研究目标,通过应用PDC的底物特意竞争抑制剂——FP(fluoropyruvate,FP)来调节乙酰辅酶A供给量,在考察扰动后裂殖壶菌的碳消耗、菌体生长、油脂合成、脂肪酸成分的基础上,分析乙酰辅酶A在FAS和PKS途径中分配比例的变化。
1 材料与方法
1.1材料与仪器
菌株裂殖壶菌菌株(Aurantiochytriumsp. SD116,CG-MCC No. 6208)由青岛生物能源与过程研究所代谢物组学实验室筛选并保藏[12];FPFP美国Sigma公司,纯度≥98%;尿素氮检测试剂盒南京建成生物工程研究所;酵母粉英国Oxoid公司;葡萄糖、丙磺酸、海水晶、硫酸铵、磷酸二氢钾、七水合硫酸锌、四水合氯化锰、七水合硫酸亚铁、六水合氯化钴、五水合硫酸铜、二水合钼酸钠国药集团化学试剂上海分公司,分析纯。
RIGOL-L3000液相色谱北京普源精电科技有限公司;Agilent GC-6890气相色谱安捷伦科技公司;SBA-40葡萄糖分析仪山东省科学院生物研究所;MiniSpin小型高速离心机Eppendorf公司;vario EL Ⅲ元素分析仪Elementar公司。
1.2实验方法
1.2.1培养基种子培养基:葡萄糖60 g/L,酵母粉20 g/L,海水晶15 g/L,pH6.4。
分析培养基:葡萄糖60 g/L,丙磺酸60 g/L,硫酸铵7 g/L,磷酸二氢钾4 g/L,海水15 g/L,七水合硫酸锌22 mg/L,四水合氯化锰5 mg/L,七水合硫酸亚铁5 mg/L,六水合氯化钴1.6 mg/L,五水合硫酸铜1.6 mg/L,二水合钼酸钠7.5 mg/L。
1.2.2培养方法
1.2.2.1种子活化从菌种保存平板上挑取单菌落,接入装有50 mL新鲜种子培养基的250 mL锥形瓶中,培养温度25 ℃,转速200 r/min,培养时间48 h。
1.2.2.2FP浓度筛选配制分别含有0、0.1、0.5、1、2、5 mmol/L FP的分析培养基。按照接种OD600为0.02的接种量将种子接入装有50 mL新鲜分析培养基的250 mL锥形瓶中,培养温度25 ℃,转速200 r/min,培养时间96 h。从36 h开始每12 h对葡萄糖消耗进行测定,培养60 h时对生物量以及油脂含量进行测定。
1.2.2.3FP代谢扰动分析按照接种密度为0.02 OD600的接种量将种子接入装有50 mL新鲜分析培养基的250 mL锥形瓶中,培养温度25 ℃,转速200 r/min。培养至40 h时,分别向扰动组发酵液中添加FP母液至1 mmol/L和对照组加入等体积的水后继续在25 ℃、200 r/min培养至84 h。在培养40、48、60、72、84 h分别取样,测定发酵参数。
1.2.3发酵参数测定
1.2.3.1葡萄糖含量测定采用生物传感器分析仪测定上清液中葡萄糖含量。
1.2.3.2铵根离子含量测定采用尿素氮检测试剂盒分析上清液中氨离子含量。
1.2.3.3FP含量测定采用高效液相色谱法分析发酵液中胞外代谢物和FP浓度变化。色谱柱:Bio-RadAminex HPX-87H Colum,300 mm×7.8 mm;柱温:50 ℃;流速:0.5 mL/min;进样量:10 μL;流动相:5 mmol/L H2SO4。等度洗脱25 min。紫外检测器:320 nm。通过高效液相色谱法测定FP在320 nm的紫外吸收,通过外标法测定标准曲线计算得到发酵液中FP的含量,并计算FP的消耗速率。FP标准曲线(R2=0.9913):不同浓度FP标准品(mmol/L)=色谱峰面积×(7×10-6)+0.0076。FP消耗速率计算:FP消耗速率(mmol/g·h)=样品中FP浓度÷生物量÷加入FP的时间。
1.2.3.4生物量的测定取2 mL菌体,经蒸馏水洗涤、4000×g离心和真空冷冻干燥后,称得菌体干重。
1.2.3.5菌体油脂含量和脂肪酸组成的测定按文献报道方法提取菌体油脂并称重[12]。硫酸-甲醇法处理油脂后,GC-MS分析脂肪酸成分。色谱分离条件:色谱柱(Agilent HP-INNOWax 30 m×250 μm×0.25 μm)。程序升温条件:初始温度为100 ℃,升温过程为15 ℃/min直至240 ℃并保持10 min,进样口温度为250 ℃,FID检测器温度为260 ℃。含油率(%)=提取的油脂重量/细胞干重×100;特定油脂百分含量(%)=该油脂气相色谱峰面积/总油脂气相色谱峰面积×100。
1.2.3.6菌体元素分析取2 mg干燥后的菌体,经元素分析仪测定菌体中C、H、N、S元素的组成。
2 结果与分析
2.1FP浓度的确定
FP是丙酮酸的结构类似物,由于它与丙酮酸脱氢酶亚基的亲和力是丙酮酸的100倍,因此在非常低的浓度下FP就可以有效抑制PDC的催化活性[13]。本研究首先考察了不同浓度FP对裂殖壶菌生长行为和代谢特征的影响研究。

图1 不同FP浓度下裂殖壶菌生长和代谢行为变化Fig.1 The growth and metabolism changesin Aurantiochytrium sp. under different concentration of FP注:(A)葡萄糖消耗;(B)培养60 h后生物量积累;(C)培养60 h后油脂含量。
由图1A中的对照组可知,60 h处于细胞的对数生长期,这一时期的细胞代谢处于平衡状态,可以更真实的反应胞内正常代谢水平,且60 h的细胞较多,带来的分析误差更小,因此本研究比较了对照组和FP处理组在该时期细胞生物量和油脂含量的差异。由图1A和B可知,FP浓度为0.1 mmol/L和0.5 mmol/L时,葡萄糖消耗速率和生物量积累并没有受到明显影响;当浓度增加到1 mmol/L时,葡萄糖消耗速率为对照组的94.28%,生物量为对照组的75.85%;浓度为2 mmol/L时,生物量为对照组的48.75%,达到了半抑制生长浓度;当FP浓度为5 mmol/L时,葡萄糖残糖量升高,生物量仅为对照组的32.57%,生长受到了严重抑制。根据未添加FP的实验组结果,这种培养条件下裂殖壶菌在40~70 h处于对数生长期,这一阶段细胞处于快速分裂状态,从发酵水平上来说可以认为这是细胞生长的代谢稳态。由图1C可知,加入FP后虽然会抑制生物量的增长,油脂含量也随之下降,但是油脂占细胞干重的比例基本维持在28%左右。当FP浓度达到2 mmol/L和5 mmol/L时,由于生物量和油脂含量都较低导致测量误差较大,这会严重干扰代谢扰动分析结果。因此本研究最终选取了1 mmol/L作为后续扰动实验中的FP浓度,因为在这一浓度下既可以显示FP的抑制作用,也保证了分析结果的准确性。
2.2FP代谢扰动分析
2.2.1FP的利用由FP作为丙酮酸脱氢酶复合体竞争性抑制剂的作用机制可知,丙酮酸脱氢酶每消耗1摩尔FP就会减少1摩尔丙酮酸的利用,因而就会相应的减少1摩尔的乙酰辅酶A的合成。因此图2的数据也反映了裂殖壶菌胞内乙酰辅酶A合成量降低的现象。由图2可知,加入FP后的前8 h(发酵48 h),FP的平均消耗速率为0.831 μmol/L·g·h,随着培养时间的延长,FP的消耗速率降低,加入44 h后(发酵84 h)FP的消耗速率为0.21 μmol/L·g·h。在培养过程中对细胞代谢进行扰动时,胞内代谢途径会受到极大干扰,但是需要经过一定的代谢积累达到扰动稳态后,在扰动因子(此处是FP抑制剂)依然存在的情况下对细胞代谢水平做出评价会更加准确。

图2 FP在胞内的代谢速率Fig.2 FP degradation rate in Aurantiochytrium cells


图3 拟稳态下1 mmol/L FP对生长的影响Fig.3 Effects of 1 mmol/L FPto cell growth during homoeostasis state注:FP:FP扰动实验组。
2.3油脂积累和脂肪酸成分变化
由图4对照组结果可见,发酵初期(前40 h)在碳源和氮源充足的情况下细胞增殖占据了主导地位,油脂积累基本稳定在35%左右,发酵72~84 h后,细胞逐渐进入碳源、氮源缺乏的状态,细胞进入油脂积累期,油脂含量可达45%以上。实验组在加入FP之前,即前40 h和对照组的结果基本一致,油脂含量基本在35%左右,但是加入FP后,油脂含量出现明显下降,84 h样品细胞油脂含量为22%,仅为同时期对照组细胞油脂含量的40%。

图4 裂殖壶菌含油率的变化Fig.4 Different ratio of total oil to dry cell weight
裂殖壶菌油脂的脂肪酸组成较为简单,主要是由 FAS途径合成的饱和脂肪酸——十六酸和十八酸以及PKS途径合成的多不饱和脂肪酸——DHA和DPA组成。由图5和图6可知,加入FP后的8 h,脂肪酸分布并没有显著变化,这可能是因为胞内代谢途径到代谢终产物受到影响的过程中有一个适应过程,当代谢扰动始终存在且对胞内代谢有较大影响的情况下,代谢终产物还是会体现出差异的。而后随着培养时间的延长,对照组细胞油脂中FAS途径生成的脂肪酸比率由40 h的58%下降到84 h的50%,PKS途径合成的多不饱和脂肪酸比率则由40 h的42%上升为50%。FP处理组则呈现截然不同的变化趋势,加入FP后,FAS途径合成的脂肪酸比率却呈上升趋势,其比率从40 h的58%升至84 h的60%,而PKS途径的占比从40 h的44%下降至84 h的40%。
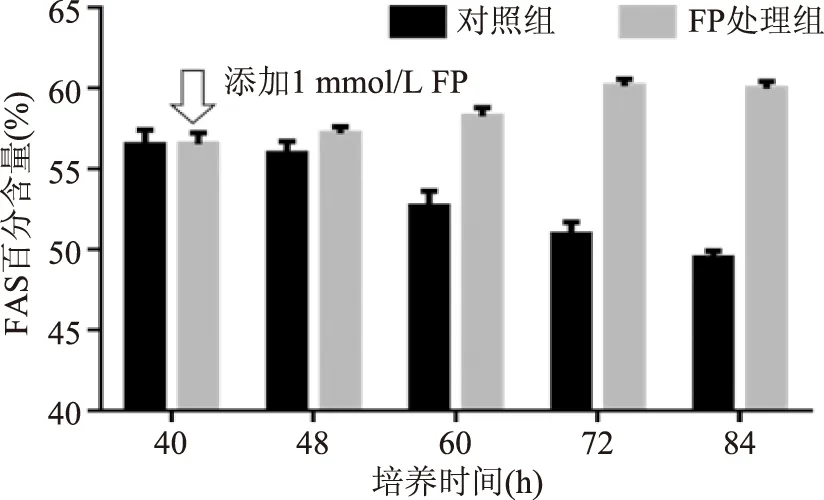
图5 裂殖壶菌胞内油脂中饱和脂肪酸比率的变化Fig.5 Different percentage of saturated fatty acids注:FAS百分含量指油脂中饱和脂肪酸占总脂肪酸的比率。

图6 裂殖壶菌胞内油脂中不饱和脂肪酸比率的变化Fig.6 Different percentage of unsaturated fatty acid注:PKS百分含量指油脂中不饱和脂肪酸占总脂肪酸的比率。
利用图4数据计算可知,加入FP后裂殖壶菌的含油率明显下降,合成油脂的FAS和PKS途径均受到抑制。在油脂合成受到抑制的前提下,不同油脂合成途径受抑制的程度有显著差别,FAS途径的抑制率为54%,而PKS途径的抑制率高达68%。因此可以说FP扰动降低乙酰辅酶A合成量对PKS的影响大于FAS。
胞内乙酰辅酶A的去向包括三羧酸循环、氨基酸合成和脂肪酸合成,由于已有裂殖壶菌的低温扰动实验说明乙酰辅酶A在FAS途径和PKS途径的分配比例与脂肪酸组成密切相关[14]。因此,首先由测定的脂肪酸组成和脂肪酸含量可以计算出用于合成脂肪酸的乙酰辅酶A总量,再根据脂肪酸的组成计算出分别由FAS途径和PKS途径消耗的乙酰辅酶A量,具体结果如表1所示。综合了前述生物量积累、葡萄糖消耗、元素平衡分析、油脂组成等诸多参数,设定对照组和FP处理组用于合成脂肪酸的乙酰辅酶A的总量分别为100%,进而计算出乙酰辅酶A在FAS和PKS途径中的分配比例变化,最终乙酰辅酶A在两个脂肪酸合成途径中的通量分布如图7所示。由计算结果可知添加FP后用于合成脂肪酸的乙酰辅酶A量由对照组的8.62 mmol降低为4.38 mmol,正常培养时乙酰辅酶A在FAS和PKS途径中的分配比例为几乎1∶1,但添加FP后其分配比例变为3∶2,即通过1 mmol/L FP处理来降低乙酰辅酶A的供给量会扩大乙酰辅酶A在FAS途径的分配比例。

表1 FP对裂殖壶菌油脂积累及乙酰辅酶A代谢的影响

图7 裂殖壶菌胞内乙酰辅酶A分支位点的分配比率Fig.7 Flux ratio of AcCoA metabolic branch point in cytoplasm注:乙酰辅酶A用于合成脂肪酸的量设定为100%。
由表1和图7的结果可知,加入FP后,PDC合成乙酰辅酶A的量降低,也就导致脂肪酸合成的碳源前体供给量减少,从而一方面降低了总油脂的合成,另一方面也显著影响了乙酰辅酶A在FAS和PKS之间的分配。FAS途径和PKS途径可以类似的看作两种酶体系,对底物乙酰辅酶A具有不同的Km值,即对底物乙酰辅酶A具有不同的亲和力。两种酶体系竞争性与同一种底物结合,Km值较小的酶体系容易与底物结合。由实验结果可知,在降低乙酰辅酶A 供给的情况下FAS占有竞争优势,因此推测FAS途径与乙酰辅酶A的亲和性高于PKS。因此为了保证PKS途径更多地合成DHA、DPA等不饱和脂肪酸,保证充足的乙酰辅酶A供给是十分有必要的。已有研究表明,通过在裂殖壶菌发酵过程中添加适当浓度的乙酸可以提高乙酰辅酶A的供给,并提高不饱和脂肪酸的合成[15],与本结果互为补充证明。
2.4碳分配变化

经计算对照组和实验组碳原子分配结果:葡萄糖中有52.42%的碳原子流向生物质合成途径;FP处理后这一比率降低为45.12%,而二氧化碳得率则相应地从对照组的47.59%上升至54.88%。以上结果表明抑制PDC降低了底物碳利用效率。
FP降低了丙酮酸脱氢酶复合体将丙酮酸转化成为乙酰辅酶A的效率,造成了胞内的丙酮酸积累以及乙酰辅酶A和NADH的减少。由于NADH是细胞代谢的能量来源之一[16],细胞可能将线粒体中的乙酰辅酶A优先供给三羧酸循环的中心代谢途径,造成了CO2的生成速率升高。
在实际生产过程中为了提高DHA的产量,通常利用代谢调控的方法将底物葡萄糖更高效地转化成为DHA,因此提高细胞内的碳转化效率是十分必要的。在裂殖壶菌中油脂合成机制的研究过程中,提高和降低碳转化率都有利于对合成机理的进一步解析。在后期研究中,可以通过13C标记代谢通量分析实验对中心代谢途径的分配比率进行模拟计算,以利于深入研究乙酰辅酶A供给对PKS途径的影响[17]。在生产应用中,应该保证充足的乙酰辅酶A的供给,提高丙酮酸脱氢酶复合体的活性,利于细胞积累更多的DPA、DHA,进一步接近理论产率。
3 结论
通过降低乙酰辅酶A供给可知丙酮酸脱氢酶复合体抑制剂FP可抑制裂殖壶菌的生长和油脂合成,同时FP会随之代谢消耗。同时,在裂殖壶菌生长拟稳态下(对数生长期),1 mmol/L FP可显著改变乙酰辅酶A在合成饱和脂肪酸的FAS途径和合成不饱和脂肪酸的PKS途径分配比率,从而导致总油脂中饱和脂肪酸含量上升而不饱和脂肪酸含量下降。经过物料平衡分析可知在降低了生物质合成途径碳通量比率的同时,应用FP来抑制PDC活性也显著增加了二氧化碳生成途径的碳通量比率。裂殖壶菌生物质降低的同时二氧化碳生成量增加。
[1]宋晓金. 富含DHA的裂殖壶菌的工业化生产实验、脂肪酸提取及应用研究[D]. 青岛:中国海洋大学,2008.
[2]DYALL S C. Long-chain omega-3 fatty acids and the brain:a review of the independent and shared effects of EPA,DPA and DHA[J]. Front Aging Neurosci,2015,7.
[3]NESTEL P,CLIFTON P,COLQUHOUN D,et al. Indications for Omega-3 Long Chain Polyunsaturated Fatty Acid in the Prevention and Treatment of Cardiovascular Disease[J]. Heart Lung Circ,2015,24(8):769-779.
[4]MA Z X,TAN Y Z,CUI G Z,et al. Transcriptome and gene expression analysis of DHA producer Aurantiochytrium under low temperature conditions[J]. Sci Rep-Uk,2015,5.
[5]DE SWAAF M E,PRONK J T,SIJTSMA L. Fed-batch cultivation of the docosahexaenoic-acid-producing marine alga Crypthecodinium cohnii on ethanol[J]. Appl Microbiol Biot,2003,61(1):40-43.
[6]RATLEDGE C. Fatty acid biosynthesis in microorganisms being used for Single Cell Oil production[J]. Biochimie,2004,86(11):807-815.
[7]SHTAIDA N,KHOZIN-GOLDBERG I,BOUSSIBA S. The role of pyruvate hub enzymes in supplying carbon precursors for fatty acid synthesis in photosynthetic microalgae[J]. Photosynth Res,2015,125(3):407-422.
[8]ZOU J T,QI Q G,KATAVIC V,et al. Effects of antisense repression of an Arabidopsis thaliana pyruvate dehydrogenase kinase cDNA on plant development[J]. Plant Mol Biol,1999,41(6):837-849.
[9]QIU X. Biosynthesis of docosahexaenoic acid(DHA,22:6-4,7,10,13,16,19):two distinct pathways[J]. Prostag Leukotr Ess,2003,68(2):181-186.
[10]METZ J G,ROESSLER P,FACCIOTTI D,et al. Production of polyunsaturated fatty acids by polyketide synthases in both prokaryotes and eukaryotes[J]. Science,2001,293(5528):290-293.
[11]SONG X J,TAN Y Z,LIU Y J,et al. Different Impacts of Short-Chain Fatty Acids on Saturated and Polyunsaturated Fatty Acid Biosynthesis in Aurantiochytrium sp SD116[J]. J Agr Food Chem,2013,61(41):9876-9881.
[12]GAO M,SONG X J,FENG Y G,et al. Isolation and characterization of Aurantiochytrium species:high docosahexaenoic acid(DHA)production by the newly isolated microalga,Aurantiochytrium sp SD116[J]. J Oleo Sci,2013,62(3):143-151.
[13]BISSWANGER H. Substrate-Specificity of the Pyruvate-Dehydrogenase Complex from Escherichia-Coli[J]. J Biol Chem,1981,256(2):815-822.
[14]FLOURNOY D S,FREY P A. Inactivation of the Pyruvate-Dehydrogenase Complex of Escherichia-Coli by Fluoropyruvate[J]. Biochemistry-Us,1989,28(25):9594-9602.
[15]魏萍,任路静,纪晓俊,等. 强化乙酰辅酶A供应对裂殖壶菌合成二十二碳六烯酸的影响[J]. 中国生物工程杂志,2011(4):87-91.
[16]崔家涛,谭延振,崔球,等. 海洋真菌SD116在产物合成中的辅因子谱分析[J]. 中国海洋药物,2013(6):27-32.
[17]HE L,XIAO Y,GEBRESELASSIE N,et al. Central Metabolic Responses to the Overproduction of Fatty Acids in Escherichia coli Based on C-13-Metabolic Flux Analysis[J]. Biotechnol Bioeng,2014,111(3):575-585.
Research of a specific competitive inhibitor of pyruvate dehydrogenase complex onAurantiochytriumsynthesizing fatty acids
CHENG Yu-rong1,2,3,SUN Zhi-jie1,*,CUI Qiu1,2,4,*
(1.Shandong Provincial Key Laboratory of Energy Genetics,Qingdao Institute of Bioenergy and BioprocessTechnology,Chinese Academy of Sciences,Qingdao 266100,China;2.Qingdao Engineering Laboratory of Single Cell Oil,Qingdao 266100,China;3.University of Chinese Academy of Sciences,Beijing 100040,China;4.Key Laboratory of Biofuels,Qingdao Institute of Bioenergy and Bioprocess Technology,Chinese Academy of Sciences,Qingdao 266100,China)
Aurantiochytriumsynthesizes polyunsaturated fatty acid(docosahexenoic acid(DHA)and docosapentaenoic acid(DPA))through polyketide synthase(PKS)pathway,and saturated fatty acid(mainly palmic acid and oleic acid)through fatty acid synthase(FAS)pathway. Both pathways competitively used acetyl-CoA as carbon precursor. Understanding the mechanism to regulate the carbon partition between FAS pathway and PKS pathway was helpful for designation of high-DHA-yield strains and optimization of industrial fermentation process. In this research,the pyruvate dehydrogenase complex,which catalyzing the synthesis of acetyl-CoA,was treated by fluoropyruvate(FP)-a specific substrate-competitive inhibitor. Based on determination of carbon consumption,biomass,total oil accumulation and the distribution ratio of acetyl-CoA between FAS and PKS pathways were investigated. The results showed that FP could be assimilated and metabolized byAurantiochytriumand FP could inhibit lipid synthesis and significantly change the partition ratioof acetyl-CoA between FAS and PKS pathways. Production of carbon-dioxide was enhanced by FP,but the accumulation of biomass was inhibited. These results hinted that the affinity of FAS pathway to acetyl-CoA was higher than that of PKS pathway and the content of polyunsaturated fatty acid(DHA and DPA)in total oil could not be increased by reducing supply of acetyl-CoA.
fluoropyruvate;docosahexenoic acid;pyruvate dehydrogenase complex;acyl-CoA;Aurantiochytrium
2016-03-08
程钰蓉(1991-),女,硕士研究生,研究方向:代谢通量分析,E-mail:chengyr@qibebt.ac.cn。
孙志杰(1978-),男,副研究员,研究方向:代谢通量分析,E-mail:sunzj@qibebt.ac.cn。
崔球(1975-),男,研究员,研究方向:微生物代谢工程及蛋白质工程,E-mail:cuiqiu@qibebt.ac.cn。
国家高技术研究发展计划(863计划)(2014AA021701);国家自然科学基金(41306132;3150078)。
TS201.3
A
1002-0306(2016)16-0161-06
10.13386/j.issn1002-0306.2016.16.024

