全自动固相萃取-高效液相色谱法同时测定饮用水中3种微囊藻毒素
徐潇颖,刘 柱,梁晶晶,周 霞,罗金文
(浙江省食品药品检验研究院,浙江杭州 310052)
全自动固相萃取-高效液相色谱法同时测定饮用水中3种微囊藻毒素
徐潇颖,刘柱,梁晶晶,周霞,罗金文*
(浙江省食品药品检验研究院,浙江杭州 310052)
建立全自动固相萃取-高效液相色谱法同时测定饮用水中3种微囊藻毒素的方法。采用全自动固相萃取仪代替传统的前处理方式,对大体积水样进行富集,以KH2PO4(pH=3.0)-甲醇(43∶57,v∶v)为流动相,采用二极管阵列检测器进行检测,结果3种微囊藻毒素在0.1~10.0 μg/mL范围内线性关系良好,相关系数r2≥0.999,3种不同微囊藻毒素的检出限均可达到0.05 μg/L(S/N=3),加标回收率在86.3%~99.7%范围内,标准偏差为1.70%~2.72%(n=6),该方法用于测定饮用水中3种微囊藻毒素具有操作简单、快速,精密度高、准确可靠等特点。
全自动固相萃取,微囊藻毒素YR,微囊藻毒素LR,微囊藻毒素RR,饮用水
由于水体富营养化及污染问题日益严重,导致蓝藻水华频发,随之产生的微囊藻毒素污染问题也日益受到重视。微囊藻毒素(Microcystins,MCs)是蓝藻释放的有毒代谢物[1-2],现今已发现不同的微囊藻毒素同分异构体共60余种,其中MC-RR,MC-LR,MC-YR最为常见,该类毒素毒性很强,主要对哺乳动物的肝脏产生损害[3]。世界卫生组织在其推荐的饮用水标准指导中也增加了微囊藻毒素(MC-LR,1 μg/L),而国内现行《生活饮用水卫生规范》和《地表水环境质量标准》中也规定微囊藻毒素LR≤0.001 mg/L[4]。
目前用于检测水体及蓝藻中微囊藻毒素的方法有酶联免疫法(ELISA)[5]、蛋白磷酸酶抑制法(PPIA)[6]、生物分析法[7],以及常用的高效液相色谱法[8-9]和液相色谱质谱联用法[10]。在采用高效液相色谱法和液相色谱质谱联用法对水体中微囊藻毒素进行测定的过程中,由于微囊藻毒素在饮用水中的残留量低,水样体积大,前期富集大多存在费时费力或消耗大量有机溶剂等缺点,除冯桂学[11]等进行了简化前处理研究外,他人尚无研究。
1 材料与方法
1.1材料与仪器
饮用水市售;MC-LR,MC-YR,MC-RR标准品(纯度≥95%)美国Enzo公司;甲醇(色谱纯)德国Merck公司;实验所用其它试剂均为分析纯,北京化学试剂公司。
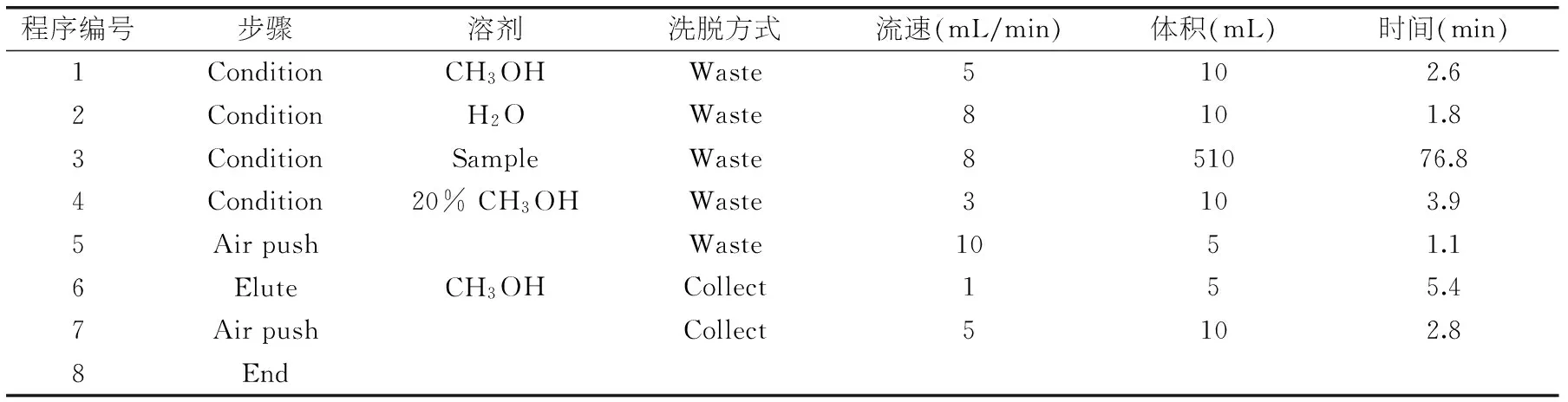
表1 全自动固相萃取仪富集洗脱条件
高效液相色谱仪Agilent 1260型,配备二极管阵列(DAD)检测器,Aglient化学工作站;全自动固相萃取仪(Fotector plus)Reeko;Milli-Q纯水仪密里博。
1.2实验方法
1.2.1全自动固相萃取仪富集条件采用全自动固相萃取仪设定洗脱程序,利用HLB固相萃取柱(Waters,500 mg,6 mL)按表1进行富集洗脱程序设定,对500 mL水样进行前处理富集。
1.2.2色谱条件色谱柱:Shim-pack VP-ODS C18(250×4.6 nm,5 μm);柱温:40 ℃;检测器:二极管阵列;检测波长:238 nm;进样量:10 μL;流速:0.9 mL/min;流动相条件1(等度洗脱):KH2PO4缓冲溶液∶甲醇=43∶57;流动相条件2(等度洗脱):乙腈∶水(0.04% TFA)=38∶62;流动相条件3(等度洗脱):乙腈∶水(0.04% TFA)=40∶60。
1.2.3标准曲线绘制将MC-LR、MC-YR、MC-RR标准品各0.1 mg分别用甲醇定容至5.0 mL,配制成20 μg/mL的标准储备液,于-20 ℃保存。用甲醇配制浓度分别为0.1、0.2、0.5、1.0、2.0、5.0、10.0 μg/mL的混合标准溶液。以仪器响应的峰面积Y对应浓度X(μg/mL)进行线性回归。
1.2.4样品溶液制备样液经过全自动固效萃取仪的富集程序后,40 ℃下氮气吹干,用洗脱液定容至1.0 mL。用0.22 μm滤膜过滤后,待上机。
1.2.5回收率实验对阴性样品进行三个不同浓度水平的加标实验,加标浓度分别为0.3、0.6、1.0 μg/L,每个浓度进行6组平行性实验。
1.2.6精密度实验对阴性样品进行三倍检出限加标测定,在0.15 μg/L浓度下进行6组平行实验,计算标准偏差。
2 结果与讨论
2.1色谱条件的选择
据报道[12],利用高效液相色谱对微囊藻毒素进行测定,多采用甲醇∶磷酸盐缓冲溶液(pH=3.0)=57∶43(v/v)或乙腈∶水(0.04% TFA)=38∶62(v/v)做为流动相。本实验分别对两种不同流动相进行优化,结果表明:当选用乙腈/水(0.04% TFA)作为流动相时,标样色谱图见图1,出峰时间短,但MC-YR和MC-RR峰中包含杂质,分离度较差。改变流动相比例为乙腈∶水(0.04% TFA)=40∶60(v/v)进行分离后,这两种微囊藻毒素回收率偏低,见图2。在选用甲醇∶磷酸盐缓冲溶液(pH=3.0)=57∶43(v/v)对三种微囊藻毒素进行分离时,三种不同的微囊藻毒素可达到有效分离,色谱图见图3。故优选甲醇∶磷酸盐缓冲溶液(pH=3.0)=57∶43(v/v)为流动相进行微囊藻毒测定。
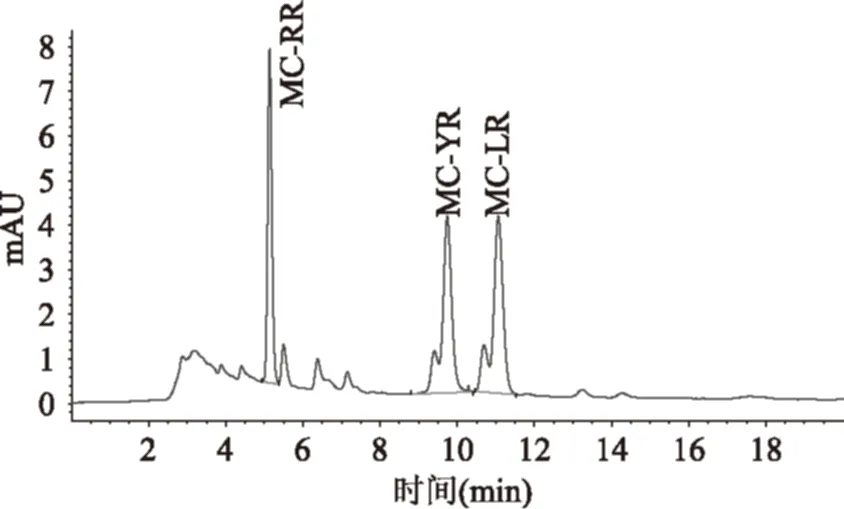
图1 3种微囊藻毒素标准溶液色谱图(以乙腈∶水(0.04% TFA)=38∶62为流动相)Fig.1 Chromatogram of Mcs with ancetonitrile-water(0.04% TFA)as mobile phase

图2 3种微囊藻毒素标准溶液色谱图(以乙腈∶水(0.04% TFA)=40∶60为流动相)Fig.2 Chromatogram of Mcs with ancetonitrile-water(0.04% TFA)as mobile phase
2.2线性评价及检出限
按照优化后的色谱条件对3种微囊藻毒素进行检测,在0.1~10.0 μg/mL范围内以仪器响应的峰面积Y对应浓度X(μg/mL)进行线性回归,结果表明MC-RR、MC-LR、MC-YR在0.1~10.0 μg/mL范围内线性关系良好,相关系数R2≥0.999,采用空白水样加标的方法,以仪器信噪比(S/N=3)计算方法检出限(LOD)可达到0.05 μg/L,结果见表2。该方法检出限要低于吴振兴等[13]利用高效液相质谱联法获得的1 μg/L。
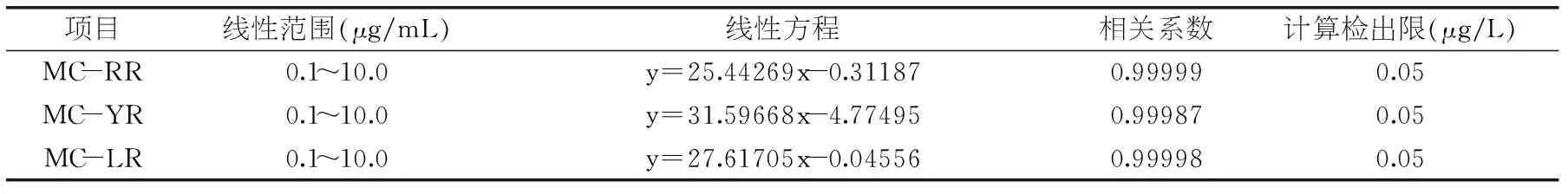
表2 3种微囊藻毒素的线性方程及检出限

图3 3种微囊藻毒素标准溶液色谱图(以甲醇/磷酸盐缓冲溶液(pH=3.0)=57∶43为流动相)Fig.3 Chromatogram of Mcs with phosphate buffer solution(pH=3.0)-methanol(57∶43)as mobile phase
2.3精密度实验
对某品牌饮用水A(阴性样品)进行三种微囊藻毒素的精密度测定,定量限加标浓度为0.15 μg/L,进行6组平行实验,测定结果见表3。从表3中可看出,3种微囊藻毒素的测定结果相对标准偏差在1.70%~2.72%,表明采用全自动固相萃取仪进行富集,各水平下测定值均呈现良好的稳定性,该方法具有较高的精密度,且平行性较好。

表3 3种微囊藻毒素精密度实验结果(n=6)
2.4回收实验
对某品牌饮用水A(阴性样品)进行不同水平的加标回收实验,加标浓度分别为0.3、0.6、1.0 μg/L,每一浓度进行6组平行实验,结果见表4,除MC-RR在0.3 μg/L浓度下回收率为86.3%外,其余加标水平的回收率在91.1%~99.7%,说明该方法具有良好的准确性。

表4 回收实验结果(n=6)

表5 样品测定结果
注:ND即视为低于检出限0.05 μg/L。
2.5实际样品测定
按照本方法对市售5个品牌饮用水A,B,C,D,E进行微囊藻毒素的测定,测定结果见表5。其中一个品牌饮用水中检出MC-YR,为阳性样品,而该指标在现行国标中并未做出规定。
3 结论
实验采用全自动固相萃取仪代替传统的人工过柱,相对于传统的前处理方法,该方法在设定洗脱程序的流速后,可达到仪器的全自动化,通过6个相对独立蠕动泵可同时进行6个样品的富集。大大缩短了洗脱时间,提高了洗脱效率,控制了洗脱速度,减小了由前处理造成的实验误差。通过不同水平的加标实验,发现3种微囊藻毒素在0.1~10.0 μg/mL范围内呈现良好的线性关系,相关系数r2≥0.999,3种不同微囊藻毒素的检出限均可达到0.05 μg/L,精密度实验中获得标准偏差在1.70%~2.72%之间,加标回收率在86.3%~99.7%范围内,证明本实验方法可达到饮用水中微囊藻毒素的检测准确度和精确度。
[1]Susan VJ,Theodore WV,Daniel LR,et al. Probabilistic ecological hazard assessment of microcystin-LR allelopathy to Prymnesium parvum[J]. J Plankton Res,2011,33(2):319-332.
[2]Huirong C,Janice M,Tom M,et al. Cyanobacteria and microcystin-LR in a complex lake system representing a range in trophic status:Lake of the Wools,Ontario,Canada[J]. J Plankton Res,2009,31(9):993-1008.
[3]周天伦,俞顺章.启东肝癌高发区饮用水对F-334大鼠肝γ-GT酶影响的分析[J].中华预防医学会杂志,1999,21(4):201-203.
[4]WHO.Guidelines for Drinking-water Quality[M].Geneva:WHO,2004.
[5]邵鹏,刘锐,陈吕军,等.酶联免疫快速检测技术在太湖流域微囊藻毒素污染调查中的应用研究[J].环境污染与防治,2009,31(5):25-30.
[6]王燕,郭宗楼,季林丹,等.蛋白磷酸酶抑制法-荧光法检测微囊藻毒素的影响因素研究[J].水生生物学报,2005,29(5):598-600.
[7]Eriksson J E,Gronberg L,Nygard S,et al. Hepatocellular uptake of 3H-dihydromicrocystin-LR,acyclic peptide toxin. Biochem[J]. Biophys Acta,1990,1025:60-66.
[8]毛敬英,杨敏,狄一安,等.高效液相色谱法检测水中5种微囊藻毒素[J].环境工程学报,2012,6(11):3882-3888.
[9]陈立坚,何敏恒,李秀英,等.高效液相色谱-串联质谱法测定水产品7种微囊藻毒素[J].现代食品科技,2012,28(9):1243-1248.
[10]赵起越,赵红帅,刘保献,等.直接进样-高效液相色谱-串联质谱法测定地表水中9种微囊藻毒素[J].分析化学研究报告,2015,43(4):594-598.
[11]冯桂学,刘莉,王明泉,等.在线固相萃取-液相色谱法测定水中3种微囊藻毒素[J].化学分析计量,2014,23(6):34-36.
[12]郭坚,杨新磊,叶明立.全自动在线固相萃取-高效液相色谱法测定水体中痕量微囊藻毒素[J].分析化学,2011,39(8):1256-1260.
[13]吴振兴,鲍蕾,赵华梅,等.液相色谱-串联质谱法测定淡水产品中的微囊藻毒素[J].食品研究与开发,2013,34(22):21-24.
Determination of three microcystins in drinking water by automatic-SPE and HPLC
XU Xiao-ying,LIU Zhu,LIANG Jing-jing,ZHOU Xia,LOU Jin-wen*
(Zhejiang Institute for Food and Drug Control,Hangzhou 310052,China)
Three microcystins were determined by automatic solid phase extraction(SPE)and high performance liquid chromatography(HPLC)in this study. Instead of the traditional pretreatment methods,Reeko automatic-SPE system was used for a fast enrichment process. Samples were chromatographed isocratically using a KH2PO4(pH3.0)buffer solution-methanol mobile phase on a C18column in-line by diode array detector. Good linear relation were presented in the range of 0.1~10.0 μg/mL for all microcystins with the correlation coefficientsR2≥0.999. The detection limits of three microcystins were 0.05 μg/L(S/N=3).Recoveries of these microcystins at three different concentration levels were studied. The recoveries of this method were 86.3%~99.7% with a good relative standard deviations of 1.70%~2.72%(n=6). This method was easy,fast and accurate and suitable for a rapid determination of microcystins in drinking water.
automatic-SPE;microcystin(YR);microcystin(LR);microcystin(RR);drinking water
2016-02-17
徐潇颖(1989-),女,硕士,助理工程师,研究方向:食品安全与分析技术,E-mail:net_easexxy@126.com。
罗金文(1974-),男,硕士,高级药师,研究方向:食品安全与分析技术,E-mail:luojw31@163.com。
浙江省科学技术厅重大科技专项重大农业项目(2014C02001)。
TS207.3
A
1002-0306(2016)18-0060-04
10.13386/j.issn1002-0306.2016.18.003

