五氯柳胺口服混悬剂的制备及其含量测定
张吉丽,李 冰,司鸿飞,郭 肖,朱 阵,尚晓飞,周绪正,张继瑜
(中国农业科学院兰州畜牧与兽药研究所,农业部兽药创制重点实验室,兰州 730050)
五氯柳胺口服混悬剂的制备及其含量测定
张吉丽,李冰,司鸿飞,郭肖,朱阵,尚晓飞,周绪正,张继瑜*
(中国农业科学院兰州畜牧与兽药研究所,农业部兽药创制重点实验室,兰州 730050)
研究的目的是制备五氯柳胺混悬剂,研究其理化性质并建立含量测定方法。通过单因素筛选及二次回归正交旋转设计,以沉降体积比和再分散性为考察因素,优化处方制备五氯柳胺混悬剂,用透射电子显微镜、激光粒度测定仪对其形态和粒径进行测定,考察制剂的稳定性,建立测定含量的高效液相色谱方法。五氯柳胺混悬剂每100 mL中含五氯柳胺 3.2 g,卡波姆974p 0.2 g,十二烷基硫酸钠 0.3 g,对羟基苯甲酸甲酯0.02 g,焦亚硫酸钠0.4 g。混悬剂沉降体积比为0.999,再分散性良好。五氯柳胺在18~100 μg·mL-1的质量浓度范围内与峰面积呈良好的线性关系。制备的五氯柳胺混悬剂工艺简单,物理性状良好,稳定性和分散性好,质量可控。
五氯柳胺混悬剂;二次回归正交旋转设计;含量测定;HPLC
肝片吸虫病(fascioliasis hepatica)是由肝片吸虫引起的食源性人畜共患病,该病遍及欧洲、亚洲、非洲、美洲和大洋洲等区域[1],引起动物消瘦、贫血、使役能力下降和生产性能降低,严重阻碍了畜牧养殖业的健康发展,同时对食品安全、公共卫生安全和环境生态安全构成了严重威胁,造成了严重的经济损失[2-3]。
临床对肝片吸虫病的防治主要依靠化学药物。在疫苗预防方面,虽然肝片吸虫重组卡介苗的研制取得了明显进展,但距离批量化生产和大面积推广还有很大差距。常用于防治肝片吸虫感染的化学药物有三氯苯达唑(triclabendazole)、阿苯达唑(albendazole)、氯舒隆(clorsulon)和五氯柳胺(oxyclozanide)等[4-5],其中三氯苯达唑、阿苯达唑和氯舒隆等由于在临床长期大面积使用已产生了耐药性,导致临床疗效大大降低[6-7]。五氯柳胺作为水杨酰苯胺类化学合成抗蠕虫药物,主要用于防治牛、羊等动物的吸虫病、绦虫病和蛔虫病,对线虫也有一定的治疗效果,其通过抑制虫体线粒体中氧化磷酸化过程从而阻碍三磷酸腺苷的生成,使虫体因能量耗尽而死亡[8]。该药的驱虫效率高、毒性小、安全范围大。国外大量的临床应用证实了五氯柳胺对蠕虫感染具有良好的治疗效果,特别是对肝片吸虫的感染效果十分突出[9-11]。至今为止,该药在欧、美和非洲等地区仍广泛应用,且未出现耐药性。
五氯柳胺在国内尚未开发为兽药产品,基于其优良的药效性能,为满足我国对兽医吸虫病防控的巨大临床需求,作者开展了抗牛、羊吸虫病五氯柳胺新制剂的研制。本研究通过单因素筛选以及二次回归正交旋转设计方法建立和优化制剂处方,制备了具有自主知识产权的五氯柳胺口服混悬剂,并对其物理性状、再分散性、沉降体积比等药学特性进行了研究,建立了药物有效成分含量测定的高效液相色谱方法,为五氯柳胺新药开发和临床应用奠定基础。
1 材料与方法
1.1主要材料
1.1.1主要仪器ME403型电子天平(梅特勒-托利多仪器有限公司);KQ-600DE数控超声清洗器(昆山市超声仪器限公司);D2010W电动搅拌器(上海梅颖浦仪器仪表制造有限公司);UPT-Ⅱ-40L优普超纯水制造系统(上海优普实业有限公司);FE20实验室pH计(梅特勒-托利多仪器有限公司);ZetasizerNano ZS ZEN 3600激光动态散射仪(英国Malverninstrument公司);TECNAL G2型场发射高分辨透射电子显微镜(美国FEI公司);Waters2695 高效液相色谱仪(美国Waters公司);Waters2489 紫外检测器(美国Waters公司);WD-A药物稳定性检测仪(天津药典标准仪器有限公司);针筒式微孔滤膜过滤器(孔径0.22 μm,广州优瓦仪器有限公司);Hypersil ODS色谱柱(4.6 mm×150 mm,5 μm,大连依利特分析仪器有限公司)。
1.1.2主要试剂五氯柳胺原料药(常州亚邦齐晖医药化工有限公司,批号:RD1506001,含量:99%以上);五氯柳胺标准品(美国TSZ公司,批号:T121-043);十二烷基硫酸钠(化学纯,国药集团化学试剂有限公司);卡波姆974p(上海阿拉丁生化科技股份有限公司);对羟基苯甲酸甲酯(化学纯,国药集团化学试剂有限公司);焦亚硫酸钠(分析纯,国药集团化学试剂有限公司);甲醇(色谱纯,美国费舍尔公司);磷酸(色谱纯,Sigma公司);超纯水和纯水为作者实验室自制。
1.2试验方法
1.2.1混悬剂的制备将五氯柳胺、焦亚硫酸钠、十二烷基硫酸钠、卡波姆 974p等原料药和辅料分别用研钵研磨,过筛,备用。将卡波姆 974p、焦亚硫酸钠等辅料成分分别缓慢加入装有蒸馏水的烧杯中,调动搅拌机转速,搅拌1.5 h,得溶液A;另将十二烷基硫酸钠和五氯柳胺加入盛有蒸馏水的烧杯中,混匀,得到溶液B;将溶液B缓慢加入到正在搅拌的溶液A中,加蒸馏水定容;搅拌1.5 h,即得[12]。
1.2.2评价指标及测定依据《中国兽药典》2010年版对口服混悬剂的质量评价要求,以沉降体积比和再分散性作为主要评价指标[13]并进行测定。
1.2.3辅料及其用量筛选主要辅料中,选择卡波姆 974p作为助悬剂,十二烷基硫酸钠作为润湿剂,焦亚硫酸钠作为抗氧化剂,通过单因素试验确定各种辅料的最佳用量范围。采用SAS软件中“GLM ”程序分析辅料各成分的显著性。
以单因素试验中显著性因素作为主要考察指标,选用二次正交回归旋转设计对处方进行优化,各因素水平见表1,并通过SAS软件进行试验设计。
以沉降体积比及再分散性作为评价指标,计算Y值进行综合评价。计算方法如下:
沉降体积比(F)测定:将各处方混悬剂置于50 mL的具塞试管中,放置,记录初始高度H0,分别在3 h、1 d、3 d和7 d进行观察,记录沉降后体积H,以H/H0为沉降体积比数值。
再分散性次数(N)测定:将各种处方混悬剂的具塞试管倒转180°,测定恢复到初制混悬状态时所需翻转的次数即为再分散性次数。
表1二次回归正交旋转设计各因素水平表
Table 1The levels of factors in the quadratic regression orthogonal rotational combination design

因素Factors水平Levels卡波姆974pCarbomer974p0.10.180.30.420.5十二烷基硫酸钠Sodiumdodecylsulfate0.10.180.30.420.5焦亚硫酸钠Sodiumpyrosulfite0.010.210.5050.81.0
Y值计算方程:
Y为沉降体积比与再分散性倒数之和,值越大则混悬剂效果越好。
1.2.4验证性试验按照筛选的最优处方制备3批五氯柳胺混悬剂样品,测定粒径大小及分布、再分散性、沉降体积比、外观颜色和pH等指标。
1.2.4.1粒径大小及分布:测定方法如下。
粒径大小测定:采用激光动态散射仪对五氯柳胺混悬剂进行粒径的测定。将制备好的混悬剂进行100倍稀释,超声5 min,在激光粒度仪中进样检测,每个样品测定3次,记录平均粒径的大小及分布范围。
形态分布测定:将三批样品用超纯水稀释10倍,负染后,自然挥干,置于透射电镜下观察,在50和100 nm标尺下检测样品的形态分布。
1.2.4.2再分散性及沉降体积比:测定方法同“1.2.3”中所述。
1.2.4.3外观颜色和pH:观察并记录五氯柳胺混悬剂的外观色泽,用酸度计进行pH测定。
1.2.5含量测定方法
1.2.5.1色谱分析条件:色谱柱为Hypersil ODS(150 mm×4.6 mm,5 μm);流动相为甲醇:0.1%磷酸水(80∶20);流速:1.0 mL·min-1;检测波长:300 nm;柱温:25 ℃;进样量:20 μL。
1.2.5.2方法专属性试验:将甲醇配制的五氯柳胺标准品溶液,五氯柳胺混悬剂供试品溶液和空白混悬剂样品溶液,分别经0.22 μm微孔滤器过滤,注入液相色谱仪,依次进样测定。
1.2.5.3线性考察:精密称取五氯柳胺标准品10.00 mg,置于100 mL容量瓶中,用甲醇溶解并定容,配制成100 μg·mL-1的五氯柳胺标准品母液,待用。采用梯度稀释法,取标准品母液配制成质量浓度为100、60、45、36、18 μg·mL-1的标准品溶液,精确吸取20 μL进样,记录峰面积。以五氯柳胺标准品的峰面积为纵坐标Y,以五氯柳胺标准品的质量浓度(C)为横坐标,绘制峰面积(Y)-质量浓度(C)标准曲线,计算标准曲线的回归方程[14-15]。
1.2.5.4回收率试验:精密称取五氯柳胺标准品,用甲醇溶解,配制成30(低)、60(中)、80 μg·mL-1(高)三个质量浓度的对照品溶液,每份溶液分别进样3次,测定每个样品的实测质量浓度。根据实测质量浓度与理论质量浓度的比值,计算回收率及相对标准偏差(RSD)。
1.2.5.5精密度试验:精密称取五氯柳胺标准品,用甲醇配制成30(低)、60(中)、80 μg·mL-1(高)三个质量浓度的对照品溶液,分别考察日内精密度和日间精密度。
1.2.5.6重复性试验:按供试品溶液制备方法,配制供试品溶液5份,并按上述色谱条件,精密吸取各样品溶液10 μL进样,记录峰面积,计算含量及其RSD值[16]。
1.2.5.7样品含量测定:分别精密吸取三批五氯柳胺混悬剂样品(含五氯柳胺32 mg·mL-1)各0.2 mL置于100 mL的容量瓶中,用甲醇稀释并定容,经0.22 μm微孔滤器过滤,注入液相色谱仪,记录峰面积,计算含量及RSD值。
1.2.6混悬剂的稳定性考察为了对混悬剂的稳定性进行评价,试验中进行了为期半年的短期稳定性考察和相关试验,内容包括加速试验和强光、高温条件下的影响因素试验。
1.2.6.1加速试验:将3批样品在市售包装条件下,放置于恒温恒湿试验箱中,在温度40 ℃±2 ℃、相对湿度75%±5%的条件下进行6个月的稳定性考察,分别于第0个月、第1个月、第2个月、第3个月、第6个月进行外观性状、再分散性和沉降体积比考察,测定pH及含量。
1.2.6.2影响因素试验:包括强光照射试验和高温试验。
强光照射试验:将3批样品置于照度4 500 lx±500 lx的光照箱中放置10 d,分别于第0天、第5天和第10天取样分析。与第0天比较,观察外观性状,考察沉降体积比、再分散性、pH等指标的变化,并进行含量测定。
高温试验:将3批样品在60 ℃下放置10 d,分别于第0天、第5天和第10天取样分析,与第0天比较,检测指标同上所述。
2 结 果
2.1二次回归正交旋转设计试验
通过单因素筛选各辅料的最佳用量范围,应用SAS软件对各因素的显著性进行分析,结果表明,卡波姆 974p、十二烷基硫酸钠及焦亚硫酸钠三种辅料对五氯柳胺混悬剂的稳定性影响极显著。
根据对沉降体积比与再分散性指标的测定,计算Y值的评价结果见表2。二次回归正交旋转设计试验的结果如图1所示,其中,图A为当十二烷基硫酸钠固定时,卡波姆 974p与焦亚硫酸钠对混悬剂稳定性的影响;图B为当焦亚硫酸钠固定时,卡波姆 974p与十二烷基硫酸钠对混悬剂稳定性的影响;图C为卡波姆974p固定时,焦亚硫酸钠与十二烷基硫酸钠对混悬剂稳定性的影响。
表2二次回归旋转正交设计试验结果
Table 2The result of the quadratic regression orthogonal rotational combination design test

试验次数Testtimes因素Factors卡波姆974pCarbomer十二烷基硫酸钠Sodiumdodecylsulfate焦亚硫酸钠SodiumpyrosulfiteY值ThevalueofY10.1800.1800.2101.02720.1800.1800.8000.98630.1800.4200.2101.57940.1800.4200.8001.49550.4200.1800.2100.83960.4200.1800.8001.45570.4200.4200.2101.99980.4200.4200.8001.99990.1000.3000.5051.323100.5000.3000.5051.735110.3000.1000.5050.912120.3000.5000.5051.486130.3000.3000.0101.500140.3000.3001.0001.582150.3000.3000.5051.590160.3000.3000.5051.350170.3000.3000.5051.480180.3000.3000.5051.331190.3000.3000.5051.596200.3000.3000.5051.112210.3000.3000.5051.577220.3000.3000.5051.484230.3000.3000.5051.053240.3000.3000.5051.572250.3000.3000.5051.041
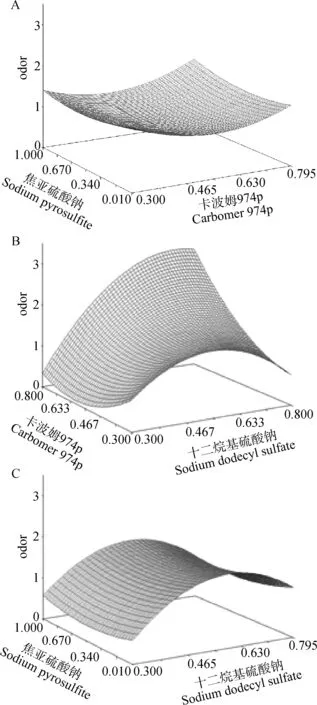
A.卡波姆 974p与焦亚硫酸钠的浓度对五氯柳胺混悬剂稳定性的响应面;B.卡波姆 974p与十二烷基硫酸钠的浓度对五氯柳胺混悬剂稳定性的响应面;C.十二烷基硫酸钠与焦亚硫酸钠的浓度对五氯柳胺混悬剂稳定性的响应面A.Response surface of carbomer 974p and sodium pyrosulfite on the stable of oxyclozanide suspension;B.Response surface of carbomer 974p and sodium dodecyl sulfate concentration on the stable of oxyclozanide suspension;C.Response surface of sodium pyrosulfite and sodium dodecyl sulfate concentration on the stable of oxyclozanide suspension图1 SAS分析二次回归旋转正交设计的响应面结果Fig.1 The response surface of the quadratic regression orthogonal rotational combination design test by SAS analysis
通过对响应面的SAS软件分析得到一个驻点如表3所示,由于此驻点是一个鞍点,因此作者对其进行了岭分析,找到了符合实际情况的最大值即:Y=1.999 943,此时,卡波姆 974p最优值为2.0 mg·mL-1,十二烷基硫酸钠最优值为3.0 mg·mL-1,焦亚硫酸钠最优值为4.0 mg·mL-1。
试验得到的最优处方:以100 mL计,当卡波姆 974p为0.2 g、焦亚硫酸钠为0.4 g、十二烷基硫酸钠为0.3 g、对羟基苯甲酸甲酯为0.02 g时,沉降体积比最大为0.999 8,接近于1,再分散性最好。
2.2验证试验
2.2.1粒径大小及分布结果根据试验优化后得到的处方,分别配制3批五氯柳胺的混悬剂,测定粒径大小及分布如图2所示,A、B、C为三批样品的粒径分布图,粒径大小分别为791、767和713 nm。

图2 混悬剂粒径分布Fig.2 The particle distribution of suspension
在透射电镜下,对混悬剂的稀释液进行检查,图3表示在标尺为50和100 nm时的粒径分布,可见粒径分布较集中,大小适宜。
表3SAS分析二次回归旋转正交设计的驻点结果
Table 3The stationary point in the quadratic regression orthogonal rotational combination design test by SAS analysis

因素Factor临界值Criticalvalue编码Coded非编码Uncoded卡波姆974pCarbomer974p-0.962517-0.949736十二烷基硫酸钠Sodiumdodecylsulfate0.2616980.691937焦亚硫酸钠Sodiumpyrosulfite0.1145650.192698在驻点的预测值为1.476144Predictedvalueatstationarypoint:1.476144

图3 混悬剂电镜下形态分布Fig.3 The electron micrograph of suspension morphology distribution
2.2.2再分散性及沉降体积比测定结果三批样品放置一个月后,测定沉降体积比及再分散性,结果如表4所示,沉降体积比均值为0.999 3,再分散性较好。
2.2.3外观颜色观察和pH测定结果本试验中制得的五氯柳胺混悬剂为乳白色均匀、浑浊、无丁达尔效应的混悬液,静止较长时间可能出现分层现象,上清液无色透明,下层为乳白色的沉降物,但轻轻振摇后重新恢复均匀体系。测定三批样品的pH分别为5.98、6.03和6.08,平均pH为6.03。
表4沉降体积比及再分散性结果
Table 4The result of sedmientation rate and redispersion

样品Thesamples沉降体积比Sedmientationrate再分散性振摇次数Theshakefrequencyofredispersion10.999220.9991311
由以上结果可知,优化后的处方粒径大小适宜,粒径均匀,沉降体积比较大,再分散性良好,pH值较为稳定,符合2010年版《中国兽药典》中关于混悬剂的质量标准要求。
2.3含量测定
2.3.1专属性考察由图4结果可见,空白的混悬剂溶剂对五氯柳胺的含量测定无干扰,该方法专属性强。

图4 五氯柳胺含量的色谱测定Fig.4 The content measurementchromatogram of oxyclozanide
2.3.2线性考察得到的标准曲线见图5,线性回归方程为:Y=24 942x-113 147(r2=0.999 3),表明五氯柳胺在18~100 μg·mL-1的质量浓度范围内与对应峰面积的线性关系良好。
2.3.3回收率与精密度五氯柳胺的平均回收率为99.37%±0.14%,RSD为0.14%(表5),表明该方法准确度较高。
五氯柳胺的日内精密度的RSD值为0.37%,日间精密度的RSD值为0.64%,表明该方法的精密度良好。
2.3.4重复性取同批五氯柳胺混悬剂样品5份,测定五氯柳胺混悬剂的含量RSD值为0.67%,表明该方法的重复性良好。
2.3.5样品含量测定将三批样品稀释液分别进样20 μL,测定3次,记录峰面积并计算实测值与理论值的比值,三批样品的平均含量为标示量的96.52%±0.47%,RSD为0.47%,如表6。

图5 五氯柳胺峰面积-质量浓度标准曲线Fig.5 The peak area-concentration standard curve of oxyzanide
表5五氯柳胺混悬剂回收率试验结果(n=9)
Table 5The recovery test results of oxyclozanide oral suspension

样品质量浓度/(μg·mL-1)Thesampleconcentration实测质量浓度/(μg·mL-1)Theactualconcentration回收率/%Therecoveryrate平均回收率(x-±s)/%TheaveragerecoveryrateRSD/%3029.3597.826059.7199.5199.37±0.150.158080.61100.77
表6含量测定结果
Table 6The result of content determination

样品Thesample质量浓度/(μg·mL-1)Concentration标示量含量/%Labeledamountofcontent平均标示量含量(x-±s)/%TheaveragelabeledamountofcontentRSD/%61.7296.44161.3895.9061.4195.9562.1097.04262.1397.0896.52±0.470.4761.8996.7061.4996.08361.8596.6461.9996.86
2.4稳定性试验
2.4.1加速试验在加速条件下,检测五氯柳胺混悬剂三批样品的外观性状、含量、pH、再分散性和沉降体积比都无明显变化。说明在市售包装下的五氯柳胺混悬剂在加速条件下性质稳定。检测结果见表7所示。
2.4.2影响因素试验在高温、强光照射条件下,五氯柳胺混悬剂的外观性状、含量、pH 值、再分散性和沉降体积比几乎没有变化,说明五氯柳胺混悬剂对热、光很稳定。检测结果见表8所示。
表7加速试验结果
Table 7The result of accelerated test

项目Project常态下各项指标Theindicatorsundernormalcondition第0个月Month0第1个月Month1第2个月Month2第3个月Month3第6个月Month6外观性状Appearance乳白色、均匀、浑浊,静止后可能出现分层,上层为澄清透明,下层为乳白色沉降物同上所述,出现分层同上所述,出现分层同上所述,出现分层同上所述,出现分层同上所述,出现分层pHpHvalue5.5~6.36.015.935.885.995.865.906.025.915.956.055.886.036.035.925.99沉降体积比Sedimentationvolumeratio0.9以上0.999110.9980.9990.9980.9830.9920.9890.9790.9820.9810.9730.9790.974再分散性Redispersibility轻轻振摇即恢复均匀状态111111111211222含量Content95%~105%97.08%96.73%96.89%97.10%96.07%96.14%96.92%96.11%95.97%96.57%95.83%95.68%96.63%95.67%95.49%
表8高温、强光照射试验结果
Table 8The result of high temperatures test and strong light test
项目Project常态下各项目指标Theindicatorsundernormalcondition高温试验Hightemperaturestest强光照射试验Stronglighttest第0天Day0第5天Day5第10天Day10第0天Day0第5天Day5第10天Day10外观性状Appearance乳白色、均匀、浑浊,静止后可能出现分层,上层为澄清透明,下层为乳白色沉降物同上所述,出现分层同上所述,出现分层同上所述,出现分层同上所述,出现分层同上所述,出现分层同上所述,出现分层pHpHvalue5.5~6.35.985.886.035.945.855.995.975.836.015.885.996.095.935.956.035.875.986.07沉降体积比Sedimenta-tionvolumeratio0.9以上1110.9990.9990.9980.9970.9980.9981110.9990.9980.9990.9980.9950.997再分散性Redispers-ibility轻轻振摇即恢复均匀状态111111111111111111含量Content95%~105%96.75%96.35%97.39%96.69%96.28%97.04%96.59%96.31%97.17%95.67%96.85%96.39%95.98%96.43%96.47%95.73%96.52%96.36%
3 讨 论
据报道,在研药物中难溶性药物比例高达70%以上,因其溶解性大大限制了药物的开发及应用。在药物制剂过程中,可以将不溶性药物考虑制成混悬剂,使不溶性药物粉粒分散在液体分散媒中形成的不均匀分散体系。混悬剂制备方法多样,生产过程简单,工业化大生产可行性强[17-19]。本研究制备的五氯柳胺口服混悬剂,由于药物粒径小,颗粒生物黏附性提高,与目前市售的抗寄生虫药物口服制剂如片剂、胶囊剂相比,五氯柳胺口服混悬剂的药物吸收良好,颗粒分布均匀,在胃肠道中降低了食物对药物吸收的影响,提高了难溶性药物的口服生物利用度,且具有分布面积大、吸收快、用量精准、给药方便等优点,该剂型在兽医临床上备受青睐。
通过筛选,最佳处方工艺中各辅料的用量均符合《药用辅料手册》中关于辅料用量的相关规定[20]以及《兽药研究技术指导原则汇编》中关于兽用化学药物制剂研究基本技术指导原则[21]。在处方工艺中,为了增加混悬剂的物理稳定性,制备时需加入能使混悬剂稳定的稳定剂,包括助悬剂、润湿剂等。本试验中选择卡波姆 974p作为助悬剂,使混悬剂的黏度适中,有助于药物均匀分散,不易沉降和絮凝[22],且制成的混悬剂为假塑性流体[23],静止时黏度较大,倒出时粘度较小,有利于临床用药,增加了五氯柳胺的动力学稳定性。本试验选用十二烷基硫酸钠作为润湿剂,它是一种阴离子型表面活性剂,它的加入改变了五氯柳胺与水相之间的表面张力,分散相的分散度大,使之形成均匀稳定的分散体系。
在制剂制备过程中,考虑到混悬剂具有动力学不稳定性,粒径的大小及分布直接影响其沉降速度,因此,本实验采用研磨法,该法适用范围广,制备过程简便,制备的混悬剂颗粒分布窄,混悬性能良好。采用该方法制备的五氯柳胺混悬剂外观呈乳白色,均匀,浑浊,且无丁达尔效应,其沉降体积比、再分散性、粒径分布、pH及含量测定等结果,均符合我国关于兽药混悬剂的相关要求。
本研究提供了一种制备工艺简单、性质稳定、质量可控、成本低廉、投药方便的用于防治牛、羊肝片吸虫病的五氯柳胺口服混悬剂,弥补了国内五氯柳胺制剂的空白。在动物抗寄生虫药物混悬剂的研制与应用方面,由于近年来我国畜牧养殖业迅速向规模化方向发展,临床对药物剂型的需求也在发生变化,传统的片剂剂型由于给药难度大,人力耗费以及剂量准确性的等因素的影响,在临床使用中带来了一定的局限性。本研究对满足兽医临床对五氯柳胺的需求、提升我国兽药制剂水平和保障畜牧业健康发展具有重要意义。
[1]ASHRAFI K,BARGUES M D,O’NEILL S,et al.Fascioliasis:A worldwide parasitic disease of importance in travel medicine[J].TravelMedInfectDis,2014,12(6):636-649.
[2]KHORAMIAN H,ARBABI M,OSQOI M M,et al.Prevalence of ruminants fascioliasis and their economic effects in Kashan,center of Iran[J].AsianPacJTropBiomed,2014,4(11):918-922.
[3]ABDEL-NASSER A,REFAAT M A.Fascioliasis prevalences among animals and human in Upper Egypt[J].JKingSaudUni(Sci),2010,22(1):15-19.
[4]VIRKEL G,LIFSCHITZ A,SALLOVITZ J,et al.Assessment of the main metabolism pathways for the flukicidal compound triclabendazole in sheep[J].JVetPharmacolTher,2006,29(3):213-223.
[5]MOONEY L,GOOD B,HANRAHAN J P,et al.The comparative efficacy of four anthelmintics against a natural acquiredFasciolahepatica,infection in hill sheep flock in the west of Ireland[J].VetParasitol,2009,164(2-4):201-205.
[6]COLES G C,STAFFORD K A.Activity of oxyclozanide,nitroxynil,clorsulon and albendazole against adult triclabendazole-resistantFasciolahepatica[J].VetRec,2001,148(23):723-724.
[7]HANNA R E,MCMAHON C,ELLISON S,et al.Fasciolahepatica:A comparative survey of adult fluke resistance to triclabendazole,nitroxynil and closantel on selected upland and lowland sheep farms in Northern Ireland using faecal egg counting,coproantigen ELISA testing and fluke histology[J].VetParasitol,2015,207(1-2):34-43.
[8]崔莹.驱虫药五氯柳胺的制备[J].现代商贸工业,2010,20:300.
CUI Y.Preparation of oxyclozanide anthelmintic[J].ModernBusinessTradeIndustry,2010,20:300.(in Chinese)
[9]ROY R M,SUKHLA S S.Oxyclozanide—activity against fasciola gigantica in naturally infected buffalo,cattle,sheep and goats[J].TropAnimHealthProd,1971,3(1):26-31.
[10]SANABRIA R,MORENO L,ALVAREZ L,et al.Efficacy of oxyclozanide against adultParamphistomumleydeniin naturally infected sheep[J].VetParasitol,2014,206(3-4):277-281.
[11]ARIAS M S,SANCHIS J,FRANCISCO I,et al.The efficacy of four anthelmintics againstCalicophorondaubneyiin naturally infected dairy cattle[J].VetParasitol,2013,197(1-2):126-129.
[12]方晓玲.药剂学[M].北京:人民卫生出版社,2007:107.
FANG X L.Pharmaceutics[M].Beijing:People's Health Publishing House,2007:107.(in Chinese)
[13]国家兽药典委员会.中华人民共和国药典[M].北京:中国农业出版社,2011:附录13.
National Veterinary Pharmacopoeia Commission.People′s Republic of China Pharmacopoeia[M].Beijing:China Agriculture Press,2011:Appendix 13.(in Chinese)
[14]高娴,欧阳五庆,李梦云,等.托氟沙星纳米乳的制备及其急性毒性研究[J].畜牧兽医学报,2015,46(11):2069-2077.
GAO X,OUYANG W Q,LI M Y, et al.Study on the Preparation and Acute Toxicity of Tosufloxacin[J].ActaVeterinariaetZootechnicaSinica,2015,46(11):2069-2077.(in Chinese)
[15]芮弦,欧阳五庆,吴敬超,等.纳他霉素纳米乳的制备及其质量评价[J].中国新药杂志,2012,21(17):2072-2076.
RUI X,OUYANG W Q,WU J C,et al.Preparation and quality evaluation of natamycin nanoemulsion[J].ChineseJournalofNewDrugs,2012,21(17):2072-2076.(in Chinese)
[16]高新富,徐彦飞,丁召兴,等.增效磺胺嘧啶银混悬剂的制备与质量控制[J].中国药房,2013,24(1):60-62.
GAO X F,XU Y F,DING Z X,et al.Preparation and quality control of synergist flamazine suspension[J].ChinaPharmacy,2013,24(1):60-62.(in Chinese)
[17]SAWANT K K,PATEL M H,PATEL K.Cefdinir nanosuspension for improved oral bioavailability by media milling technique:formulation,characterization and in vitro-in vivo evaluations[J].DrugDevIndPharm,2015:1-11.
[18]陈充抒,梁艳,梁莉.纳米混悬剂的制备、表征及其应用研究进展[J].武警医学,2013,24(4):358-361.
CHEN C Y,LIANG Y,LIANG L.Nano suspensions,characterization and application of research progress[J].JournaloftheChinesePeople’sArmedPoliceForces,2013,24(4):358-361.(in Chinese)
[19]HONG C,DANG Y,LIN G,et al.Effects of stabilizing agents on the development of myricetin nanosuspension and its characterization:Aninvitroandinvivoevaluation[J].IntJPharm,2014,477(1):251-260.
[20]ROWE R C,SHESKEY P J,QUINN M E.Handbook of Pharmaceutical Excipients[M].Sisth edition.London:Pharmaceutical Press,2009.
[21]农业部兽药评审中心.兽药研究技术指导原则汇编[M].北京:化学工业出版社,2012:11.
Ministry of agriculture veterinary drug evaluation center.Veterinary technical research guidelines compilation[M].Beijing:The Chemical Industry Publishers,2012:11.(in Chinese)
[22]袁开红,吴玉霞,卓海通,等.布洛芬混悬液的研制及生物利用度[J].中国医药工业杂志,2003,34(9):444-445.
YUAN K H,WU Y X,ZHUO H T,et al.Preparation and bioavailability of the ibuprofen suspension[J].ChineseJournalofPharmaceuticals,2003,34(9):444-445.(in Chinese)
[23]金从形,李阿玲,杜有功,等.卡马西平混悬剂的研制及质量控制研究[J].海峡药学,2010,22(5):82-85.
JIN C X,LI A L,DU Y G,et al.Preparation and quality control study of Carbamazepine (CBZ)Suspension[J].StraitPharmaceuticalJournal,2010,22(5):82-85.(in Chinese)
(编辑白永平)
Preparation and Content Measurement of Oxyclozanide Oral Suspension
ZHANG Ji-li,LI Bing,SI Hong-fei,GUO Xiao,ZHU Zhen,SHANG Xiao-fei,ZHOU Xu-zheng,ZHANG Ji-yu*
(KeyLaboratoryofVeterinaryPharmaceuticalDevelopmentofMinistryofAgriculture,LanzhouInstituteofHusbandryandPharmaceuticalSciences,ChineseAcademyofAgriculturalSciences,Lanzhou730050,China)
The study aimed to prepare oxyclozanide oral suspension and evaluate its physical and chemical properties,and establish an HPLC method for the determination of oxyclozanide.The sedimentation volume ratio and redispersibility were used as variable factors,the single factor experiment and the quadratic regression orthogonal rotational combination design were carried out to optimize the prescription.Then,the shape,size of oxyclozanide suspension was measured by transmission electron microscopylaser and particle size analyzer,and the content of oxyclozanide in suspension was determined by HPLC.The result showed that the suspension (100 mL) was consisted of 3.2 g oxyclozanide,0.2 g carbomer 974p,0.3 g sodium dodecyl sulfate sodium salt,0.02 g methyl 4-hydroxybenzoate and 0.4 g sodium pyrosulfite.With good redispersibility,the sedimentation volume ratio of oxyclozanide suspension was 0.999.Excellent line relationship was obtained in the range of 18-100 μg·mL-1(r2=0.999 3).The oxyclozanide suspension was successfully prepared with simple preparation process,good stability and well quality-controlled product.
oxyclozanide suspension;quadratic regression orthogonal rotational combination design;determination of content;HPLC
10.11843/j.issn.0366-6964.2016.10.021
2016-02-01
国家科技支撑计划项目(2015BAD1101);国家现代农业产业技术体系专项(CAR-38)
张吉丽(1992-),女,黑龙江大庆人,硕士生,主要从事动物抗寄生虫药研究,E-mail:zhangjlzjl@sina.com
张继瑜(1967-),E-mail: infzjy@sina.com
S859.5
A
0366-6964(2016)10-2115-11

