携带NDV HN基因疫苗的重组减毒鸡白痢沙门菌口服免疫原性研究
丁 轲,余祖华,李 蒙,郁 川,尚 珂,程相朝,陈桂华,廖成水,贾艳艳,汪 洋,张春杰
(河南科技大学动物疫病与公共卫生重点实验室,洛阳 471003)
携带NDVHN基因疫苗的重组减毒鸡白痢沙门菌口服免疫原性研究
丁轲,余祖华,李蒙,郁川,尚珂,程相朝*,陈桂华,廖成水,贾艳艳,汪洋,张春杰
(河南科技大学动物疫病与公共卫生重点实验室,洛阳 471003)
为研究携带新城疫病毒(NDV)血凝素-神经氨酸酶(HN)基因疫苗的重组减毒鸡白痢沙门菌的口服免疫原性,将携带NDVHN基因的重组质粒pcDNA3-HN电转化减毒鸡白痢沙门菌ΔcrpC79-13,构建重组疫苗菌株ΔcrpC79-13 (pcDNA3-HN)。将重组菌株ΔcrpC79-13 (pcDNA3-HN)以1×109CFU·只-1口服免疫7日龄雏鸡,同时设PBS、ΔcrpC79-13 (pcDNA3) 和NDV Ⅳ系疫苗免疫对照,于免疫后7、14、21、28、35 d 测定免疫雏鸡诱导的抗NDV 的HI抗体、鸡白痢沙门菌IgG抗体和肠道黏膜IgA抗体动态水平,同时测定免疫雏鸡的外周血淋巴细胞增殖水平并进行攻毒试验。结果表明,成功获得携带NDVHN基因疫苗的重组菌株ΔcrpC79-13 (pcDNA3-HN);在免疫后14~35 d,可诱导产生抗NDV的HI抗体,且在免疫后21 d时达到最高值;可诱导产生抗鸡白痢沙门菌的IgG抗体,且在免疫后28 d 达到最高值;Δcrp(C79-13 pcDNA3-HN)组肠道黏膜IgA抗体含量最高值略高于Δcrp C79-13 (pcDNA3)组,但差异不显著(P>0.05)。在免疫28 d 以后,Δcrp(C79-13 pcDNA3-HN)组外周血淋巴细胞刺激指数极显著高于PBS对照组(P<0.01),显著高于ΔcrpC79-13(pCDNA3)组(P<0.05)。用103EID50NDV F48E9株攻毒,保护率达67%(10/15),用108CFU鸡白痢沙门菌C79-13攻毒,保护率为100%。本研究结果表明重组减毒鸡白痢沙门菌ΔcrpC79-13 (pcDNA3-HN)具有良好的口服免疫原性。
新城疫病毒;HN基因;减毒沙门菌;口服免疫;免疫原性
新城疫(Newcastle disease,ND)是由新城疫病毒(Newcastle disease virus,NDV)引起的一种急性、高度接触性传染病,严重危害全球养禽业[1]。NDV又称禽副黏病毒-1(avain paramyxo-virus,PMV-1),为单股负链不分节有囊膜的RNA病毒,其基因组全长1.5 kb,编码6种结构蛋白(L、HN、F、 NP、P),其中血凝素-神经氨酸酶(haemagglutinin-neuraminidase,HN)位于囊膜外表面,具有血凝素及神经氨酸酶的活性[2]。HN蛋白是NDV重要的宿主保护性抗原,具有良好的免疫原性,可在NDV侵染的过程中起到识别细胞受体、介导病毒吸附细胞膜的作用[3-4]。因此,HN基因可作为NDV基因工程疫苗的重要抗原靶基因之一。目前,我国用于ND防制的疫苗主要有弱毒苗和灭活苗,但近年来常有弱毒疫苗和灭活疫苗免疫失败的报道。因此,研究新型疫苗来控制NDV是亟待解决的问题之一。
沙门菌是一种较为常见的侵袭性胞内菌,通过基因工程方法减毒后对宿主致病性显著降低,但仍保留良好的侵袭力,并且减毒沙门菌还可作为载体直接将真核表达质粒携带进入动物细胞内表达相应的蛋白而诱导特异性的免疫应答反应[5-6]。以减毒沙门菌为载体的DNA疫苗具有诸多优点[7-8]。首先,它不仅可以通过口服、鼻内感染途径进行免疫,既省时又方便,而且可以将抗原直接运载至内脏淋巴组织,产生有效的黏膜免疫。其次,以沙门菌为载体能够将质粒DNA运载至相关免疫器官的APC细胞,特别是巨噬细胞对沙门菌有特殊的亲和性,能更有效的将抗原递呈给树突细胞,比DNA疫苗的传统免疫途径的递呈更有效。最后,质粒表达的抗原与减毒沙门菌本身的抗原也起到了联合免疫的作用。因此,减毒沙门菌为载体携带外源DNA疫苗的策略为研究新型NDV疫苗提供了可能。近年来,关于ND基因工程疫苗的研究取得长足的进步。X.Yang等[9]以传染性支气管炎病毒为载体构建了能够表达HN的重组病毒R-H120-HN/5a,用该重组病毒免疫SPF雏鸡,可诱导机体产生较高的NDV HI抗体水平,用NDV F48E9强毒株攻毒后的免疫保护率可达80%。王善辉等[10]利用杆状病毒表达系统获得了HN-Bacmid重组病毒,用该病毒免疫SPF 鸡,可诱导产生了高滴度的NDV 特异性抗体,强毒攻击后免疫保护率可达75%。目前已有利用减毒沙门菌携带NDV DNA疫苗的报道[11-12],但以减毒鸡白痢沙门菌ΔcrpC79-13为载体携带NDV DNA疫苗的研究还鲜有报道。因此,本研究在构建携带NDVHN基因疫苗的减毒鸡白痢沙门菌ΔcrpC79-13 (pcDNA3-HN)基础上,对其口服免疫原性作了进一步研究,从而为研制新型鸡白痢—新城疫口服活载体疫苗奠定基础。
1 材料与方法
1.1材料
1.1.1菌株、质粒、疫苗和毒株大肠杆菌JM109、减毒鸡白痢沙门菌ΔcrpC79-13、pMD18-HN、真核表达载体pCDNA3,均由河南科技大学动物疫病与公共卫生重点实验室保存;NDV Ⅳ系疫苗购自辽宁益康生物股份有限公司;S.pullorum标准强毒株C79-13、NDV F48E9株均购自中国兽医药品监督所。
1.1.2主要试剂TaqDNA聚合酶、T4DNA 连接酶、BamHⅠ、HindⅢ等限制性内切酶等购自宝生物工程(大连)有限公司;新生牛血清、RPMI 1640培养基、青链霉素购自Gibco (Life TechnoLogies) 公司;鸡外周血淋巴细胞分离液购自天津灏洋华科生物技术有限公司;鸡sIgA酶联免疫吸附测定试剂盒购自武汉Elabscience生物科技有限公司;刀豆球蛋白A(Con A)、MTT、PMSF、DMSO购自Sigma公司;NDV 阳性血清购自中国兽医药品监察所;HRP标记的兔抗鸡IgG购自北京博奥森生物技术有限公司;TMB显色液购自碧云天生物技术公司。1.1.3实验动物1日龄健康雏鸡购自洛阳公华禽业有限公司,按常规方法检测沙门菌抗体阴性。
1.2方法
1.2.1重组减毒鸡白痢沙门菌ΔrpC79-13(pCDNA3-HN)的基因疫苗的制备用设计的引物Pa1:5′-CCCAAGCTTACCATGGACCGCGCCGTTAGC-3′(下划线为HindⅢ酶切位点),Pa2:5′-CGGGATCCCTAGCCAGACCTGGCTTC-3′(下划线为BamHⅠ酶切位点),以pMD18-HN为模板,PCR扩增出HN基因片段。将扩增的HN产物通过BamHⅠ、HindⅢ酶切后定向插入真核表达载体pCDNA3中,构建重组质粒pCDNA3-HN。通过电转化的方法将重组质粒pCDNA3-HN和pCDNA3分别转入减毒鸡白痢沙门菌ΔcrpC79-13中,挑取在LB固体培养基(100 μg·mL-1,Amp+)的上生长的阳性单菌落进行PCR和酶切鉴定,获得重组减毒鸡白痢沙门菌ΔcrpC79-13(pCDNA3-HN)和ΔcrpC79-13(pCDNA3)。然后将重组减毒鸡白痢沙门菌ΔcrpC79-13(pCDNA3-HN)和ΔcrpC79-13(pCDNA3)分别接种LB 液体培养基(100 μg·mL-1,Amp+),37 ℃振荡培养过夜,用PBS 洗涤 3次后重悬菌液,并将菌液浓度调整为1×109CFU·mL-1。
1.2.2雏鸡的分组与免疫随机选取6只雏鸡进行血清母源抗体检测,待母源抗体下降到4 log2以下后,挑选体重均匀的雏鸡240只,随机分为4组,每组60只。按表1免疫方式和剂量进行免疫。
表1雏鸡免疫试验分组
Table 1The grouping of chicken

分组Groups免疫方式Immunemethods免疫剂量Immunizingdose免疫次数Immunitytimes数量NumberPBS口服200μL160ΔcrpC79-13(pCDNA3-HN)口服1×109CFU160ΔcrpC79-13(pCDNA3)口服1×109CFU160Ⅳ系口服2头份160
1.2.3NDV HI 抗体水平检测分别于免疫后7、14、21、28、35从各组随机取6只雏鸡,采血,分离血清,测定各组雏鸡NDV HI抗体水平。
1.2.4鸡白痢沙门菌 IgG抗体的检测挑取鸡白痢沙门菌C79-13单菌落,活化过夜,以1∶100比例转接培养8 h,收集菌体并用PBS洗涤2次,以1∶100倍浓缩重悬于PBS,置于冰上超声破碎至菌液澄清,离心后收集上清,并将浓度调整至10 μg·mL-1包被96孔酶标反应板,每孔100 μL,置于4 ℃过夜。弃去包被液,PBS洗涤3次,每孔加入0.5%的脱脂奶粉100 μL,37 ℃封闭2 h;PBS洗涤3次,将待检血清按1:200比例稀释后100 μL·孔-1,37 ℃孵育2 h,PBS洗涤3次;每孔加入HRP标记的兔抗鸡IgG(稀释倍数为1∶3 000)100 μL,37 ℃孵育2 h;经洗涤后每孔加入50 μL TMB底物显色液,避光反应10 min。每孔加入50 μL终止液,用酶标仪测量其OD492 nm值。1.2.5免疫雏鸡肠道sIgA抗体水平的测定分别于免疫后7、14、21、28、35 d从各组随机挑选6只雏鸡,扑杀鸡,采集小肠,用含100 μg·mL-1PMSF 的PBS缓冲液灌洗小肠。离心收集小肠液并制备免疫雏鸡及对照的小肠样本,采用鸡sIgA ELISA 检测试剂盒测定免疫雏鸡肠道sIgA 抗体水平。1.2.6免疫雏鸡淋巴细胞增殖检测分别于免疫后7、14、21、28、35 d从每组随机抽取6只雏鸡,无菌心脏采血,分离淋巴细胞,将分离的淋巴细胞悬浮于RPMI 1640培养基中并调整细胞浓度为5×106个·mL-1。将淋巴细胞加入96孔细胞培养板(100 μL·孔-1),每个样品3个重复孔,每孔加100 μL 含有ConA(5 μg·mL-1)的RPMI-1640营养液。阴性对照组加100 μL完全RPMI-1640培养基,于37 ℃ 5 % CO2培养箱中孵育48 h;最后加入10 μL MTT(终质量浓度为5 mg·mL-1),37 ℃培养4 h,1 500 r·min-1离心5 min,弃上清,并每孔加入100 μL DMSO,室温振荡10 min,酶标仪测定OD492 nm值。以免疫组的OD值/对照组的OD值表示各组的刺激指数(SI)。
1.2.7免疫雏鸡的攻毒保护试验在免疫21 d后,每组选择30只鸡,其中15只鸡用NDV F48E9株进行滴鼻攻毒,攻毒剂量103EID50,另外15只鸡用S.pullorum菌野生株C79-13口服攻毒,攻毒剂量为108CFU·mL-1(100倍LD50)。各组鸡攻毒后连续观察20 d,记录鸡的精神状态、发病和死亡情况,统计免疫保护率。
1.2.8数据统计与分析数据采用SPSS 19.0软件进行统计分析,采用单因素方差分析one-way ANOVA进行差异性比较,并用GraphPad Prism 5.0软件作图,P>0.05表示差异不显著,P<0.05表示差异显著,用 * 表示,P<0.01表示差异极显著,用 ** 表示。
2 结 果
2.1重组菌株ΔcrpC79-13(pCDNA3-HN)的鉴定
将构建成功的阳性重组质粒pCDNA3-HN电转化至减毒鸡白痢沙门菌ΔcrpC79-13后,挑取含Amp 的LB固体培养基上的单菌落,用引物Pa1/Pa2进行PCR扩增,获得一条大小约1.7 kb的条带(图1)。阳性菌落的质粒进行酶切后获得两条大小不同的片段,大小分别为5.4 kb和1.7 kb左右(图2)。PCR和酶切结果表明,重组减毒鸡白痢沙门菌ΔcrpC79-13(pCDNA3-HN)构建成功。
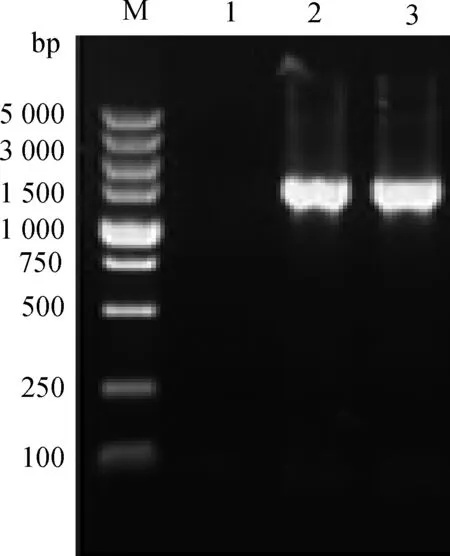
M.DNA相对分子质量标准(DL5000);1.对照;2、3.重组菌ΔcrpC79-13 (pCDNA3-HN)HN基因PCR产物M.DNA Marker (DL5000);1.Control;2-3.PCR products of HN gene in ΔcrpC79-13(pCDNA3-HN)图1 重组减毒菌的PCR鉴定Fig.1 Identification of recombinant attenuated strain
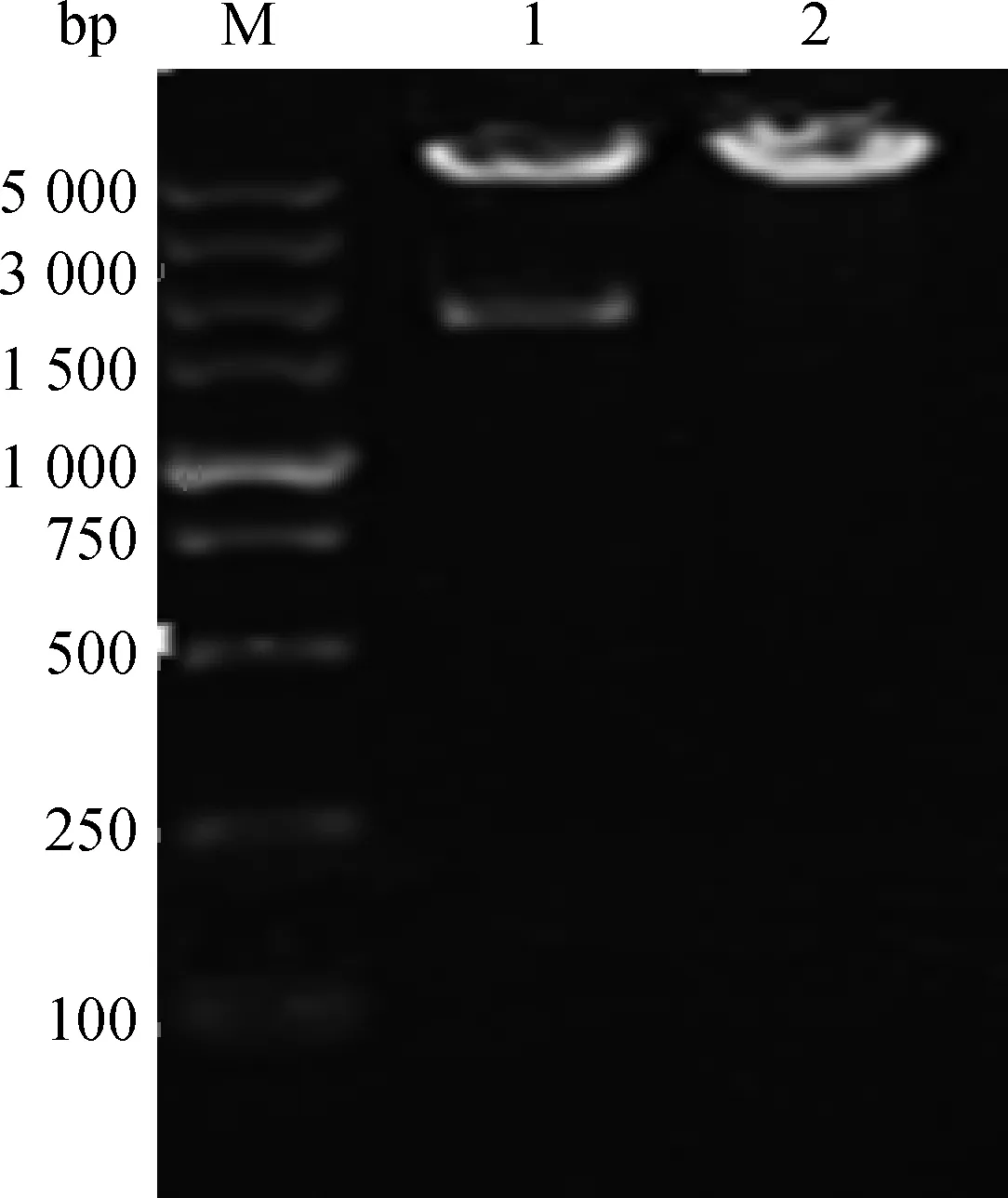
M.DNA相对分子质量标准(DL5000);1.BamH Ⅰ+HindⅢ 酶切ΔcrpC79-13 (pCDNA3-HN);2.BamH Ⅰ+HindⅢ酶切ΔcrpC79-13(pCDNA3)M.DNA Marker (DL5000);1.Restriction fragments of ΔcrpC79-13(pCDNA3-HN) with BamH Ⅰ+HindⅢ;2. Restriction fragments of pCDNA3 with BamH Ⅰ+Hind Ⅲ图2 重组减毒菌的酶切鉴定Fig.2 Identification of enzyme for recombinant attenuated strain
2.2重组菌株对雏鸡NDV HI抗体水平的影响
ΔcrpC79-13 (pcDNA3-HN)重组菌株免疫雏鸡后,在一定时期内可以有效刺激机体NDV HI抗体水平的增长,且在免疫后21 d时抗体水平达到最高值,之后两周开始缓慢降低。21~35 d,ΔcrpC79-13 (pcDNA3-HN)重组菌免疫组和NDV Ⅳ系疫苗免疫组显著高于ΔcrpC79-13(pcDNA3)免疫组与PBS对照组(P<0.05),而ΔcrpC79-13 (pcDNA3-HN)重组菌免疫组和NDV Ⅳ系疫苗免疫组之间差异不显著(P>0.05),ΔcrpC79-13(pcDNA3)免疫组和PBS对照之间差异也不显著(P>0.05)(图3)。
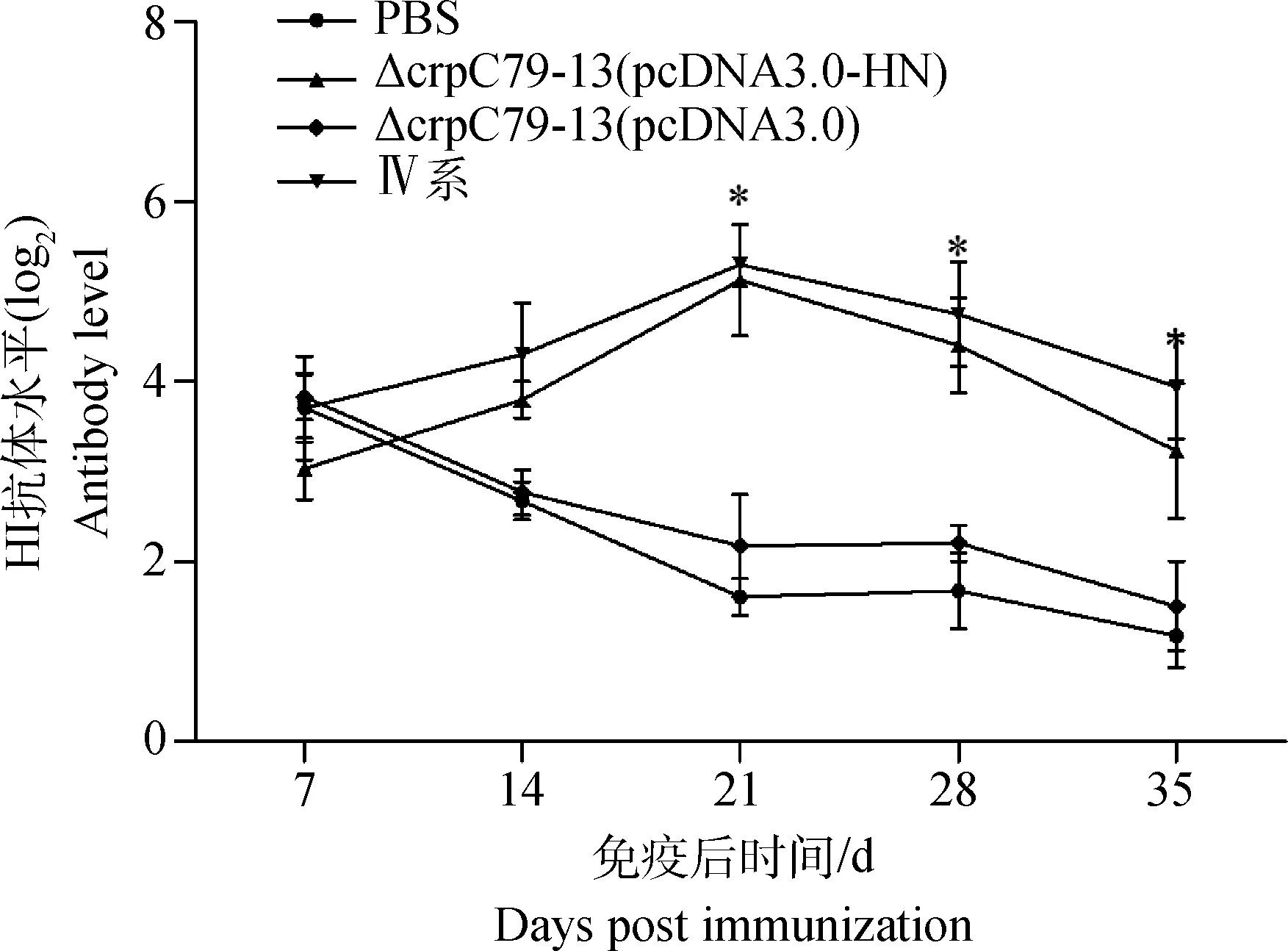
*.P<0.05;**.P<0.01图3 NDV HI抗体检测Fig.3 Assay of HI antibody of NDV
2.3重组菌株对雏鸡体内沙门菌血清IgG抗体水平的影响
以S.PullorumC79-13菌体蛋白作为抗原,运用间接ELISA方法检测各组雏鸡血清IgG抗体水平。ELISA结果表明,14~35 d重组菌株ΔcrpC79-13(pcDNA3-HN)免疫组和ΔcrpC79-13 (pcDNA3)免疫组的血清IgG抗体极显著高于PBS对照组和NDV Ⅳ系疫苗免疫组(P<0.01)。免疫雏鸡的血清IgG抗体含量在7~28 d之间呈上升趋势,且在28 d时达到最高水平,在第28天之后又呈下降趋势(图4)。
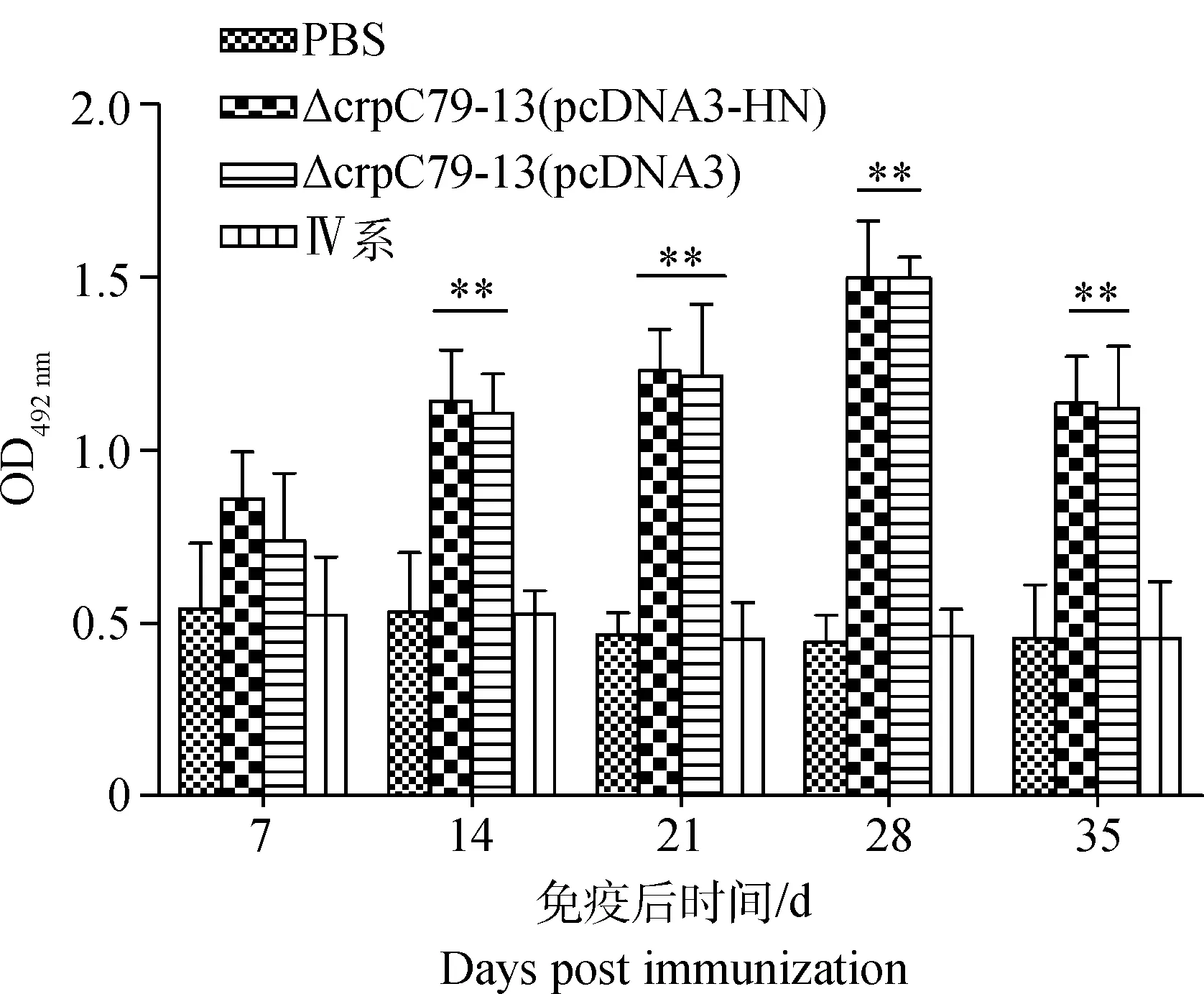
*.P<0.05;**.P<0.01图4 沙门菌 IgG抗体检测Fig.4 Assay of IgG antibody to Salmonella
2.4重组菌株对雏鸡肠道sIgA抗体水平的影响
运用ELISA方法检测各组雏鸡肠道sIgA抗体水平,结果显示ΔcrpC79-13 (pcDNA3-HN)免疫组、ΔcrpC79-13 (pcDNA3)免疫组和NDV Ⅳ系疫苗免疫组肠道sIgA抗体含量均高于PBS对照组,且在28 d时达到最高水平。免疫后14 d时ΔcrpC79-13 (pcDNA3-HN)免疫组和NDV Ⅳ系疫苗免疫组肠道sIgA抗体含量显著高于ΔcrpC79-13 (pcDNA3)免疫组和PBS对照组(P<0.05),NDV Ⅳ系疫苗免疫组肠道sIgA抗体含量略高于ΔcrpC79-13 (pcDNA3-HN)免疫组,但差异不显著(P>0.05);免疫后21~35 d,ΔcrpC79-13 (pcDNA3-HN)免疫组、ΔcrpC79-13 (pcDNA3)免疫组和NDV Ⅳ系疫苗免疫组均极显著高于PBS对照组(P<0.01),但ΔcrpC79-13 (pcDNA3-HN)免疫组与NDV Ⅳ系疫苗免疫组及ΔcrpC79-13 (pcDNA3)免疫组之间差异不显著(P>0.05) (图5)。

*.P<0.05;**.P<0.01图5 肠道sIgA 抗体检测Fig.5 Assay of secretion IgA antibodiy in intestinal
2.5重组菌株对雏鸡淋巴细胞增殖的影响
用MTT法检测各组雏鸡外周血淋巴细胞的增殖水平,计算刺激指数(SI)。结果显示,重组菌株ΔcrpC79-13(pcDNA3-HN)免疫组的SI在免疫后28 d达到最大值,为1.725左右,重组菌ΔcrpC79-13 (pcDNA3)免疫组的SI为1.371左右,NDV Ⅳ系疫苗免疫组的SI为1.579左右。方差的单因子变量分析显示,免疫后21 d时,重组菌株ΔcrpC79-13 (pcDNA3-HN)和NDV Ⅳ系疫苗免疫组显著高于PBS对照组和ΔcrpC79-13 (pcDNA3)免疫组(P<0.05),而ΔcrpC79-13 (pcDNA3)免疫组与PBS组之间差异不显著;免疫28 d时重组菌株ΔcrpC79-13 (pcDNA3-HN)和NDV Ⅳ系疫苗免疫组均极显著高于PBS对照组(P<0.01),显著高于ΔcrpC79-13 (pcDNA3)免疫组(P<0.05)(图6)。
2.6重组菌株对雏鸡的免疫保护效力检测
免疫后21 d,以口服的方式进行攻毒鸡白痢沙门菌 C79-13,以滴鼻、点眼的方式进行攻毒NDV F48E8株,攻毒后连续观察20 d,评价重组菌免疫雏鸡对C79-13的免疫保护作用(表2)。免疫雏鸡对鸡白痢沙门菌保护效力结果显示,重组菌株ΔcrpC79-13 (pcDNA3-HN)和ΔcrpC79-13 (pcDNA3)免疫组能100%抵抗野生株的感染,而PBS对照组和NDV Ⅳ系疫苗免疫组的免疫保护率为0;免疫雏鸡对NDV保护效力结果显示,NDV F48E9攻毒后,PBS组死亡率高达80%,重组菌株ΔcrpC79-13 (pcDNA3) 死亡率为77%,而重组菌ΔcrpC79-13 (pcDNA3-HN)死亡率为33%,保护率为67%,NDV Ⅳ系疫苗免疫组的存活率为73%,表明该重组菌株对NDV感染具有一定的免疫保护,但其免疫保护效果略低于NDV Ⅳ系疫苗。
表2重组菌免疫雏鸡抵抗沙门菌C79-13和NDV F48E8攻毒的保护力
Table 2The immune protective efficiency of recombinant strain toSalmonellapullorumC79-13 and NDV F48E9in chickens

组别GroupsC79-13F48E9死亡数/总数Death/Total存活率/%Survivalrate死亡数/总数Death/Total存活率/%SurvivalratePBS15/15012/1520ΔcrpC79-13(pcDNA3-HN)0/151005/1567ΔcrpC79-13(pcDNA3)0/1510010/1523Ⅳ系15/151004/1573
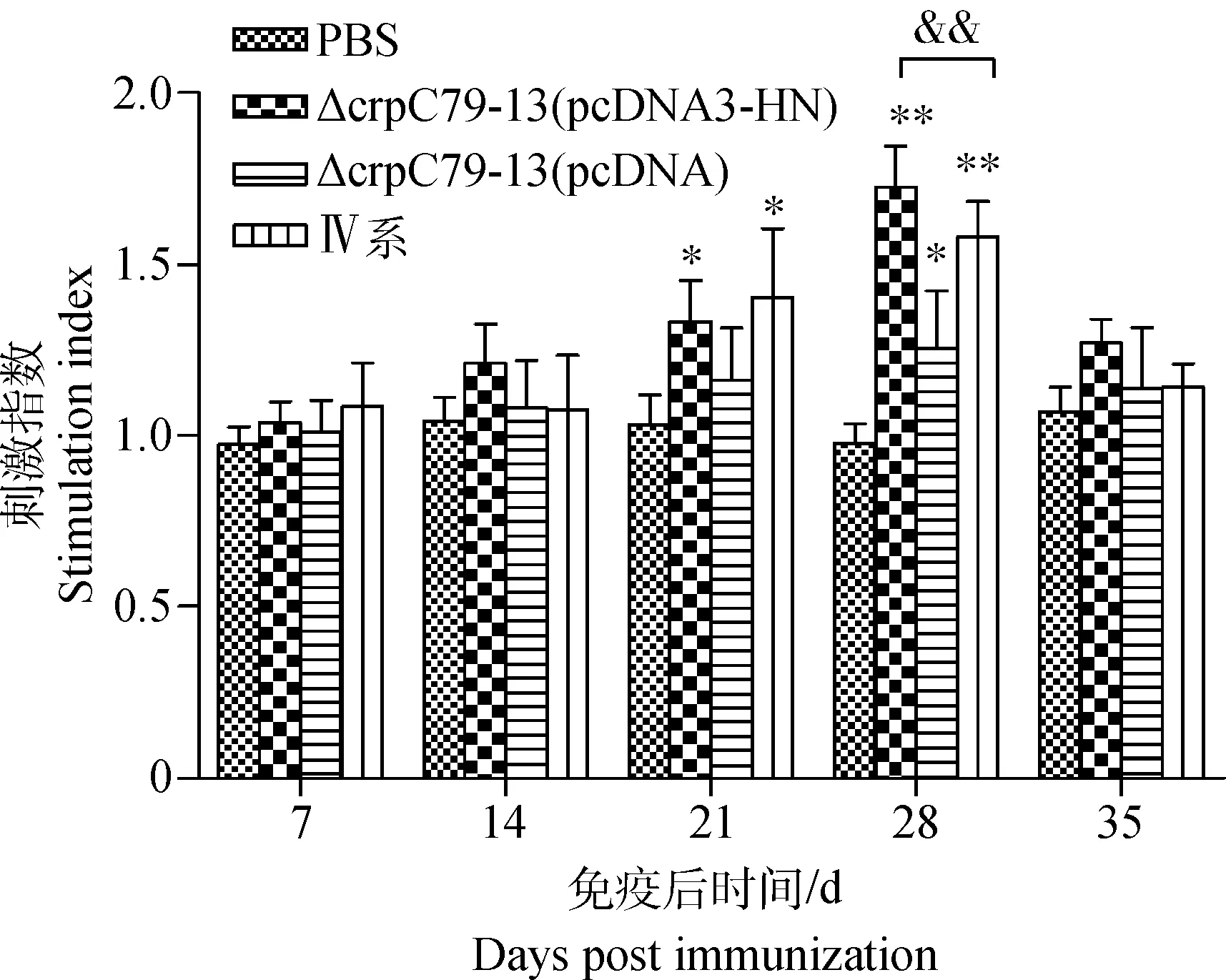
*.P<0.05;**.P<0.01图6 雏鸡免疫后各时间点的淋巴细胞刺激指数Fig.6 Stimulation index of lymphocytes in various time points after immunization
3 讨 论
减毒沙门菌作为载体可以通过自然感染途径侵入宿主的派伊尔氏结、肠淋巴结、肝、脾等组织细胞,将携带的DNA疫苗运送至免疫诱导部位,乃至于特定的免疫细胞(如APCs等),借助于宿主细胞表达目的抗原,不仅激发出宿主针对沙门菌本身的免疫反应,而且激发出针对其所携带抗原的各种免疫反应,包括全身体液免疫、细胞免疫和局部黏膜反应[13-14]。
甘军纪等[15]用表达鸡NDVHN基因的重组鸡痘病毒活载体疫苗rFPV-12LS HN免疫14日龄的SPF鸡群,7 d后即可检测到鸡NDV HI抗体,rFPV-12LS HN 免疫后仅2~3周NDV HI抗体平均滴度>4log2,免疫后10~18周,HI抗体平均滴度均<2log2,但依然能完全保护试验鸡抵抗NDV强毒的致死性攻击。孙景秀等[16]构建的重组干酪乳杆菌(pLA-HN/L.casei)免疫雏鸡,将重组菌表达的产物HN蛋白作为抗原刺激机体产生免疫应答,前1周其IgG 抗体水平呈平稳上升,二免、三免后试验组抗体水平迅速上升,而对照组没有变化。以上研究表明NDVHN基因可诱导机体产生HI抗体,且HI抗体具有较好的保护效力。本研究构建的重组减毒沙门菌ΔcrpC79-13(pcDNA3-HN)免疫后一定时期内,雏鸡体内NDV HI抗体水平持续增长,且在免疫后21 d时抗体水平达到最高值,表明减毒沙门菌ΔcrpC79-13携带的HN基因疫苗能有效刺激机体产生NDV的HI抗体产生,对雏鸡的新城疫有一定的免疫效果。程相朝等[17]将构建的减毒鸡白痢沙门菌ΔcrpC79-13口服免疫4日龄雏鸡,结果显示ΔcrpC79-13不影响雏鸡生长,且在第14~21天体内特异性细胞和体液免疫水平达到最高。本研究中,在免疫后7 d 即可检测到鸡白痢沙门菌的IgG抗体,且在免疫后28 d时达到最高水平,表明重组减毒沙门菌ΔcrpC79-13 (pcDNA3-HN)在作为减毒活载体的同时还能有效刺激机体产生一定水平的抗沙门菌IgG,保持了亲本株良好的体液免疫原性。
禽类黏膜免疫是机体内抵御外界病原感染的首道免疫屏障,对维护机体健康有着至关重要的作用。黏膜免疫的主要效应因子为slgA,它能够阻止病原菌黏附子在黏膜表面,可以激活机体免疫机制,清除病原,在保护自身机体和抗感染等方面发挥重要作用[18]。在ΔcrpC79-13 (pcDNA3-HN)免疫组的鸡只体内检测到了肠黏液分泌型IgA,且21 d后ΔcrpC79-13 (pcDNA3-HN)免疫组和ΔcrpC79-13 (pcDNA3)免疫组均极显著高于PBS对照组,表明ΔcrpC79-13 (pcDNA3-HN)可定植肠道的相关淋巴结,并引起有效的黏膜免疫反应。血液中T淋巴细胞的转化水平可反映机体细胞免疫的状态。孙景秀等[16]构建的重组干酪乳杆菌pLA-HN/L.casei免疫鸡淋巴细胞增殖刺激指数显著高于pLA/L.casei免疫组,表明含HN的重组干酪乳杆菌可诱生细胞免疫应答。在本研究中,重组菌株ΔcrpC79-13 (pcDNA3-HN)免疫组与PBS免疫组SI差异显著(P<0.05),表明淋巴细胞在重组菌的刺激下,发生了分裂增殖,证实携带的HN基因疫苗的重组菌株ΔcrpC79-13 (pcDNA3-HN)能够刺激机体产生一定的细胞免疫应答反应。
本研究的攻毒保护试验结果显示,重组菌ΔcrpC79-13 (pcDNA3-HN)免疫雏鸡用103EID50NDV F48E9强毒株攻击后,雏鸡的存活率可达67%,略低于NDV Ⅳ系疫苗。X.Yang等[9]用重组菌R-H120-HN/5a免疫SPF雏鸡后,用NDV F48E9强毒株攻毒后的免疫保护率可达80%。沙万里等[19]构建pVAXⅠ-HN、pVAXⅠ-F-HN 两种DNA疫苗肌肉注射2周龄雏鸡,免疫14 d后用105EID50的NDV LaSota株滴鼻攻毒免疫保护率分别为46.7%和93.3%。重组菌ΔcrpC79-13 (pcDNA3-HN)免疫雏鸡用鸡白痢沙门菌强毒株C79-13攻毒后,仍全部存活,表明携带新城疫病毒HN基因疫苗的减毒鸡白痢沙门菌ΔcrpC79-13(pcDNA3-HN)不仅能够诱导产生对新城疫病毒的保护性免疫应答,还能100%抵抗鸡白痢沙门菌C79-13的感染,但对雏鸡的免疫保护效果略低于NDV Ⅳ系疫苗。S.Kumar等[20]研究表明雏鸡单独免疫表达HN蛋白的禽3型副黏病毒对NDV强毒的攻击可产生部分抵抗力,但同时免疫表达HN蛋白和F蛋白的禽3型副黏病毒对NDV强毒的攻击可提供完全保护,表明同时免疫表达NDV F蛋白和HN 蛋白的基因工程疫苗具有更好的免疫效果,构建能够同时表达HN蛋白和F蛋白的重组减毒鸡白痢沙门菌是否可诱导产生更高的免疫保护率还需进一步研究探索。
综上所述,本试验构建的携带NDVHN基因疫苗的重组减毒S.pullorumC79-13Δcrp(pcDNA3-HN)不仅能够刺激机体产生鸡白痢沙门菌特异性应答反应,而且可以诱导机体产生针对NDV的免疫应答反应,具有良好的口服免疫效应,为进一步将其开发为鸡白痢-新城疫二联活疫苗奠定了基础。
[1]JIANG Y L,HU J T,GUO Y B,et al.Construction and immunological evaluation of recombinantLactobacillusplantarumexpressingHNof Newcastle disease virus and DC-targeting peptide fusion protein[J].JBiotechnol,2015,216:82-89.
[2]杨煦,刘玉芬,刘怀然.新城疫疫苗的研究进展[J].现代农业科技,2012(2):325-327.
YANG X,LIU Y F,LIU H R.Research progresses of Newcastle disease vaccine[J].ModernAgriculturalScienceandTechnology,2012(2):325-327.(in Chinese)
[3]MORRISON T G.Structure and function of a paramyxovirus fusion protein[J].BiochimBiophysActa,2003,1614(1):73-84.
[4]侯巍.新城疫病毒分子生物学及其疫苗的研究进展[J].草业与畜牧,2011(9):7-10.
HOU W.Study progress in application of molecular biology in Newcastle disease virus and vaccines[J].Prataculture&AnimalHusbandry,2011(9):7-10.(in Chinese)
[5]GENTSCHEV I,DIETRICH G,SPRENG S,et al.Recombinant attenuated bacteria for the delivery of subunit vaccines[J].Vaccine,2001,19 ( 17):2621-2628.
[6]CHIRULLO B,AMMENDOLA S,LEONARDI L,et al.Attenuated mutant strain ofSalmonellaTyphimuriumlacking the ZnuABC transporter contrasts tumor growth promoting anti-cancer immune response[J].Oncotarget,2015,6(19):17648-17660.
[7]HAN L,ZHEN Y H,LIANG A X,et al.Oral vaccination with inhibin DNA delivered using attenuatedSalmonellacholeraesuisfor improving reproductive traits in mice[J].JBasicMicrobiol,2014,54(9):962-968.
[8]张明亮,张春杰,程相朝.沙门氏菌减毒及其作为疫苗活载体的研究进展[J].生物学杂志,2012(2):65-68.
ZHANG M L,ZHAGN C J,CHENG X C.Advances in attenuation for salmonella and attenuated salmonella as vaccine carrier[J].JournalofBiology,2012(2):65-68.(in Chinese)
[9]YANG X,ZHOU Y S,LI J N,et al.Recombinant infectious bronchitis virus (IBV) H120 vaccine strain expressing the hemagglutinin-neuraminidase (HN) protein of Newcastle disease virus (NDV) protects chickens against IBV and NDV challenge[J].ArchVirol,2016,161(5):1209-1216.
[10]王善辉,薛忠,汪鹏旭,等.昆虫细胞表达基因Ⅶ NDV HN基因的免疫效力研究[J].安徽农业大学学报,2015,43(1):1-5.
WANG S H,XUE Z,WANG P X,et al.Expressions of protein HN of Newcastle disease virus in recombinant baculovirus and its antigenicity analysis[J].JournalofAnhuiAgriculturalUniversity,2015,43 (1):1-5.(in Chinese)
[11]潘志明,焦新安,张小荣,等.运送鹅源新城疫病毒DNA疫苗的减毒沙门氏菌及其免疫原性[J].农业生物技术学报,2004,12(4):412-415.
PANG Z M,JIAO X A,ZHANG X R,et al.DNA vaccine against Newcastle disease virus of goose origin delivered by attenuatedSalmonellatyphimuriumand its immunogenicity for mice[J].JournalofAgriculturalBiotechnology,2004,12(4):412-415.(in Chinese)
[12]潘志明,黄金林,程宁宁,等.稳定携带新城疫病毒DNA疫苗减毒沙门氏菌的构建及其免疫原性[J].病毒学报,2008,24(1):41-46.
PAN Z M,HUANG J L,CHENG N N,et al.Construction and immunogenicity of attenuatedSalmonellatyphimuriumstably harbouring DNA vaccine against Newcastle disease virus[J].ChineseJournalofVirology,2008,24(1):41-46.(in Chinese)
[13]张丽君,罗开健.减毒沙门菌在禽用疫苗应用中的研究进展[J].动物医学进展,2007,28(8):73-76.
ZHANG L J,LUO K J.Study progress of attenuatedSalmonellain the application of avain vaccines[J].ProgressinVeterinaryMedicine,2007,28(8):73-76.(in Chinese)
[14]HUANG L Y,WANG K Y,XIAO D,et al.Safety and immunogenicity of an oral DNA vaccine encoding Sip ofStreptococcusagalactiaefrom Nile tilapia Oreochromis niloticus delivered by live attenuated Salmonella typhimurium[J].FishShellfishImmunol,2014,38(1):34-41.
[15]甘军纪,陶鸽,张胜文,等.鸡新城疫重组鸡痘病毒活疫苗的免疫持续期和加强免疫研究[J].中国兽医学报,2011,12(31):1681-1685.
GAN J J,TAO G,ZHANG S W,et al.Duration of immunity and boost vaccination of a recombinant fowlpox virus expressing Newcastle disease virus HN gene[J].ChineseJournalofVeterinaryScience,2011,12(31):1681-1685.(in Chinese)
[16]孙景秀,王桂华,侯喜林,等.锚定NDV HN 蛋白重组干酪乳杆菌诱导雏鸡黏膜免疫应答[J].黑龙江八一农垦大学学报,2012,24(2):43-47.
SUN J X,WANG G H,HOU X L,et al.The mucosal immune response induced in chicks immunized withLactobacilluscaseianchoring NDV HN Protein[J].JournalofHeilongjiangBayiAgriculturalUniversity,2012,24(2):43-47.(in Chinese)
[17]程相朝,郁川,廖成水,等.减毒鸡白痢沙门氏菌ΔcrpC79-13株的构建及其对雏鸡的免疫活性[J].中国兽医科学,2012,42(1):19-25.
CHENG X C,YU C,LIAO C S,et al.Construction of an attenuatedSalmonellapullorumΔcrpC79-13 mutant and its immunogenicity in chicks[J].ChineseVeterinaryScience,2012,42(1):19-25.(in Chinese)
[18]SUN Y,ZHANG Y,SHI C,et al.Newcastle disease virus vaccine encapsulated in biodegradable nanoparticles for mucosal delivery of a human vaccine[J].HumVaccinImmunother,2014,10(8):2503-2506.
[19]沙万里,宋泰,尹柏双,等.新城疫病毒F-HN基因DNA疫苗的免疫效果评价[J].吉林农业科技学院学报,2014,23(1):7-9.
SHA W L,SONG T,YIN B S,et al.Evaluation of immune efficacy with DNA vaccines based on F and HN gene of Newcastle disease virus[J].JournalofJilinAgriculturalScienceandTechnologyUniversity,2014,23(1):7-9.(in Chinese)
[20]KUMAR S,NAYAK B,COLLINS P L, et al. Evaluation of the Newcastle disease virus F and HN proteins in protective immunity by using a recombinant avian paramyxovirus type 3 vector in chickens[J].JVirol,2011,85(13):6521-6534.
(编辑白永平)
Oral Immunogenicity of an AttenuatedSalmonellapullorumHarbouringHNGene Vaccine of Newcastle Disease Virus
DING Ke,YU Zu-hua,LI Meng,YU Chuan,SHANG Ke,CHENG Xiang-chao*,CHEN Gui-hua,LIAO Cheng-shui, JIA Yan-yan, WANG Yang, ZHANG Chun-jie
(KeyLaboratoryofAnimalDiseaseandPublicHealth,HenanUniversityofScienceandTechnology,Luoyang471003,China)
To study the oral immunogenicity of attenuatedSalmonellapullorum,carriedHN(haemagglutinin-neuraminidase) gene vaccine of Newcastle disease virus (NDV).In this study,the recombinant plasmid pcDNA3-HN was finally electro-transformed into attenuatedSalmonellapullorumΔcrpC79-13 to construct the recombinant strainΔcrpC79-13 (pcDNA3-HN).Then the 7-day-old chickens were oral inoculated with 1×109CFU recombinant strainΔcrpC79-13 (pcDNA3-HN),and theΔcrpC79-13 (pcDNA3),PBS,NDV Ⅳvaccine were act as the control group.Then the dynamic level of HI antibody and intestinal mucosal IgA antibody against NDV were determined at 7,14,21,28,35 days post vaccination.At the same time,the level of peripheral blood lymphocyte proliferation of immune chicken and the challenge protection efficiency were determined.The results showed that the recombinant vaccine strainsΔcrpC79-13 (pcDNA3-HN) carrying NDVHNgene vaccine was constructed successfully,which could induce HI antibody against NDV at 14-35 d after immunization and reach the highest value at 21 d after immunization.The content of intestinal mucosal IgA antibody inΔcrp(C79-13 pcDNA3-HN) group was slightly higher than that inΔcrpC79-13 (pcDNA3) group,but the difference was not significant (P> 0.05).The peripheral blood lymphocyte stimulation index ofΔcrp(C79-13 pcDNA3-HN) group was significantly higher than that of the PBS control group (P<0.01),and was slightly higher than that of theΔcrpC79-13 (pCDNA3) group (P<0.05) at 28 d after immunization.The immunity protection rate against strong virus was 67%(10/15) in experiment group with 103EID50 NDV F48E9,the protection rate was 100% which challenged with 108CFUSalmonellapullorumC79-13 strain.The results showed that the recombinant attenuatedSalmonellapullorumΔcrpC79-13 (pcDNA3-HN) strains have good oral immunogenicity.
NDV;HNgene;attenuatedSalmonellabacteria;oral immunization;immunogenicity
10.11843/j.issn.0366-6964.2016.10.017
2016-03-22
河南省重点科技攻关项目(152102110078)
丁轲(1977-),男,河南永城人,副教授,博士,主要从事动物传染病与动物微生态学研究,Tel:0379-64895698,E-mail: keding19@163.com
程相朝,E-mail: chengxch@126.com
S852.52
A
0366-6964(2016)10-2081-08

