葛根素对成骨细胞增殖能力及靶向Runx2的miRNA的影响
张莹莹,周建斌,曾祥伟,赵凤鸣,刘光东,詹秀琴
(1.南京中医药大学基础医学院,江苏 南京 210023 2.南京中西医结合医院疼痛科,江苏 南京 210014)
葛根素对成骨细胞增殖能力及靶向Runx2的miRNA的影响
张莹莹1,周建斌2,曾祥伟1,赵凤鸣1,刘光东2,詹秀琴1
(1.南京中医药大学基础医学院,江苏 南京210023 2.南京中西医结合医院疼痛科,江苏 南京210014)
目的研究葛根素作用成骨细胞MC3T3-E1后对细胞的增殖能力和靶向Runx2基因的miRNA的影响。方法① MTT法检测葛根素作用于MC3T3-E1细胞后对成骨细胞增殖能力的影响。② 碱性磷酸酶活性检测葛根素对于成骨细胞活力影响。③ 葛根素作用于成骨细胞后,采用荧光实时定量PCR(Q-PCR)和蛋白印迹法(Western blot)法检测Runx2的mRNA表达水平和蛋白表达水平。④ 采用Target Scan、PicTar等靶点预测软件预测靶向Runx2的miRNA,并与表达谱测定的葛根素作用MC3T3-E1前后miRNA变化作比较。⑤ 采用Q-PCR法验证葛根素作用MC3T3-E1前后靶向Runx2基因的miRNA表达量。⑥ 构建Runx2 3′UTR/突变型Runx2 3′UTR重组质粒、合成miRNA-204mimics、miRNA-204inhibitor、miRNA-204NC共转染MC3T3-E1细胞,用双荧光素酶报告基因系统验证Runx2与miRNA-204的靶向关系。结果葛根素作用后,与空白对照组比较,细胞增殖活性提高,Runx2的mRNA和蛋白表达水平上升,miRNA-204和miRNA-344f-5p表达水平下降,miRNA-2861表达水平上升,miRNA-23a-5p、miRNA-770-5p、miRNA-871-5p表达水平无明显改变。细胞转染48h后,只有Runx2 3′UTR+miRNA204 mimics组荧光素蛋白的表达水平明显降低,说明只有miRNA-204可抑制Runx2 3′UTR报告基因的表达。结论葛根素可促进成骨细胞增殖,并通过下调靶向Runx2的miRNA的表达来提高Runx2表达水平。
葛根素; 成骨细胞; 增殖; 碱性磷酸酶; Runx2; miR-204;双荧光素酶报告基因
骨质疏松症是骨脆性增加且容易发生骨折的一种全身性骨骼疾病,以骨量减少,骨微结构退化为主要特征[1]。成骨细胞是骨形成过程中的主要的功能性细胞,负责骨基质的合成、相关物质的分泌和骨组织矿化[2]。大量研究表明[3-4],葛根素对成骨细胞的增殖有明显的促进作用。Runt家族相关转录因子2(Runx2)是骨发育过程中激活与启动骨髓基质干细胞向成骨细胞分化并调节成骨细胞成熟的重要转录因子,它能上调多种成骨相关基因的表达,对膜内和软骨内骨化成骨均有控制作用[5],加深葛根素对Runx2表达影响的研究,对进一步阐明葛根素对骨细胞的作用的分子机制有重要意义。
1 材料与试剂
1.1细胞前成骨细胞系MC3T3-E1(中国科学研究院上海细胞库);葛根素标准品(中国药品生物制品检定所):20 mg/支,纯度为96.0%,白色粉末状,干燥密封保存;α-MEM培养基(维森特);胎牛血清(Gibco);四唑盐MTT(凯基生物有限公司);对酚磷酸酯二钠盐(p-NPP, Sigma);mRNA逆转试剂盒(TaKaRa公司);TRIzol(Invitrogen公司);Realtime PCR SYBR premix 2×(TaKaRa公司);mRNA引物由南京金斯瑞公司合成序列:Runx2 Forward:5′-CGGACGAGGCAAGAGTTTCA-3′,Reverse:5′-GGATGAGGAATGCGCCCTAA-3′,扩增片段长度为192 bp;β-actin Forward:5′-GTGCTATGTTGCTCTAGACTTCG-3′,Reverse:5′-ATGCCACAGGATTCCATACC-3′,扩增片段长度为174 bp。目的基因一抗(rabbit Runx2)(Cell Signaling Technology公司);蛋白裂解液(碧云天公司);显色液 (BIO-BAD公司);BCA试剂盒(Solarbio公司);内参一抗(rabbit β-actin公司)(Cell Signaling Technology公司);二抗(Anti-Rabbit IgG HRP)(Cell Signaling Technology公司);RNAiso for Small RNA(TaKaRa公司),miRNA反转录酶、酶抑制剂( VaZyMe 公司);miRNA所有相关引物(Tab 1)由上海生物工程有限公司合成。表中的Reverse是miR-204、miR-2861、miR-344f-5p、miR-23a-5p、miR-770-5p、miR-871-5p 6个基因的通用下游引物。
1.2主要仪器荧光实时定量PCR仪(Agilent Technologies Mx3000P); 紫外可见光分光光度计(BioDrop, USA); 凝胶成像仪(Bio-Rad, USA); 酶标仪(BioTek, USA).
1.3方法
1.3.1MTT法检测葛根素对成骨细胞增殖能力影响将细胞以0.5×104每孔种在96孔板,用含胎牛血清的α-MEM培养液培养,37℃、5% CO2孵育24 h后,分为2组。葛根素组:每孔加入葛根素药液180 μL,使其终浓度为10 mg·L-1;空白对照组:加入等体积的培养液。加药后分别继续培养24、48和72 h,每组均设6个复孔。培养结束后,每孔加入新鲜配制的5× 103mg·L-1的MTT 溶液20 μL,4 h后弃上清,每孔加DMSO 150 μL,水平摇床混匀,酶标仪于490 nm波长处测定OD值。
1.3.2葛根素对成骨细胞碱性磷酸酶活性的影响每孔1×105个细胞分别接种至6孔板中,37℃、5% CO2培养。设对照组,葛根素作用72 h后收集细胞, PBS洗2次,冰上超声处理30 s 2次后,12 000×g离心15 min。取上清液100 uL加入含1.0×103mg·L-1p-NPP、1 mol·L-1二乙醇胺和0.5 mmol·L-1MgCl2的缓冲100 μL,37℃避光孵育30 min,每孔加入3 mol·L-1NaOH 50 μL终止反应,在405 nm波长下测定光吸收。BCA法测定样品蛋白浓度,用于校正碱性磷酸酶活性。
1.3.3荧光实时定量PCR检测Runx2转录水平将细胞以1×105种在6孔板里,设置葛根素处理组和空白对照组,加入等体积加了胎牛血清的培养液,培养72 h。使用TRIzol法对细胞进行总RNA的提取,用核酸蛋白分析仪测其浓度和纯度。使用逆转录试剂盒得到cDNA。参考说明书反应体系并每组设置3个复孔。PCR的循环条件:采用二步法:95℃ 30 s预变性,(95℃ 5 s,60℃ 34 s)× 40个循环,做熔解曲线分析。
1.3.4Western blot检测蛋白表达水平按全蛋白抽提试剂盒说明书提取处理72h后的各组细胞总蛋白,并用BCA法进行蛋白定量,-20℃冻存。取各组样本25 μg进行SDS-PAGE凝胶电泳,将分离后的蛋白质电转移到PDVF膜上,放入少量封闭液,室温下,摇床上封闭1 h。TBST漂洗滤膜3次,每次5 min。加入一抗抗体和封闭液(1 ∶1 000)3 mL孵育过夜后,TBST漂洗滤膜3次,每次5 min。将膜与HRP结合的二抗(二抗用封闭液稀释1 ∶3 000),室温下摇荡孵育1 h,TBST漂洗滤膜3次,每次5 min。配制显色液: 按A液 ∶B液=1 ∶1配制,在正面加混匀的显色液,放入凝胶成像仪中显影,调整曝光时间,直至出现最佳条带。用Bandscan分析软件分析条带灰度,进行半定量比较分析,并且均采用自身灰度值校正,以目的基因的条带灰度与管家基因β-actin的灰度比值表示蛋白的表达水平。

Tab 1 microRNA primer sequence
1.3.5microRNA表达谱检测TRIzol法提取葛根素作用72 h后的成骨细胞和对照组细胞的RNA,交由康成生物公司完成表达谱实验。
1.3.6软件预测靶向Runx2的miRNA生物学信息软件对可能靶向Runx2的miRNA进行预测。目前常用的靶基因预测软件有TargetScan、PicTar、miRBase和miRDB。综合利用这4个软件预测,选取几个软件预测皆靶向Runx2的miRNA,并与表达谱入选的miRNA进行比对,重复的miRNA基因作为研究对象。
1.3.7葛根素作用后靶向Runx2的miRNA变化细胞培养方法及葛根素作用时间同“1.3.1”、RNA提取方法同“1.3.3”。miRNA 逆转录反应体系:5×Reverse Transcription Mix 10.0 μL、Stem-loop 反转录引物1.0 μL、microRNA 500 ng、hiscript Enzyme Mix 2.0 μL、加 RNA free H2O至总体积20 μL。反应条件为:25℃,5 min;45℃,50 min;85℃,5 min;4℃,反应结束后,将其放入-20℃保存。
Real-Time PCR 检测反应体系条件方法同“1.3.3”。
1.3.8双荧光素酶报告基因法验证靶基因取对数生长期细胞,以每孔2×104细胞种于24孔培养板中,充分混匀,培养24 h。当融合度接近90%时进行转染。取1.5 mL EP管6个,均加入无血清双抗的αMEM培养液(按50 μL每孔)和Lipofectamine 2000脂质体(按1 μL每孔),使其充分混匀,静置5 min。向新的EP管中加入无血清双抗的αMEM培养液(按50 μL每孔)和Runx2 3′UTR/突变型Runx2 3′UTR重组质粒(100 ng每孔)、miRNA mimics/miRNA inhibitor/阴性对照NC(2 μmol·L-1/孔),并充分混匀,共分成6组,即Runx2 3′UTR+miRNA mimics、Runx2 3′UTR+miRNA inhibitor、Runx2 3′UTR+miRNA NC、Runx2mut 3′UTR+miRNA mimics、Runx2mut 3′UTR+miRNA inhibitor、Runx2mut 3′UTR+miRNA NC。将混有脂质体的αMEM培养液和上述6组αMEM培养液分别相混合(100 uL/孔),并充分混匀,室温下静置20 min,分别加到24孔培养板相应的实验组中(每组设定3个复孔),混匀放置于37℃ CO2培养箱中培养48 h。
每孔用1×PBS轻柔洗涤1次,每孔加1×PLB(裂解液),反复吹打,冻融3次,以充分裂解细胞。离心后取上清。用荧光检测仪中进行测定,设置2 s的预测延迟和10 s的测定用时,在测量管中加入5 μL样本充分混匀10 s,再加入100 μL Luciferase Reporter Assay Reagent Ⅱ(LAR Ⅱ,萤火虫荧光素酶底物)测定萤火虫荧光1,而后加入100 μL Stop&Glo®substrate(海肾荧光素酶底物)测定海肾荧光2。以荧光1/荧光2的值作为相对荧光素酶活性。
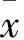
2 结果
2.1葛根素对成骨细胞增殖能力的影响实验结果显示(Fig 1),加药组的细胞OD值明显高于空白组,表明葛根素作用后细胞的增殖能力明显增强。作用72 h后加药组与空白组的差异更为明显,故后面实验葛根素作用时间均为72 h。
2.2葛根素对成骨细胞内碱性磷酸酶活性的影响葛根素作用成骨细胞72 h后,细胞内碱性磷酸酶活性的检测结果为:空白对照组54.44±0.45,葛根素处理组55.52±0.81,与空白对照组比较,葛根素作用成骨细胞72 h后,碱性磷酸酶活性提高,且实验数据差异具有统计学意义(P<0.05)。
*P<0.05,**P<0.01vscontrol
2.3葛根素对成骨细胞Runx2 mRNA表达水平的影响实验结果显示(Fig 2),葛根素作用72 h后,Runx2 mRNA表达量,空白对照组为1,葛根素组为2.47±0.66,与空白对照组比较差异具有显著性,葛根素作用后Runx2 mRNA表达量上升了1.47倍(P<0.01)。
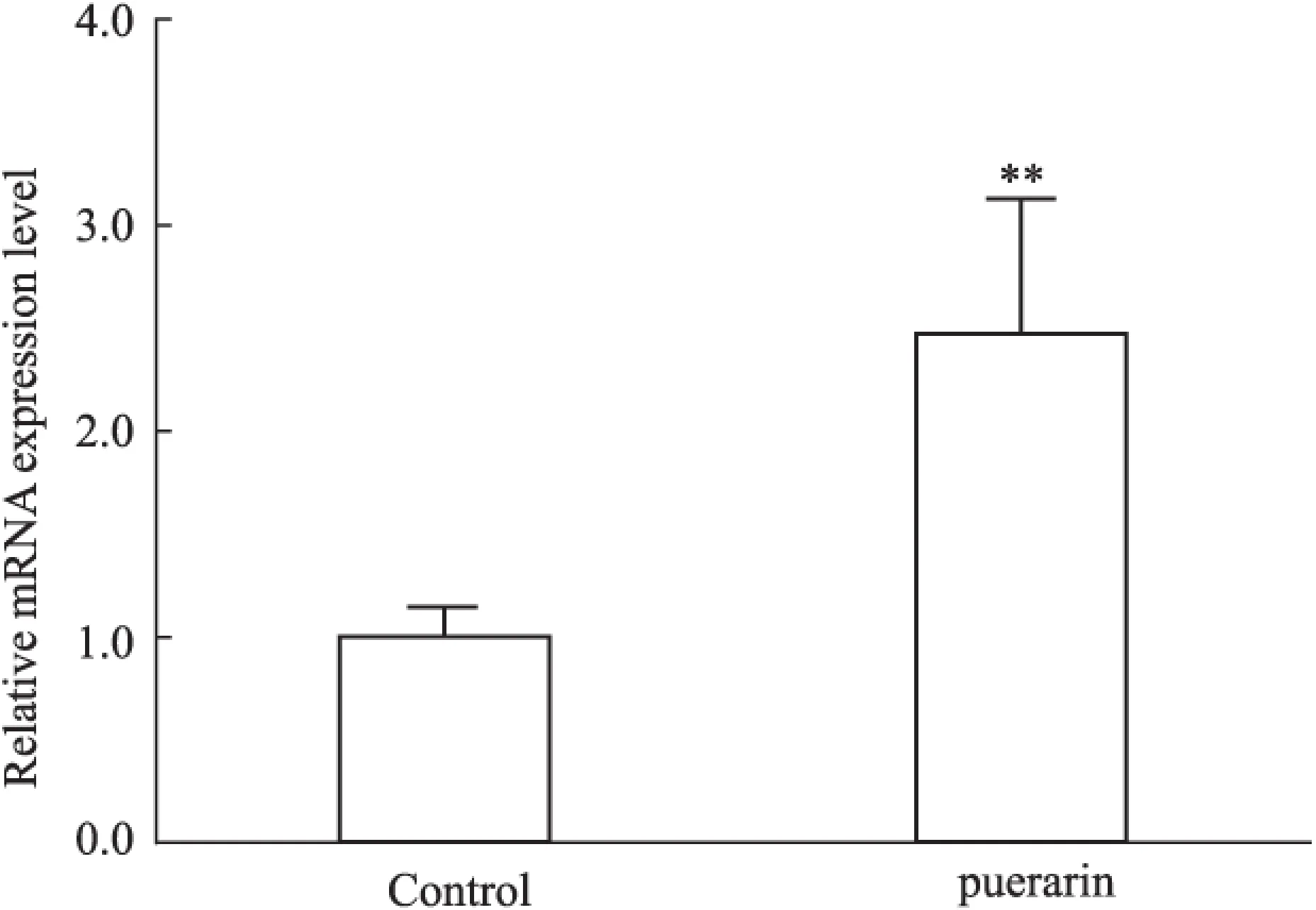
Fig 2 RNA expression levels of Runx2 before and after effect of puerarin
*P<0.01vscontrol
2.4葛根素对成骨细胞Runx2蛋白表达水平的影响实验结果显示,同空白组相比,葛根素作用后Runx2/β-actin的值明显高于对照组,表明Runx2蛋白水平明显上升。每组蛋白样本重复3次,Runx2蛋白水平见Fig 3。
2.5表达谱检测葛根素作用后microRNA的变化送检样品测序数据标准化后,选取同一个体药物作用前后两标本间miRNA表达差异,并用Chi-squared 2X2的方法计算p-value(取P<0.05)。microRNA表达谱检测结果显示:miR-204、miR-2861、miR-344f-5p、miR-23a-5p、miR-871-5p、miR-770-5p等119个microRNA葛根素作用前后发生变化。部分表达谱结果见Tab 2。
2.6靶向Runx2的miRNA预测结果综合利用TargetScan、PicTar、miRBase和miRDB这4个软件预测结果显示,靶向Runx2的miRNA有miR-204、miR-128、miR-135b-5p、miR-3072-3p、miR-2861、miR-344f-5p等。与表达谱入选的miRNA进行比对,miRNA-204、miRNA-344f-5p、miR-2861是共同存在的。2.7葛根素作用后miRNA表达量的变化选取表达谱既有改变软件也预测到的miRNA-204、miRNA-344f-5p、miR-2861和表达谱有改变软件没有预测到的miR-23a-5p、miR-871-5p、miR-770-5p 6个microRNA作为PCR的研究对象。结果显示(Fig 4)葛根素作用后miRNA在成骨细胞中的表达水平与空白对照组比较,miRNA-204、miRNA-344f-5p表达水平下降,miR-2861表达水平上升,且变化特别明显,其机制与成骨细胞活性之间的关系有待进一步研究。miR-23a-5p、miR-871-5p、miR-770-5p表达水平无明显改变。实验研究表明miRNA在体内常作为负调节器调节相关基因的表达[6],由于葛根素作用以后Runx2的表达水平上升,我们只选取葛根素作用以后表达水平下降的miRNA作为研究对象。经过综合考虑,我们在实验中进一步验证miRNA-204与Runx2的靶向关系。
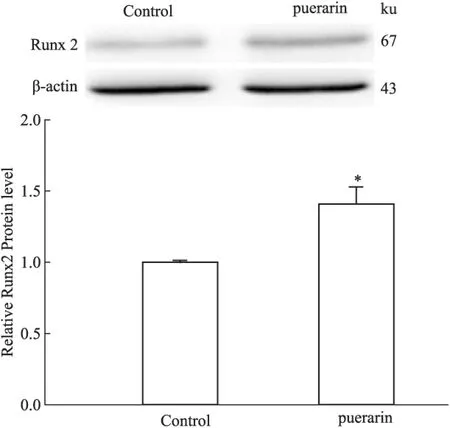
Fig 3 Protein expression of Runx2 before and after puerarin effects on osteoblasts
*P<0.05vscontrol
Tab 2 microRNA expression spectrum of drug vs blank
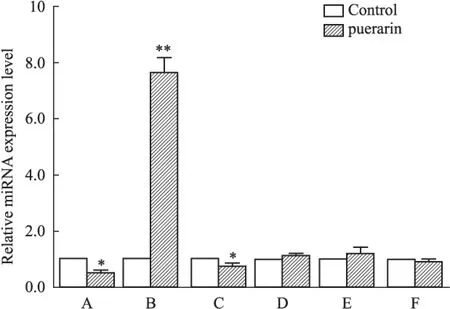
Fig 4 Expression levels of miRNA before and after puerarin on osteoblast
A:miR-204;B:miR-2861;C:miR-344f-5;D:miR-23a-5p;E:miR-770-5p;F:miR-871-5p,*P<0.05,**P<0.01vscontrol
2.8双荧光素酶报告基因法验证miRNA与Runx2的靶向关系结果显示(Fig 5),细胞转染48 h后,只有Runx2 3′UTR+miRNA-204 mimics组荧光素蛋白的表达水平明显降低,Runx2 3′UTR+miRNA-204 inhibitor组荧光素蛋白的表达水平明显提高(P<0.05),说明只有miRNA-204可抑制Runx2 3′UTR报告基因的表达,miRNA inhibitor促进Runx2 3′UTR报告基因的表达,miRNA-204+Runx2mut 3′UTR组、Runx2mut 3′UTR+miRNA inhibitor、miRNA-204NC+Runx2 3′UTR组和miRNA-204NC+Runx2mut 3′UTR组荧光素蛋白的表达水平均变化不明显(P>0.05),表明了Runx2为miRNA-204的靶基因。
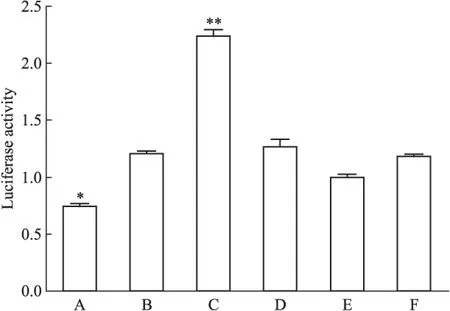
Fig 5 Effects of miRNA-204 on expression of Runx2
3′UTR OE=miRNA-204mimics, IN=miRNA-204inhbitor, NC=miRNA-204NC,*P<0.05,**P<0.01vsRunx2 3′UTR+NC. A:Runx2 3′UTR+OE;B:Runx2mut 3′UTR+OE;C:Runx2 3′UTR+IN;D:Runx2mut 3′UTR+IN;E:Runx2 3′UTR+NC;F:Runx2mut 3′UTR+NC
3 讨论
葛根素是从葛根这一味中药里提取的单体成分,是一种异黄酮化合物,属于植物雌激素[7]。研究表明,葛根素能够刺激成骨细胞的增殖作用,提高成骨细胞的碱性磷酸酶的活性[3,8]。碱性磷酸酶是成骨细胞分化早期的特异性标志物,常被用来作为评价成骨细胞矿化功能的指标[9]。成骨细胞分泌碱性磷酸酶和钙盐结晶体到细胞外基质中,碱性磷酸酶使局部的磷酸含量增加,促使基质钙化[10]。本实验葛根素组碱性磷酸酶活性明显增加,也表明了葛根素可以促进成骨细胞的生物矿化进程。
Runx2的表达是成骨细胞分化的开始,它能促进骨髓基质干细胞向成骨细胞分化[11],是骨形成过程中最早和最具特征性的标志,对防治骨质疏松症具有重要意义[12]。miRNA是细胞内的一类小分子RNA,在转录后调节基因表达,能影响多种生物学过程,包括细胞的增殖、分化、凋亡、发育[13-15]。它的发现可能成为极有应用价值的分子标志物,为骨质疏松症的治疗提供新的靶标。
本实验表明,葛根素在上调成骨细胞Runx2表达的同时,miRNA表达谱也有很大的改变,推测葛根素对Runx2表达的影响可能与miRNA有关。miRNA表达谱检测到葛根素作用于成骨细胞后miR-23a-5p、miR-871-5p、miR-770-5p发生改变,而PCR结果发现葛根素作用后这3种miRNA并没有发生统计学的改变,初步判断miRNA表达谱只能作为参考,验证其靶向关系还有待进一步实验。表达谱和PCR结果都发现葛根素作用后miRNA-204、miRNA-344f-5p表达下降,说明了Runx2和miRNA-204、miRNA-344f-5p的表达呈负相关。采用生物信息学分析发现,miRNA-204能与Runx2的3′非翻译区特异性结合从而抑制其翻译。为进一步验证miR-204和Runx2之间的关系,我们构建了Runx2 3′UTR和突变型Runx2 3′UTR的表达载体,用双荧光素酶报告基因系统进行验证,最终实验结果证实了它们之间的靶向关系。以上结果表明miRNA对Runx2表达有调控作用,葛根素对成骨细胞Runx2的影响,一定程度上与干涉靶向Runx2的miRNA相关,葛根素干涉miRNA表达的分子机制我们还在进一步的研究中。(致谢:本实验主要是在南京中医药大学基础医学院实验室完成,感谢实验室各位老师的帮助让我顺利完成实验。)
[1]刘金鑫,张方怡,张岩. 血管紧张素II调控骨代谢的研究进展[J]. 中国药理学通报, 2015, 3(4): 458-61.
[1]Liu J X, Zhang F Y, Zhang Y. The research progress of angiotensin II regulation of bone metabolism[J].ChinParmacolBull, 2015, 31(4): 458-61.
[2]Saito A, Yoshimura K, Miyamoto Y,et al. Enhanced and suppressed mineralization by acetoacetate and β-hydroxybutyrate in osteoblast cultures[J].BiochemBiophysResCommun,2016, 473(2): 537-44.
[3]Chang W, Meng M X, Tang X L, et al. The proliferation, differentiation, and mineralization effects of puerarin on osteoblastsinvitro[J].ChinJNatMed, 2014, 12(6): 436-42.
[4]Yue W, Wen L W, Wen L X, et al. Puerarin stimulates proliferation and differentiation and protects against cell death in human osteoblastic MG-63 cells via ER-dependent MEK/ERK and PI3K/Akt activation[J].Phytomedicne, 2013, 20(10): 787-96.
[5]Bruderer M, Richards R G, Alini M, et al. Role and regulation of RUNX2 in osteogenesis[J].EurCellMater, 2014, 28(28): 269-86.
[6]Wang Y, Chen S, Deng C, et al. MicroRNA-204 targets Runx2 to attenuate BMP-2-induced osteoblast differentiation of human aortic valve interstitial cells[J].JCardiovascPharmacol, 2015, 35(7):839-48.
[7]Zhou Y X, Zhang H, Peng C. Puerarin: a review of pharmacological effects[J].PhytotherRes, 2014, 28(7): 961-75.
[8]Tiyasatkulkovit W, Malaivijitnond S, Charoenphandhu N, et al. Pueraria mirifica extract and puerarin enhance proliferation and expression of alkaline phosphatase and type I collagen in primary baboon osteoblasts[J].Phytomedicine, 2014, 21(12): 1498-503.
[9]Yamada T, Ezura Y, Hayata T, et al. β2 adrenergic receptor activation suppresses bone morphogenetic protein (BMP)-induced alkaline phosphatase expression in osteoblast-like MC3T3E1 cells[J].JCellBiochem, 2015, 116(6): 1144-52.
[10]Gan X Q, Huang S B, Yu Q, et al. Blockade of Drp1 rescues oxidative stress- induced osteoblastdys function[J].BlochemBiophysResCommun, 2015, 468(4): 719-25.
[11]Ge C X, Cawthorn W P, Li Y, et al. Reciprocal control of osteogenic and adipogenic differentiation by ERK/MAP kinase phosphorylation of Runx2 and PPAR transcription factors[J].JCellPhysiol, 2016, 231(34): 587-96.
[12]Kumar Y,Kapoor I,Khan K, et al. E3 ubiquitin ligase Fbw7 negatively regulates osteoblast differentiation by targeting Runx2 for degradation[J].JBiolChem, 2015, 290(52): 30975-87.
[13]Ambros V. The functions of animal microRNAs[J].Nature, 2004, 431(7006): 350-5.
[14]Liu C, Lou C H, Shah V, et al. Identification of microRNAs and microRNA targets in Xenopus gastrulae: The role of miR-26 in the regulation of Smad1[J].DevBiol, 2016, 409(1): 26-38.
[15]Wu D, Pan H, Zhou Y, et al. Upregulation of microRNA-204 inhibits cell proliferation, migration and invasion in human renal cell carcinoma cells by downregulating SOX4[J].MoleMedRep, 2015, 12(5): 7059-64.
Effects of puerarin on proliferation of osteoblasts and Runx2-targeting miRNAs
ZHANG Ying-ying1,ZHOU Jian-bin2,ZENG Xiang-wei1,ZHAO Feng-ming1,LIU Guang-dong2,ZHAN Xiu-qin1
(1.BasicMedicalCollegeofNanjingUniversityofChineseMedicine,Nanjing210023,China;2.NanjingIntegratedTraditionalChineseandWesternMedicineHospital,Nanjing210014)
AimTo study proliferation capacity of cell and the target relationship between microRNA and Runx2 after effect of puerarin on osteoblasts MC3T3-E1.MethodsThe proliferation capacity of cell was detected by MTT after effect of puerarin on osteoblasts MC3T3-E1 .The vitality of osteoblasts was detected by activity of alkaline phosphatase. The expression level of mRNA and protein of Runx2 were detected by real-time quantitative PCR and Western blot. The result of miRNA expression spectrum was compared with the predicted result to determine the Runx2-targeting miRNAs. The expression levels of miRNAs possiby targeted to Runx2 were detected by real-time quantitative PCR. The RhoE 3′UTR vector and RhoE mut 3′UTR vector were constructed. miRNA-204 mimics and miRNA-204 NC were synthetised. The target genes were verified by dual luciferase report gene assay.ResultsAfter osteoblasts treated with puerarin, proliferation capacity and activity of cells were enhanced ,expression levels of mRNA and protein of Runx2 were both increased , the expression levels of miRNA-204 and miRNA-344f-5p were declined, the expression levels of miRNA-2861 was increased,the expression levels of miRNA-23a-5p, miRNA-770-5p and miRNA-871-5p showed no obvious change. According to the results of dual luciferase reporter gene method after cell transfection of 48 h, only set of 3′UTR Runx2+mimics the miRNA - 204 of fluorescein protein expression level decreased significantly, showing only the miRNA-204 inhibits Runx2 3′UTR report gene expression.ConclusionPuerarin promotes the proliferation of osteoblasts and regulates the miRNAs which possibly target to Runx2.
puerarin; osteoblast; proliferation; alkaline phosphatase; Runx2; miR-204; dual luciferase reporter gene
时间:2016-9-22 11:14
http://www.cnki.net/kcms/detail/34.1086.R.20160922.1114.048.html
2016-06-21,
2016-08-17
江苏省科技厅资助项目(No BK20131417)
张莹莹(1989-),女,硕士生,研究方向:分子生物学,E-mail:593556188@qq.com;
詹秀琴(1966-),女,博士,副教授,研究方向:分子生物学,通讯作者,E-mail:xqzhan14@sina.com
10.3969/j.issn.1001-1978.2016.10.024
A
1001-1978(2016)10-1457-06
R284.1;R329.24;R342.2;R681.022

