富氢液通过自噬途径下调中波紫外线诱导的HaCaT细胞炎症因子的表达
张秉新 邢卫斌 付国俊 陈红光
300193天津中医药大学第一附属医院皮肤科(张秉新);天津市第五中心医院皮肤科(邢卫斌);河北省沧州市人民医院皮肤科(付国俊);天津医科大学总医院麻醉科(陈红光)
富氢液通过自噬途径下调中波紫外线诱导的HaCaT细胞炎症因子的表达
张秉新 邢卫斌 付国俊 陈红光
300193天津中医药大学第一附属医院皮肤科(张秉新);天津市第五中心医院皮肤科(邢卫斌);河北省沧州市人民医院皮肤科(付国俊);天津医科大学总医院麻醉科(陈红光)
目的 探讨氢气是否能通过自噬途径调节中波紫外线(UVB)诱导的HaCaT细胞炎症因子的表达。方法 将培养的HaCaT细胞分为空白对照组(不做任何处理),氢气组(仅用富氢培养液培养),1、10、50 mJ/cm2UVB 组,1、10、50 mJ/cm2UVB+氢气组,50 mJ/cm2UVB+3甲基腺嘌呤(3MA)组,50 mJ/cm2UVB+雷帕霉素组,50 mJ/cm2UVB+3MA+氢气组,50 mJ/cm2UVB+雷帕霉素+氢气组。细胞经过不同处理培养12 h后,噻唑蓝(MTT)法检测细胞增殖,LDH试剂盒检测乳酸脱氢酶(LDH),细胞提取蛋白检测自噬蛋白LC3和Beclin1的表达,上清液用ELISA检测炎症因子肿瘤坏死因子(TNF)α、白细胞介素(IL)-1β、HMGB1和IL-6的水平。结果 与空白对照组相比,UVB诱导的HaCaT细胞LDH释放增多,细胞活力下降,自噬蛋白LC3和Beclin1表达增加,炎症因子TNF-α、IL-1β、HMGB1和IL-6释放增加(均P<0.05)。与UVB组相比,氢气可减少LDH释放,提高细胞活力,自噬蛋白LC3和Beclin1表达进一步增加,炎症因子TNF-α、IL-1β、HMGB1和IL-6表达减少(均P<0.05)。与50 mJ/cm2UVB组相比,50 mJ/cm2UVB+3MA组炎症因子TNF-α、IL-1β、HMGB1和IL-6表达进一步增加(P<0.05),而50 mJ/cm2UVB+雷帕霉素组炎症因子TNF-α、IL-1β、HMGB1和IL-6表达减少(P<0.05)。与50 mJ/cm2UVB+氢气组相比,50 mJ/cm2UVB+氢气+3MA组炎症因子TNF-α、IL-1β、HMGB1和IL-6表达增加(P<0.05)。结论 UVB照射可以诱发自噬蛋白表达增加;富氢液可以下调UVB诱导的HaCaT细胞炎症因子的表达,而这一过程是通过激活自噬途径实现的。
紫外线;自噬;炎症趋化因子类;氢气;HaCaT细胞
紫外线照射是引起光线性皮肤病的因素之一,其中以中波紫外线(UVB)对角质形成细胞的影响最大,能诱导角质形成细胞分泌多种细胞因子,如,肿瘤坏死因子 α(TNF-α),白细胞介素(IL)-6,IL-8,iNOS等,引起皮炎及免疫反应[1-2]。细胞自噬是真核生物普遍存在的自稳机制,在细胞自我保护和生存等过程中发挥作用[3]。细胞自噬不仅可通过调控炎症反应发挥细胞保护效应[3],还可调节UVB引起的人成纤维细胞和角质形成细胞的细胞损伤[4-5]。据报道,氢气可以通过抗炎和调节自噬作用发挥对疾病的治疗作用[5-6]。因此,本研究探讨氢气是否可减轻UVB引起的HaCaT细胞释放的炎症因子的表达,这一过程是否通过自噬的调节发挥作用,进而明确氢气治疗疾病的相关机制。
资料与方法
一、资料
人HaCaT细胞来源于美国ATCC细胞库。胎牛血清、胰蛋白酶、EDTA、噻唑蓝(MTT)(美国 Sigma公司),乳酸脱氢酶(LDH)检测试剂盒(南京建成生物工程研究所),β肌动蛋白、LC3和Beclin1抗体、山羊抗人辣根过氧化物酶(HPR)标记二抗(美国Abcom 公司),TNF-α、IL-1β、HMGB1和IL-6试剂盒(美国RD公司)。紫外线光疗仪为上海希格玛高技术有限公司产品。3甲基腺嘌呤(3MA)购自美国Sigma公司。
二、方法
1.含氢培养液制备:参考文献[7]方法,在0.5mPa压力下加压暴露4 h,使纯氢气溶解于正常含10%FBS的DMEM培养基中并达到饱和水平,4℃贮存。富氢液新鲜制备,利用氢电极(丹麦Unisense公司)室温检测氢浓度为0.6 mmol/L,且饱和浓度至少可存放1周。为了保证稳定的氢气浓度,含氢培养液至少每周配置1次。
2.细胞培养及分组处理:将HaCaT细胞用含10%胎牛血清的DMEM培养基稀释到1×106个/ml,接种于6孔培养板,置于37℃、含体积分数为5%CO2的培养箱中常规培养,将处于对数生长期的细胞用于实验。根据实验设计分组为:①空白对照组,不做任何处理;②氢气组:未经UVB照射的细胞用富氢培养液培养;③1、10、50 mJ/cm2UVB组:分别用1、10、50 mJ/cm2UVB 照射细胞;④1、10、50 mJ/cm2UVB+氢气组:分别用1、10、50 mJ/cm2UVB照射细胞+富氢培养液培养;⑤UVB+3MA组:50 mJ/cm2UVB照射细胞+3MA(自噬抑制剂);⑥UVB+雷帕霉素组:50 mJ/cm2UVB照射细胞+雷帕霉素(自噬激活剂);⑦UVB+3MA+氢气组:50 mJ/cm2UVB照射细胞+3MA+富氢培养液培养;⑧UVB+雷帕霉素+氢气组:50 mJ/cm2UVB照射细胞+雷帕霉素+富氢培养液培养。
[8]及预实验结果,3MA和雷帕霉素(浓度分别为1 mmol/L、0.1 μmol/L)在UVB照射前1 h加入培养基。UVB照射前将培养基吸去,用磷酸盐缓冲液(PBS)冲洗后,加入薄层PBS,以刚好覆盖细胞为度。根据预实验结果,用1、10、50 mJ/cm2照射剂量分别照射30 s,照射时细胞与光源间的照射距离为15 cm。照射后立即弃去上覆的PBS,加入新鲜培养基继续培养12 h,进行相关检测。
3.LDH检测:各组细胞经过不同处理并培养12h后,根据LDH试剂盒说明检测LDH释放水平。
4.MTT法检测细胞增殖:各组细胞经过不同处理并培养12 h后,每孔加入5 g/L MTT 20 μl,37℃孵育4 h后弃去上清液,加入200 μl二甲基亚砜(DMSO),室温振荡15 min,用酶标仪(美国Clinibi公司)选择490 nm波长测定每孔细胞的吸光度值(A值),观察HaCaT细胞的细胞活力变化。
5.Western印迹法检测自噬蛋白LC3和Beclin1的表达:按照上述实验细胞培养12 h后,收集细胞,留取蛋白,用蛋白酶抑制剂裂解蛋白,收集后置于-80℃冰箱保存备用。将蛋白进行SDS-PAGE蛋白质电泳1 h,行PVDF膜转移蛋白质1 h,血清封闭2 h,加入一抗β肌动蛋白(稀释度1∶1 000),LC3或Beclin1(稀释度1∶500)4℃过夜,洗膜,加入二抗HRP(稀释度1∶5 000)孵育2 h,然后进行化学发光显像,以目的蛋白条带积分吸光度值与β肌动蛋白条带积分吸光度值的比值反映目的蛋白表达水平。
6.ELISA 检测炎症因子 TNF-α、IL-1β、HMGB1和IL-6的水平:细胞按照上述实验培养12 h后,收集标本,离心取上清液,根据炎症因子TNF-α、IL-1β、HMGB1和IL-6检测试剂盒说明书,采用用ELISA 法检测 TNF-α、IL-1β、HMGB1和IL-6的表达水平。
7.统计学处理:用SPSS18.0软件,正态分布的计量资料以±s表示,组间比较采用单因素方差分析,两两比较采用LSD法,P<0.05为差异有统计学意义。
结 果
一、氢气对不同剂量UVB照射HaCaT细胞的LDH和细胞增殖的影响
与空白对照组相比,低剂量UVB对细胞无明显影响(P>0.05),而 10 mJ/cm2和50 mJ/cm2UVB 可明显诱发细胞损伤,LDH增多、细胞活力降低(P<0.05),且呈剂量依赖性变化。给予富氢液处理低剂量UVB照射的细胞后,与1 mJ/cm2UVB组相比,LDH和MTT无明显变化(P>0.05);给予富氢液处理10 mJ/cm2和50 mJ/cm2UVB照射的细胞后,与同剂量UVB组相比,细胞LDH释放减少,细胞活力增加,差异有统计学意义(P<0.05)。见表1。
表1 氢气对不同剂量UVB照射的HaCaT细胞LDH和细胞增殖的影响(±s)
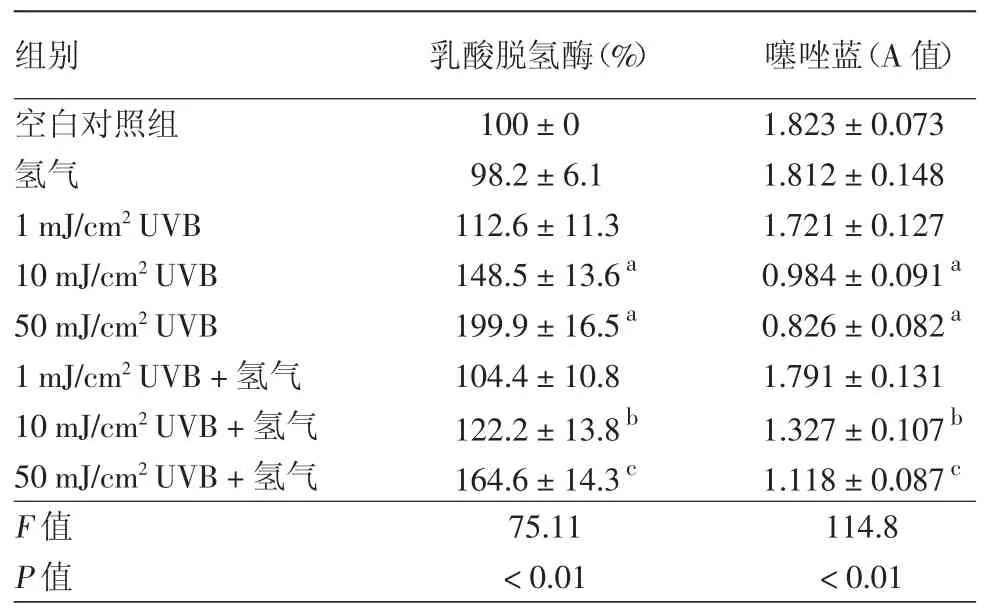
表1 氢气对不同剂量UVB照射的HaCaT细胞LDH和细胞增殖的影响(±s)
注:n=6。a:与空白对照组比较,P<0.05;b:与 10 mJ/cm2UVB 组比较,P<0.05;c:与50 mJ/cm2UVB组比较,P<0.05
组别 乳酸脱氢酶(%) 噻唑蓝(A值)空白对照组 100±0 1.823±0.073氢气 98.2±6.1 1.812±0.148 1 mJ/cm2UVB 112.6±11.3 1.721±0.127 10 mJ/cm2UVB 148.5±13.6a 0.984±0.091a 50 mJ/cm2UVB 199.9±16.5a 0.826±0.082a 1 mJ/cm2UVB+氢气 104.4±10.8 1.791±0.131 10 mJ/cm2UVB+氢气 122.2±13.8b 1.327±0.107b 50 mJ/cm2UVB+氢气 164.6±14.3c 1.118±0.087c F值 75.11 114.8 P值<0.01<0.01
二、氢气对不同剂量UVB照射HaCaT细胞的自噬蛋白LC3和Beclin1的影响
与空白对照组相比,1 mJ/cm2UVB虽可引起HaCaT细胞自噬蛋白LC3和Beclin1轻微升高,但差异无统计学意义(P>0.05),而10 mJ/cm2和50 mJ/cm2UVB可明显诱发自噬蛋白LC3和Beclin1表达呈剂量依赖性增加,差异有统计学意义(P<0.05)。给予富氢液处理并经不同剂量UVB照射后,与相同剂量UVB组相比,1 mJ/cm2组两蛋白表达差异无统计学意义(P>0.05),10 mJ/cm2和50 mJ/cm2UVB 组自噬蛋白LC3和Beclin1表达进一步增加,差异有统计学意义(P<0.05)。见表 2,图 1。
表2 氢气对不同剂量UVB照射HaCaT细胞的自噬蛋白LC3和Beclin1的影响(±s)
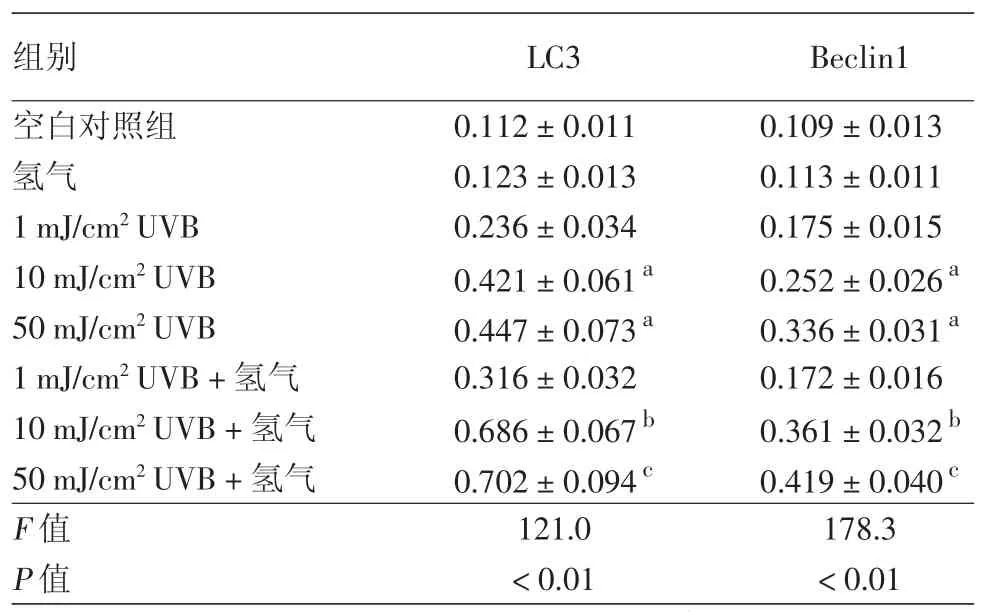
表2 氢气对不同剂量UVB照射HaCaT细胞的自噬蛋白LC3和Beclin1的影响(±s)
注:n=6。a:与空白对照组比较,P<0.05;b:与 10 MJ/CM2UVB组比较,P<0.05;c:与50 mJ/cm2UVB组比较,P<0.05
组别 LC3 Beclin1空白对照组 0.112±0.011 0.109±0.013氢气 0.123±0.013 0.113±0.011 1 mJ/cm2UVB 0.236±0.034 0.175±0.015 10 mJ/cm2UVB 0.421±0.061a 0.252±0.026a 50 mJ/cm2UVB 0.447±0.073a 0.336±0.031a 1 mJ/cm2UVB+氢气 0.316±0.032 0.172±0.016 10 mJ/cm2UVB+氢气 0.686±0.067b 0.361±0.032b 50 mJ/cm2UVB+氢气 0.702±0.094c 0.419±0.040c F值 121.0 178.3 P值<0.01<0.01
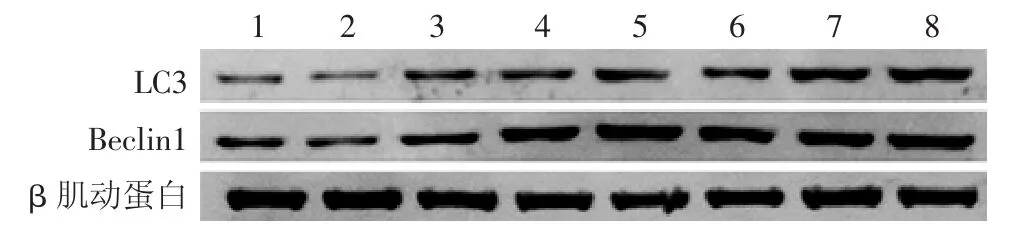
图1 Western印迹法检测氢气对不同剂量UVB照射HaCaT细胞的自噬蛋白LC3和Beclin1的表达 与空白对照组相比,10、50 mJ/cm2UVB可明显诱发自噬蛋白LC3和Beclin1表达呈剂量依赖性增加。给予富氢液处理并经不同剂量UVB照射后,与相同剂量UVB组相比,自噬蛋白LC3和Beclin1表达进一步增加。1:空白对照组;2:空白对照组 + 氢气;3:UVB1;4:UVB2;5:UVB3;6:UVB1+氢气;7:UVB2+氢气;8:UVB3+氢气
三、富氢液通过自噬途径对UVB照射的HaCaT细胞炎症因子的影响
与空白对照组相比,50 mJ/cm2UVB组细胞炎症因子 TNF-α、IL-1β、IL-6 和HMGB1 释放明显增加,差异有统计学意义(均P<0.05)。与50 mJ/cm2UVB组相比,50 mJ/cm2UVB+氢气组炎症因子显著降低,50 mJ/cm2UVB+3MA组各炎症因子显著增加,而50 mJ/cm2UVB+雷帕霉素组则反之,差异有统计学意义(均P<0.05)。与50 mJ/cm2UVB+氢气组相比,50 mJ/cm2UVB+氢气+3MA组炎症因子增加,差异有统计学意义(均P<0.05),说明3MA翻转了富氢液对UVB照射细胞的炎症因子过量释放的抑制作用。此外,与50 mJ/cm2UVB+氢气组相比,50 mJ/cm2UVB+氢气+雷帕霉素组炎症因子降低。见表3。
表3 氢气对UVB照射HaCaT细胞的炎症因子的表达变化(±s)
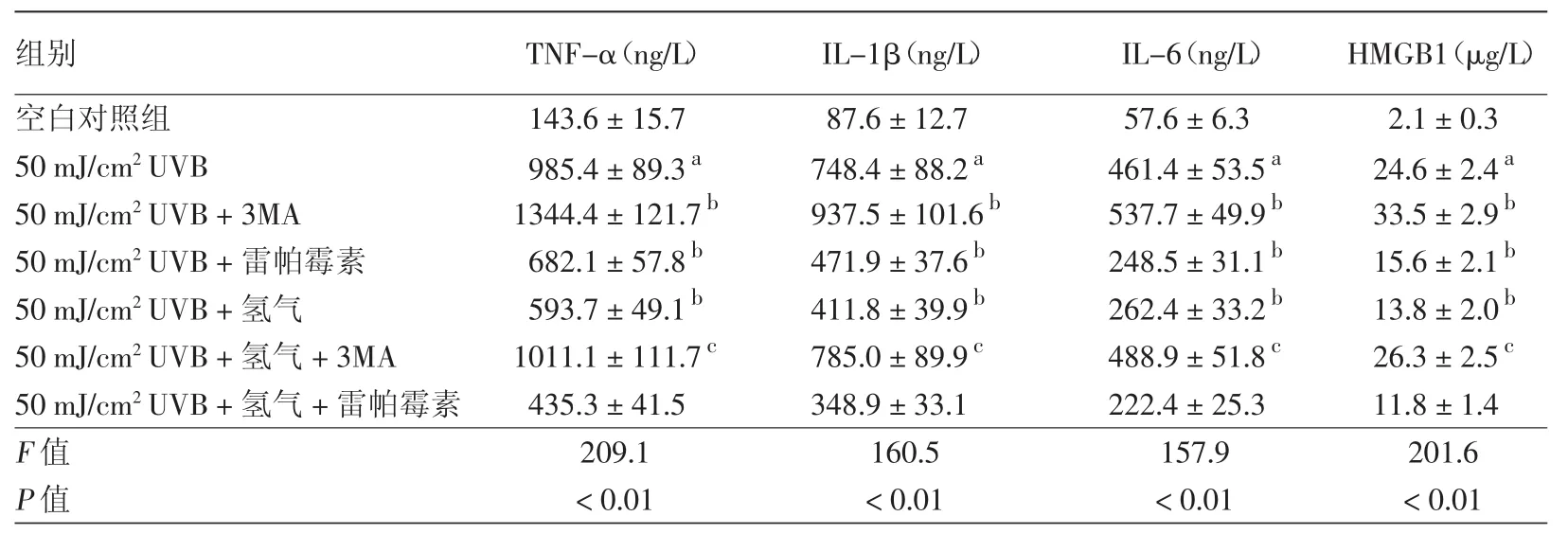
表3 氢气对UVB照射HaCaT细胞的炎症因子的表达变化(±s)
注:n=6。a:与空白对照组比较,P<0.05;b:与 50 mJ/cm2UVB 组比较,P<0.05;c:与 50 mJ/cm2UVB+ 氢气组比较,P<0.05
组别 TNF-α(ng/L) IL-1β(ng/L) IL-6(ng/L) HMGB1(μg/L)空白对照组 143.6±15.7 87.6±12.7 57.6±6.3 2.1±0.3 50 mJ/cm2UVB 985.4±89.3a 748.4±88.2a 461.4±53.5a 24.6±2.4a 50 mJ/cm2UVB+3MA 1344.4±121.7b 937.5±101.6b 537.7±49.9b 33.5±2.9b 50 mJ/cm2UVB+雷帕霉素 682.1±57.8b 471.9±37.6b 248.5±31.1b 15.6±2.1b 50 mJ/cm2UVB+氢气 593.7±49.1b 411.8±39.9b 262.4±33.2b 13.8±2.0b 50 mJ/cm2UVB+氢气+3MA 1011.1±111.7c 785.0±89.9c 488.9±51.8c 26.3±2.5c 50 mJ/cm2UVB+氢气+雷帕霉素 435.3±41.5 348.9±33.1 222.4±25.3 11.8±1.4 F值 209.1 160.5 157.9 201.6 P值<0.01<0.01<0.01<0.01
讨 论
造成皮肤光损伤的紫外线主要为UVB,由角质形成细胞所组成的表皮层是UVB损伤的靶组织,且UVB照射可导致皮肤角质形成细胞的增殖能力下降[7,9]。本实验通过给予不同剂量的UVB照射HaCaT细胞后,出现细胞损伤,LDH释放增加,细胞活力降低,且随着照射剂量的增加,细胞损伤和细胞活力下降增加。紫外线还可通过炎症损伤调控皮肤的形态和功能,可诱发细胞核和线粒体DNA损伤,并产生的大量细胞因子,如IL-1、IL-6等,从而引起细胞的损伤与修复功能异常,诱发皮肤红斑、老化、光敏性疾病、异常的DNA合成、DNA损伤、免疫抑制等[10]。本实验结果显示,UVB照射可通过增加炎症因子 TNF-α、IL-1β、IL-6和HMGB1的过量释放引起HaCaT细胞的炎症反应。
自噬是清除损伤蛋白和细胞器的有效形式[11]。研究表明,细胞可通过激活自噬来抵抗炎症[12]。LC3参与自噬体的形成,它的多少与自噬小泡数量成正比,所以LC3的表达可以反应自噬的活性[13]。Beclin1是参与自噬调控的重要基因,通过与ClassIII/PI3K形成复合物参与自噬体的形成[14]。本研究中,对HaCaT细胞系进行不同剂量UVB照射,结果显示,UVB照射HaCaT细胞可诱发自噬蛋白LC3和Beclin1的表达,且呈剂量依赖性增加。在进一步应用自噬诱导剂雷帕霉素和抑制剂3MA的实验中发现,自噬的诱发可以减少UVB导致的HaCaT细胞炎症因子 TNF-α、IL-1β、IL-6和HMGB1的过量释放,而自噬的抑制则进一步增加UVB照射的HaCaT 细 胞 炎 症 因 子 TNF-α、IL-1β、IL-6 和HMGB1的释放水平,提示通过自噬途径可调节UVB照射的HaCaT细胞炎症因子的释放。
近年来研究发现,氢气通过抗炎等作用发挥对疾病的治疗作用。氢气及富氢液通过抗炎反应、抗氧化和抗凋亡等作用,可减轻小鼠变应性皮炎炎症因子 TNF-α、IL-6、IL-17 和INF-γ 的释放[7]等。本研究中,氢气可以降低UVB照射的HaCaT细胞炎症因子 TNF-α、IL-1β、IL-6和HMGB1 的释放。此外,氢气还可以增加UVB照射的HaCaT细胞自噬蛋白LC3和Beclin1的表达。本文结果显示,通过给予UVB照射的HaCaT细胞雷帕霉素和富氢液处理,细胞炎症因子的释放减少,而给予UVB照射的细胞3MA和富氢液处理,细胞的炎症因子仍旧增加,表明3MA逆转了富氢液对UVB照射HaCaT细胞的抑制炎症因子释放的作用。氢气可能通过激活自噬,使UVB照射的细胞经过自噬途径裂解,裂解后细胞内容物释放并为新细胞的合成提供原料,而UVB导致的炎症因子释放也将随着细胞的裂解而减少或终止。可见氢气通过自噬蛋白的表达来反映自噬的激活,为细胞或组织正常生长提供重要的保障。
参考文献
[1]付兰,何黎.UVB对角质形成细胞产生细胞因子的影响[J].国际皮肤性病学杂志,2007,33(4):231-233.DOI:10.3760/cma.j.issn.1673-4173.2007.04.012.Fu L,He L.Effects of UVB on the production of cytoldnes by keratinocytes[J].Int J Dermatol Venereol,2007,33(4):231-233.DOI:10.3760/cma.j.issn.1673-4173.2007.04.012.
[2]Kim SB,Kang OH,Joung DK,et al.Anti-inflammatory effects of tectroside on UVB-induced HaCaT cells[J].Int J Mol Med,2013,31(6):1471-1476.DOI:10.3892/ijmm.2013.1343.
[3]Levine B,Mizushima N,Virgin HW.Autophagy in immunity and inflammation[J].Nature,2011,469 (7330):323-335.DOI:10.1038/nature09782.
[4]陈旭,张青松,鞠梅,等.中波紫外线诱导人皮肤成纤维细胞自噬对凋亡影响的初步研究[J].中华皮肤科杂志,2012,45(7):496-500.DOI:10.3760/cma.j.issn.0412-4030.2012.07.011.Chen X,Zhang QS,Ju M,et al.Effects of ultraviolet B-induced autophagy on apoptosis in human skin fibroblasts:a preliminary study[J].Chin J Dermatol,2012,45(7):496-500.DOI:10.3760/cma.j.issn.0412-4030.2012.07.011.
[5]黄丹,任发亮,陈旭,等.不同剂量中波紫外线照射对角质形成细胞增殖活力和自噬体表达影响的研究[J].中华皮肤科杂志,2013,46(12):881-884.DOI:10.3760/cma.j.issn.0412-4030.2013.12.010.Huang D,Ren FL,Chen X,et al.Effect of different doses of ultraviolet B on the proliferation of and autophagosome formation in keratinocytes[J].Chin J Dermatol,2013,46(12):881-884.DOI:10.3760/cma.j.issn.0412-4030.2013.12.010.
[6]Huang T,Wang W,Tu C,et al.Hydrogen-rich saline attenuates ischemia-reperfusion injury in skeletal muscle[J].J Surg Res,2015,194(2):471-480.DOI:10.1016/j.jss.2014.12.016.
[7]邢卫斌,付国俊,叶文静,等.氢气对中波紫外线致皮肤成纤维细胞氧化损伤的影响[J].中华皮肤科杂志,2013,46(6):424-426.DOI:10.3760/cma.j.issn.0412-4030.2013.06.015.Xing WB,Fu GJ,Ye WJ,et al.Effects of hydrogen on ultraviolet B-induced oxidative damage to skin fibroblasts[J].Chin J Dermatol,2013,46(6):424-426.DOI:10.3760/cma.j.issn.0412-4030.2013.06.015.
[8]Li IH,Ma KH,Weng SJ,et al.Autophagy activation is involved in 3,4-methylenedioxymethamphetamine (′ecstasy′)--induced neurotoxicity in cultured cortical neurons[J].PLoS One,2014,9(12):e116565.DOI:10.1371/journal.pone.0116565.
[9]金慧,陈旭,徐松,等.不同剂量中波紫外线对HaCaT细胞p62及自噬体形成关键基因Beclin-1、Atg12和Atg3的调控效应研究[J].中华皮肤科杂志,2014,47(4):233-236.DOI:10.3760/cma.j.issn.0412-4030.2014.04.001.Jin H,Chen X,Xu S,et al.Regulatory effects of different doses of ultraviolet B on the expressions of p62,Beclin-1,Atg12 and Atg3 in HaCaT cells[J].Chin J Dermatol,2014,47(4):233-236.DOI:10.3760/cma.j.issn.0412-4030.2014.04.001.
[10]Kondo S.The roles of cytokines in photoaging[J].J Dermatol Sci,2000,23 Suppl 1:S30-S36.
[11]Deretic V.A master conductor for aggregate clearance by autophagy[J].Dev Cell,2010,18 (5):694-696.DOI:10.1016/j.devcel.2010.04.009.
[12]吕小翠,周海燕.自噬与炎症及麻醉的关系[J].中华医学杂志,2011,91(22):1578-1580.DOI:10.3760/cma.j.issn.0376-2491.2011.22.020.Lyu XC,Zhou HY.Relationship of autophagy with inflammation and anesthesia[J].Natl Med J China,2011,91(22):1578-1580.DOI:10.3760/cma.j.issn.0376-2491.2011.22.020.
[13]Liu XH,Liu TB,Lin FC.Monitoring autophagy inMagnaporthe oryzae[J].MethodsEnzymol,2008,451:271-294.DOI:10.1016/S0076-6879(08)03219-9.
[14]Meijer AJ,Codogno P.Regulation and role of autophagy in mammalian cells[J].Int J Biochem Cell Biol,2004,36(12):2445-2462.DOI:10.1016/j.biocel.2004.02.002.
Hydrogen-rich liquid down-regulates the expressions of inflammatory factors by ultraviolet B-induced human HaCaT keratinocytes through the autophagy pathway
Zhang Bingxin,Xing Weibin,Fu Guojun,Chen Hongguang
Department of Dermatology,First Teaching Hospital of Tianjin University of Traditional Chinese Medicine,Tianjin 300193,China(Zhang BX);Department of Dermatology,Tianjin Fifth Centre Hospital,Tianjin 300450,China(Xing WB);Department of Dermatology,Cangzhou People′s Hospital,Cangzhou 061000,Hebei,China(Fu GJ);Department of Anesthesiology,Tianjin Medical University General Hospital,Tianjin 300052,China(Chen HG)
ObjectiveTo investigate whether hydrogen can regulate the expressions of inflammatory factors by ultraviolet B (UVB)-induced human HaCaT keratinocytes through the autophagy pathway.MethodsCultured HaCaT keratinocytes were divided into several groups:blank control group receiving no treatment,hydrogen group cultured in hydrogen-rich medium,three UVB groups irradiated with UVB at 1,10,50 mJ/cm2respectively,three UVB+hydrogen groups irradiated with UVB at 1,10,50 mJ/cm2respectively followed by culture in hydrogen-rich medium,UVB+3MA group pretreated with the autophagy inhibitor 3MA for 1 hour followed by UVB radiation at 50 mJ/cm2,UVB+rapamycin group pretreated with the autophagy activator rapamycin for 1 hour followed by UVB radiation at 50 mJ/cm2,UVB+3MA+hydrogen group pretreated with 3MA for 1 hour followed by UVB radiation at 50 mJ/cm2and culture in hydrogen-rich medium,UVB+rapamycin+hydrogen group pretreated with rapamycin for 1 hour followed by UVB radiation at 50 mJ/cm2and culture in hydrogen-rich medium.After additional culture with or without hydrogen for 12 hours,methyl thiazolyl tetrazolium (MTT)assay was performed to evaluate cellular proliferative activity,Western-blot analysis to measure the expressions of autophagy-associated protein 1 light chain 3(LC3)and Beclin1,and enzyme-linked immunosorbent assay(ELISA)to measure the supernatant levels of inflammatory factors including tumor necrosis factor (TNF)-α,interleukin(IL)-1β,IL-6 and high mobility group protein B1 (HMGB1),and a test kit was used to determine the level of lactate dehydrogenase(LDH).ResultsCompared with the blank control group,the 10-and 50-mJ/cm2UVB groups showed significantly increased release of LDH,expressions of LC3 and Beclin1 and supernatant levels of TNF-α,IL-1β,IL-6 and HMGB1,but decreased cellular proliferative activity(allP<0.05).Hydrogen significantly attenuated the release of LDH,down-regulated the supernatant levels of TNF-α,IL-1β,IL-6 and HMGB1,but up-regulated cellular proliferative activity as well as LC3 and Beclin1 expressions in the 10-and 50-mJ/cm2UVB+hydrogen groups compared with the 10-and 50-mJ/cm2UVB groups respectively (allP<0.05).In addition,the levels of TNF-α,IL-1β,IL-6 and HMGB1 were significantly higher in the 50-mJ/cm2UVB+3MA group than in the 50-mJ/cm2UVB group,and higher in the 50-mJ/cm2UVB+3MA+hydrogen group than in the 50-mJ/cm2UVB+hydrogen group,but lower in the 50-mJ/cm2UVB+rapamycin groupthaninthe50-mJ/cm2UVBgroup(allP<0.05).ConclusionUVBradiationcanincreasetheexpressionsofautophagyassociated proteins,and hydrogen-rich medium can down-regulate the expressions of inflammatory factors by UVB-induced HaCaT cells through the autophagy pathway.
Ultraviolet rays;Autophagy;Chemokines;Hydrogen;HaCaT cells
Xing Weibin,Email:xingweibin111@163.com
2015-04-20)
(本文编辑:吴晓初)
邢卫斌,Email:xingweibin111@163.com
10.3760/cma.j.issn.0412-4030.2016.02.010
国家自然科学基金(81101409、81471842)
Fund program:National Natural Science Foundation of China(81101409,81471842)
——雷帕霉素

