角质形成细胞无血清培养基条件下构建组织工程皮肤
林建红 汪宇 卢彬 刘志 江蕾微 王今朝 张伟 李世军 陆洪光
550004贵阳,贵州医科大学附属医院皮肤科(第一作者现在湖南省邵阳市第一人民医院皮肤科,422000)
角质形成细胞无血清培养基条件下构建组织工程皮肤
林建红 汪宇 卢彬 刘志 江蕾微 王今朝 张伟 李世军 陆洪光
550004贵阳,贵州医科大学附属医院皮肤科(第一作者现在湖南省邵阳市第一人民医院皮肤科,422000)
目的 探讨在角质形成细胞无血清培养基条件下,用人成纤维细胞、角质形成细胞和黑素细胞接种于人去表皮真皮构建组织工程皮肤。方法 胰酶和胶原酶消化处理健康小儿包皮,获得表皮和真皮细胞悬液。分别将角质形成细胞、黑素细胞传至第3代,成纤维细胞传至第5代,调整细胞密度为2.5×105/ml。制备人去表皮真皮(含部分基底膜成分),先将成纤维细胞悬液种于6孔板板底,24 h后将人去表皮真皮放入6孔板,角质形成细胞、黑素细胞悬液接种于人去表皮真皮表面(成纤维细胞、角质形成细胞、黑素细胞比例为1∶4∶1。实验组用角质形成细胞无血清培养基培养,对照组用含10%FBS的DMEM、K-SFM、M254,3种培养液比例为1∶1∶1的混合培养基培养,人去表皮真皮作为空白对照。液下培养3 d后,空气液面培养相结合的方式进行培养,每 3 天换液 1 次,2 周后取培养的组织工程皮肤分别行 HE 染色,Melan-A、S-100、HMB45、CKpan、P63、K5、K6、K14、Ki67、Vimentin、CollagenⅣ、Laminin免疫组化染色及PAS染色并取正常皮肤做阳性对照。结果 经过14 d的气液培养,实验组出现完整的新生表皮结构,CKpan、P63、K5、K6、K14、Ki67、Melan-A、S-100、HMB45、CollagenⅣ、Laminin免疫组化染色阳性;对照组出现完整的新生表皮结构,可见角质层,CKpan、P63、K5/6、K14、Ki67、Laminin免疫组化染色阳性。结论 角质形成细胞、黑素细胞及成纤维细胞与人去表皮真皮在角质形成细胞无血清培养基条件下,体外可构建组织工程皮肤。
皮肤;组织工程;培养基,无血清;成纤维细胞;黑素细胞;角蛋白细胞
体外构建组织工程皮肤因其能较好地模拟皮肤的生理功能甚至用于疾病的治疗而引起广泛关注,相继很多学者对此进行研究和改进[1-2]。大多皮肤模型构建均有血清成分的参与,始终存在潜在的风险。本实验在角质形成细胞无血清培养基(K-SFM)条件下用角质形成细胞(KC)、黑素细胞(MC)及成纤维细胞(Fb)共同体外构建组织工程皮肤。并通过对新生表皮进行表皮相关分化蛋白标记物进行免疫组化,对新生表皮的分化、增殖功能进行分析。
资料与方法
一、资料
1.主要试剂:K-SFM、EGF、BPE、M254、HMGS和高糖型DMEM培养基购自美国Gibico生物公司。Ⅳ型胶原酶购自北京索莱宝科技有限公司公司,胎牛血清购自美国Hyclone公司,谷氨酰胺和0.25%胰蛋白酶-0.01%EDTA购自美国Sigma公司。兔抗人CKpan多克隆抗体、兔抗人S100多克隆抗体、鼠抗人HMB45单克隆抗体、鼠抗人Melan-A单克隆抗体、鼠抗人P63单克隆抗体、鼠抗人Ki67单克隆抗体、即用型CK14鼠抗人单克隆抗体、即用型CK14鼠抗人单克隆抗体、4%甲醛固定液、柠檬酸磷酸盐修复液、即用型兔抗人蛋白基因产物9.5免疫组化多克隆抗体、即用型MaxVisionTM试剂及DAB显色液均由福州迈新生物技术有限公司生产。
2.主要仪器:CO2细胞培养箱3100型购自美国Thermo公司,CK40-F200型倒置显微镜购自日本Olympus公司,超净工作台购自苏州净化设备公司。自制组织培养支撑架[3]常规消毒灭菌处理后备用。
3.标本采集:贵州医科大学院附属医院小儿外科6~12岁患儿包皮环切术后的正常包皮组织。实验经本院伦理委员会批准,患者家属均签署知情同意书。
二、方法
1.KC、MC及Fb的分离培养:将包皮用无菌生理氯化钠溶液和聚维酮碘各冲洗2次,然后用含有双抗(含100U/ml青霉素和100 μg/ml链霉素)的PBS液冲洗包皮5次,将包皮剪成0.5 cm×1 cm的细长条,Dispase酶4℃消化16~18 h。18 h后将表皮与真皮分离,表皮用0.25%胰酶0.01%EDTA室温消化2~3 min,用10%FBS的DMEM终止消化,低速离心(224×g),用M-254重悬,计数板计数,调整细胞密度为2×106/ml,分别接种于一次性培养瓶中。真皮组织用0.2%Ⅳ型胶原酶37℃消化2~3 h,用含10%FBS的DMEM重悬,调整细胞密度为2×106/ml,接种于一次性培养瓶中。置于孵箱(5%CO2、37℃)中培养,24h后首次换液,每3天换液1次。15~20d后传代,取第3代KC、MC及第5代Fb进行实验。
2.细胞贴附情况观察:分别将KC、MC及Fb制成1×105/ml的细胞悬液,每3天换液1次,并在倒置显微镜下观察细胞贴附情况。
3.细胞爬片及抗 CKpan、L-Dopa及 Vimentin染色均由福州迈新生物技术开发有限公司完成。
4.去表皮真皮制备:标本来源于贵州医科大学附属医院急诊骨外科32岁男性截肢大腿处坏死组织周围正常皮肤。将皮下脂肪组织层剪除,制成1cm×1 cm皮片,在56℃PBS恒温水浴箱中浸泡30 min,用眼科镊分离真表皮,将真皮置于1.5 ml微量离心管中,迅速置入液氮中6~8 min,取出后室温放置30 min,如此重复10个循环,-20℃冰箱中保存备用[4],置于-20 ℃冰箱中保存备用。
5.KC、MC及Fb与去表皮真皮体外构建组织工程皮肤:取第5代密度为2.5×105/ml的Fb各8 μl分别接种于含相应培养基3 ml的两个6孔板中,其中一个用含等比例的10%DMEM、完全M-254、完全K-SFM培养,另外一个单独用完全K-SFM。将6孔板置于温箱(5%CO2、37℃)环境中孵育备用。24 h后,将经预处理的去表皮真皮,基底膜面向上置于板底含成纤维细胞的6孔板中,用移液器将第3代密度为 2.5×105/ml MC、KC细胞悬液各 8 μl、32 μl接种于去表皮真皮上,将6孔板置于温箱(5%CO2、37℃)环境中孵育,以促使 MC、KC紧密地贴附于去表皮真皮。4 h后,实验组加入单一无血清的完全K-SFM培养基,对照组加入等比例的10%FBS的DMEM培养基、完全M-254培养基以及无血清的完全K-SFM培养基共3 ml,使之浸没去表皮真皮,置于温箱(5%CO2、37℃)中培养,每 2、3天换液1次。上述两组分别用不添加任何细胞的去表皮真皮作为阴性对照。
6.组织工程皮肤HE染色及Melan-A、S-100、HMB45、CKpan、P63、CK14、CK5/6、Ki67、Vimentin、CollagenⅣ、Laminin免疫组化染色,正常人乳房皮肤作为阳性对照,HE及免疫组化染色均由福州迈新生物技术开发有限公司完成。
结 果
1.细胞贴附情况:第3代MC培养7 d后,轮廓清楚、折光性好,形态多样,主要呈树突状,见图1。第3代KC培养5 d后呈典型上皮细胞铺路石样,见图2。第5代FBs培养5 d后,生长排列多呈放射状、编织状或漩涡状走行,见图3。
2.KC、MC及Fb爬片免疫组化检测:KC行CKpan免疫组化染色示胞质呈棕黄色阳性着色,见图4A。MC行L-Dopa染色,L-Dopa染色示细胞呈黑色,见图4B。Fb行vimentin免疫组化染色示胞质呈棕黄色阳性着色,见图4C。
3.培养2周后HE染色:实验组组织工程皮肤表皮结构清晰,排列整齐,未见颗粒层、透明层,部分细胞胞质空泡化,见图5A,5B。对照组组织工程皮肤表皮结构清晰,层次分明,角质层角化不完全,见图5D,5E。各组空白对照去表皮真皮无细胞生长,见图5C,5F。正常皮肤表皮结构清晰,层次分明,见图 5G,5H。
4.Melan-A、S-100、HMB45、CKpan、P63、CK14、CK5/6、Ki67、Vimentin、CollagenⅣ、Laminin 染色:组织工程皮肤及正常皮肤可见表皮细胞胞质CKpan免疫组化染色表皮细胞均呈阳性反应,胞质呈棕黄色,见图6A~6C。组织工程皮肤及正常皮肤P63免疫组化,可见表皮基底层、棘层部分细胞呈阳性反应,细胞核呈棕黄色,见图7A~7C。CK14免疫组化,可见实验组、正常组基底层、棘层细胞胞质呈棕红色,对照组表皮全层细胞胞质阳性。CK5/6免疫组化显示实验组、正常皮肤表皮胞质呈棕黄色阳性反应。组织工程皮肤及正常皮肤Ki67免疫组化,可见表皮基底层、棘层部分细胞呈阳性反应,细胞核呈棕红色,见图8A~8C。Mel-A、S-100、HMB-45染色,实验组可见表皮基底层部分细胞呈阳性反应,细胞质呈棕黄色。对照组阴性。正常皮肤Mel-A、S-100、HMB-45阳性对照,可见表皮基底层部分细胞呈阳性反应,细胞质呈棕黄色。
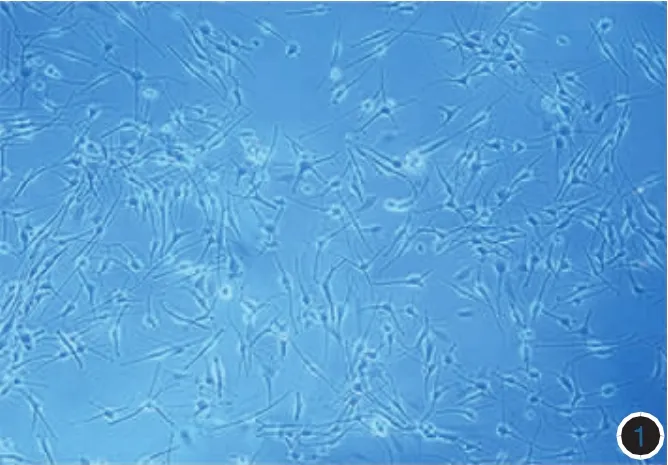
图1 培养7 d,第3代黑素细胞轮廓清楚、折光性好,形态多样,主要呈树突状(倒置显微镜×100)
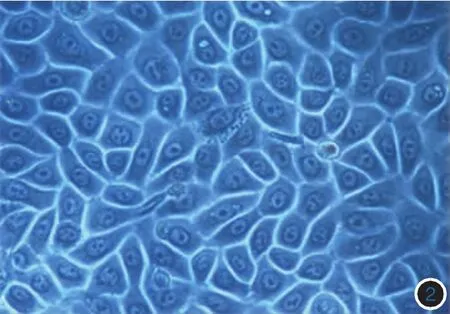
图2 培养5 d,第3代角质形成细胞呈典型上皮细胞铺路石样(倒置显微镜×400)

图3 培养5 d,第5代成纤维细胞呈放射状、编织状或漩涡状走行(倒置显微镜×100)

图4 4A:第3代角质形成细胞胞质呈棕黄色阳性着色(CKpan免疫组化×200);4B:第3代黑素细胞呈树突状,细胞呈黑色(L-Dopa染色×400);4C:第5代成纤维细胞胞质呈棕黄色阳性着色(Vimentin免疫组化×200)
讨 论
尽管有研究将培养的KC组织工程皮肤用于疾病的治疗[5-6],实际上在体外进行扩增或构建人工皮肤时,添加了血清的成分促进其分化与增殖,而血清中所含生长因子和生长激素的含量变化大,且成分极为复杂,不利于组织工程皮肤生长及安全性的调控[7]。本实验使用的K-SFM,成分包含表皮生长因子和牛脑垂体提取物,有促进角质形成细胞的增值、分化[8]和迁移[9]。其中不含血清成分,并且已证明可用于角质形成细胞的体外扩增培养[10-11]。利用无血清培养基体外构建组织工程皮肤除了获得临床治疗上的优势外,还可为进一步研究KC、MC及Fb旁分泌之间的关系提供了研究基础。除此之外,在体外构建组织工程皮肤,细胞支架及基质(即真皮替代物)在体外构建组织工程皮肤过程中对诱导细胞发育成完整的表皮结构起到重要的作用。我们选用的去表皮真皮支架是经过一系列处理后将去表皮的真皮组织细胞杀死,去表皮真皮表面及真皮内残留的附属器导管内存在丰富的粘多糖,保留部分基底膜及胶原蛋白成分,完整地保持了真皮胶原纤维和弹性纤维的结构[4]。可能为诱导表皮生长发育提供了微环境,不仅有利于种子细胞的黏附、发育和分化,而且其生物相容性好。

图5 第14天,实验组组织工程皮肤表皮结构清晰,排列整齐,未见颗粒层、透明层,部分细胞胞质空泡化(5A:HE×100;5B:HE×400);5C:实验组去表皮的真皮空白对照,无表皮生长(HE×200)。第14天对照组组织工程皮肤表皮结构清晰,层次分明,角质层角化不完全。(5D:HE×40;5E:HE×200);5F:对照组去表皮的真皮空白对照,无表皮生长(HE×200)。正常皮肤组织表皮结构清晰,层次分明(5G:HE×40;5H:HE × 200)
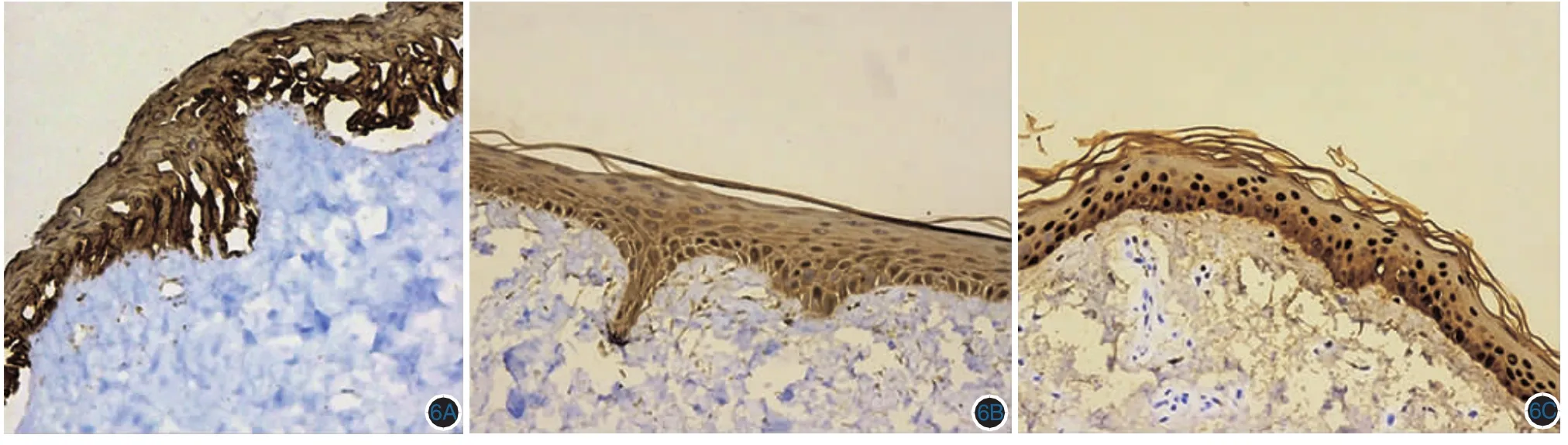
图6 实验组组织工程皮肤(6A)、对照组组织工程皮肤(6B)、正常皮肤组织(6C)CKpan免疫组化染色,胞质呈棕黄色(免疫组化×200)
KC与Fb之间有完整的作用通路:一方面,KC分泌IL-1促进Fb分泌IL-6、IL-8、角质形成细胞生长因子、粒细胞-巨噬细胞集落刺激因子等,这些因子可促进KC的分化与增殖。另一方面,KC分泌甲状旁腺素相关肽,增加Fb分泌角质形成细胞生长因子,角质形成细胞生长因子反过来作用于KC促进其分化与增殖[12]。前期[10]研究提示,Fb 不能通过去表皮真皮表面往真皮层生长或者进入真皮层的细胞较少,所以,我们将Fb种于培养板底,通过细胞分泌的相关因子来相互影响重建皮肤组织表皮细胞的生长。
通过对K-SFM培养基培养的KC、MC及Fb体外构建的组织工程皮肤新生细胞相关标记蛋白进行免疫组化分析。结果表明,在K-SFM完全培养基培养下,KC、MC及Fb体外构建的新生表皮具有类似于正常皮肤的分化、增殖功能以及黑素细胞的存在使色素修复成为可能,这些均为临床应用提供了基础。
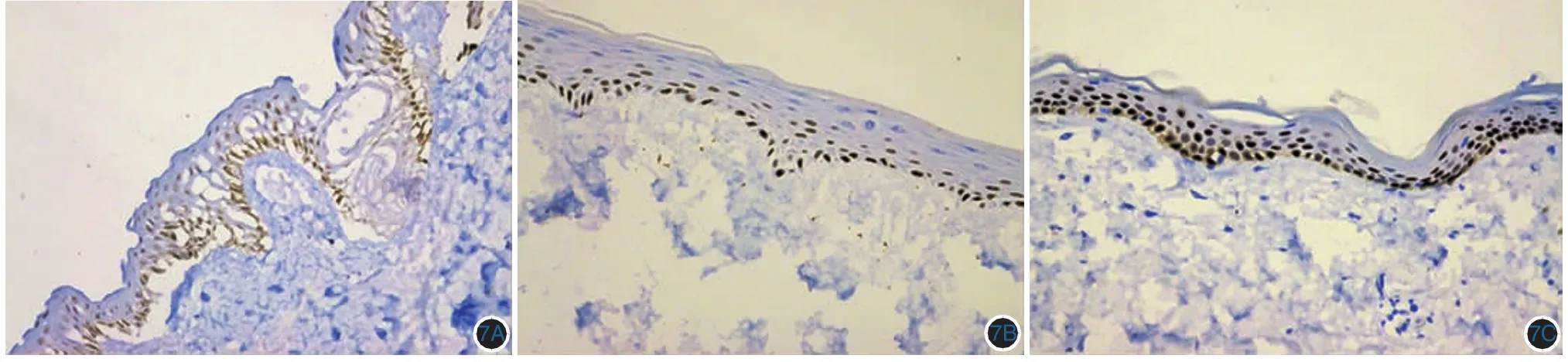
图7 实验组组织工程皮肤(7A)、对照组组织工程皮肤(7B)、正常皮肤组织(7C)表皮基底层、部分棘层细胞P63表达,细胞核呈棕黄色(免疫组化×200)

图8 实验组组织工程皮肤(8A)、对照组组织工程皮肤(8B)、正常皮肤组织(8C)表皮基底层、部分棘层细胞Ki67表达,细胞核呈棕红色(免疫组化×400)
[1]Bullock AJ,Higham MC,MacNeil S.Use of human fibroblasts in the development of a xenobiotic-free culture and delivery system for human keratinocytes[J].Tissue Eng,2006,12(2):245-255.DOI:10.1089/ten.2006.12.245.
[2]Coolen NA,Verkerk M,Reijnen L,et al.Culture of keratinocytes for transplantation without the need of feeder layer cells[J].Cell Transplant,2007,16(6):649-661.DOI:http://dx.doi.org/10.3727/000000007783465046.
[3]Halaban R,Ghosh S,Duray P,et al.Human melanocytes cultuerd from nevi and melanomas[J].Invest Dermatol,1986(87):95-101.DOI:10.1111/1523-1747.ep12523594.
[4]Onuma H,Mastui C,Morohashi M.Quantitative analysis of the proliferation of epidermal cells using a human skin organ culture system and the effect of DbcAMP using markers of proliferation(BrdU,Ki-67,PCNA)[J].Arch Dermatol Res,2001,293(3):133-138.DOI:10.1007/s004030000195.
[5]Nayak S,Dey S,Kundu SC.Skin equivalent tissue-engineered construct:co-cultured fibroblasts/keratinocytes on 3d matrices of sericin hope cocoons[J].PloS One,2013,8 (9):e74779.DOI:10.1371/journal.pone.0074779.eCollection 2013.
[6]Varkey M,Ding J,Tredget EE,et al.The effect of keratinocytes on the biomechanical characteristics and pore microstructure of tissue engineered skin using deep dermal fibroblasts[J].Biomaterials,2014,35(36):9591-9598.DOI:10.1016/j.biomaterials.2014.07.048.
[7]Noser FK,Limat A.Organotypic culture of outer root sheath cells from human hair follicles using a new culture device[J].In Vitro Cell Dev Biol,1987,23(8):541-545.DOI:10.1007/BF02620971.
[8]Shipley GD,Keeble WW,Hendrickson J E,et al.Growth of normal human keratinocytes and fibroblasts in serum-free medium is stimulated by acidic and basic fibroblast growth factor[J].J Cell Physiol,1989,138(3):511-518.DOI:10.1002/jcp.1041380310.
[9]Sogabe Y,Abe M,Yokoyama Y,et al.Basic fibroblast growth factor stimulates human keratinocyte motility by Rac activation[J].Wound Repair Regen,2006,14 (4):457-462.DOI:10.1111/j.1743-6109.2006.00143.x.
[10]陆洪光,郭哲,崔绍山,等.表皮体外重建模型的研究[J].中华皮肤科杂志,2005,38(12):738-740.DOI:10.3760/j.issn:0412-4030.2005.12.007.Lu HG,Guo Z,Cui SS,et al.A study of reconstructed human epidermis modelin vitro[J].Chin J Dermatol,2005,38(12):738-740.DOI:10.3760/j.issn:0412-4030.2005.12.007.
[11]Boyce ST,Ham RG.Cultivation,frozen storage,and clonal growth of normal human epidermal keratinocytes in serum-free media[J].J Tissue CultMethods,1985,9 (2):83-93.DOI:10.1007/BF01797779.
[12]Taniguchi K,Arima K,Masuoka M,et al.Periostin controls keratinocyte proliferation and differentiation by interacting with the paracrine IL-1α/IL-6 loop[J].J Invest Dermatol,2014,134(5):1295-1304.DOI:10.1038/jid.2013.500.
Reconstruction of tissue-engineered skin using keratinocyte serum-free medium
Lin Jianhong,Wang Yu,Lu Bin,Liu Zhi,Jiang Leiwei,Wang Jinzhao,Zhang Wei,Li Shijun,Lu Hongguang
Department of Dermatology,Affiliated Hospital of Guizhou Medical University,Guiyang 550004,China(the current affiliation of the first author was Department of Dermatology,First People′s Hospital of Shaoyang,Shaoyang 422000,Hunan,China)
ObjectiveTo reconstruct tissue-engineered skin by co-culture of human fibroblasts,keratinocytes and melanocytes on human de-epidermized dermis with keratinocyte serum-free medium (K-SFM).MethodsHealthy children′s prepuce tissues were treated with pancreatin and collagenase to prepare epidermal and dermal cell suspensions respectively.After keratinocytes and melanocytes were cultured separately up to passage 3 and fibroblasts up to passage 5,the density of these cells was adjusted to 2.5×105/mlfor the following experiment.Human de-epidermized dermis containing some components of the basement membrane was prepared.Firstly,fibroblast suspensions were seeded at the bottom of 6-well plates followed by 24-hour culture.Subsequently,the prepared de-epidermized dermis was added into the 6-well plates,then,keratinocyte and melanocyte suspensions were seeded on the surface of the de-epidermized dermis with the melanocyte∶keratinocyte∶fibroblast ratio being 1∶4∶1.After 4 hours of culture,the cell mixtures were divided into two groups:an experimental group cultured with K-SFM,a control group cultured with a mixed medium containing DMEM with 10%fetal bovine serum,K-SFM and M254 at a ratio of 1 ∶1∶1.De-epidermized dermis cultured with K-SFM or the mixed medium alone served as blank control groups.After submerged cultivation for 3 days,the tissue cultures were maintained at an air-liquid interface for another 11 days with the culture medium changed every 3 days.Finally,these cultures were subjected to hematoxylin and eosin staining,periodic acid-Schiff(PAS)staining and immunohistochemical staining for Melan-A,S-100,HMB45,cytokeratin-Pan,P63,K5,K6,K14,Ki67,vimentin,collagenⅣand laminin.ResultsAfter 14-day submerged and air-liquid interface culture,a well-structured epidermis developed in both the experimental group and control group with the formation of the stratum corneum.The immunohistochemical study showed positive staining for cytokeratin-Pan,P63,K5,K6,K14,Ki67,laminin in both the experimental group and control group,but positive staining for Melan-A,S-100,HMB45 and collagenⅣin only the experimental group.ConclusionTissue-engineered skin can be constructed using keratinocytes,melanocytes and fibroblasts co-cultured on de-epidermized dermis with K-SFMin vitro.
Skin;Tissue engineering;Culture media,serum-free;Fibroblasts;Melanocytes;Keratinocytes
Lu Hongguang,Email:hongguanglu@hotmail.com
2015-06-08)
(本文编辑:吴晓初)
陆洪光,Email:hongguanglu@hotmail.com
10.3760/cma.j.issn.0412-4030.2016.02.006

