燃烧法可控制备Eu3+-Eu2+共存Ca12Al14O32F2荧光粉及其荧光性能的研究
陈彩花, 彭海龙, 梁利芳, 蒙丽丽, 张丽霞
(广西师范学院 化学与材料科学学院, 广西 南宁 530001)
燃烧法可控制备Eu3+-Eu2+共存Ca12Al14O32F2荧光粉及其荧光性能的研究
陈彩花, 彭海龙, 梁利芳*, 蒙丽丽, 张丽霞
(广西师范学院 化学与材料科学学院, 广西 南宁530001)
采用燃烧法合成Ca12-xAl14O32F2∶xEu荧光粉,对样品进行了X射线粉末衍射(XRD)、X射线光电子能谱(XPS)、扫描电镜(SEM)以及光致发光光谱等表征,探讨了燃烧温度、氟化铵、尿素、硼酸以及铕浓度等合成条件对荧光性能的影响。研究结果表明,利用燃烧法可以合成Eu3+-Eu2+共存、发光可调的荧光粉。通过改变合成条件,改变Eu2+和Eu3+的比例,荧光粉的发光颜色可表现为白光-橙红色-蓝白光-淡紫色-深蓝色-淡蓝色等变化。
Ca12Al14O32F2; Eu3+-Eu2+; 燃烧法可控合成; 发光材料
1 引 言
Eu3+和Eu2+离子作为重要的激活剂常用于荧光粉的合成。Eu3+离子受制于f-f跃迁禁阻,不利于吸收激发能量,其光谱呈狭窄线状,谱线强度较低。Eu2+的基态价电子构型为4f65d1,5d轨道裸露在外,容易受环境的影响,4f65d1→4f7的跃迁发射呈宽带,强度较高,发射光谱随基质组成、结构的改变而发生改变,且激发光谱位于近紫外区。如果在荧光基质中使Eu3+和Eu2+共存,则可以同时利用二者的荧光特点,改善荧光粉的发光性能,甚至有可能得到单一基质的白光荧光粉。近年来有不少文献报道Eu3+和Eu2+共存的体系,比如磷酸盐[1-2]、硼酸盐[3-6]、硅酸盐[7-10]和铝酸盐[11-13]等,对于氟氧化物体系,这方面的报道很少。所报道的Eu3+和Eu2+共存体系,主要以高温固相合成为主,多数是在还原条件得到[1,4-8,10-13],少数则在氧化氛围中生成[2-3,9]。
燃烧法是一种湿化学合成方法,因其反应温度低、时间短、却又易于得到纯相等优点,常被用于合成氧化物、硼酸盐、硅酸盐和铝酸盐等物质[14]。本研究以金属硝酸盐为氧化剂、尿素和氟化铵为还原剂、氟化铵为氟化剂,采用燃烧法合成Eu3+-Eu2+共存的氟氧化物Ca12-xAl14O32F2∶xEu荧光粉,利用XRD、荧光光谱、XPS和扫描电镜进行表征,研究了反应温度、NH4F、硼酸、尿素和激活剂Eu等合成条件对Ca12-xAl14O32F2∶xEu荧光性能的影响。
2 实 验
根据Ca12-xAl14O32F2∶xEu(x=0.12~0.72)的化学计量比,以合成0.5 mmol目标产物Ca11.64-Al14O32F2∶0.36Eu为例,将5.82 mmol的Ca(NO3)2·4H2O (AR)、7.00 mmol的Al(NO3)3·9H2O (AR)和1.80 mL浓度为 0.10 mol·L-1的Eu(NO3)3溶液放于坩埚中,加入一定量的NH4F (AR)(1.0~5.0 mmol,作用是提供氟源和还原气体NH3)、一定量的燃烧剂尿素 (AR)(尿素和硝酸盐的质量比m(尿素)∶m(硝酸盐)=0.5~3.0)和一定量的助溶剂H3BO3(AR)(cB为硼酸的量与产物的量的比值,cB=0~0.6),添加少量蒸馏水使坩埚混合相体积大约为6~7 mL,超声波振荡15 min,得到透明的前驱体。将前驱体迅速放入一定温度(700~1 000 ℃)的箱式马弗炉中燃烧10 min,取出,冷却,研磨,得目标产物。
采用XD-3型X射线仪(XRD,北京普析)测试物相结构,辐射源为铜靶 Kα射线(λ=0.154 06 nm),管电压为36 kV,管电流为25 mA,扫描速度8(°)/min,扫描范围 2θ=10°~80°,步宽为 0.02°。采用日本岛津RF-5301PC型荧光光谱仪和日立F-2500型荧光光谱仪测试荧光性能,激发光源采用 150 W的氙气灯,扫描范围为220~730 nm。采用德国蔡司ZEISS-EVO18电子扫描显微镜(SEM)分析样品形貌,加速电压为10.0 kV,分辨率为2 μm,放大倍数为5 000。采用美国Thermo Electron 250Xi型X射线光电子能谱(XPS)分析样品组分,单色A1 Kα,hν=1 486.6 eV,工作电压为250 V,功率为150 W,束斑尺寸为500 μm。
3 结果与讨论
图1(a)是Ca11.64Al14O32F2∶0.36Eu的XPS 图,样品中的Ca、Al、O、F和Eu 5种元素均被检测出来。由于Eu的掺杂浓度较低,所以Eu3d5/2和Eu3d3/2结合能的相对强度较弱。图1(b) 显示样品Ca11.64Al14O32F2∶0.36Eu中F和O表面原子含量随NH4F量的变化情况,当NH4F添加量从0.5 mmol增加到2.5 mmol时, F摩尔分数从6.21%增加到27.73%,而O摩尔分数从54.99%降低到32.08%,表明随着NH4F添加量的增加,形成了富含F的化合物。
图2(a~d)为不同条件下合成的Ca11.64Al14-O32F2∶0.36Eu样品的XRD图谱。由图2(a)可知,在900 ℃下,改变NH4F添加量所合成的样品基本为立方纯相,与标准图谱(JCPDS No. 53-1232)对比,衍射角有明显移动。随着NH4F添加量的增加,2θ从46.74°增大到47.00°,且衍射强度增大(图2(b))。这是因为氟离子的半径(r=0.133 nm)小于氧离子(r=0.14 nm),随着氟化铵添加量的增大,晶面间距d减小,衍射角θ增大。这进一步说明增加氟化铵的量可形成富含F的样品,与图1(b)的结果相符。由图2(c)可知,添加不同尿素所合成样品的XRD图谱有所差异,当m(尿素)∶m(硝酸盐)=1.0, 1.5, 2.0时与标准谱基本符合;而当m(尿素)∶m(硝酸盐)=0.5, 2.5, 3.0时,18°左右的衍射峰不明显或缺失,说明尿素用量过少或过多对产物均有不良影响。因此,我们选择m(尿素)∶m(硝酸盐)=1.5作为尿素添加量。由图2(d)可知,在700~1 000 ℃范围所合成样品基本为纯相。1 000 ℃下所合成样品的SEM图显示(图2(e)),样品颗粒大小不均匀,外形无规则,原因可能是燃烧时温度急剧升高,影响了晶体生成。
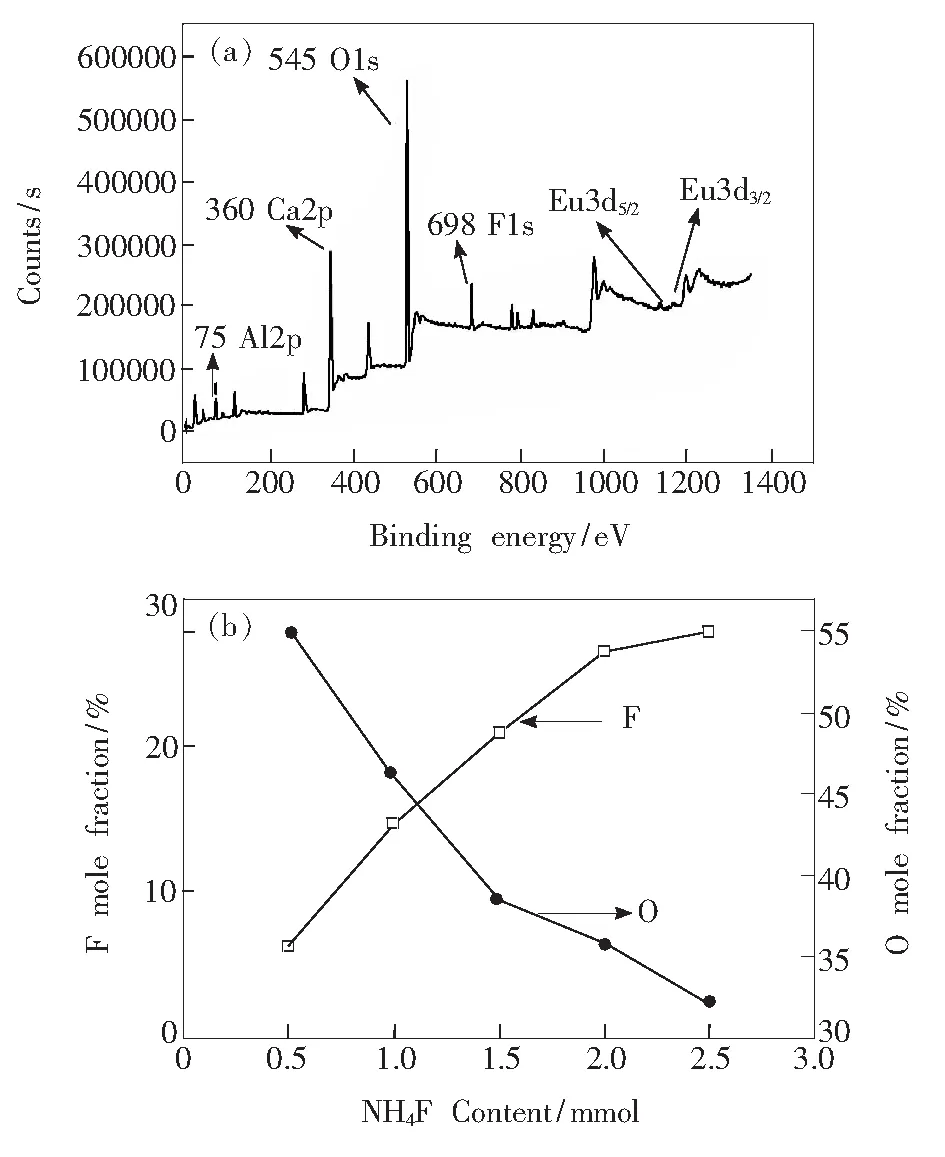
图1(a) Ca11.64Al14O32F2∶0.36Eu的XPS图谱;(b) Ca11.64Al14O32F2∶0.36Eu中F和O表面摩尔分数随NH4F用量的变化(900 ℃)。
Fig.1(a) XPS spectrum of Ca11.64Al14O32F2∶0.36Eu. (b) Surface mole fraction of elemental fluorine and oxygenvs. amount of NH4F added in the synthesis (900 ℃).

图2改变NH4F添加量(900 ℃)(a,b)、改变尿素添加量(900 ℃)(c)、改变温度(d)条件下制备的Ca11.64Al14O32F2∶0.36Eu的XRD图谱,以及Ca11.64Al14O32F2∶0.36Eu的SEM图 (1 000 ℃) (e)。
Fig.2XRD patterns of Ca11.64Al14O32F2∶0.36Eu with different content of NH4F (900 ℃) (a,b), different content of urea (900 ℃) (c), different combusted temperature (d), and SEM micrograph of Ca11.64Al14O32F2∶0.36Eu (1 000 ℃) (e).
图3为Ca11.64Al14O32F2∶0.36Eu的激发光谱。监测波长为438 nm时,激发峰由一个220~280 nm的弱带和一个280~400 nm的强带组成,前者归属于O2--Eu3+的电荷迁移吸收,后者归属于Eu2+的4f-5d能级跃迁吸收。监测波长为611 nm的激发峰由位于220~280 nm的强带(激发主峰位于240 nm附近)和360~400 nm附近的极弱峰组成,前者归属于O2--Eu3+的电荷迁移吸收,后者归属于Eu3+的4f-4f跃迁。
图4为不同NH4F添加量下合成的Ca11.64-Al14O32F2∶0.36Eu的发射光谱以及对应的CIE色度坐标。在239 nm光激发下(图4(a)),样品发射弱的蓝光(400~500 nm)和强的红光(580~620 nm),蓝光宽峰归属于Eu2+的4f65d1→4f7跃迁,红光锐锋归属于Eu3+的5D0→7F0(588 nm)、5D0→7F1(597 nm)和5D0→7F2(611 nm)跃迁[15]。在合成过程中,部分Eu3+被原料中的NH4+和尿素还原成Eu2+,所合成样品中Eu2+和Eu3+共存。在239 nm光激发下,体系吸收主要是O2--Eu3+的电荷迁移,导致Eu3+的发光强于Eu2+。随着NH4F量的增加,荧光粉的红光强度先升高后降低,在NH4F用量为3.0 mmol时发光强度最大。改变NH4F的添加量,Ca11.64Al14O32F2∶0.36Eu的色坐标由(0.371 7, 0.338 1)变化到(0.426 7, 0.335 7),再到(0.382 3, 0.273 1),发光颜色由白色调节到橙黄色再到淡紫色(图4(b))。在334 nm光激发下(图4(c)),荧光粉主要发射400~520 nm范围的蓝光。随着NH4F量的增加,发光强度逐渐增强而后降低,在NH4F用量为4.0 mmol时达到最大。由于NH4+具有还原性,随着NH4F用量的增加,更多的Eu3+被还原为Eu2+,蓝光强度在NH4F用量为5.0 mmol时降低,可能是Eu2+浓度过高致使荧光猝灭。随着NH4F添加量的增加, Ca11.64Al14O32F2∶0.36Eu的色坐标由(0.220 9, 0.273 6)变化到(0.154 9, 0.048 9),荧光粉的发光颜色由蓝绿色调节到深蓝色(图4(d))。在391 nm光激发下(图4(e)),样品发射400~500 nm范围的蓝光和580~620 nm范围的红光。随着NH4F量的增加,不管是蓝光还是红光,发光均先增强后减弱,并在NH4F用量为3.0 mmol时达到最强,但在低浓度时红光强度大于蓝光,高浓度时则相反。原因在于在391 nm光激发下,Eu2+和Eu3+均可被激发而发光。增加NH4F的用量,Ca11.64Al14O32F2∶0.36Eu的色坐标由(0.287 2, 0.215 0)变化到(0.315 4, 0.274 6),再到(0.169 5, 0.069 2),发光颜色由蓝绿色变化到蓝白色,再到深蓝色(图4(f))。

图3Ca11.64Al14O32F2∶0.36Eu的激发光谱。(a)λem=611 nm;(b)λem=438 nm。
Fig.3Excitation spectra of Ca11.64Al14O32F2∶0.36Eu. (a)λem=611 nm. (b)λem=438 nm.

图4不同NH4F 添加量下合成的Ca11.64Al14O32F2∶0.36Eu的发射光谱及对应的CIE色度坐标。(a, b)λex=239 nm; (c, d)λex=334 nm;(e, f)λex=391 nm。
Fig.4Emission spectra and CIE chromaticity diagrams of Ca11.64Al14O32F2∶0.36Eu.(a,b)λex=239 nm.(c,d)λex=334 nm.(e,f)λex=391 nm.
图5为NH4F用量为3.0 mmol时在900 ℃下合成的Ca11.64Al14O32F2∶0.36Eu在不同波长(λex=230 ~392 nm)光激发下的发射光谱及其对应的CIE色坐标。由图5(a)可知,当λex增大时,红光和蓝光的强度均先增大后减小。当λex=240 nm时,红光最强;当λex=330 nm时,蓝光最强。在不同波长激发下,红光和蓝光强度的比值I红/I蓝呈现明显的变化(图5(c))。当λex由230 nm增大到330 nm时,I红/I蓝从5.045急剧减小到0.011;当λex继续增大到392 nm时,I红/I蓝缓慢增大到0.235。由图5(b)可知,当λex由230 nm增大到392 nm时,荧光粉的CIE色坐标从(0.396 8, 0.310 8)变到(0.201 6, 0.151 4),发光颜色由橙红色变化到淡紫色,再到深蓝色,最后到淡蓝色。

图5Ca11.64Al14O32F2∶0.36Eu在不同波长激发下的发射光谱(a)及其对应的CIE色度坐标(b)
Fig.5Emission spectra excitated by different wavelengths (a) and CIE chromaticity diagram (b) of Ca11.64-Al14O32F2∶0.36Eu

图6不同温度下合成的Ca11.64Al14O32F2∶0.36Eu的发射光谱及对应的CIE色坐标。(a,b)λex=244 nm; (c,d)λex=334 nm。
Fig.6Emission spectra and CIE chromaticity diagrams of Ca11.64Al14O32F2∶0.36Eu obtained at different temperature. (a,b)λex=244 nm. (c,d)λex=334 nm.
图6为不同温度下合成的Ca11.64Al14O32F2∶0.36Eu的发射光谱及其对应的CIE色坐标。在244 nm光激发下(图6(a,b)),蓝光随温度升高而逐渐减弱,红光则逐渐增强,发光颜色从淡紫色变化到橙红色。在334 nm光激发下(图6(c,d)),随着温度的升高,蓝光逐渐减弱,发光颜色从深蓝色变化为浅蓝色。说明随着温度的升高,样品中Eu2+的量减少,而Eu3+的量增加。

图7不同尿素添加量下合成的Ca11.64Al14O32F2∶0.36Eu的发射光谱。(a)λex=241 nm;(b)λex=336 nm;(c)λex=392 nm。
Fig.7Emission spectra of Ca11.64Al14O32F2∶0.36Eu prepared with different additions of urea. (a)λex=241 nm. (b)λex=336 nm. (c)λex=392 nm.
图7为不同尿素添加量下合成的Ca11.64Al14-O32F2∶0.36Eu的发射光谱。随着尿素量的增加,在241 nm光激发下(图7(a)),红光和蓝光均逐渐增强而后减弱,并在m(尿素)∶m(硝酸盐)=1.5时达到最强;在336 nm光激发下(图7(b)),蓝光逐渐增强而后减弱,在m(尿素)∶m(硝酸盐)=2.0时达到最强;在392 nm光激发下(图7(c)),蓝光逐渐增强而后减弱,在m(尿素)∶m(硝酸盐)=1.5时达到最强,而红光则一直增强。尿素做为燃烧剂,在消耗氧气的同时,其氨基或产物在某种程度上起还原或保护作用,和铵离子一起共同还原Eu3+离子。
图8为Eu浓度对Ca12-xAl14O32F2∶xEu发光性能的影响。在241 nm光激发下(图8(a)),红光明显强于蓝光。随着Eu浓度的增加,红光逐渐增强而后减弱,在Eu用量为0.60 mmol时达到最强,而蓝光则逐渐减弱。在336 nm光激发下(图8(b)),蓝光随着Eu浓度的增加逐渐减弱。这是因为在NH4F和尿素用量相同情况下,随着Eu浓度的增加,被还原的Eu2+所占的比率逐渐减少,发光强度逐渐降低。
图9为不同硼酸添加量下合成的Ca11.64Al14O32F2∶=336 nm.0.36Eu的发射光谱。在241 nm光激发下(图9(a)),随着硼酸用量的增加,蓝光和红光的强度均逐渐增大而后减小,当cB=0.3时,发光强度达到最大。在332 nm光激发下(图9(b)),蓝光随着硼酸的增加逐渐增强而后减弱,当cB=0.3时,发光最强。硼酸是助溶剂,加入一定量的硼酸可以促进产物的晶体生长,提高发光强度。

图8Ca12-xAl14O32F2∶xEu的发射光谱。 (a)λex=241 nm;(b)λex=336 nm。
Fig.8Emission spectra of Ca12-xAl14O32F2∶xEu. (a)λex=241 nm. (b)λex

图9 不同硼酸添加量下合成的Ca11.64Al14O32F2∶0.36Eu的发射光谱。(a) λex=241 nm;(b) λex=332 nm。
Fig.9Emission spectra of Ca11.64Al14O32F2∶0.36Eu synthesized with different amount of boric acid. (a)λex=241 nm. (b)λex=332 nm.
4 结 论
采用燃烧法合成了Eu3+-Eu2+共存、发光性能可调的Ca12-xAl14O32F2∶xEu荧光粉。通过改变燃烧温度以及氟化铵、尿素、铕离子以及硼酸的添加量,使掺杂的Eu3+得到不同程度的还原,得到Eu3+-Eu2+共存的荧光粉。其中合成0.5 mmol目标产物的最佳条件为:氟化铵用量3.0 mmol,m(尿素)∶m(硝酸盐)=1.5,硼酸用量0.3。燃
烧温度为700 ℃时,Eu2+的蓝光发射明显;而燃烧温度为1 000 ℃时,Eu3+的红光发射明显。由于Eu2+和Eu3+的共存,激发峰涵盖所有的近紫外区,在不同波长激发下可以得到不同的发光效果。激发波长为336 nm时,主要发射蓝光;而当激发波长为240 nm和391 nm时,可以得到强度相当的蓝光和红光。通过改变合成条件及Eu2+和Eu3+的比例,荧光粉的发光颜色可表现为白光-橙红色-蓝白光-淡紫色-深蓝色-淡蓝色等变化。
[1] YU R J, WANG J, ZHAO Z,etal.. Structure and tunable blue-white-red luminescence of Eu2+/Eu3+-doped Na5Al(PO4)2F2single-phase phosphor [J].Mater.Lett., 2015, 160:294-297.
[2] ZHANG J C, LONG Y Z, ZHANG H D,etal.. Eu2+/Eu3+-emission-ratio-tunable CaZr(PO4)2∶Eu phosphors synthesized in air atmosphere for potential white light-emitting deep UV LEDs [J].J.Mater.Chem. C, 2014, 2(2):312-318.
[3] PEI Z, ZENG Q, SU Q. A study on the mechanism of the abnormal reduction of Eu3+→Eu2+in Sr2B5O9Cl prepared in air at high temperature [J].J.SolidStateChem., 1999, 145(1):212-215.
[4] HOU J S, JIANG W Z, FANG Y Z,etal.. Red, green and blue emissions coexistence in white-light-emitting Ca11(SiO4)4(BO3)2∶Ce3+, Eu2+, Eu3+phosphor [J].J.Mater.Chem. C, 2013, 1(37):5892-5898.
[5] XU S C, LI P L, WANG Z J,etal.. Luminescence and energy transfer of Eu2+/Tb3+/Eu3+in LiBaBO3phosphors with tunable-color emission [J].J.Mater.Chem. C, 2015, 3(35):9112-9121.
[6] XIA Z G, ZHUANG J Q, LIAO L B. Novel red-emitting Ba2Tb(BO3)2Cl∶Eu phosphor with efficient energy transfer for potential application in white light-emitting diodes [J].Inorg.Chem., 2012, 51(13):7202-7209.
[7] SOKOLNICKI J, ZYCH E. Synthesis and spectroscopic investigations of Sr2Y8(SiO4)6O2∶Eu2+, Eu3+phosphor for white LEDs [J].J.Lumin., 2015, 158:65-69.
[8] CHEN X, ZHAO J F, YU L P,etal.. A white light emitting phosphor Sr1.5Ca0.5SiO4∶Eu3+, Tb3+, Eu2+for LED-based near-UV chip: preparation, characterization and luminescent mechanism [J].J.Lumin., 2011, 131(12):2697-2702.
[9] DAI W B. Mechanism of the reduction and energy transfer between Eu2+and Eu3+in Eu-doped CaAl2Si2O8materials prepared in air [J].J.Mater.Chem. C, 2014, 2(20):3951-3959.
[10] DOBROWOLSKA A, ZYCH E. Spectroscopic characterization of Ca3Y2Si3O12∶Eu2+, Eu3+powders in VUV-UV-Vis region [J].J.Phys.Chem. C, 2012, 116(48):25493-25503.
[11] ZHANG Y, LI X J, LI K,etal.. Crystal-site engineering control for the reduction of Eu3+to Eu2+in CaYAlO4: structure refinement and tunable emission properties [J].ACSAppl.Mater.Inter., 2015, 7(4):2715-2725.
[12] ZHANG Y, LIU X M, LI X J,etal.. Overcoming crystallographically imposed geometrical restrictions on the valence state of Eu in CaGdAlO4: realization of white light emission from singly-doped Eu phosphors [J].DaltonTrans., 2015, 44(17):7743-7747.
[13] CHEN W P. Eu2+and Eu3+co-activated LaAlO3phosphor: synthesis and tuned luminescence [J].DaltonTrans., 2015, 44(40):17730-17735.
[14] YE S, XIAO F, PAN Y X,etal.. Phosphors in phosphor-converted white light-emitting diodes: recent advances in materials, techniques and properties [J].Mater.Sci.Eng.RRep., 2010, 71(1):1-34.
[15] 付作岭,董晓睿,盛天琦,等. 纳米晶体中稀土离子的发光性质及其变化机理研究 [J]. 中国光学, 2015, 8(1):139-144.
FU Z L, DONG X R, SHENG T Q,etal.. Luminescene properties and various mechanisms of rare earth ions in the nanocrystals [J].Chin.Opt., 2015, 8(1):139-144. (in Chinese)

陈彩花(1989-),女,广西桂平人,硕士研究生,2014年于广西贺州学院获得学士学位,主要从事发光材料方面的研究。

E-mail: 847716059@qq.com梁利芳(1964-),女,广西崇左人,教授,2005 年于中山大学获得博士学位,主要从事发光材料方面的研究。
E-mail: 13607811964@163.com
Tunable Luminescence of Ca12Al14O32F2∶Eu2+,Eu3+Phosphors Prepared by Combustion Method
CHEN Cai-hua, PENG Hai-long, LIANG Li-fang*, MENG Li-li, ZHANG Li-xia
(CollegeofChemistryandMaterialsScience,GuangxiTeachersEducationUniversity,Nanning530001,China)
,E-mail: 13607811964@163.com
A series of luminescent emission-tunable phosphors Ca12Al14O32F2:xEu were synthesized by combustion method. X-ray powder diffraction (XRD), X-ray photoelectron spectroscopy (XPS), scanning electron microscope (SEM) and photoluminescence spectra (PL) were used to characterize the phosphors. The effects of combustion temperature, ammonium fluoride, urea, boric acid and co-activator Eu3+-Eu2+on the luminescent properties of the phosphors were also studied. The results show that the emission color of the prepared phosphors can be tuned appropriately from orange red to blue by adjusting the synthesis condition due to the coexistence of Eu3+and Eu2+.
Ca12Al14O32F2; combustion method; Eu3+, Eu2+; phosphor
1000-7032(2016)08-0932-08
2016-04-06;
2016-05-12
国家自然科学基金(21161004); 广西自然科学基金(2011GXNSFA018048)资助项目
O482.31; O614
ADOI: 10.3788/fgxb20163708.0932
——记嘉荫县红光乡燎原村党支部

