硝酸知识要点学习归纳
安徽省灵璧中学 汤伟
硝酸知识要点学习归纳
安徽省灵璧中学 汤伟
硝酸是化工生产中常用的三大强酸之一,属于中学化学中重点学习的一类极为重要的化工原料。硝酸也是高考化学常常涉及的热点物质。我们如何在学习过程中把握该知识要点?下面我们将对其做一梳理。
学习要点一:硝酸的物理性质
硝酸是无色、易挥发、有刺激性气味的强酸,浓度越高越易挥发;硝酸不仅易挥发,而且不稳定,见光、受热均会分解,所以硝酸必须密封在棕色瓶中并存放于阴凉处,保存不当的浓硝酸久置会分解,产生的NO2溶于其中而呈黄色。注意:浓硝酸保存在棕色细口瓶中,用玻璃塞而不用橡胶塞。
例1 对于硝酸的物理性质,下列叙述不正确的是( )。
A.可以与水以任意比例互溶
B.不易挥发
C.有刺激性气味
D.质量分数在95%以上的硝酸为发烟硝酸
解析 硝酸是一种易挥发的酸,A、C、D选项均正确。故选B。
学习要点二:硝酸的化学性质
硝酸具有酸的通性,但是也有其特性,如硝酸与金属反应时一般无H2产生。硝酸具有强氧化性,硝酸越浓氧化性越强。硝酸可以氧化绝大多数金属,如
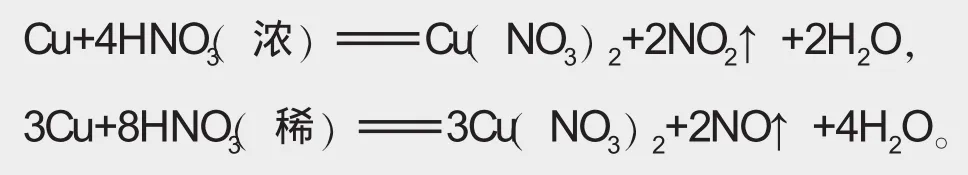
注意:铁和铝在常温下遇浓硝酸可发生钝化现象。
例2 在通风橱中进行下列实验:
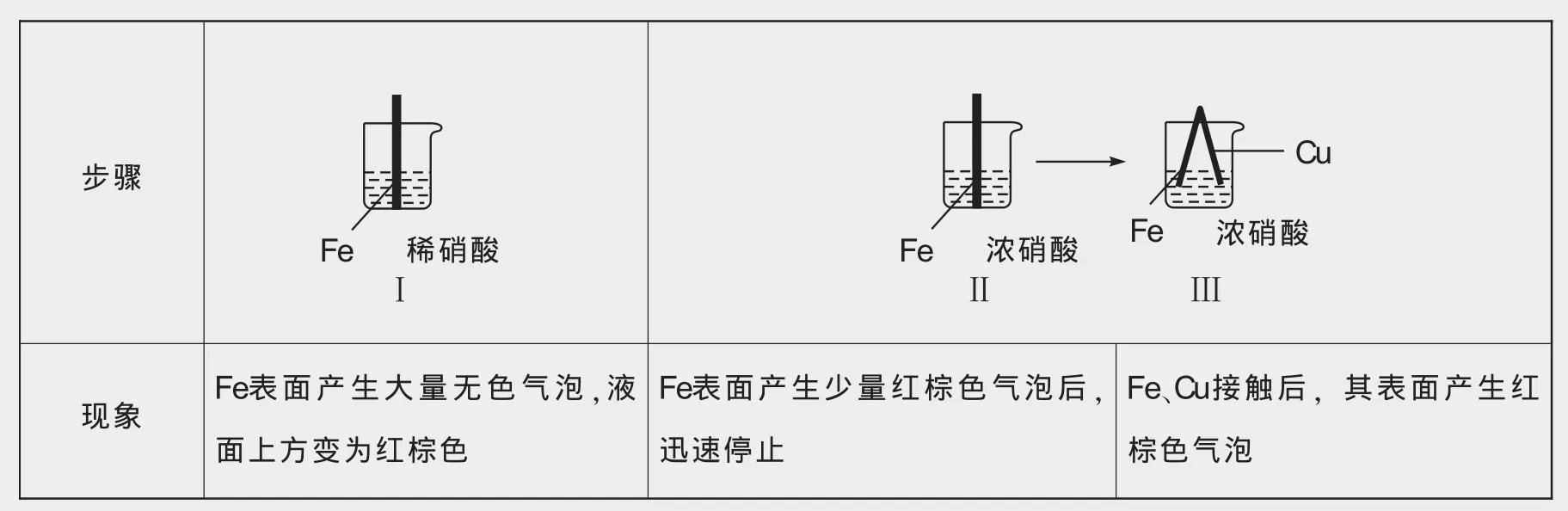
步骤现象Fe表面产生大量无色气泡,液面上方变为红棕色Fe表面产生少量红棕色气泡后,迅速停止Fe、Cu接触后,其表面产生红棕色气泡Fe稀硝酸ⅠFe浓硝酸ⅡFe浓硝酸CuⅢ
下列说法不正确的是( )。
A.Ⅰ中气体由无色变红棕色的化学方程式为2NO+O2=2NO2
B.Ⅱ中现象的产生是因为Fe表面形成致密的氧化层,阻止了Fe与硝酸的进一步反应
C.对比Ⅰ、Ⅱ中的现象可知,稀硝酸的氧化性强于浓硝酸
D.针对Ⅲ中的现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
解析 Ⅰ中,Fe与稀硝酸反应生成无色气体NO,NO被空气中的氧气氧化,生成红棕色的NO2气体,故A正确;Ⅱ中的现象是因为Fe发生了钝化,其表面形成致密的氧化层,阻止了Fe与浓硝酸的进一步反应,故B正确;Ⅱ中反应停止是因为发生了钝化,不能用来比较稀硝酸和浓硝酸的氧化性强弱,物质氧化性强弱只能通过比较物质得电子能力的强弱来分析,故C错误;Ⅲ中Fe、Cu都能与硝酸反应,二者接触,符合原电池构成条件,要想验证铁是否发生氧化反应,可以连接电流计,故D正确。故选C。
例3 下列相关说法正确的是( )。
A.向稀硝酸中滴加Na2SO3溶液,发生反应的离子方程式为
B.将可调高度的铜丝伸入到稀硝酸中,溶液会变蓝,说明Cu与稀硝酸发生置换反应
C.因为反应物浓度越大,反应速率越快,所以常温下,向相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完
D.实验室不可以选取锌粒、稀硝酸,并使用试管、带导管的橡皮塞等仪器制取H2
解析 硝酸具有强氧化性,会氧化Na2SO3,所以不会生成SO2气体,故A错误;Cu与稀硝酸反应,溶液会变蓝,但不能说明Cu与稀硝酸发生了置换反应,只能够说明生成物中有铜离子,故B错误;常温下,Al遇到浓硝酸会钝化,所以浓硝酸中铝片不可能先溶解完,故C错误;硝酸与金属反应,不生成H2,故D正确。故选D。
学习要点三:硝酸的两个特性
硝酸不仅具有酸的通性,还具有两个特性,即强氧化性和不稳定性。在众多的化学反应过程中,硝酸不仅表现出酸性,还表现出强氧化性。
例4 下列反应中,浓硝酸既表现酸性又表现氧化性的是( )。
A.浓硝酸分解B.FeO与浓硝酸反应
C.Cu(OH)2与浓硝酸反应D.C与浓硝酸反应
例5 一定量的Cu和1mol·L-1稀硝酸反应,如果c(NO-3)的浓度下降0.2mol·L-1,则溶液中c(H+)同时下降(假定反应前后溶液体积不变)( )。
A.0.2 mol·L-1B.0.4 mol·L-1C.0.6 mol·L-1D.0.8 mol·L-1
解析 由Cu与稀HNO3反应的离子方程式可知,当下降0.2 mol·L-1时,c(H+)下降0.8 mol·L-1。故选D。
方法规律 硝酸在化学反应中的有关变化
(1)参加反应的HNO3中的H+全部被消耗,只表现氧化性的HNO3中的NO-3才被还原、被消耗。
(2)足量金属与一定量浓硝酸反应时,随着反应的进行,应考虑硝酸浓度的变化:浓硝酸逐渐变为稀硝酸,从而发生不同的反应。
学习要点四:涉及硝酸的典型计算问题
对于涉及硝酸的计算,一般情况下有如下结论:
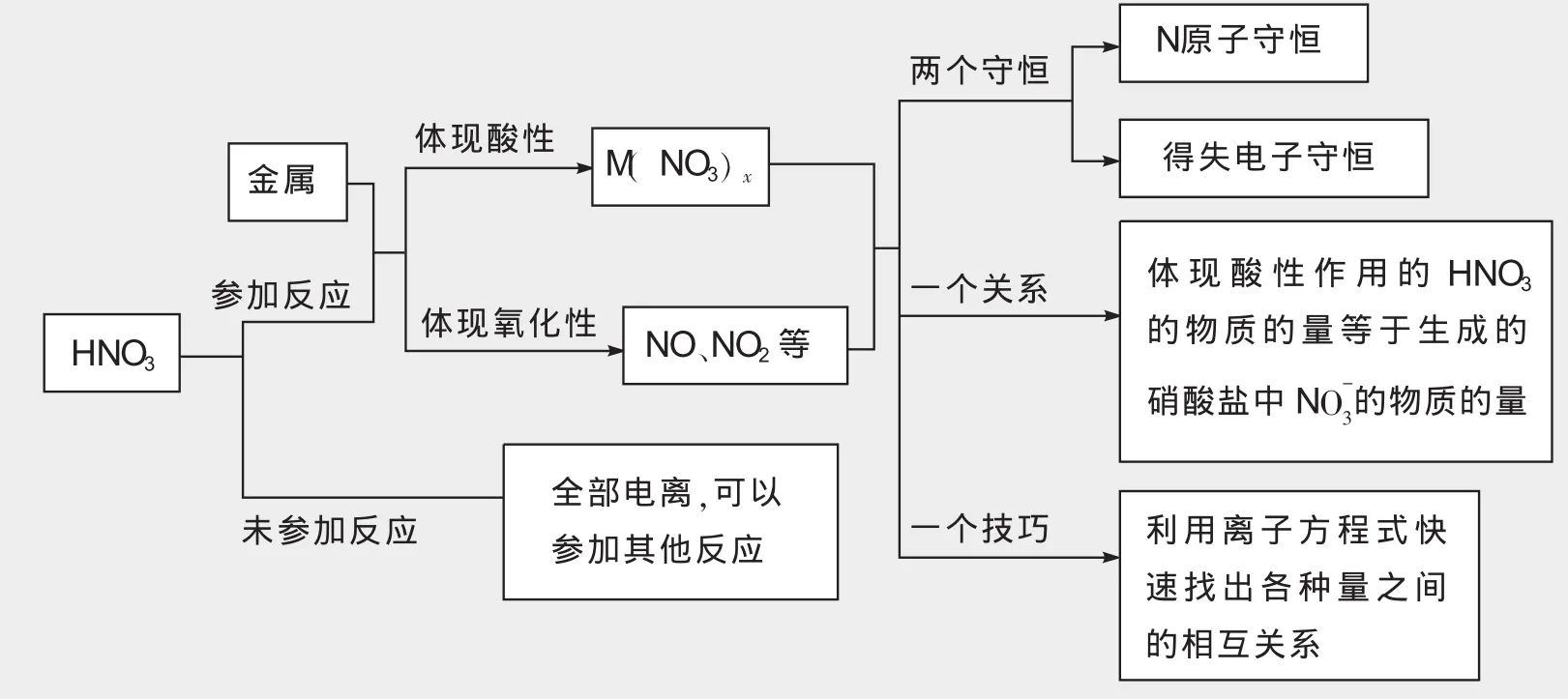
n(消耗硝酸总量)=n(体现酸性的硝酸)+n(体现氧化性的硝酸)
注意:与金属反应时,硝酸表现强氧化性和酸性,表现酸性的标志是生成硝酸盐;与非金属反应时,硝酸表现强氧化性,不表现酸性。
例6 等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多的是( )。
A.FeO B.Fe2O3C.FeSO4D.Fe3O4
解析 设几种物质的质量为m g,其中含有的+2价铁的物质的量依次可表示为m/72、0(只含+3价铁)、m/152、m/232,+2价铁含量最高的是FeO,所以与足量稀硝酸反应后硝酸得到电子最多,放出NO最多,所以A正确。故选A。
例7 1.52 g铜镁合金完全溶解于50 mL密度为1.40 g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况下),向反应后的溶液中加入1.0 mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀,下列说法不正确的是( )。
A.该合金中铜与镁的物质的量之比是2∶1
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol·L-1
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
解析 设Cu的物质的量为x,Mg的物质的量为y,则64x+24y=1.52 g,98x+58y=2.54 g,可以求得x=0.02 mol,y=0.01 mol,A正确;
c(HNO3)=1000×1.40 g·L-1×63%/63 g·mol-1=14.0 mol·L-1,B正确;
依据N元素守恒,得n(HNO3)=14.0 mol·L-1×0.05 L=0.7 mol=n(NO2)+2n(N2O4)+n(NaNO3),

依据电子守恒,得0.02 mol×2+0.01 mol×2=n(NO2)×1+n(N2O4)×2,
解得n(NO2)=0.04 mol,n(N2O4)=0.01 mol,C正确;
n(NaOH)=n(NaNO3)=0.7 mol-0.04 mol-0.02 mol=0.64 mol,
V(NaOH)aq=0.64 mol/1.0 mol·L-1=0.64 L,故需要NaOH溶液640 mL。故选D。

