新疆产桑属植物HPLC指纹图谱研究
杨 璐, 范少丽, 程 平, 李 宏
新疆林业科学院,新疆乌鲁木齐 830054)
新疆产桑属植物HPLC指纹图谱研究
杨 璐, 范少丽, 程 平, 李 宏*
新疆林业科学院,新疆乌鲁木齐 830054)
[目的]采用HPLC建立新疆产桑属植物指纹图谱。[方法]采用SunFire C18(4.6 mm×150.0 mm,5.0 μm)色谱柱;以甲醇-0.2%磷酸为流动相进行梯度洗脱,检测波长330 nm,流速0.8 mL/ min,柱温25℃,进样体积10 μL。[结果]对13批新疆不同来源的桑葚、桑叶进行检测,结果表明,建立的桑葚、桑叶指纹图谱精密度、稳定性和重复性良好。[结论]桑葚、桑叶HPLC指纹图谱可作为新疆桑属植物鉴别与质量控制的科学依据。
新疆;桑属植物;指纹图谱;高效液相色谱
桑属(MorusLinn.)植物是桑科多年生落叶乔木或灌木,新疆作为古丝绸之路的重要通道,拥有丰富的桑树资源[1]。桑属植物是重要的药用植物资源,其根皮、茎、果实和叶子均可入药,其果实(桑葚)具有补血滋阴、生津润燥的功效[2],其叶(桑叶)具有疏散风热、清肺润燥、清肝明目的功效[3]。现代药理研究表明,桑葚与桑叶均具有抗氧化[4-5]、降血糖[6]、降血脂[7-8]等药理活性。指纹图谱是国内外广泛采用的一种药材质量评价模式,而HPLC指纹图谱具有分离效能高、分析速度快等优点[9-10]。研究者对广西、陕西等地产桑葚、
桑叶药材的指纹图谱进行研究[11-13],但对于新疆产桑葚、桑叶的指纹图谱系统研究鲜见报道[14]。笔者采用高效液相色谱法,建立新疆产桑葚、桑叶的指纹图谱,并对不同来源的13批新疆产桑葚、桑叶HPLC色谱图进行分析,以期为更好地评价新疆桑属植物的综合质量提供参考。1材料与方法
1.1试验材料桑葚(鲜果)、桑叶(干燥叶)采自新疆吐鲁番地区,共采集13批桑葚、桑叶样品(表1),采集时间为2015年5月。

表1 桑葚、桑叶样品来源
1.2试剂对照品:芸香叶苷(批号:C10027472,上海麦恪林生化科技有限公司,含量≥98%);桑色素(批号:C10031384,上海麦恪林生化科技有限公司,含量≥98%);甲醇(色谱纯,Fisher Scientific);磷酸(分析纯,天津市致远化学试剂有限公司);水为超纯水。
1.3仪器高效液相色谱仪(美国Waters,Alliance E2695,包括自动进样器、Empower色谱工作站等);紫外检测器(美国Waters,Alliance 2998),数控超声清洗器(KQ-300DE,昆山市超声仪器有限公司)。
1.4色谱条件色谱柱:SunFire C18(4.6 mm×150.0 mm,5.0 μm);流动相:甲醇-0.2%磷酸;检测波长:330 nm;柱温:25 ℃;进样量:10 μL。梯度洗脱程序见表2。

表2 梯度洗脱程序
1.5供试品溶液制备精密称取桑葚(鲜果匀浆0.50 g)、桑叶(干燥粉末1.00 g)样品,分别加入10 mL 70%的甲醇超声提取30 min,5 000 r/min离心10 min,取上清液全量,氮吹,再定容至2 mL,用0.22 μm 微孔滤膜过滤,取续滤液,即得供试品溶液。
1.6混合对照品溶液制备分别精密称定芸香叶苷、桑色素对照品,各加甲醇制成对照品浓度分别为0.600、0.400、0.200、0.100、0.060、0.010、0.002 mg/mL的混合对照品溶液,再用0.22 μm 微孔滤膜过滤,取续滤液,即得混合对照品溶液。0.4 mg/mL的混合对照品溶液色谱见图1。

注:1.芸香叶苷;2.桑色素。Note: 1.Rutin hydrate; 2.Morin hydrate. 图1 混合对照品的HPLC色谱 Fig.1 HPLC chromatogram of mixed reference substances
2 结果与分析
2.1方法学考察
2.1.1精密度。取同一批次的样品(亚亚长黑1号),按“1.5”供试品溶液的制备方法处理后,在已确定的HPLC色谱条件下连续进样6次,记录图谱,考察主要色谱峰相对保留时间和相对峰面积的一致性,结果各色谱峰的相对保留时间RSD在0.01%~0.02%;各峰相对峰面积RSD在0.2%~1.2%。应用相似度软件对色谱峰进行自动匹配,结果表明,各指纹图谱的相似度均等于1。表明仪器的精密度良好,符合指纹图谱的检测要求。
2.1.2重复性。取同一批次的样品(亚亚长黑1号),按“1.5”供试品溶液的制备方法处理后,平行6份,在已确定的色谱条件下进行检测,记录图谱,考察试验方法的重复性。结果表明,6 份样品中各色谱峰的相对保留时间RSD在0.01%~0.02%,共有峰相对峰面积RSD在1.2%~0.2%,应用相似度软件对色谱峰进行自动匹配,结果表明,各指纹图谱的相似度均大于0.999,符合指纹图谱的检测要求。
2.1.3稳定性。取同一批次的样品(亚亚长黑1号),按“1.5”供试品溶液的制备方法制备一份供试品,在已确定的色谱条件下分别在 0、 2、 4、 8、16、 24 h 进行检测,记录图谱,考察样品溶液的稳定性。结果各色谱峰的相对保留时间RSD在0.03%~0.08%,各峰相对峰面积RSD在0.2%~0.8%,应用相似度软件对色谱峰进行自动匹配,结果表明,各指纹图谱的相似度均大于0.9。表明样品在24 h内稳定,符合指纹图谱的检测要求。

图2 5批黑桑HPLC指纹图谱Fig.2 HPLC fingerprint overlapping of 5 batches of black mulberry

图3 7批白桑HPLC指纹图谱Fig.3 HPLC fingerprint overlapping of 7 batches of white mulberry
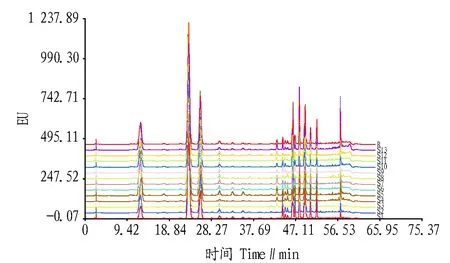
图4 13批桑叶HPLC指纹图谱Fig.4 HPLC fingerprint overlapping of 13 batches of mulberry leaves
2.2指纹图谱的建立2.2.1共有峰的确定。精密称定13批桑葚、桑叶样品,分别按“1.5”方法制备供试品溶液,按“1.4”色谱条件分析,记录色谱图,桑葚、桑叶样品HPLC图谱见图2~4。采用国家药典委员会《中药色谱指纹图谱相似度评价系统软件(2004A版)》,以均值法生成指纹图谱共有模式,生成的对照指纹图谱R1、R2、R3见图5~7。按照峰面积的大小,13批桑叶样品共标示出9个共有峰,5批黑桑样品共标示出5个共有峰,7批白桑样品则标示出2个共有峰。经对照品保留时间定位及色谱峰紫外光谱分析,鉴别出2个共有峰。图5的峰2、图6的峰2与图7的峰5为芸香叶苷,图5的峰5与图7的峰8则为桑色素。

注:2.芸香叶苷;5.桑色素。Note: 2.Rutin hydrate; 5.Morin hydrate图5 5批黑桑HPLC特征指纹图谱的共有模式R1Fig.5 Common pattern R1 of HPLC fingerprints of 5 batches of black mulberry

图6 7批白桑HPLC特征指纹图谱的共有模式R2Fig.6 Common pattern R2 of HPLC fingerprints of 7 batches of white mulberry

注:5.芸香叶苷;8.桑色素。Note: 5.Rutin hydrate; 8.Morin hydrate.图7 13批桑叶HPLC特征指纹图谱的共有模式R3Fig.7 Common pattern R3 of HPLC fingerprints of 13 batches of mulberry leaves
2.2.2各共有峰相对保留时间与相对峰面积的测定。由HPLC色谱图可以看出,芸香叶苷是13批桑葚、桑叶共有的主要药效成分。选择图5的峰2、图6的峰2与图7的峰5(芸香叶苷)作为参照峰,分别计算各指纹图谱共有峰的相对保留时间与相对峰面积。结果13批桑叶样品各共有峰的相对保留时间RSD在0.01%~0.30%,各峰相对峰面积RSD在0.204%~0.839%。5批黑桑样品各共有峰的相对保留时间RSD在0.02%~0.04%,各峰相对峰面积RSD在49.22%~100.51%。7批白桑样品各共有峰的相对保留时间RSD为0.02%,相对峰面积RSD为19.55%。13批桑葚、桑叶样品的芸香叶苷含量见表3。由表3可知,各批样品之间共有指纹峰的相对保留时间具有较好的重现性,但各桑葚、桑叶样品中共有指纹峰的相对峰面积与芸香叶苷含量均有很大差异。

表3 样品中芸香叶苷含量
2.2.3相似度分析。通过《中药色谱指纹图谱相似度评价系统软件(2004A版)》将13批桑叶、5批黑桑与7批白桑样品色谱图与相应的对照指纹图谱进行相似度分析,结果表明,桑叶样品S1~S13与对照指纹图谱R的相似度均大于0.900(表4),符合指纹图谱的要求,可建立共有模式。但桑葚色谱图与对照指纹图谱有一定差异,可见桑葚品种与种植环境对桑葚质量的控制有重要影响。

表4 样品HPLC指纹图谱与对照指纹图谱R的相似度
3 讨论
3.1色谱条件的优化该试验对不同提取溶剂(体积分数分别为60%、70%、80%、100%甲醇)的超声提取效果进行比较,结果表明,以70%甲醇提取效果较优。孙莲等[15]、谭振鹏[16]研究表明,桑叶指纹图谱的检测波长为芦丁的最大吸收波长280 nm。该试验对供试品进行全波长扫描,结果表明,在330 nm处检测的峰数目较多,多数峰响应值较大,因此,选择330 nm作为桑葚、桑叶HPLC指纹图谱的检测波长。为了保证色谱图能从总体上反映桑葚的化学信息,各化学成分尽可能出峰,并达到基线分离,有良好的分离度,不断优化流动相的比例[17],最终确定色谱条件,可实现图谱各峰较好分离,出峰时间适宜,峰形正态分布。
3.2共有峰的标定指纹图谱共有峰的标定,按照《重要注射剂指纹图谱研究的技术要求(暂行)》,根据13批供试品的检测结果,采用相对保留时间标定指纹共有峰,色谱峰的相对保留时间根据参照峰的保留时间计算[18]。该研究借助《中药色谱指纹图谱相似度评价系统软件(2004A版)》自动匹配色谱图相关参数,13批桑叶样品共标示出9个共有峰,5批黑桑样品共标示出5个共有峰,7批白桑样品则标示出2个共有峰,避免人工判断的盲目性与误差。
从该试验得出的指纹图谱可看出,对于不同批次的新疆桑叶,共有指纹峰数量较多,其相对保留时间一致,且HPLC色谱图谱相似;相似度均较高(﹥0.900),说明不同来源、批次桑叶的质量相对较稳定。7批白桑HPLC色谱图相似度有一定差异,可以反映不同批次白桑样品的内在质量差别。5批黑桑HPLC指纹图谱中,各批次样品间共有指纹峰的相对保留时间比较吻合,但不同批次的部分峰面积比值差别很大。
芸香叶苷为桑葚及其有关制剂的主要药效成分,在桑葚药品开发过程中,芸香叶苷为其制剂的主要质量控制标准[19]。该试验结果表明,芸香叶苷含量由高到低依次为桑叶、黑桑、白桑,尤其是桑葚样品,不同果实颜色的桑葚样品,芸香叶苷含量具有明显差异,推测这也是新疆黑桑药用价值高于白桑的原因之一[20]。该试验样品是于相近时间在新疆吐鲁番不同种植区采收的样品,且采收后使用统一前处理方法和保存条件,故认为品种因素与种植环境造成样品中各组分含量比例差异,在以后的研究中,将进一步累积样品,着重考虑品种因素的影响深入研究。该研究建立的HPLC指纹图谱方法精密度、稳定性、重复性良好,可为评价新疆桑葚、桑叶质量提供方法依据,争取优选出新疆产药效含量高的优质桑属植物品种,实现新疆桑属植物的规范化种植以保持其产品质量的稳定。
[1] 买买提依明,徐立,夏庆友,等.新疆维吾尔自治区桑树自然分布区域的地理生态环境及桑树形态特征[J].蚕业科学,2008,34(2):294-297.
[2] 国家药典委员会.中华人民共和国药典:一部2010年版[M].北京: 中国医药科技出版社,2010: 211,279.
[4] 李层层,王德萍,江岩.新疆桑叶营养成分分析及体外抗氧化作用研究[J].食品工业,2015(5):78-82.
[5] SHIH P H,CHAN Y C,LIAO J W,et al.Antioxidant and cognitive promotion effects of anthocyanin-rich mulberry (MorusatropurpureaL.) on senescence-accelerated mice and prevention of Alzheimer’s disease[J].Journal of nutritional biochemistry,2009,21(7):598-605.
[6] 王元成,徐立.桑树各入药部位的活性成分及降血糖功能研究进展[J].蚕业科学,2015,41(2):367-375.
[7] DOI K,KOJIMA T,FUJIMOTO Y.Mulberry leaf extract inhibits the oxidative modification of rabbit and human low density lipoprotein[J].Biological & pharmaceutical bulletin,2000,23(9):1066-1071.
[8] 贾珺.桑葚萃取物降血脂及预防动脉粥状硬化形成之作用[J].医学美学美容,2015(3):242-243.
[9] ABOURASHED E A,VANDERPLANK J R,KHAN I A.High-speed extraction and HPLC fingerprinting of medicinal plants - I.Application to passiflora flavonoids[J].Pharmaceutical biology,2008,40(2):81-91.
[10] 李强,杜思邈,张忠亮,等.中药指纹图谱技术进展及未来发展方向展望[J].中草药,2013,44(22):3095-3104.
[11] 陈诚,李洪波,王柳萍,等.不同产地桑椹药材HPLC指纹图谱研究[J].中药材,2012,35(12):1925-1928.
[12] 王华,孙伟.大十桑椹HPLC指纹图谱研究[J].食品与发酵工业,2007,33(4):52-55.
[13] 彭丽英,彭攸灵,杨先国.不同产地桑叶药材UPLC指纹图谱研究[J].中国当代医药,2014,21(14):8-10.
[14] 孙莲,李玲,姑再努尔·阿布力孜.新疆药桑叶的HPLC指纹图谱研究[J].中国药房,2014(39):3693-3695.
[15] 孙莲,刘龙,杨文菊.桑叶药材HPIC指纹图谱的研究[C]// 中国药学杂志岛津杯第八届全国药物分析优秀论文评选交流会.保定:中国农业工程学会,2007.
[16] 谭振鹏.桑椹多酚含量测定、指纹图谱和抗氧化能力研究[D].南宁:广西中医药大学,2013.
[17] 李洪波.桑椹色素性质评价与应用研究[D].南宁:广西中医药大学,2011.
[18] 耿旦,马雯芳,丘琴,等.广西产桑椹HPLC指纹图谱研究[J].中国实验方剂学杂志,2011,17(22):54-56.
[19] 周庆颂,孙若飞,宴丽芳,等.不同产地桑葚中总黄酮含量的测定[J].湖北农业科学,2014,53(22):5526-5528.
[20] ERCISLI S,ORHAN E.Chemical composition of white (Morusalba), red (Morusrubra),and black (Morusnigra) mulberry fruits[J].Food chemistry,2007,103(4):1380-1384.
Study on Fingerprints ofMorusalbafrom Xinjiang by HPLC
YANG Lu,FAN Shao-li,CHENG Ping,LI Hong*
Xinjiang Academy of Forestry Sciences,Urumqi,Xinjiang 830054)
[Objective] To establish the fingerprints ofMorusalba. from Xinjiang by HPLC.[Methods] The samples were separated on SunFire C18 (4.6 mm×150.0 mm,5.0 μm) with methanol-0.2% phosphoric acid as the mobile phase to conduct gradient eluent at the flow rate of 0.8 mL/min at 30 ℃,and the detection wavelength was 330 nm.The sample injection was 10 μL.[Results] 13 samples of mulberry and mulberry leaves from different origins of Xinjiang were detected.The results showed that the fingerprints had good accuracy,repeatability and stability.[Conclusion] The HPLC fingerprints can be used as the scientific evidence for identification and quality control ofM.albafrom Xinjiang.
Xinjiang;Morusalba; Fingerprint; HPLC
自治区公益性科研院所基本科研业务经费资助项目(KY201521)。
杨璐(1985- ),女,新疆乌鲁木齐人,助理研究员,硕士,从事植物资源化学与生物活性物质研究。*通讯作者,研究员,博士,从事林果栽培和综合利用研究。
2016-07-20
S 188
A
0517-6611(2016)26-0111-04

