“阿伏加德罗定律”要点点拨
安徽省灵璧中学 汤伟 张茹英
“阿伏加德罗定律”要点点拨
安徽省灵璧中学汤伟张茹英

阿伏加德罗定律是我们学习气体及其相关变化过程中遇到的一个极为重要的规律。如果我们还没有充分理解该定律的本质和内涵,就盲目地运用,势必会出现错误。下面笔者针对高一学生,就如何学习该知识要点做一探究,供参考。
一、理解定律的本质与内涵
阿伏加德罗定律指出,对于任何气体,在同温、同压下,若气体的体积相同,则气体内含有的分子个数相同,即气体的物质的量相同。我们可以简单地总结为“三同”定“一同”。
学习该定律,我们要重点把握两个核心。一是研究对象:单一气体或混合气体;二是“三同”定“一同”,即只有在同温、同压、同体积的条件下,才有分子数相同这一结论。
学习该定律,我们还要理解如下几个容易出错的问题。
①同温、同压下,相同体积的任何气体所含有的原子数是否相同?
所含有的原子数目不一定相同。同温、同压下,相同体积的任何气体都含有相同的分子数,但不同的气体分子可能含有不同的原子数,所以同温、同压下,相同体积的任何气体不一定都含有相同的原子数。
②同温、同压下,气体的体积大小与气体的物质的量有什么关系?
同温、同压下,气体分子之间的距离相同,所以分子数越多,气体体积越大,即同温、同压下,气体的体积与物质的量成正比。
③同温、同压下,相同体积的任何气体所具有的质量是否相同?
具有的质量不一定相同。同温、同压下,相同体积的任何气体都具有相同的物质的量,气体的摩尔质量不同时,相同物质的量的气体的质量也不相同。
例1同温、同压下,A容器中H2和B容器中NH3所含氢原子数相同,则两个容器的容积比VA∶VB为()。
A.3∶2 B.1∶3 C.2∶3 D.1∶2
解析1 mol H2含2 mol氢原子,1 mol NH3含3 mol氢原子,若H2和NH3所含氢原子数相同,则H2和NH3的物质的量之比为3∶2,同温、同压下气体的体积之比等于物质的量之比,两个容器的容积比也为3∶2。
答案A
例2下列说法正确的是()。
A.同温、同压下,原子数目相同的气体必具有相同的体积
B.等体积的O2和H2的质量之比为16∶1
C.不同的气体若体积不等,则它们所含的分子数一定不等
D.同温、同体积下,两种气体的物质的量之比等于压强之比
解析同温、同压下,原子数目相同的气体分子数不一定相同,所以体积也不一定相同。只有同温、同压下,等体积的O2和H2的质量之比才是16∶1。不同的气体,若只是体积不相同,其物质的量在不同条件下也有可能相同,所以分子数也有可能相同。根据阿伏加德罗定律的推论可知,同温、同体积下,两种气体的压强之比等于其物质的量之比。
答案D
二、阿伏加德罗定律的常用推论
阿伏加德罗定律的推论比阿伏加德罗定律更加具有实用性,其常用的重要推论主要有以下四个:

例3在标准状况下,a g气体A与b g气体B的分子数相同,下列说法不正确的是()。
A.气体A与气体B的摩尔质量之比为a∶b
B.同温、同压下,气体A与气体B的密度之比为b∶a
C.质量相同的气体A与气体B的分子数之比为b∶a
D.相同状况下,同体积的气体A与气体B的质量之比为a∶b
解析解答本题应注意以下几点:同温、同压下,分子数相同的气体的物质的量相同,物质的量相同的气体的质量之比等于摩尔质量之比;同温、同压下,气体的密度之比等于摩尔质量之比。对于分子数相同的气体,其摩尔质量之比等于质量之比,A、D对。同温、同压下,A与B的密度之比应等于其摩尔质量之比a∶b,B项错。质量相同的气体的分子数之比等于摩尔质量之比的倒数,C项对。
答案B
例4(1)同温、同压下,两种气体A和B的体积之比为2∶1,质量之比为8∶5,则A与B的密度之比为____,摩尔质量之比为____。
(2)在标准状况下:
a.6.72 L CH4气体b.3.01×1023个HCl气体分子
c.13.6 g H2S气体d.0.2 mol NH3
按下面的要求对这四种气体从大到小排列(用上述序号表示):
①按四种气体的物质的量的顺序:____;
②按标准状况下四种气体的体积的顺序:____;
③按四种气体的质量的顺序:____。
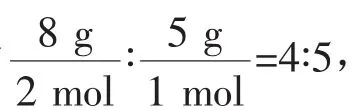

答案(1)4∶54∶5(2)①b>c>a>d②b>c>a>d③b>c>a>d

