食管癌变进程中间质成纤维细胞的表型变化*
徐志彬,袁 丽,郑秀丽,王士杰,吴明利
(河北医科大学第四医院内镜科,石家庄 050011)
论著·临床研究doi:10.3969/j.issn.1671-8348.2016.27.010
食管癌变进程中间质成纤维细胞的表型变化*
徐志彬,袁丽,郑秀丽,王士杰,吴明利△
(河北医科大学第四医院内镜科,石家庄 050011)
目的研究在食管正常上皮历经癌前病变发展到食管鳞状细胞癌的过程中,食管间质中的成纤维细胞的α-SMA表型变化。方法免疫组化法分析20例正常食管组织、80例食管癌前病变组织及50例食管癌组织标本中食管间质成纤维细胞α-SMA的表达,细胞培养3种食管间质成纤维细胞,纯化后行细胞免疫染色,RT-PCR法检测三种食管间质成纤维细胞α-SMA的表达。结果免疫组化结果显示,α-SMA在正常食管、食管癌前病变和食管癌组织间质成纤维细胞中的表达具有明显差异;RT-PCR法显示,3种食管间质成纤维细胞在mRNA α-SMA的表达量上具有明显差异。结论食管间质成纤维细胞随癌变进展会逐步发生活化,食管癌相关纤维母细胞可能是由正常的食管成纤维细胞发展至不典型增生成纤维细胞,再逐步恶变发展而来。
食管肿瘤;间质细胞;间质成纤维细胞;癌变;表型
虽然肿瘤的发生发展是由自身的基因结构及其表达的改变而导致的,但是肿瘤所处的间质微环境在肿瘤的发展中起着举足轻重的作用,亦不能被忽视。成纤维细胞是肿瘤基质中最重要、最主要的细胞成分,活化后获得平滑肌表型的成纤维细胞被称为癌相关纤维母细胞(cancer-associated fibroblasts,CAFs)。学者们对多种实体肿瘤中的CAFs进行了研究,包括其免疫表型及生物学特性及功能,以及其与癌细胞的相互作用机制。本实验重点研究正常的食管间质成纤维细胞、食管不典型增生成纤维细胞以食管及癌相关纤维母细胞的形态特点及其免疫表型的变化,探讨不典型增生间质成纤维细胞是否为处于正常成纤维细胞与癌相关纤维母细胞之间的过渡阶段。
1 资料与方法
1.1一般资料根据2008年WHO食管上皮性肿瘤诊断分类标准,选取河北省肿瘤医院2010~2012年的食管癌前期病变标本80例,同时50例食管癌组织标本蜡块和20例贲门癌标本的阴性上残作为研究对象。150例入选,其中男84例,年龄50~76岁,平均(58.0±5.5)岁;女66例,年龄48~75岁,平均(62.0±6.5)岁。随机抽取3组患者各5例行细胞培养。试剂:CK鼠抗人细胞单克隆抗体, Vimentin鼠抗人单克隆抗体,α-SMA鼠抗人单克隆抗体,浓度为1∶50,以上产品均由北京西雅金桥生物技术有限公司提供。RPMI1640培养基(美国Gibco公司),胎牛血清(Hyclone),D-Hanks液,胰蛋白酶粉(美国Sigma公司),胶原酶Ⅱ(美国Gibco公司),基因及内参照β-actin 的引物序列由上海英骏生物技术有限公司合成;RNA提取试剂(美国Invitrogen公司),M-MLV逆转录酶(美国Promega公司),Oligo(dT)15/10 mmol/L dNTPs/RNase-inhibitor(日本Toyobo公司),Matrigel Basement Membrane Matrix(美国BD公司)。
1.2方法
1.2.1一步法免疫组化染色阳性对照选择阳性的人癌组织切片,阴性对照选择PBS液。
1.2.2细胞培养将组织转移入培养瓶,于 37℃恒温CO2培养箱中进行消化,显微镜下窥见独立的细胞即终止消化,一般正常组织消化约为70 min,癌前病变组织消化约为90 min,癌组织消化约为100 min,细胞收集→过滤→离心→洗涤→离心→制备细胞悬液→计数→接种后,再向培养瓶中置入胰蛋白酶-EDTA混合液,消化1 min后,用吸管轻轻吹打瓶底,收集细胞,制备细胞悬液,接种培养。将制作好的细胞爬片固定于载玻片上,3%H2O2室温孵育10 min,PBS液漂洗3次,每次5 min,10%牛血清封闭30 min,加α-SMA一抗,37℃孵育1 h,PBS漂洗3次,每次5 min,加二抗,孵育30 min,PBS漂洗3次,5 min,DAB显色,室温反应10 min,水洗1 min,2次,苏木素复染1 min,水洗10 min,95%乙醇脱水,封片。用已知阳性细胞爬片做阳性对照,磷酸盐缓冲液(PBS)液代替一抗做阴性对照。细胞质中出现棕黄色颗粒即可判定为染色阳性。
1.2.3RT-PCR提取总的RNA:长满细胞的75 mL培养瓶弃去培养基后用PBS液洗2次,再加1 mL Trizol裂解液裂解细胞,将裂解细胞液移入Ep 管中,室温条件下静置5 min后加入 0.2 mL氯仿,剧烈振荡15 s,室温下静置 2~3 min,4 ℃条件下 12 000 r/min离心15 min,溶液层析为3层,将最上层的无色液体含移至另一EP 管中,加入等量异丙醇后颠倒混匀;经冰浴15 min,在4℃下12 000 r/min 离心15 min后弃去上清液,加75%乙醇1 mL振摇混匀后,在4℃下7 500 r/min 离心5 min弃上清液,室温下于空气中干燥 5 min,加入20~30 μL无RNA 酶水,紫外分光光度仪测定RNA的A260/A280比值,1.8~2.0较好。逆转录体系: 总RNA 1 μg,Oligo(dT)15Primer 1 μL,5×Reaction buffer 4 μL,10 mmol/L dNTP 2 μL,Ribolock RNase inhibitor 1 μL,M-MLV逆转录酶1 μL。将以上试剂依次加入200 μL的PCR管中,补足无RNase水,总体积12 μL,将上述试剂混匀,置于PCR仪上,42 ℃孵育60 min,70 ℃孵育5 min,终止反应。引物序列全长选自Pubmed基因库,引物序列是由上海英骏生物有限公司合成、设计并合成,经GenBank核实。Alpha-SMA、Vimentin及内参β-actin的引物序列和PCR扩增产物长度见表1。
1.3判定标准α-SMA阳性判断标准:按照王立峰等[6]的标准,以间质成纤维细胞胞质中出现棕黄色颗粒为阳性细胞,观察5个具有代表性的高倍视野(×400),根据阳性范围:无明显阳性细胞为(-),局灶阳性者判定为(+),弥漫阳性者判定为(++),为便于统计,将(+)和(++)合并为阳性。
1.4统计学处理采用SPSS17.0统计软件进行分析,计数资料以率或百分比表示,均数的比较用t检验,率的比较用χ2检验,以α=0.05为检验水准,P<0.05为差异有统计学意义。
2 结 果
2.1食管癌变进程中间质成纤维细胞的α-SMA表达情况α-SMA在正常食管间质成纤维细胞中基本不表达(0/20),可表达于平滑肌细胞和血管平滑肌细胞;癌前病变组、癌组的表达率分别为26%(21/80)、76%(38/50);阳性的食管间质成纤维细胞多呈梭形或条带样,多分布于癌前病变或癌团周围间质中,在进展期癌组织中可见条索状成纤维细胞包裹癌巢。本组结果显示,间质成纤维细胞α-SMA的阳性表达率随着食管癌变进展呈逐渐上升趋势,组间阳性表达率差异有统计学意义,与正常组比较,食管癌前病变组和食管癌组差异均有统计学意义(P<0.01)。见图1。

表1 引物序列和PCR扩增产物长度
2.2细胞免疫染色结果食管正常成纤维细胞(NFs)中α-SMA染色为阴性,食管不典型增生成纤维细胞(AFs)和食管CAFs细胞质中可见α-SMA的阳性染色。而Vimentin在3种食管间质成纤维细胞中均为阳性表达,CK在3种食管间质成纤维细胞中均为阴性表达(图2~4)。
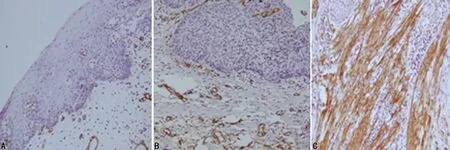
A:α-SMA 在正常组织成纤维细胞的阴性表达;B:α-SMA 在上皮内瘤变组织中成纤维细胞的阳性表达;C:α-SMA 在食管癌组织中的阳性表达。
图1α-SMA在食管癌变过程中间质成纤维细胞的表达(IHC,×200)
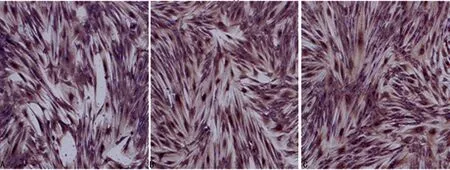
A:Vimentin在NFs的阳性表达;B:Vimentin在AFs的阳性表达;C:Vimentin在CAFs的阳性表达。
图2Vimentin在三种食管间质成纤维细胞的表达(IHC,×100)
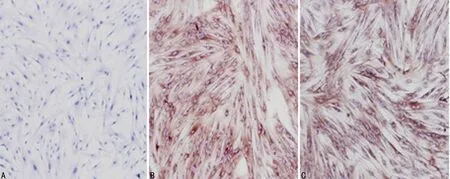
A:α-SMA在NFs的阴性表达;B:α-SMA在AFs的阳性表达;C:α-SMA在CAFs的阳性表达。
图3α-SMA在三种食管间质成纤维细胞的表达(IHC,×100)
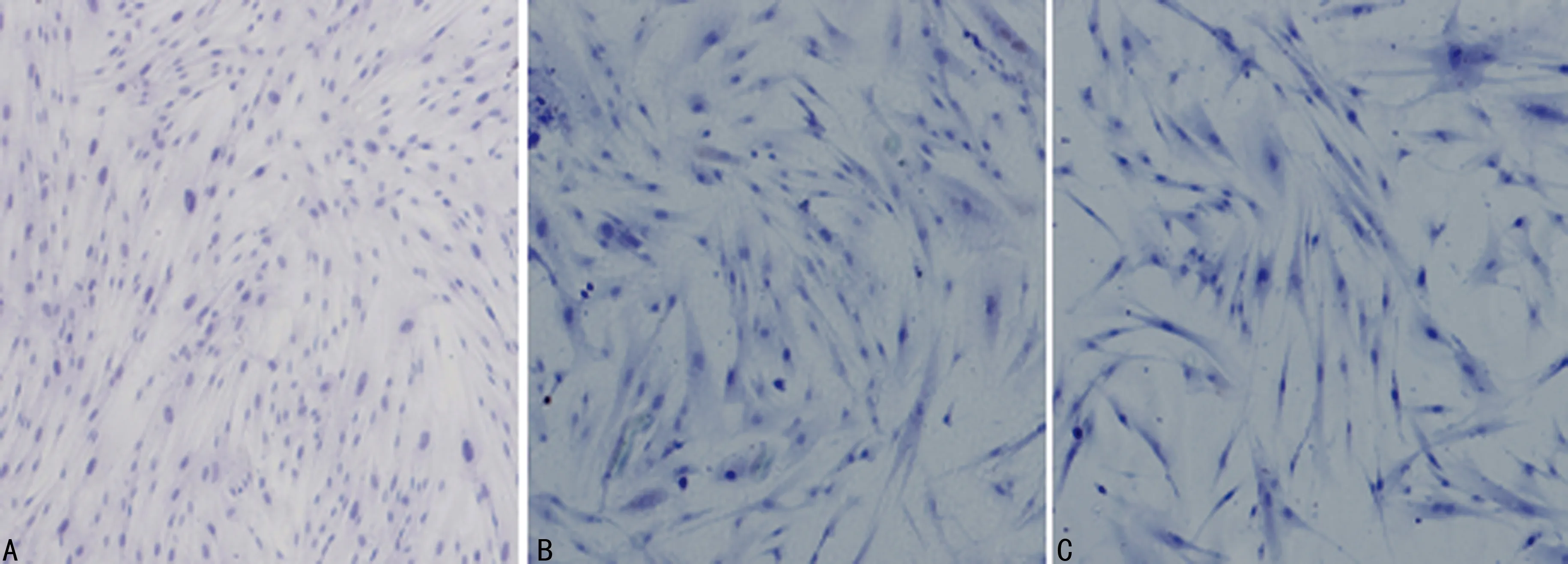
A:CK在NFs的阴性表达;B:CK在AFs的阴性表达;C:CK在CAFs的阴性表达。
图4CK在3种食管间质成纤维细胞的表达(IHC,×100)
2.33种食管间质成纤维细胞的Vimentin、α-SMA基因表达从NFs→AFs→CAFs,Vimentin的表达无明显变化,α-SMA的表达逐渐增强,差异有统计学意义(P<0.05),见图5~6。
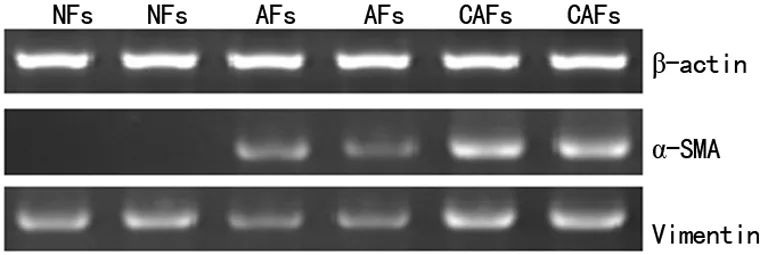
图5 Vimentin、α-SMA在3种食管间质成纤维细胞的表达
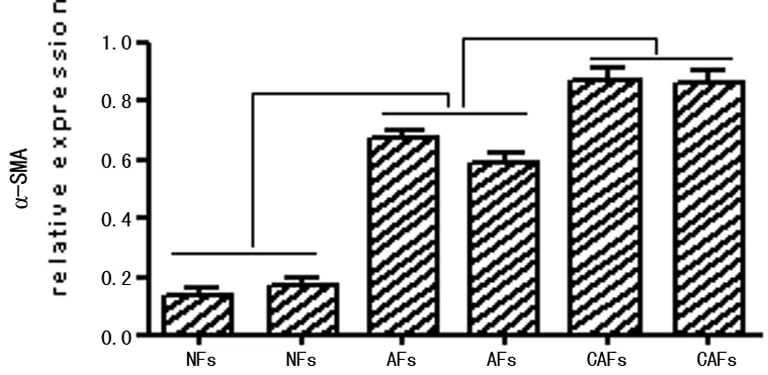
图6 3种食管间质成纤维细胞mRNA α-SMA的测定
3 讨 论
肿瘤间质微环境已经成为肿瘤研究热点之一。CAFs指存在于肿瘤间质微环境中的活化纤维母细胞[1]。与正常成纤维细胞相比,CAFs已发生表型改变,主要表现为间质成纤维细胞CD34的表达缺失,取而代之的是α-SMA、波形蛋白(vimentin)、成纤维细胞活化蛋白、成纤维细胞特异蛋白等表面蛋白的阳性表达。关于多种实体肿瘤的CAFs研究证实:α-SMA阳性表达是高发事件[2-4]。由静止的正常成纤维细胞发展到活化的CAFs期间是否存在半活化的状态,尚未得到证实。
关于癌旁纤维母细胞的起源学者们意见不一,有的学者认为CAFs是由肿瘤细胞经上皮间质转化(epithelial-to-mesenchymaltransition,EMT)而来,血管平滑肌细胞和周细胞也可能是CAFs来源之一,大多数的观点认为CAFs是由间质既存的成纤维细胞活化而来[5-6]。本组免疫研究结果显示,正常组α-SMA表达为阴性,而进展期癌组中的α-SMA表达率高达76%,明显高于正常组。值得一提的是,本研究中的癌前病变也出现了α-SMA的阳性染色,表达率为26%,镜下可观察到,紧邻异型细胞的间质成纤维细胞更容易出现α-SMA阳性,呈丝带状分布。本研究对从正常组、癌前病变组、进展期癌组分离、提取、培养的间质成纤维细胞进行了α-SMA免疫染色和mRNAα-SMA的半定量检测,结果发现:NFs中α-SMA染色近乎阴性,mRNA检测量极低,而AFs和CAFs的α-SMA染色均为阳性,mRNA检测值呈逐渐增高的趋势。以上结果提示:在食管癌变进程中,正常的食管间质成纤维细胞是处于静止期的,而在食管上皮受到外界刺激而基因突变时,间质被动的做出应答,与恶变上皮细胞临近的间质成纤维细胞逐步发生了活化,不典型增生成纤维细胞与癌旁纤维母细胞mRNAα-SMA的表达越来越强,肿瘤间质中的成纤维细胞可能是由最初的静止期正常成纤维细胞经半活化的不典型增生间质成纤维细胞而来。研究证实,肿瘤间质成纤维细胞α-SMA的表型获得与转化生长因子-β1(TGF-β1)密切相关,TGF-β1能下调纤维细胞CD34的表达,促进α-SMA的表达,诱导CD34细胞凋亡可能是其机制之一,而TGF-β1是可以由肿瘤细胞和癌旁纤维母细胞大量分泌的[7-9]。
肿瘤的发生机制目前尚不完全清楚,普遍认为,在癌变过程中上皮细胞的基因突变是主动的,间质反应只是被动地做出应答。以往有研究将已经发生了癌前病变的口腔上皮组织去掉,将其黏膜下层结缔组织与正常的口腔上皮组织贴合后发现,正常的口腔上皮会发生异型性改变,可见间质成纤维细胞在肿瘤的发生中扮演的不仅是被动的角色,本研究中间质成纤维细胞在癌前病变时即可发生活化的现象也恰恰证实了这一观点。由此可见食管癌变进程中间质成纤维细胞的表型变化具有非常重要的意义。
[1]Polyak K,Haviv I,Campbell IG.Co-evolution of tumor cells and their microenvironment[J].Trends Genet,2009,25(1):30-38.
[2]王瑞芬,黄坊,孙和国,等.α-SMA和MMP-9在乳腺癌中的表达及意义[J].诊断病理学杂志,2013,20(2):91-93,96.
[3]李青,纪捷,张静敏,等.子宫颈鳞状上皮内瘤变及鳞状细胞癌中间质细胞CD34、α-SMA的表达及意义[J].临床与实验病理学杂志,2007,23(6):669-672.
[4]王瑞芬,王正彩,王健,等.胃癌间质中肿瘤相关纤维母细胞CD34和SMA的表达及意义[J].临床与实验病理学杂志,2007,23(4):412-415.
[5]Catalano V,Turdo A,Di Franco S,et al.Tumor and its microenvironment:A synergistic interplay[J].Semin Cancer Biol,2013,23(6B):522-532.
[6]Xue Z,Wu X,Chen X,et al.Mesenchymal stem cells promote epithelial to mesenchymal transition and metastasis in gastric cancer though paracrine cues and close physical contact[J].J Cell Biochem,2015,116(4):618-627.
[7]肖光,熊小亮,罗达亚,等.非小细胞肺癌中TGF-β_1与肿瘤相关纤维母细胞α-SMA及CD34表达的相关性和意义[J].广东医学,2011,32(14):1866-1869.
[8]莫立根,罗元,党阳,等.TGF-β1、CD34和α-SMA在鼻咽癌中的表达及其意义[J].现代肿瘤医学,2015,23(2):185-188.
[9]王立峰,王瑞芬,郝兆星,等.胃癌中肿瘤相关纤维母细胞蛋白表达改变及意义[J].世界华人消化杂志,2007,15(20):2263-2267.
[10]崔晓梅,章魁华.癌前病变结缔组织对正常粘膜上皮的作用[J].中华口腔医学杂志,1992,27(5):266-269.
Change of phenotype of stromal fibroblasts in esophageal carcinogenesis*
Xu Zhibin,Yuan Li,Zheng Xiuli,Wang Shijie,Wu Mingli△
(DepartmentofEndoscopy,theFourthHospitalofHebeiMedicalUniversity,Shijiazhuang,Hebei050011,China)
Objective To investigate the expressions of α-SMA in different esophageal stromal fibroblasts in esophageal carcinogenesis.MethodsIHC method was uesd to detect the expression of α-SMA protein in stromal fibroblasts of twenty normal esophageal tissues,eighty precancerous lesions and fifty esophageal carcinomas respectively.Three kinds of esophageal stromal fibroblasts were cultured primarily and cells immunohistochemical staining was carrired out after being purified.Expression of α-SMA was detected by RT PCR.ResultsIHC results showed that α-SMA expressions in normal,precancerous and cancerous lesions were of significant differences.RT-PCR results showed that α-SMA expressions were different significantly among three kinds of fibroblasts.ConclusionEsophageal stromal fibroblasts were activated with carcinogenensis.AFs was possibly the origion of CAFs.
esophageal neoplasms;stromal cells;stromal fibroblast;carcinogenesis;phenotype
河北省卫生厅医学科学研究重点课题计划(20160656)。作者简介:徐志彬(1976-),副主任医师,博士,主要从事食管癌早诊早治研究。△
,E-mail:xzblxh@sina.com。
R735.1
A
1671-8348(2016)27-3777-03
2016-03-11
2016-05-26)

