基于高通量测序的猪鞭虫雌、雄虫差异基因表达分析
周作勇,邵骜骏,徐婷婷,陈家磊,胡世君*
(1.西南大学荣昌校区动物医学系,重庆 402460;2.西南大学动物科技学院,重庆 400715)
基于高通量测序的猪鞭虫雌、雄虫差异基因表达分析
周作勇1,邵骜骏1,徐婷婷2,陈家磊2,胡世君1*
(1.西南大学荣昌校区动物医学系,重庆 402460;2.西南大学动物科技学院,重庆 400715)
为了探明猪鞭虫(Trichurissuis)雌、雄虫的转录组差异,丰富T.suis转录组数据信息,利用Illumina Hiseq 2000对临床采集的T.suis雌、雄虫进行高通量测序,将组装得到的Unigenes在NR、GO、COG和KEGG数据库中比对注释,并进行差异表达基因分析。结果,T.suis雌、雄虫分别获得59 657 854条和48 414 184条高质量测序数据,分别组装获得21 026个和28 886个Unigenes。注释到NR、GO、COG和KEGG数据库的雌虫Unigenes数量分别为11 700、2 287、1 650和9 690个,雄虫Unigenes数量分别为12 902、2 414、1 791和10 377个,在NR数据库比对显示84.90%以上信息均来源于猪鞭虫。T.suis雌、雄虫共有4 320个差异表达基因。以雌虫为对照,雄虫中共有3 496个基因表达上调,有824个基因表达下调。共有906个差异表达基因获得160个KEGG通路富集,其中显著富集通路7个。在T.suis转录组中发现了许多重要基因的表达,包括与T.suis繁殖相关的主要精子蛋白、组蛋白H2A/H2B及卵黄蛋白原,与T.suis致病性、免疫及炎症调节相关的蛋白酶、丝氨酸蛋白酶抑制分子和半胱氨酸蛋白酶抑制分子,以及众多未知功能的基因。本研究揭示了T.suis雌、雄虫差异表达基因的数量,获得了这些差异表达基因的功能、分类和代谢通路注释,为丰富T.suis转录组信息,揭示鞭虫与宿主互作特点及抗鞭虫靶点药物研发奠定基础。
猪鞭虫;转录组;基因注释;差异表达基因
猪鞭虫(Trichurissuis)又称为猪毛尾线虫,主要寄生于猪盲肠,是仅次于蛔虫的猪最常见寄生性蠕虫之一。T.suis感染在世界范围内广泛存在[1-2],我国农户散养猪T.suis感染率甚至高达52%[3-4]。T.suis感染可引起猪腹泻、贫血和生长发育不良等,严重感染甚至造成死亡,给养猪业带来巨大的经济损失[5]。因此,如何有效地防制猪鞭虫病是急需要解决的问题。目前,猪鞭虫病主要依靠化学药物防制,由于治疗药物种类不多,防治效果较差[6],加之鞭虫耐药性及药物残留问题[7],筛选鞭虫免疫保护性抗原和基于药物靶点的新型药物研究无疑是一种有效的途径。另一方面,由于人肠道结构和生理特性与猪相似,T.suis与宿主的互作关系是研究鞭形鞭虫(T.trichiura)感染人的重要模型[8]。因T.suis及其分泌排泄物分子对宿主具有免疫应答和炎症反应调节作用[9-10],能有效降低人炎症性肠道疾病和溃疡性结肠炎等自身免疫相关疾病的临床症状而备受关注[11-12],然而T.suis与宿主的特异性互作关系尚不十分清楚[13]。
转录组学是功能基因组学研究的重要组成部分,转录组研究能够从整体水平研究基因功能以及结构,揭示特定生物学过程以及疾病发生过程中的分子机制[14]。随着寄生虫基因组信息的不断解析以及高通量测序技术的应用,越来越多的寄生虫包括间日疟原虫[15]、猫后睾吸虫[16]、日本血吸虫[17]、柔嫩艾美尔球虫[18]、肝片吸虫[19]和犬弓首蛔虫[20]等的转录组得以测序完成,为研究这些寄生虫的生物学特性、发育繁殖过程中的基因调控和免疫逃避机制等提供重要的依据。本研究以临床采集的T.suis为试验材料,对雌、雄虫进行高通量测序,进一步丰富T.suis的基因表达信息,为揭示鞭虫与宿主互作特点及抗鞭虫靶点药物研发提供基础。
1 材料与方法
1.1虫株来源
T.suis成虫采自于荣昌某猪场83日龄的发病猪,其临床表现为严重腹泻、食欲少、消瘦,曾以磺胺间甲氧嘧啶钠预混剂拌料饲喂,效果不明显。剖检发现病猪大肠上有圆形乳白色结节,肠黏膜出血,其上有大量鞭虫寄生,载虫量在200条以上。采集虫体后分别按雌虫(RC1-M)和雄虫(RC1-F)装入离心管,置于液氮冻存备用。
1.2T.suis总RNA的提取
按RNAisoTMPlus提取试剂盒(TaKaRa公司)说明书进行T.suis总RNA提取,通过NanoDrop2000及电泳检测RNA的浓度、纯度和完整性,总RNA置于-70 ℃保存备用。
1.3T.suis转录组测序
首先以磁珠法分离 mRNA,离子打断 mRNA;进行双链cDNA合成、补平、3′端加 A、连接index接头;然后进行文库富集,PCR扩增15个循环,以2%琼脂糖胶回收目的条带。通过TBS380(Picogreen)定量,按数据比例混合上机,cBot上进行桥式 PCR扩增,生成 clusters;通过Illumina HiSeqTM2000测序平台,进行高通量测序(转录组测序委托上海美吉生物医药科技有限公司完成)。
1.4T.suis转录组测序数据的处理与分析
通过碱基含量、碱基质量和碱基错误率分布统计对测序得到的原始数据(Raw data)进行评估。以SeqPrep和Sickle软件去除制备文库时产生的接头序列,修剪掉序列末端低质量的碱基,去除含N比率超过10%的reads,得到高质量的测序数据(Clean data)。以Trinity将所有Clean data从头组装,利用 Trinity 软件提供的ORF 预测流程对组装得到的所有转录本序列进行基因预测,使用Blast X(Version 2.2.25)分别与非冗余蛋白数据库(Non-redundant,NR)、基因本体论联合数据库(Gene ontology,GO) 、蛋白直系同源数据库(Clusters of Orthologous Groups,COG)和京都基因和基因组的百科全书(Kyoto Encyclopedia of Genes and Genome,KEGG)数据库进行比对获得相应的注释信息。
同理当连续缺失阵元数大于1时也可以通过相应的内插方法,重构出所有的缺失虚拟阵元响应,得到连续虚拟阵列流型B2,B2为(4MN-2N+1)×D维均匀阵列流型,因此
1.5T.suis雌、雄虫转录组差异基因的筛选
参考A.Mortazavi等[21]的方法计算FPKM(fragments per kilobase of exon per million mapped reads,FPKM),以评价对应基因的表达量。先用FC(Fold-change,倍数变化)和统计检测P值初选,然后以FDR (false discovery rate)校验方法对P值进行假阳性检验,筛选差异基因。以FDR≤0.05和|log2FC| ≥2为显著基因筛选标准。
1.6T.suis雌、雄虫转录组差异表达基因的GO、 KEGG注释及富集分析
将差异表达基因在GO、KEGG数据库中注释,使用Goatools软件进行差异基因的GO富集分析,以KOBAS软件进行KEGG PATHWAY富集分析,使用 Fisher 精确检验进行计算。使用多重检验方法(Bonferroni,Holm和false discovery rate)对P值进行校正以控制计算的假阳性率,当校正的P值(p_fdr)≤0.05时,认为存在显著富集。
2 结 果
2.1T.suis转录组测序数据质量检测
T.suis转录组测序数据质量如表1。通过测序所获得的总原始reads达111.17 M条,总原始碱基数为16.79 Gb。在清除引物、接头序列和低质量的测序数据后,所获得的T.suis高质量reads达108.07 M条(雌虫59.66 M条,雄虫48.41 M条),雌虫获得的碱基数为8.38 Gb,雄虫获得的碱基数为6.84 Gb,Q20在97%以上,Q30在92%以上。
表1测序数据评估统计
Table 1The statistical results of sequencing data
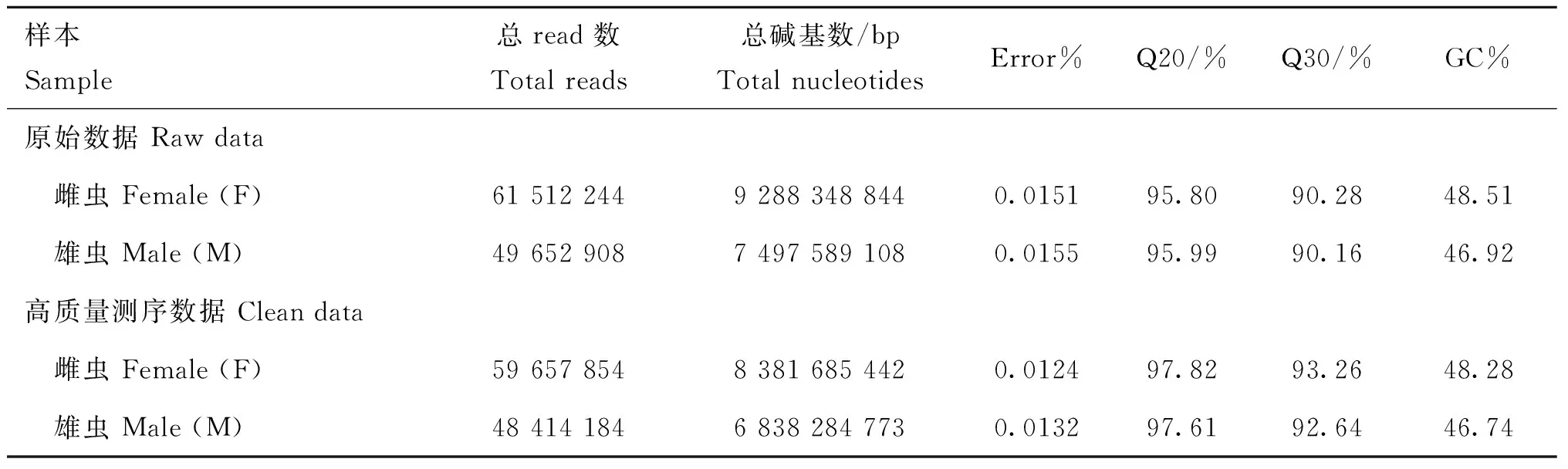
样本Sample总read数Totalreads总碱基数/bpTotalnucleotidesError%Q20/%Q30/%GC%原始数据Rawdata 雌虫Female(F)6151224492883488440.015195.8090.2848.51 雄虫Male(M)4965290874975891080.015595.9990.1646.92高质量测序数据Cleandata 雌虫Female(F)5965785483816854420.012497.8293.2648.28 雄虫Male(M)4841418468382847730.013297.6192.6446.74
Error %.碱基错误率;Q20.质量值大于或等于20的碱基所占的百分比;Q30.质量值大于或等于30的碱基所占的百分比;GC.测序结果中 G 和 C 两种碱基所占总碱基的百分比
Error % means error rate of base;Q20 means the percentage of quality value greater or equal to 20 base;Q30 means the percentage of quality value greater or equal to 30 base;GC means the percentage of G and C content of total base in sequencing result
2.2T.suis转录组的组装及注释

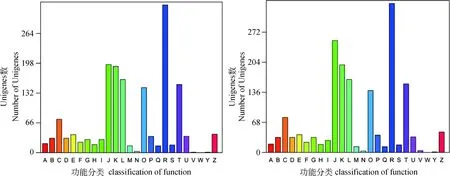
图1 T.suis 雌、雄虫Unigenes分布Fig.1 Unigenes distribution of T.suis
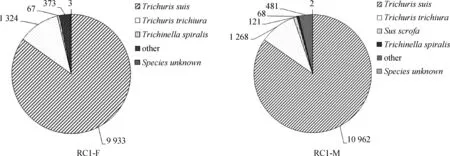
图2 T.suis 转录组的物种分布Fig.2 Species distribution of T.suis
2.2.3T.suis转录组GO数据库注释通过与GO数据库比对,所获得的T.suis转录组分别在生物过程、分子功能及细胞组分三个大类及64个亚类得以注释,在所获得的21 026条雌虫Unigenes中,注释了2 287条,共注释到了58个亚类,在28 886条雄虫Unigenes中,注释了2 414条,共注释到了63个亚类(表2)。
2.2.4T.suis转录组COG数据库注释根据序列同源性,共有1 650个T.suis雌虫Unigenes在COG数据库中得到注释,有1 791个雄虫Unigenes在COG数据库中得到注释,这些序列分为25个COG类别,包括细胞生理过程、信号传导和新陈代谢等(表3、图3)。
2.2.5T.suis转录组KEGG数据库注释注释到KEGG数据库中的Unigenes分别为9 690条(RC1-F)和10 377条(RC1-M),这些Unigenes分别注释到319条(RC1-F)和328条(RC1-M)信号通路,其中注释最多的均与代谢通路有关,雌虫Unigenes为626个,雄虫为634个。一些重要的代谢通路包括PI3K-Akt/PKB信号通路,P53、MAPK信号通路和AMPK信号通路均有注释。
2.3T.suis雌、雄虫表达差异分析及显著性富集
2.3.1T.suis雌、雄虫表达差异分析T.suis雌、雄虫共有4 320个差异表达基因,以雌虫作为对照,雄虫中共有3 496个基因表达上调,有824个基因表达下调,进一步将这些差异基因在NR数据库进行注释,得到2 352个注释基因,其中下调基因有 570 个,上调基因有1 782个(表4,图4)。与雌虫相比,极显著上调的基因有主要精子蛋白(major sperm protein)、活动精子结构域包含蛋白(motile sperm domain containing protein)、磷酸烯醇丙酮酸羧化激酶(phosphoenolpyruvate carboxykinase)、人表皮生长因子和组氨酸磷酸酶1包含蛋白(hEGF and His Phos 1 domain containing protein)、泛素蛋白酶(ubiquitin protease)、跨膜蛋白酶丝氨酸5(transmembrane protease serine 5)、跨膜丝氨酸蛋白酶 (membrane-type serine protease 1)、天冬氨酸蛋白酶(aspartate protease)、半胱氨酸蛋白酶(cysteine protease)、尿苷磷酸化酶2(Uridine phosphorylase 2)、Tau微管蛋白激酶1(Tau tubulin kinase 1)、组蛋白H2A/H2B(histone H2A/H2B)、桩蛋白(paxillin),蛋白质酪氨酸磷酸酶(protein-tyrosine phosphatase)、tigger 转座子衍生蛋白(tigger transposable element derived protein)、组蛋白赖氨酸 N-甲基转移酶(histone-lysine N-methyltransferase)等。而极显著下调的基因包括卵黄蛋白原(Vitellogenin)及卵黄原蛋白受体(Vitellogenin receptor),酪氨酸酶(tyrosinase),谷氨酰胺合成酶(glutamine synthetase)、丝氨酸:苏氨酸蛋白激酶MAK(serine:threonine protein kinase MAK)、丝氨酸蛋白酶抑制剂Kunitz-1(serine protease inhibitor Kunitz-1)、跨膜蛋白酶丝氨酸 11E (Transmembrane protease serine 11E)、转录因子AP-2 α(transcription factor AP-2 alpha)和细胞色素B561(Cytochrome b561)等。
表2T.suis转录组在GO数据库中的注释结果
Table 2Transcriptome annotation ofT.suisin GO database
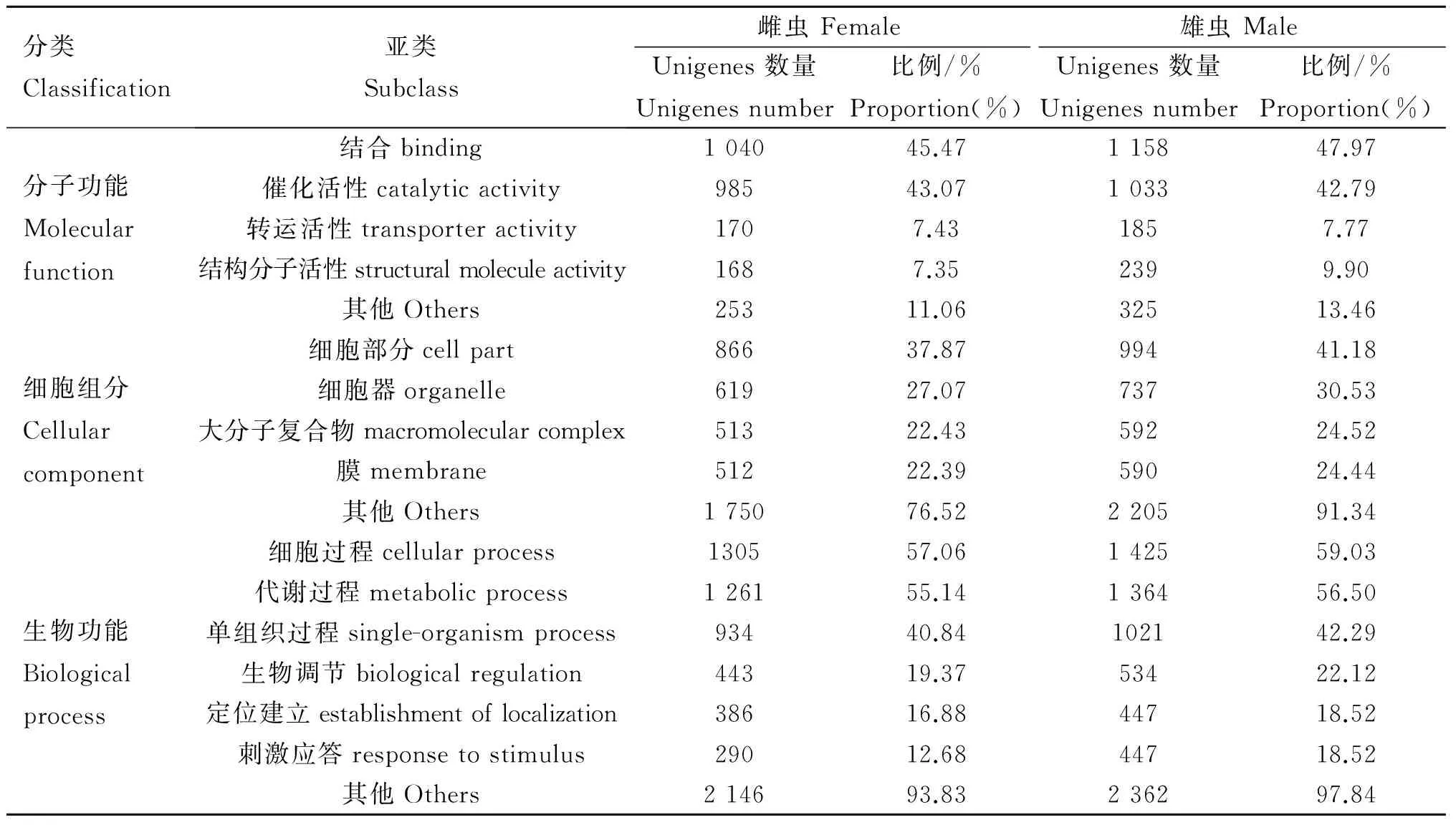
分类Classification亚类Subclass雌虫Female雄虫MaleUnigenes数量Unigenesnumber比例/%Proportion(%)Unigenes数量Unigenesnumber比例/%Proportion(%)分子功能Molecularfunction结合binding104045.47115847.97催化活性catalyticactivity98543.07103342.79转运活性transporteractivity1707.431857.77结构分子活性structuralmoleculeactivity1687.352399.90其他Others25311.0632513.46细胞组分Cellularcomponent细胞部分cellpart86637.8799441.18细胞器organelle61927.0773730.53大分子复合物macromolecularcomplex51322.4359224.52膜membrane51222.3959024.44其他Others175076.52220591.34生物功能Biologicalprocess细胞过程cellularprocess130557.06142559.03代谢过程metabolicprocess126155.14136456.50单组织过程single-organismprocess93440.84102142.29生物调节biologicalregulation44319.3753422.12定位建立establishmentoflocalization38616.8844718.52刺激应答responsetostimulus29012.6844718.52其他Others214693.83236297.84
表3T.suis转录组在COG数据库中的注释最多的前7位结果
Table 3Top 7 of functional_categories annotation ofT.suistranscriptome in COG database
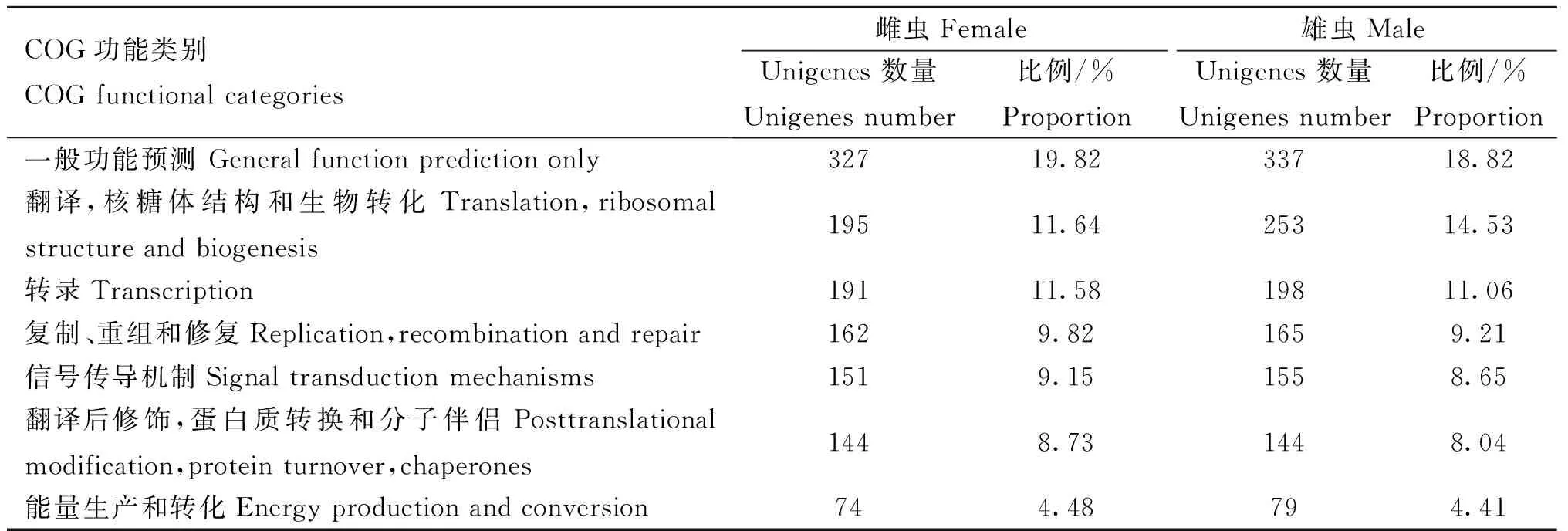
COG功能类别COGfunctionalcategories雌虫Female雄虫MaleUnigenes数量Unigenesnumber比例/%ProportionUnigenes数量Unigenesnumber比例/%Proportion一般功能预测Generalfunctionpredictiononly32719.8233718.82翻译,核糖体结构和生物转化Translation,ribosomalstructureandbiogenesis19511.6425314.53转录Transcription19111.5819811.06复制、重组和修复Replication,recombinationandrepair1629.821659.21信号传导机制Signaltransductionmechanisms1519.151558.65翻译后修饰,蛋白质转换和分子伴侣Posttranslationalmodification,proteinturnover,chaperones1448.731448.04能量生产和转化Energyproductionandconversion744.48794.41
A.RNA加工和修饰;B.染色质结构与动力学;C.能源生产和转换;D.细胞周期控制、细胞分裂、染色体分区;E.氨基酸运输和代谢;F.核苷酸运输和代谢;G.碳水化合物运输和代谢;H.辅酶运输和代谢;I.脂类运输和代谢;J.翻译、核糖体结构和生物转化;K.转录;L.复制、重组和修复;M.细胞壁/膜/包膜生源论;N.细胞运动性;O.翻译后修饰,蛋白质转换和分子伴侣;P.无机离子运输和代谢;Q.次生代谢产物生物合成、运输和分解代谢;R.一般功能预测;S.未知功能;T.信号传导机制;U.细胞内转运、分泌和膜泡运输;V.防卫机制;W.胞外结构;Y.细胞和结构;Z.细胞骨架A.RNA processing and modification;B.Chromatin structure and dynamics;C.Energy production and conversion;D.Cell cycle control,cell division,chromosome partitioning;E.Amino acid transport and metabolism;F.Nucleotide transport and metabolism;G.Carbohydrate transport and metabolism;H.Coenzyme transport and metabolism;I.Lipid transport and metabolism;J.Translation,ribosomal structure and biogenesis;K.Transcription;L.Replication,recombination and repair;M.Cell wall/membrane/envelope biogenesis;N.Cell motility;O.Posttranslational modification,protein turnover,chaperones;P.Inorganic ion transport and metabolism;Q.Secondary metabolites biosynthesis,transport and catabolism;R.General function prediction only;S.Function unknown;T.Signal transduction mechanisms;U.Intracellular trafficking,secretion,and vesicular transport;V.Defense mechanisms;W.Extracellular structures;Y.Nuclear structure;Z.Cytoskeleton图3 T.suis 转录组在COG注释结果Fig.3 Transcriptome annotation of T.suis in COG

图4 T.suis 雌、雄虫差异表达基因散点图和火山图Fig.4 Scatter plot and volcano plot of differentially expressed genes of T.suis
表4与雌虫相比,鞭虫雄虫中上调/下调幅度最大的前10位基因
Table 4The top 10 genes of up-regulated or down-regulated differential genes in maleT.suisvs femaleT.suis

基因号Gene_id雌虫FFPKM雄虫MFPKMlog2FC(M/F)FDRUp/Down功能Functioncomp76923_c00281.4514.471.01E-23up蛋白磷酸酶1comp72196_c00498.6914.253.56E-23up假定蛋白M513_06844comp77651_c00382.5413.981.86E-22up假定蛋白M513_08219comp70876_c00382.913.981.91E-22up假定蛋白M513_03647comp71933_c00361.4113.972.02E-22upUnknowncomp77333_c00290.0513.962.09E-22up假定蛋白TTRE_0000765901comp74102_c00139.3313.776.13E-22up假定蛋白M513_00687comp74270_c00263.7113.756.90E-22up假定蛋白M514_03450comp74177_c00324.9813.709.39E-22up假定蛋白M513_02983comp69213_c10747.0113.641.28E-21upUnknowncomp73933_c0166676.116.11-13.713.74E-32down假定蛋白M513_00366comp75470_c03793.860.59-12.971.01E-28down假定蛋白M513_11202comp64800_c0668.360.1-12.911.95E-26down假定蛋白M514_04483comp75804_c011115.921.84-12.806.56E-29down假定蛋白M513_00865comp60017_c01167.10.26-12.421.55E-26down假定蛋白M514_28338comp72998_c17799.151.87-12.372.07E-27down假定蛋白M514_17772comp72098_c0635.770.17-12.221.79E-26down假定蛋白M513_11229comp69325_c010440.142.66-12.152.42E-27down假定蛋白M513_04098comp75943_c085.740.02-11.996.83E-23down假定蛋白M513_02225comp39339_c0172.360-11.303.04E-15down假定蛋白M514_17772
此外,糜蛋白酶样蛋白酶 (chymotrypsin-like protease)、丝氨酸蛋白酶52(serine protease),乙酰胆碱酯酶(acetylcholinesterase,AchE)、三磷酸腺苷双磷酸酶(apyrase)、半胱氨酸蛋白酶抑制分子(cystatin)、丝氨酸蛋白酶抑制分子(serpin)、孔蛋白(porin)、半乳凝素(galectin)和巨噬细胞移动抑制因子(macrophage migration inhibitory factor)等在雌雄虫中均有表达,无显著性差异。
2.3.2T.suis雌、雄虫差异基因GO、KEGG通路显著性富集分析共有434个差异表达基因获得GO功能显著性富集,主要分为生物学过程和细胞组分2大类27个小类,其中显著性富集最多的主要参与基因与蛋白质导向(protein targeting)、转录启始和终止(translational initiation and termination)、内质网的蛋白质定位(establishment of protein localization to endoplasmic reticulum)及核转录mRNA分解代谢(nuclear-transcribed mRNA catabolic process)等。共有906个差异表达基因获得160个KEGG通路富集,7个为显著富集通路,其中2个与信号通路有关(Notch信号通路和胰岛素信号通路),1个与神经系统有关(长时程突触增强),2个与代谢有关(脂肪酸生物合成和硫代谢),2个与发育有关(背腹轴形成和卵母细胞减数分裂)(表5)。
3 讨 论
3.1猪鞭虫转录组测序质量评价
高通量核酸测序技术和生物信息学方法对于研究具有重要社会经济学价值的寄生虫,有着深远的意义[20]。本研究以Illumina HiSeqTM2000对T.suis雌、雄虫进行高通量测序,获得高达111.17M条原始reads。经分析评估,发现所测序列碱基分布均匀,碱基质量Q20在97%以上,Q30在92%以上,碱基的错误率均在0.1%以下。在清除引物、接头序列和低质量的测序数据后,雌、雄虫分别获得59 657 854条和48 414 184条高质量序列。组装获得T.suis雌、雄虫Unigenes数量分别为21 026条和28 886条。在NCBI-NR数据库注释的序列中,84.96%雄虫Unigenes来源于T.suis,9.83%来源于T.trichiura,而雌虫Unigenes中,84.90%来源于T.suis,其次为T.trichiura(11.32%),表明本次测序质量可靠,测序数据覆盖率较高。
表5T.suis差异表达基因显著性富集的通路
Table 5The top 10 significant enriched pathway for differentially expressed genes ofT.suis

通路Pathway差异基因1Differentialgene1KEGGunigenes2校正P值CorrectedPvaluesPathwayIDNotch信号通路Notchsignalingpathway31521.04×10-10ko04330背腹轴形成Dorso-ventralaxisformation24353.04×10-10ko04320胰岛素信号通路Insulinsignalingpathway32835.81×10-6ko04910脂肪酸生物合成Fattyacidbiosynthesis568.62×10-3ko00061卵母细胞减数分裂Oocytemeiosis22698.62×10-3ko04114硫代谢Sulfurmetabolism453.86×10-2ko00920长时程突触增强Long-termpotentiation14424.35×10-2ko04720
1.比对到 KEGG数据库某通路中的差异基因数;2.比对到KEGG数据库中某通路中所有基因数
1.Differentially expressed gene in each pathway in KEGG database;2.Gene numbers in this pathway in KEGG database
3.2猪鞭虫雌、雄虫的差异表达基因
本研究发现,与雌虫相比,雄虫中显著上调的基因有主要精子蛋白、活动精子结构域包含蛋白、磷酸烯醇丙酮酸羧化激酶、人表皮生长因子和组氨酸磷酸酶1包含蛋白、泛素蛋白酶、跨膜蛋白酶丝氨酸5、跨膜丝氨酸蛋白酶、天冬氨酸蛋白酶、半胱氨酸蛋白酶、尿苷磷酸化酶2、Tau微管蛋白激酶1、组蛋白H2A/H2B、桩蛋白、蛋白质酪氨酸磷酸酶、tigger 转座子衍生蛋白和组蛋白赖氨酸 N-甲基转移酶等。雄虫中显著下调的基因有卵黄蛋白原及卵黄原蛋白受体、酪氨酸酶、谷氨酰胺合成酶、丝氨酸:苏氨酸蛋白激酶MAK、丝氨酸蛋白酶抑制剂Kunitz-1、跨膜蛋白酶丝氨酸 11E、转录因子AP-2α和细胞色素B561等。在雄虫高度表达的基因中,精子蛋白是线虫独有的表达丰富的细纤维蛋白,是精子的主要成分[22],组蛋白H2A/H2B亚型及其翻译后修饰也与精子生成相关[23-24]。在雌虫中高度表达的卵黄蛋白原及卵黄原蛋白受体与胚胎发育直接相关,其中卵黄蛋白原是一种普遍存在于卵生非哺乳动物中重要的生殖蛋白,主要参与卵生动物生殖、发育等生理过程,是胚胎发育的主要能源物质[25]。而其他差异性表达基因的功能有待进一步研究。
此外,本研究显示糜蛋白酶样蛋白酶、丝氨酸蛋白酶52、乙酰胆碱酯酶、丝氨酸蛋白酶抑制分子、半胱氨酸蛋白酶抑制分子、三磷酸腺苷双磷酸酶、孔蛋白、半乳凝素和巨噬细胞移动抑制因子等在雌雄虫中均有表达,差异不显著。其中孔蛋白与形成包裹鞭虫杆状体的合胞体隧道有关[26];三磷酸腺苷双磷酸酶可阻止调节性T细胞向促炎性T细胞转化[13];糜蛋白酶样蛋白酶与寄生线虫侵入宿主[27]、免疫抑制[28]和破坏组织[29]密切相关;丝氨酸蛋白酶抑制分子可抑制中性白细胞蛋白酶组织蛋白酶G和弹性蛋白酶[30];半胱氨酸蛋白酶抑制分子不仅抑制宿主抗原递呈所需的半胱氨酸蛋白酶类以降低促炎T细胞的激活,还可引发免疫抑制细胞因子IL-10释放,减少抗原递呈细胞共刺激分子的表达,直接抑制T细胞的增殖[30];一些模拟宿主的凝集素、半乳凝素和巨噬细胞移动抑制因子可以宿主多糖为靶点,可能参与多糖结合串联调节宿主的免疫抑制过程[13,30-32];而乙酰胆碱酯酶能水解破坏宿主神经递质乙酰胆碱以阻止其信号传导[30,33]。本研究结果表明T.suis雌、雄虫具有显著性差异表达的基因大多与虫体性别及繁殖密切相关,而与鞭虫致病性、免疫抑制及抗炎相关基因在T.suis雌、雄虫中的表达差异不显著。
3.3 猪鞭虫雌、雄虫差异表达基因的富集分析
在生物体内,不同基因相互协调来行使生物学功能,基于 Pathway 富集分析有助于进一步解读基因的功能。对差异基因进行 Pathway 富集分析,可以确定差异表达基因参与的主要代谢途径和信号传导途径,以及与其他基因的相互作用。本研究 KEGG Pathway分析表明,差异表达基因涉及到160个KEGG通路富集,其中Notch信号通路、胰岛素信号通路、长时程突触增强、脂肪酸生物合成和硫代谢、背腹轴形成和卵母细胞减数分裂通路显著富集。这些信号通路大多与生物代谢、组织细胞的分化和免疫调控等功能有关[34-37],本研究结果提示T.suis雌、雄虫在这些信号通路中的差异较大。
4 结 论
作者对T.suis转录组进行高通量测序分析,揭示了T.suis雌、雄虫差异表达基因的数量,获得了这些差异表达基因的功能、分类和代谢通路注释,为丰富T.suis转录组信息,揭示鞭虫与宿主互作特点及抗鞭虫靶点药物研发奠定基础。
[1]NISSEN S,POULSEN I H,NEJSUM P,et al.Prevalence of gastrointestinal nematodes in growing pigs in Kabale District in Uganda[J].TropAnimHealthProd,2011,43(3):567-572.
[2]MATSUBAYASHI M,KITA T,NARUSHIMA T,et al.Coprological survey of parasitic infections in pigs and cattle in slaughterhouse in Osaka,Japan[J].JVetMedSci,2009,71(8):1079-1083.
[3]LAI M,ZHOU R Q,HUANG H C,et al.Prevalence and risk factors associated with intestinal parasites in pigs in Chongqing,China[J].ResVetSci,2011,91(3):e121-e124.
[4]WENG Y B,HU Y J,LI Y,et al.Survey of intestinal parasites in pigs from intensive farms in Guangdong Province,People’s Republic of China[J].VetParasitol,2005,127(3-4):333-336.
[5]ROEPSTORFF A,MEJER H,NEJSUM P,et al.Helminth parasites in pigs:new challenges in pig production and current research highlights[J].VetParasitol,2011,180(1-2):72-81.
[6]XIAO S H,UTZINGER J,TANNER M,et al.Advances with the Chinese anthelminthic drug tribendimidine in clinical trials and laboratory investigations[J].ActaTrop,2013,126(2):115-126.
[7]VERCRUYSSE J,SCHETTERS T P,KNOX D P,et al.Control of parasitic disease using vaccines:an answer to drug resistance?[J].RevSciTech,2007,26(1):105-115.
[8]BOES J,HELWIGH A B.Animal models of intestinal nematode infections of humans[J].Parasitology,2000,121 Suppl:S97-S111.
[9]HEWITSON J P,GRAINGER J R,MAIZELS R M.Helminth immunoregulation:the role of parasite secreted proteins in modulating host immunity[J].MolBiochemParasitol,2009,167(1):1-11.
[10]HIEMSTRA I H,KLAVER E J,VRIJLAND K,et al.Excreted/secretedTrichurissuisproducts reduce barrier function and suppress inflammatory cytokine production of intestinal epithelial cells[J].MolImmunol. 2014,60(1):1-7.
[11]SCHÖLMERICH J.Trichurissuisova in inflammatory bowel disease[J].DigDis,2013,31(3-4):391-395.
[12]SUMMERS R W,ELLIOTT D E,URBAN J J,et al.Trichurissuistherapy for active ulcerative colitis:a randomized controlled trial[J].Gastroenterology,2005,128(4):825-832.
[13]JEX A R,NEJSUM P,SCHWARZ E M,et al.Genome and transcriptome of the porcine whipwormTrichurissuis[J].NatGenet,2014,46(7):701-706.
[14]祁云霞,刘永斌,荣威恒.转录组研究新技术:RNA-Seq及其应用[J].遗传.2011,33(11):1191-1202.
QI Y X,LIU Y B,RONG W H.RNA-Seq and its applications:a new technology for transcriptomics[J].Hereditas,2011,33(11):1191-1202.(in Chinese)
[15]LIU G H,XU M J,SONG H Q,et al.De novo assembly and characterization of the transcriptome of the pancreatic flukeEurytremapancreaticum(trematoda:Dicrocoeliidae) using Illumina paired-end sequencing[J].Gene,2016,576(1 Pt 2):333-338.
[16]POMAZNOY M Y,LOGACHEVA M D,YOUNG N D,et al.Whole transcriptome profiling of adult and infective stages of the trematodeOpisthorchisfelineus[J].ParasitolInt,2016,65(1):12-19.
[17]WANG X,XU X,LU X,et al.Transcriptome Bioinformatical Analysis of Vertebrate Stages ofSchistosomajaponicumReveals Alternative Splicing Events[J].PLoSOne,2015,10(9):e138470.
[18]WALKER R A,SHARMAN P A,MILLER C M,et al.RNA Seq analysis of theEimeriatenellagametocyte transcriptome reveals clues about the molecular basis for sexual reproduction and oocyst biogenesis[J].BMCGenomics,2015,16(1):94.
[19]HACARIZ O,AKGUN M,KAVAK P,et al.Comparative transcriptome profiling approach to glean virulence and immunomodulation-related genes ofFasciolahepatica[J].BMCGenomics,2015,16(1):366.
[20]ZHU X Q,KORHONEN P K,CAI H,et al.Genetic blueprint of the zoonotic pathogenToxocaracanis[J].NatCommun,2015,6(2):6145.
[21]MORTAZAVI A,WILLIAMS B A,MCCUE K,et al.Mapping and quantifying mammalian transcriptomes by RNA-Seq[J].NatMethods,2008,5(7):621-628.
[23]RAMOS I,MARTIN-BENITO J,FINN R,et al.Nucleoplasmin binds histone H2A-H2B dimers through its distal face[J].JBiolChem,2010,285(44):33771-33778.
[24]鲁爽.精子发生过程中组蛋白H2A.H2B编码及功能研究[D].北京:中国协和医科大学,2009.
LU S.The research on histone H2A.H2B protein coding and function of spermatogenesis[D].Beijing:Peking Union Medical College,2009.(in Chinese)
[25]李兆杰,杨丽君,王静,等.卵黄蛋白原的研究进展[J].生命科学.2010,22(3):284-290.
LI Z J,YANG L J,WANG J,et al.The progress in studies on vitellogenin[J].ChineseBulletinofLifeSciences,2010,22(3):284-290.(in Chinese)
[26]TILNEY L G,CONNELLY P S,GUILD G M,et al.Adaptation of a nematode parasite to living within the mammalian epithelium[J].JExpZoolACompExpBiol,2005,303(11):927-945.
[27]TOUBARRO D,LUCENA-ROBLES M,NASCIMENTO G,et al.Serine protease-mediated host invasion by the parasitic nematodeSteinernemacarpocapsae[J].JBiolChem,2010,285(40):30666-30675.
[28]BALASUBRAMANIAN N,TOUBARRO D,SIM?ES N.Biochemical study and in vitro insect immune suppression by a trypsin-like secreted protease from the nematodeSteinernemacarpocapsae[J].ParasiteImmunol,2010,32(3):165-175.
[29]TOUBARRO D,LUCENA-ROBLES M,NASCIMENTO G,et al.An apoptosis-inducing serine protease secreted by the entomopathogenic nematodeSteinernemacarpocapsae[J].IntJParasitol,2009,39(12):1319-1330.
[30]HEWITSON J P,GRAINGER J R,MAIZELS R M.Helminth immunoregulation:the role of parasite secreted proteins in modulating host immunity[J].MolBiochemParasitol,2009,167(1):1-11.
[31]KLAVER E J,KUIJK L M,LAAN L C,et al.Trichurissuis-induced modulation of human dendritic cell function is glycan-mediated[J].IntJParasitol,2013,43(3-4):191-200.
[32]VERMEIRE J J,CHO Y,LOLIS E,et al.Orthologs of macrophage migration inhibitory factor from parasitic nematodes[J].TrendsParasitol,2008,24(8):355-363.
[33]SELKIRK M E,LAZARI O,HUSSEIN A S,et al.Nematode acetylcholinesterases are encoded by multiple genes and perform non-overlapping functions[J].ChemBiolInteract,2005,157-158:263-268.
[34]NOZAKI T,ALI V,TOKORO M.Sulfur-containing amino acid metabolism in parasitic protozoa[J].AdvParasitol,2005,60:1-99.
[35]MORGAN C T,NOBLE D,KIMBLE J.Mitosis-meiosis and sperm-oocyte fate decisions are separable regulatory events[J].ProcNatlAcadSciUSA,2013,110(9):3411-3416.
[36]RADTKE F,MACDONALD H R,TACCHINI-COTTIER F.Regulation of innate and adaptive immunity by Notch[J].NatRevImmunol,2013,13(6):427-437.
[37]FORTINI M E.Notch signaling:the core pathway and its posttranslational regulation[J].DevCell,2009,16(5):633-647.
(编辑白永平)
Differential Expression Analysis of Female and MaleTrichurissuisby a High-throughput Transcriptome Sequencing Method
ZHOU Zuo-yong1,SHAO Ao-jun1,XU Ting-ting2,CHEN Jia-lei2,HU Shi-jun1*
(1.DepartmentofVeterinaryMedicine,RongchangCampusofSouthwestUniversity,Chongqing402460,China;2.CollegeofAnimalScienceandTechnology,SouthwestUniversity,Chongqing400715,China)
To find transcriptome difference of female and maleTrichurissuis,and to enrich pig whipworm transcriptome data,the transcriptomes were analyzed by Illumina Hiseq 2000 high-throughput RNA sequencing.All of the assembled Unigenes were annotated using BLAST search against NR,GO,COG and KEGG databases.The differentially expressed genes were enriched in gene ontology and KEGG pathway.The results showed that 21 026 and 28 886 unigenes were got from female and maleT.suistranscriptomes which were assembled from 59 657 854 and 48 414 184 clean reads respectively.The annotated Unigenes of femaleT.suisto NR,GO,COG and KEGG databases were 11 700,2 287,1 650 and 9 690 respectively,while the data of maleT.suiswere 12 902,2 414,1 791 and 10 377.There were 4 320 differentially expressed genes found in female and maleT.suis,and more than 84.90% of the information were derived from pig whipworm in NR database.Take femaleT.suisfor reference,3 496 genes were up-regulated and 824 genes were down-regulated in maleT.suis.There were 906 differentially expressed genes enriched in KEGG pathways,and 7 of them were significantly enriched.Many important genes associated with reproduction including Major sperm protein,Histone H2A/H2B and Vitellogenin,and genes related to pathogenisis,immunity and inflammatory regulation such as protease,Serpin and Cystatin were found in transcriptome ofT.suis,in addition to these,there were many genes of unknown functions.This study revealed the number of differentially expressed genes in female and maleT.suis,and obtained the function,classification and metabolic pathways of the differentially expressed genes,which enrichedT.suistranscriptome information,and provide a solid basis for the study onT.suis-host interactions and developing anti-whipworm drugs.
Trichurissuis;transcriptome;gene annotation;differentially expressed genes
10.11843/j.issn.0366-6964.2016.09.021
2016-03-29
中央高校基本科研业务费专项基金资助项目(XDJK2015C030);重庆市社会事业与民生保障科技创新专项(CSTC2015SHMSZX80020)
周作勇(1979-),男,四川冕宁人,博士,副教授,主要从事动物传染病与寄生虫病防治研究。E-mail:zzyxnny@163.com
胡世君,男,副教授,E-mail:chhjj006@163.com
S852.73
A
0366-6964(2016)09-1914-10

