小麦成熟胚愈伤组织诱导及植株再生体系的优化
刘 君,蒋鲁亚,王君雅,刘晓颖,范宝莉,王振英
(天津师范大学a.生命科学学院,b.天津市动植物抗性重点实验室 300387)
小麦成熟胚愈伤组织诱导及植株再生体系的优化
刘君,蒋鲁亚,王君雅,刘晓颖,范宝莉,王振英
(天津师范大学a.生命科学学院,b.天津市动植物抗性重点实验室 300387)
为了建立和优化小麦成熟胚愈伤组织的诱导和植株再生体系,以京411、Brock、春麦S10鉴-6和春麦津强5号4种小麦的成熟胚为外植体,进行愈伤组织的诱导、分化及再生体系优化的研究.结果表明:(1)京411在各种诱导培养基中的平均出愈率高于其他3个品种;(2)京411在MS1(MS+2.0mg/L2,4-D+200mg/LCH+100mg/LMI+250mg/LGlu)培养基中的出愈率最高,因此将该培养基定为京411的最佳诱导培养基;(3)同不切相比,采用纵全切的方式处理京411的成熟胚能够获得较高的出愈率和质量较好的愈伤组织;(4)在分化培养基F7(MS+10mg/LZT+0.1mg/LIAA)中,京411成熟胚的愈伤组织分化率、出苗率和生根率最高,幼苗长势最好,因此该培养基可以用作京411成熟胚愈伤组织的分化培养基.
小麦;成熟胚;愈伤组织诱导;培养基;分化;再生
小麦是我国的主要粮食作物之一.在生产上,逆境胁迫和病虫害是制约小麦产量和质量的主要因素,培育抗逆、抗病、优质的小麦品种是解决这一问题的有效途径之一[1].目前小麦育种的主要技术有基因工程育种、细胞工程育种、轮回选择育种等,利用基因工程育种能够打破种间隔离,缩短育种年限,对小麦进行定向改良具有广阔的应用前景[2].在方法上,转基因技术可分为依赖和不依赖植物组织培养2类,依赖植物组织培养常见的转基因方法有基因枪法和农杆菌介导法[3].与烟草、大豆和水稻等作物相比,小麦组织培养的再生率低,遗传转化难度大,这在很大程度上阻碍了转基因技术在小麦育种中的应用.优化小麦愈伤组织再生体系,提高其植株再生率是小麦转基因研究的重要基础工作.
不同基因型小麦愈伤组织的再生能力差异很大,外植体的选择对植株再生能力也具有很大影响[4].目前小麦的幼胚[5]、成熟胚[6]、花药[7]、幼穗[8]等多种材料均已被选作外植体进行愈伤组织诱导和植株再生研究.由于来源于幼胚的愈伤组织再生能力较强,因此多数研究都以幼胚为外植体进行诱导[9-10].但小麦幼胚的获得受季节限制,而且幼胚的消毒程度不易控制,消毒力度小在后续的诱导培养中容易染菌,消毒力度大又会抑制愈伤组织生长,降低诱导率[11].与幼胚相比,成熟胚作为外植体具有易于消毒、取材方便、不受季节限制等优点[12],但再分化率较幼胚低[13].
本研究以成熟胚为外植体,在种子消毒、成熟胚处理、激素浓度、诱导、分化、生根培养基的组成等方面进行优化,以期获得高频再生率的成熟胚愈伤组织诱导及植株再生体系,为小麦的遗传转化提供重要的基础性材料.与已有的京411再生体系的报道[14-15]相比,本研究的植株再生率显著提高.本研究建立的京411成熟胚组织培养及再生体系可以为后续的转基因研究提供良好的受体材料.
1 材料与方法
1.1植物材料
栽培小麦(Triticum aestivum L.)京411为农艺性状优良的华北地区当家品种,易感白粉病;栽培小麦Brock作为抗锈病资源由本课题组从英国引进;春麦S10鉴-6为强抗白粉病品种,春麦津强5号为易感白粉病品种,均由天津市农业科学院提供.上述小麦品种现均种植于天津师范大学生物科技园内.
1.2培养基
诱导培养基:分别以MS和NB为基本培养基并添加蔗糖、琼脂、营养物质和激素.分化培养基:以MS培养基为基本培养基,添加蔗糖和琼脂,并根据添加激素与否及激素不同配比构成8种分化培养基.生根培养基:以1/2的MS培养基为基本培养基,添加蔗糖和琼脂.以上所有培养基均添加蔗糖30 g/L,琼脂粉8.5 g/L,pH 5.8,在121℃下经1.1 kg/cm2高压湿热灭菌20 min.
各种培养基的具体成分如表1所示.
1.3方法
1.3.1种子处理
选取色泽、大小均匀的小麦种子,用体积分数为70%的乙醇溶液处理5 min,无菌水冲洗2~3次.用质量分数为50%的次氯酸钠溶液灭菌30 min,无菌水冲洗3次,4℃冷藏2 h后取出,再用无菌水冲洗1次.
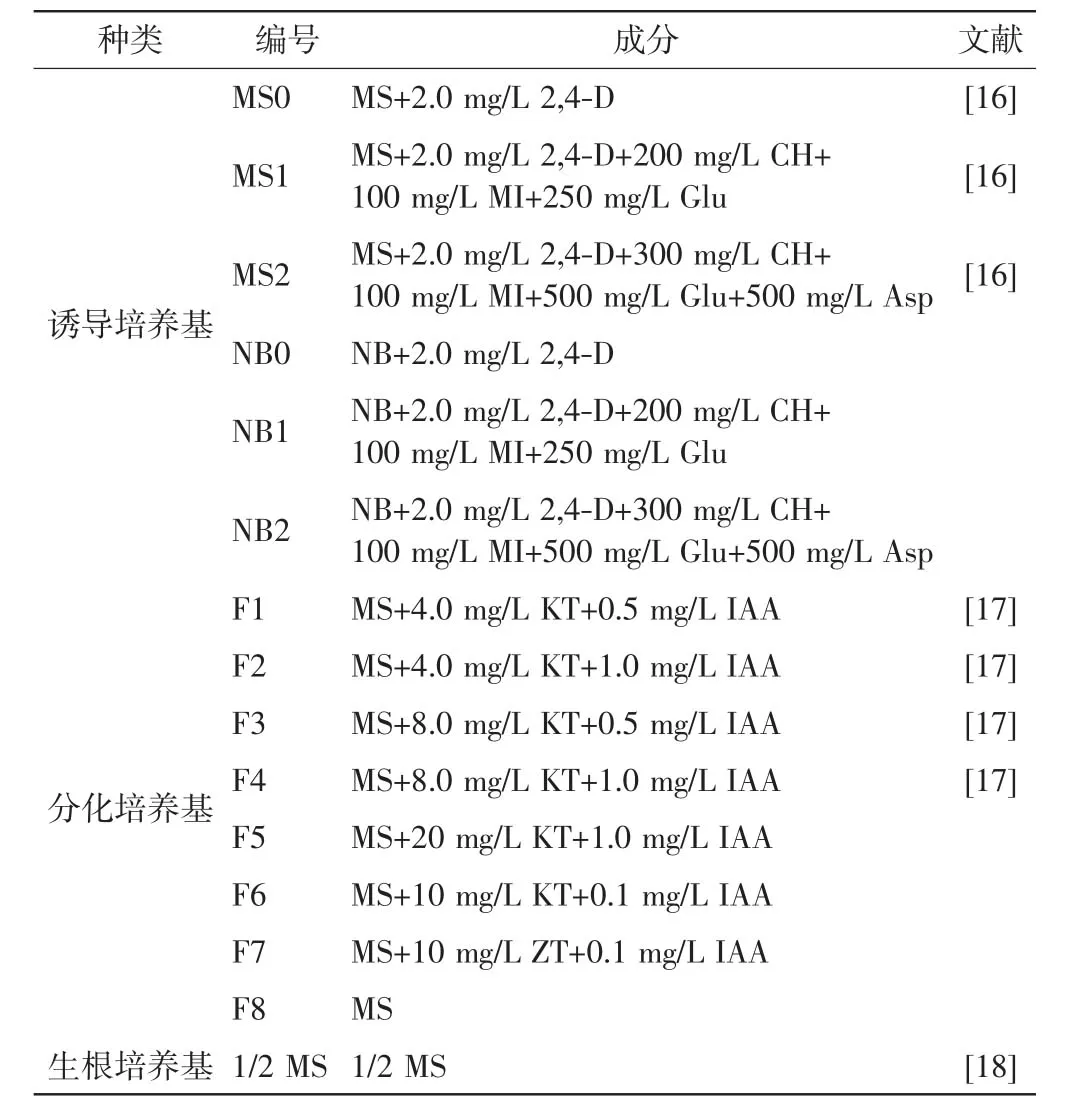
表1 培养基的编号及成分Tab.1 Numbers and ingredients of mediums
1.3.2成熟胚的诱导
选取有胚乳支撑的成熟胚,将其纵全切(沿胚轴完全切开至种脐),置于诱导培养基中,每皿接种20个.25℃下暗培养,在培养皿上标明品种、培养基、日期和接种外植体数,培养10 d后统计出愈率.挑选胚性愈伤组织继代,每周继代1次,继代4次后转入分化培养基进行光照培养,光强2000Lux,每天光照16h,培养温度为25℃,每15 d继代1次,30 d后统计愈伤组织分化率及出苗率.待分化苗长至3~4 cm时接入生根培养基中进行生根培养,30 d后统计植株生根率.
1.3.3组培苗的管理
待组培苗的根生长1个月后(根长约4~5 cm)将其炼苗培养,炼苗营养土为经高压蒸汽灭菌后的泥炭土、蛭石和珍珠岩,其比例为6∶3∶1.炼苗培养2周后将苗移栽至田间,定期管理,直至植株成熟收获.
1.3.4数据处理与分析

应用SPSS Statistics 17.0软件完成所有统计分析.成熟胚的脱分化实验中,每个处理设置3个重复,数据分析采用t检验.愈伤组织分化培养实验设置3个重复,采用单因素S-N-K检验法分析数据.
2 结果与分析
2.1基因型和诱导培养基对小麦成熟胚出愈率的影响
将4个品种的小麦接种在6种不同的诱导培养基中,出愈率结果如表2所示.2个冬小麦品种,即京411和Brock在接种第3天时,就开始有愈伤组织形成,但2个春麦品种,即春麦S10鉴-6和春麦津强5号接种6 d后才诱导出愈伤组织.由于冬麦和春麦材料出愈的时间不同,因此连续观察了诱导15 d的出愈情况.结果发现,冬麦在诱导培养基上诱导7 d时,愈伤组织长势良好,可以满足继代培养要求;而春麦需要10 d的诱导才能切下愈伤组织进行继代培养,因此在诱导培养第10天统计各培养基的愈伤组织出愈率并评定愈伤组织质量.
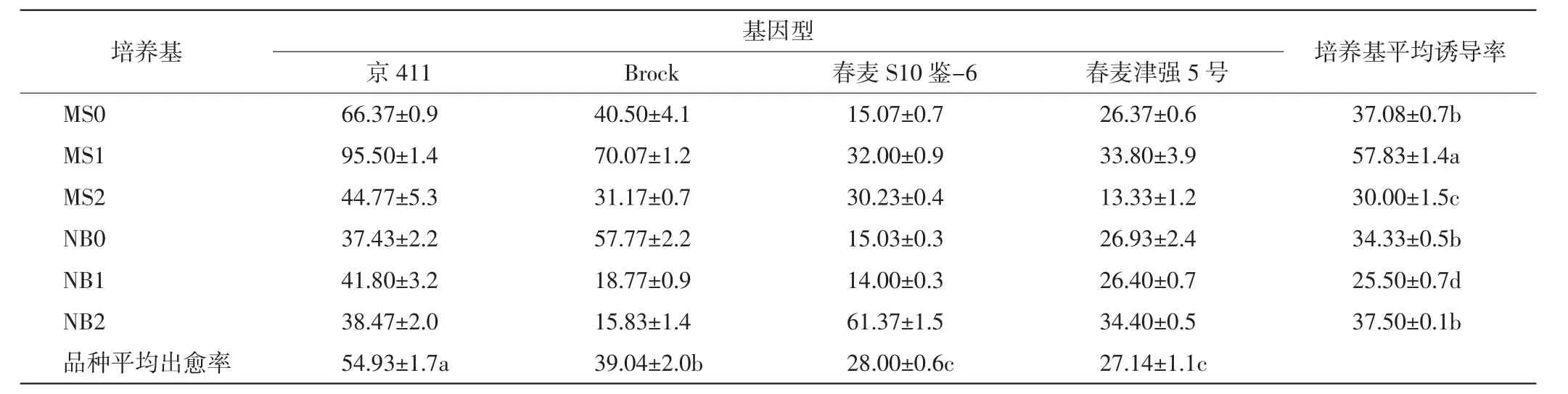
表2 4个品种小麦的成熟胚在诱导培养基上的出愈率Tab.2 Callus induction rate of mature embryos of four wheat genotypes in induction mediums %
统计结果发现,与其他3个品种相比,小麦京411成熟胚在6种诱导培养基中的平均出愈率最高,且在MS1培养基上的出愈率高达95.50%;Brock成熟胚在各培养基中的平均出愈率居中,也是在MS1中的出愈率最高,达到了70.07%;春麦S10鉴-6成熟胚在各诱导培养基中的平均出愈率仅次于Brock,其在NB2中的出愈率最高,达到了61.37%;春麦津强5号成熟胚在各诱导培养基中的平均出愈率最低,仅为27.14%,其在NB2培养基中的出愈率最高,为34.40%.这说明MS1培养基适用于冬麦品种京411和Brock,NB2培养基适用于春麦品种春麦S10鉴-6和春麦津强5号,冬麦品种比春夏品种更适合于进行愈伤组织诱导.结果还表明,本实验设计的6种诱导培养基中,MS1培养基诱导愈伤的平均出愈率最高,其次是MS0和NB2培养基.4个小麦品种在MS1培养基上的出愈情况如图1所示.
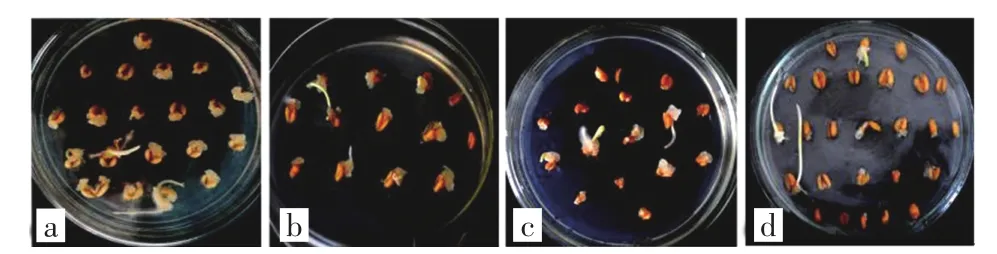
图1 4个不同品种的小麦成熟胚在MS1培养基上的出愈情况Fig.1 Callus induction information of mature embryos of four different wheat genotypes in MS1
综上所述,成熟胚基因型和培养基种类是出愈率的重要影响因素.由于4个品种中京411的平均出愈率最高且在MS1培养基上愈伤组织的出愈率达到了95.50%,因此选定MS1培养基作为京411的诱导培养基,并对京411的愈伤组织进行再生培养研究.
2.2不同处理方式对成熟胚形成愈伤组织的影响
以京411成熟胚为材料,比较纵全切(沿胚轴完全切开至种脐)和不切2种处理方式对其脱分化及形成愈伤组织状态的影响,2种方式各接种了约300颗种子于MS1培养基中,结果如图2所示.

图2 小麦京411成熟胚不切与纵全切的脱分化率Fig.2 Callus induction rate of mature embryos of jing411 with no cut or half longitudinal cut method
由图2(a)可以看出,未切的成熟胚形成胚芽较多,愈伤组织相对较少,并且长芽,胚因为长芽而呈空苞状,愈伤组织逐渐变小,出愈率仅为64.12%.纵全切胚的出愈效果较好,愈伤组织块大、干燥、呈淡黄色,出愈率达到95.50%,如图2(b)所示.这些结果表明,破坏胚的完整性能够抑制其萌发,从而将更多的营养物质用于愈伤组织的形成,提高了出愈率和愈伤组织的质量.这2种处理方式脱分化率差异显著,纵全切出愈效果较好,因此本实验采用纵全切方法处理京411的成熟胚.
2.3不同浓度2,4-D对小麦成熟胚愈伤组织诱导的影响
为筛选出最适宜京411成熟胚诱导愈伤组织的激素浓度,研究不同浓度的2,4-D对愈伤组织出愈率及质量的影响.诱导愈伤组织培养基(MS1)的2,4-D的质量浓度分别设置为0.5、1.0、2.0、4.0 mg/L.每个浓度的培养基中接种100个外植体,诱导培养7 d,重复3次.结果如表3和图3所示.

表3 不同浓度2,4-D对小麦京411成熟胚愈伤组织出愈率的影响Tab.3 Effect of different concentrations of 2,4-D on callus induction rate of mature embryos of Jing 411 %

图3 不同浓度2,4-D对小麦京411成熟胚诱导出的愈伤组织质量的影响Fig.3 Effects of different concentrations of 2,4-D on callus quality of mature embryos of Jing 411
由表3可以看出,诱导培养基的2,4-D质量浓度为2.0 mg/L时,愈伤组织出愈率最高达到95.50%,同其他浓度处理间的差异具有高度统计学意义(p≤0.01).在该质量浓度下,愈伤组织质量较好,呈颗粒状,如图3(a)所示.2,4-D质量浓度为4.0 mg/L时出愈率仅为78.67%,诱导出的愈伤组织大多为水浸状,乳白色,呈松散状态,甚至停止生长,如图3(b)所示.因此认为,小麦成熟胚诱导培养基2,4-D的质量浓度以2.0 mg/L为宜,后续的诱导过程中诱导培养基中2,4-D的质量浓度均采用2.0 mg/L.
2.4不同比例的激素KT、ZT和IAA对小麦成熟胚愈伤组织分化、出苗及生根的影响
将长势良好的愈伤组织继代培养4次后转移到不同的分化培养基上进行再分化,愈伤组织的分化和出苗情况如表4和图4所示.
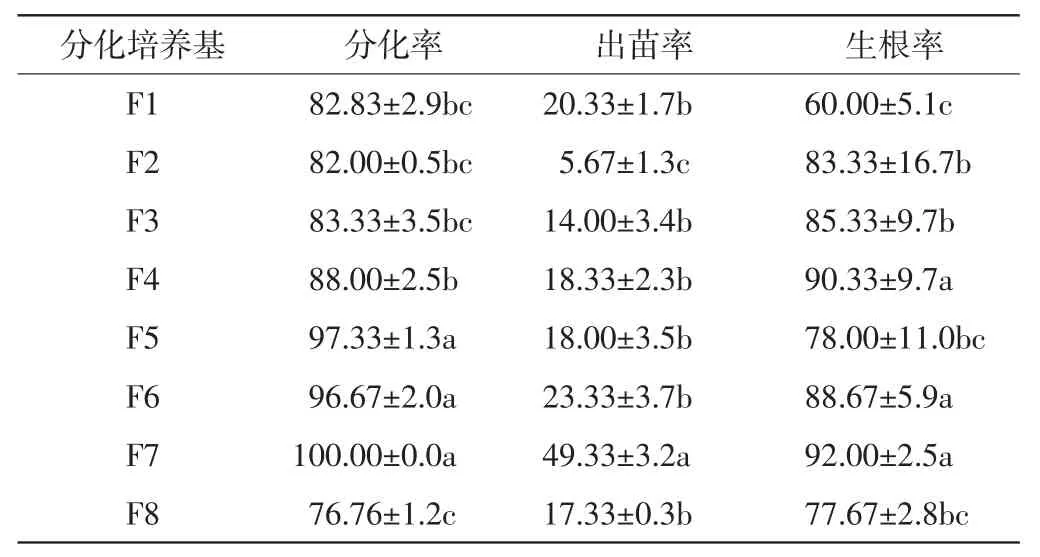
表4 不同激素配比对小麦京411愈伤分化率、出苗率及生根率的影响Tab.4 Effects of hormone ratios on differentiation rate,emergence rate and root rate of mature embryo %

图4 京411的愈伤组织在不同培养基中的分化出苗情况Fig.4 Differentiation and plantlet of callus of Jing 411 in different mediums
由表4可以看出,F7(10 mg/L的ZT+0.1 mg/L的I AA)培养基中,京411愈伤组织的分化率最大,达到100%,出苗率和生根率也最高,分别为49.33%和92.00%.其次是F6(10 mg/L的KT+0.1mg/L的IAA)培养基,出苗率(23.33%)虽然只有F7培养基中的1/2,但也高于其他培养基中的愈伤组织出苗率,而且该培养基中愈伤组织的生根率也较高,达到了88.67%.不添加任何激素的F8培养基中,愈伤组织的分化率最低,仅为76.76%,出苗率和生根率也属于较低水平.图4也显示京411愈伤组织在F7培养基中的分化和出苗情况最好,幼苗长势明显好于在其他培养基中的情况.因此认为,F7培养基最适合京411愈伤组织的再生,可以作为分化培养基.
2.5组培苗的炼苗、移栽及田间管理
愈伤组织继代4次后转移到分化培养基中进行再分化,大部分愈伤组织在1周后开始分化,长出绿点,15 d后开始出现植株幼苗,如图5(a)所示,期间持续统计各培养基中愈伤组织的分化率及出苗率.25 d后,幼苗长至3~4 cm高,如图5(b)所示.此时接入1/2 MS生根培养基中,如图5(c)所示.生根培养30 d后移栽炼苗,如图5(d)和5(e)所示.田间炼苗2周后植株叶片开始变壮,观察根的生长情况,如图5(f)所示,发现根明显比炼苗前粗壮,且长度和数目都增加.将炼苗后的植株移栽至田间,如图5(g)所示.为保证组培苗安全过冬,用一薄层芦苇草覆盖田间麦苗,翌年3月初组培苗正常返青,4月可发现植株分蘖,植株数量明显增多,茎干粗壮,如图5(h)所示.5月初植株开始抽穗,如图5(i)所示,待麦穗成熟后收割,如图5(j)所示.平均每颗穗约收51粒种子,如图5(k)所示.

图5 小麦京411愈伤组织分化再生成苗、再生苗的生根培养、炼苗培养、移栽至成熟过程Fig.5 Callus differentiation into plantlet,plantlet rooting,acclimatization,transplant and mature of Jing 411
3 讨论和结论
成熟胚作为外植体诱导愈伤组织过程中存在的主要问题是再生成苗率较低.从目前的研究结果看,成熟胚诱导的愈伤组织再生植株效率总体在20%左右[19-22],仅张东武在小麦西农928中获得了77.6%的高频再生植株[19],远远达不到遗传转化的需求.
本课题组对京411、Brock、春麦S10鉴-6和春麦津强5号共4个不同遗传背景的小麦品种的再生体系进行了研究.实验设计了6种诱导培养基,用这6种培养基分别诱导培养4个小麦品种,发现基因型和诱导培养基的成分是影响小麦成熟胚出愈率的重要因素.本研究结果发现,京411在6种培养基中的平均出愈率高于其他3个小麦品种的数值.京411是华北地区广泛种植的小麦优良品种,但对白粉菌敏感,建立京411成熟胚再生体系,对该品种进行基因转化、抗病基因聚集以及品种改良具有重要意义.叶兴国等[14]以京411花药为材料进行再生研究,发现与其他材料相比,京411的花药诱导愈伤组织较难,或很难再生植株;后猛[15]利用京411成熟胚诱导愈伤组织,其出苗率仅为7.25%.而本实验构建的诱导培养体系中,以京411成熟胚为外植体,用MS1培养基诱导愈伤组织、用添加10 mg/L的ZT+0.1 mg/L的IAA的MS培养基分化再生,最终能够使京411成熟胚的再生出苗率高达49.33%.
张东武等[19]用纵半切、纵全切、横切、刮碎的方式对小偃216成熟胚进行脱分化培养,发现用纵半切全胚接种,几乎完全抑制了胚萌发,形成的愈伤组织状态最佳,优于纵全切胚.本研究采用纵全切和不切2种方式处理成熟胚,并进行脱分化培养,结果发现纵全切的脱分化率(95.50%),即出愈率显著高于不切的脱分化率(64.12%),且愈伤组织质量也有明显差异,前者诱导的愈伤组织块较大,颗粒明显,胚芽生成较少,而后者愈伤组织块较小,颗粒不明显,胚芽生成较多.这表明纵全切处理具胚乳支撑的成熟胚能够有效抑制胚芽分化,更多的营养供给愈伤组织,有利于愈伤组织的形成,从而提高脱分化率.
李丕军等[23]在用银x新杨的叶外植体材料进行研究时,比较了BA、ZT、KT、TDZ等激素对叶外植体再生的影响,发现作用效果为TDZ>ZT>BA>KT.本研究采用7种含有不同种类和浓度激素的分化培养基对小麦京411成熟胚的愈伤组织进行再生培养,发现在添加了10mg/L的ZT和0.1mg/L的IAA的MS培养基中,京411成熟胚的分化率、出苗率和生根率都高于其他培养基,证明ZT具有较好的诱导愈伤组织分化成苗的作用.
[1]李振声.我国小麦育种的回顾与展望[J].中国农业科技导报,2010,12(2):1-4.LI Z S.Retrospect and prospect of wheat breeding in China[J].Journal ofAgricultureScienceandTechnology,2010,12(2):1-4(inChinese).
[2]LI J,YE X,AN B,et al.Genetic transformation of wheat:current status and future prospects[J].Plant Biotechnology Reports,2012,6(3):183-193.
[3]张婷婷.植物非组培转化法获得转基因植株[D].太原:山西大学,2011.ZHANG T T.Introduction of transgenic plants via non-tissue-culture methods[D].Taiyuan:Shanxi University,2011(in Chinese).
[4]覃建兵,何光源.不同小麦基因型及其不同外植体离体培养研究初探[J].华中农业大学学报,2001,20(6):522-527.QIN J B,HE G Y.Preliminary study on in vitro culture of different wheat genotypes and their explants[J].Journal of Huazhong Agricultural University,2001,20(6):522-527(in Chinese).
[5]安海龙,卫志明,黄健秋.小麦幼胚培养高效成株系统的建立[J].植物生理学报,2000,26(6):532-538.AN H L,WEI Z M,HUANG J Q.High efficiency regeneration of wheat plants from immature embryos[J].Acta Plytophysiologica Sinica,2000,26(6):532-538(in Chinese).
[6]刘芳,周翠红,李丽雅,等.不同遗传背景小麦成熟胚再生体系的初步研究[J].麦类作物学报,2010,30(1):39-42.LIU F,ZHOU C H,LI L Y,et al.Preliminary study on the regeneration system of mature wheat embryos with different genetic background[J].Journal of Triticeae Crops,2010,30(1):39-42(in Chinese).
[7]陈红,秦瑞珍.提高水稻同源四倍体花药培养愈伤诱导率的研究[J].作物学报,2007,33(1):120-125.CHEN H,QIN R Z.Improvement of callus induction efficiency in anther culture of autotetraploid rice[J].Acta Agronomica Sinica,2007,33(1):120-125(in Chinese).
[8]栗聪.小麦组织培养及幼穗一传体系建立的优化[D].榆林:西北农林科技大学,2014.LI C.The optimization of wheat culture system an Yang Spike transformation system[D].Yulin:Northwest Agriculture and Forestry University,2014(in Chinese).
[9]石珍源,殷桂香,杜丽璞,等.小麦大龄幼胚再生性能改进与农杆菌转化[J].中国农业科学,2011,44(2):225-232.SHIZY,YINGX,DULP,etal.Plantregenerationandagrobacteriummediated transformation using large immature embryos of wheat[J].Scientia Agricultura Sinica,2011,44(2):225-232(in Chinese).
[10]别晓敏,杜丽璞,佘茂云,等.不同生长素类型及ABA搭配对小麦幼胚再生效果的影响[J].核农学报,2011,25(5):1023-1028.BIE X M,DU L P,SHE M Y,et al.Effects of different auxins and combining application with ABA on regeneration of immature embryos of wheat[J].Journal of Nuclear Agricultural Sciences,2011,25(5):1023-1028(in Chinese).
[11]杨玉萍,李红玲,应浩.冬小麦成熟胚立体培养中的消毒处理研究[J].安徽农业学报,2010,38(15):7764-7766.YANG Y P,LI H L,YING H.Sterilization treatments of triticum aetivum mature embryo culture in vitro[J].Journal of Anhui Agriculture Science,2010,38(15):7764-7766(in Chinese).
[12]MIKHAIL F,DMITRY M,DARYA V,et al.The effect of auxins,time exposure to auxin and genotypes on somatic from mature embryos of embryogenesis wheat[J].Plant Cell,Tissue and Organ Culture,2006,84(2):213-222.
[13]李娜,焦浈,谷运红,等.小麦组织培养研究进展[J].河南农业科学.2005(8):11-14.LI N,JIAO Z,GU Y H,et al.Research advances of wheat tissue culture[J].Journal of Henan Agricultural Sciences,2005(8):11-14(in Chinese).
[14]叶兴国,徐惠君,徐琼芳,等.小麦花药培养力的基因型差异和配合力分析[J].中国农业科学,1997,30(6):50-54.YE X G,XU H J,XU Q F,et al.Genetic analysis and combining ability evaluation of the anther culture response in common wheat[J].Scientia Agricultura Sinica,1997,30(6):50-54(in Chinese).
[15]后猛.农杆菌介导小麦遗传体系的建立及转化体系的建立及转基因研究[D].泰安:山东农业大学,2008.HOU M.The establishment of wheat transformation system mediated by A.tumefaciens and the studies on transgene[D].Taian:Shandong Agricultural University,2008(in Chinese).
[16]王新国,任江萍.不同培养基及激素配比对小麦成熟胚离体培养的影响[J].安徽农业科学,2008,36(6):2240-2242.WANG X G,REN J P.Effect of different media and hormone proportioning on the in vitro culture of mature wheat embryo[J].Journal of Anhui Agricultural Sciences,2008,36(6):2240-2242(in Chinese).
[17]唐宗祥,张怀琼,张怀渝,等.2,4-D、KT对小麦成熟胚愈伤组织形成、分化的影响[J].四川农业大学学报,2004,22(3):203-205.TANG Z X,ZHANG H Q,ZHANG H Y,et al.Effect of 2,4-D,KT on callus formation and plantlet regeneration from mature wheat(Triticum eastivuml L.)embryos[J].Journal of Sichuan Agricultural University,2004,22(3):203-205(in Chinese).
[18]BI R M,JIA H Y,FENG D S,et al.Production and analysis of transgenic wheat(Triticum aestivum L.)with improved insect resistance by the introduction of cowpea trypsin inhibitor gene[J].Euphytica,2006,151(3):351-360.
[19]张东武,刘辉,赵慧贤.小麦成熟胚组织培养再生体系的优化及高再生率基因型的筛选[J].麦类作物学报,2001,31(5):847-852.ZHANG D W,LIU H,ZHAO H X.Optimization of regeneration system of tissue culture from mature embryos and screening of wheat genotypes with high regeneration frequency[J].Journal of Triticeae Crops,2001,31(5):847-852(in Chinese).
[20]陈学虎,陈耀锋,王丽,等.基因型和2,4-D浓度对小麦不同外植体离体培养特性的影响[J].麦类作物学报,2013,33(3):450-454.CHEN X H,CHEN Y F,WANG L,et al.Study on effect of genotype and 2,4-D concentration on explant in vitro culture traits[J].Journal of Triticeae Crops,2013,33(3):450-454(in Chinese).
[21]李映辉,宋娜,王瑜辉,等.小麦成熟胚培养方法的优化及其在小麦遗传转化中的应用[J].麦类作物学报,2013,33(1):6-12.LI Y H,SONG N,WANG Y H,et al.Optimization of the tissue culture method using wheat mature embryos and its application in wheat transformation[J].Journal of Triticeae Crops,2013,33(1):6-12(in Chinese).
[22]栗聪,雒景吾,张磊,等.小麦成熟胚再生体系优化及优良受体基因型筛选[J].麦类作物报,2014,34(5):583-590.LI C,LUO J W,ZHANG L,et al.Optimizing the regeneration system from mature embryo and screening of elite wheat genotypes[J].Journal of Triticeae Crops,2014,34(5):583-590(in Chinese).
[23]李丕军,李宏,朱玉伟,等.不同激素对银x新杨叶外植体芽分化的影响[J].东北林业大学学报,2005,33(8):136-139.LI P J,LI H,ZHU Y W,et al.Different hormone on the bud differentiation of leaf explant for Populus alba L.var pyamidalis[J].Journal of Northeast Forestry University,2005,33(8):136-139(in Chinese).
(责任编校纪翠荣)
Optimization of regeneration culture system from wheat mature embryos
LIU Jun,JIANG Luya,WANG Junya,LIU Xiaoying,FAN Baoli,WANG Zhenying
(a.College of Life Sciences,b.Tianjin Key Laboratory of Animal and Plant Resistance,Tianjin Normal University,Tianjin 300387,China)
To establish and optimize an induction and regeneration culture system for wheat mature embryos,the mature embryos of cultivar wheat Jing 411,Brock,spring wheat S10jian-6 and Jinqiang 5 were adopted as explants to study the optimization of induction,differentiation and regeneration system of callus.The results showed that:(1)Jing 411 had higher average callus induction rate than the other three varieties in all kinds of induction mediums;(2)The induction rate of Jing 411 in MS1 medium(MS+2.0 mg/L 2,4-D+200 mg/L CH+100 mg/L MI+250 mg/L Glu)was higher than that in the other mediums,so MS1 was taken as the best induction medium;(3)Compared with the mature embryos of Jing 411 treated with no cut method,the embryos treated with half longitudinal cut method can obtain higher induction rate and callus with better quality;(4)In F7 medium(MS+10 mg/L ZT+0.1 mg/L IAA),the differentiation rate and the emergence rate of callus of Jing 411 were higher than those in the other mediums,and the seedlings grew better.So,F7 can be used as differentiation medium for the callus of mature embryos of Jing 411.
wheat;mature embryo;callus induction;medium;differentiation;regeneration
Q945
A
1671-1114(2016)02-0059-06
2015-11-23
国家自然科学基金资助项目(31071671);天津市科委青年基金资助项目(14JCQNJC14900);天津市科技支撑重点资助项目(11ZCKFNC00700).
刘君(1990—),女,硕士研究生.
王振英(1966—),女,教授,主要从事植物细胞遗传学方面的研究.

