高速逆流色谱法用于纵条纹炭角菌中过氧麦角甾醇的分离纯化
黄 毅,雷传文,宋 航,杨智芹,袁小红,贺新生
(1.西南科技大学生命科学与工程学院,四川绵阳 621010;2.四川大学化学工程学院,四川成都 610065)
高速逆流色谱法用于纵条纹炭角菌中过氧麦角甾醇的分离纯化
黄毅1,2,雷传文1,宋航2,杨智芹1,袁小红1,贺新生1
(1.西南科技大学生命科学与工程学院,四川绵阳 621010;2.四川大学化学工程学院,四川成都 610065)
过氧麦角甾醇生物活性多样,具有较大开发价值,但传统柱色谱分离手段步骤多效率低,本文建立了高速逆流色谱从纵条纹炭角菌中高效快速制备过氧麦角甾醇的方法。通过高效薄层色谱和高效液相色谱测定分配系数,再利用高速逆流色谱考查了多个溶剂体系的分离效果,确定最佳溶剂体系为:正己烷-乙酸乙酯-乙醇-水(体积比为3∶1∶2∶0.8)。以上相为固定相,下相为流动相,转速为800 r/min(正转),流速为2 mL/min,检测波长为220 nm。制备所得过氧麦角甾醇经13C-NMR和1H-NMR鉴定,并经高效液相色谱分析纯度达到96.05%(峰面积归一化法)。经DPPH体外抗氧化活性测试,发现该化合物在0.2 mg/mL时,对DPPH自由基清除为28.36%,远低于阳性对照抗坏血酸(93.41%),且量价关系也不明显,表明其DPPH自由基清除能力较弱。该方法制备过氧麦角甾醇简便、快速,所得产物纯度高,可用于纵条纹炭角菌中该化合物的分离。
过氧麦角甾醇,高速逆流色谱,纵条纹炭角菌,抗氧化活性
纵条纹炭角菌(XylariastriataPat. 1887),属子囊菌门(Ascomycota),盘菌亚门(Pezizomycotina),粪壳菌纲(Sordariomycetes),炭角菌亚纲(Xylariomycetidae),炭角菌目(Xylariales),炭角菌科(Xylariaceae),炭角菌属(XylariaHillex Schrank),原始标本采自中国南京的棕榈树(Trachycarpusfortunei)树干上[1]。文献报道同属的黑柄炭角菌具有改善中枢神经系统、造血、抗前列腺增生以及提高机体免疫等功能[2],目前已有医药产品开发成功并上市销售。化学成分研究也发现同属多种炭角菌中具有各种活性小分子[3-8]。本课题组于2012年在四川省绵阳市重新发现该种后便开始对该菌展开系统性研究,先期完成了培养优化工作[9-11]。在后续化合物分离工作中,笔者发现该菌含有较多的真菌标识型化合物麦角甾醇,在HPLC跟踪比对过程中发现了麦角甾醇的氧化物-过氧麦角甾醇(如图1所示)也有较高含量。

图1 过氧麦角甾醇结构式Fig.1 The structural formula of ergosterol peroxide
过氧麦角甾醇(CAS:2061-64-5,C28H44O3)结构比较特殊,在5,8位有过氧桥键,具有免疫抑制、抗炎、抗病毒、抗肿瘤和杀锥虫等多种生理活性[12-16],具有较大开发价值。该化合物传统获取手段主要是柱色谱法,该法固相吸附严重,步骤多效率低。近年来迅速发展的高速逆流色谱(High-speed counter-current chromatography,简称HSCCC)技术,因其液-液分配机制,无固相载体,具有了分离效率高、样品回收率高、适用范围广,可一步大剂量制备纯品的优点,在生物医药、天然产物化学和食品等领域应用愈发丰富。为了寻找简单,高效的过氧麦角甾醇大量制备方法,本研究在参考麦角甾醇、豆甾醇、β-谷甾醇等化合物高速逆流色谱分离方法的基础上,建立了纵条纹炭角菌中该化合物的高速逆色谱分离纯化法,并测试了纯化的单体化合物过氧麦角甾醇的体外抗氧化活性。
1 材料和方法
1.1材料与仪器
纵条纹炭角菌子实体,由西南科技大学微生物实验室提供,培养方法见文献[9]。经自然风干并于50 ℃烘干后,粉碎过100目筛备用。
TBE-300C高速逆流色谱仪(柱体积300 mL,进样环体积20 mL)和TBP5002型双柱塞中压恒流泵上海同田生物技术有限公司;UV2000D逆流色谱专用紫外检测器上海三为科学仪器有限公司;1260型高效液相色谱仪,Zorbax Eclipse XDB C-18分析柱(4.6 mm×250 mm,5 μm)美国安捷伦科技公司;LX-300型冷却水循环机北京长流科学仪器公司;R-210旋转蒸发仪瑞士步琪公司;KQ5200DE型数控超声波清洗器昆山市超声仪器有限公司;Bruker 600 MHz核磁共振仪美国布鲁克科技有限公司。
高速逆流色谱用分析纯乙醇、甲醇、乙酸乙酯、正己烷等成都科龙化试有限公司;高效液相色谱用色谱纯甲醇美国Fisher公司。高效薄层色谱GF254硅胶板烟台江友硅胶开发有限公司;过氧麦角甾醇标准品(纯度96.0%)云南西力生物技术股份有限公司;水为实验室制超纯水(电阻率为18 MΩ·cm)。
1.2实验方法
1.2.1标样及样品制备对照品溶液制备:精密称取过氧麦角甾醇对照品5.0 mg,置于10 mL棕色容量瓶中,加甲醇溶解并定容即得对照品溶液(0.5 mg/mL),置于4 ℃冰箱避光保存备用,可稳定放置2周。
样品制备:38 g子实体粉末,按固液比5∶1加入无水乙醇避光冷浸提取5次,每次24 h,滤液合并后经55 ℃减压旋干得黑色醇提浸膏1.71 g。
1.2.2分配系数测定及分离条件筛选将各种备选溶剂按比例配好,静止分层后,用已经分配平衡的下相溶解少量样品,过滤除去不溶物,加入等体积的上相,剧烈振摇后静置,待上相与下相分层后,对两相溶剂中的过氧麦角甾醇含量进行测定,即可计算分配系数K=CS/CM(CS-目标成分在固定相中的浓度,CM-目标成分在流动相中的浓度)。
实验中采用高效薄层色谱(HPTLC)和高效液相色谱(HPLC)两种方式进行含量测定。HPTLC方法:微量进样针定量点样,展开剂为石油醚∶乙酸乙酯=5∶1,凝钼酸显色并拍照,使用ImageJ比色软件进行色度比较,色度深浅代表浓度;HPLC方法参见文献[17]中麦角甾醇的方法且略作修改:色谱柱为Zorbax Eclipse XDB C18(4.6 mm×250 mm,5 μm),流动相为纯甲醇,流速1 mL/min,检测波长220 nm,柱温25 ℃。
1.2.3固相保留率的测定对筛选出的分离体系还需进行固相保留率评价,方法是以850 r/min的转速正向旋转已被上相充满管路的主机,同时以10 mL/min的流速往分离管路内泵入流动相,当主机出柱口管路流出流动相后,螺旋柱内固定相和流动相达到动力学平衡,此时量出被流动相推出的上相体积(V出),按以下公式计算固相保留率,保留率≥50%的溶剂体系方可在分离中使用。

式中:V总-管路总体积,V出-流动相推出上相体积,V环-进样环的体积。
1.2.4高速逆流色谱分离样品确定优选体系后,首先按体积比配制溶剂,分液漏斗中低温(4 ℃)静止过夜后分离上下相。上相(固定相)和下相(流动相)均超声波脱气处理20 min。高速逆流色谱仪开机恒温预热15min后,先将固定相以10mL/min恒速度泵满螺旋管柱,开启速度控制器,使高速逆流色谱仪螺旋管柱按顺时针方向旋转并达到800 r /min,再以2 mL/min 泵入流动相,待流动相流出分离柱时,六通阀进样品(样品需由固定相∶流动相=1∶1比例溶液超声溶解并经0.45 μm微孔滤膜过滤),同时开启检测器,以220 nm波长进行检测,根据出峰情况进行收集。
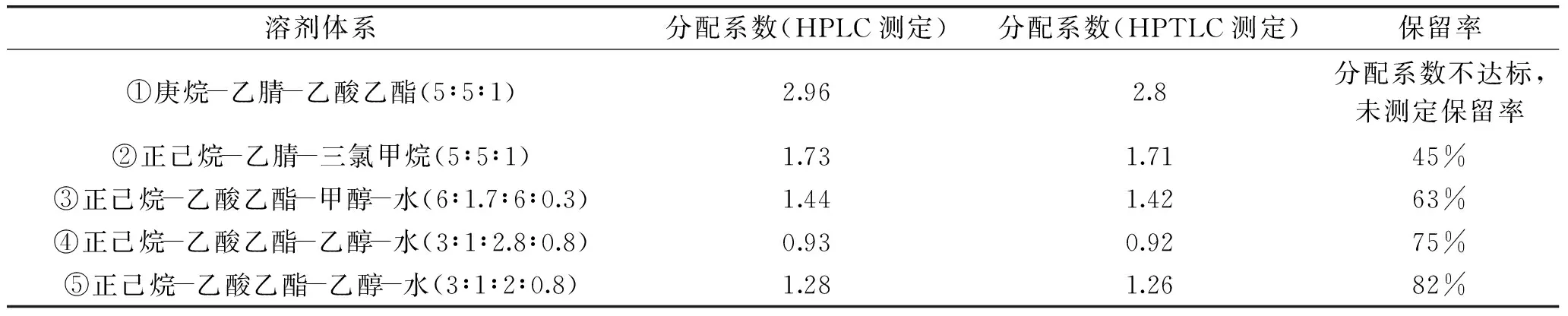
表1 HSCCC分离过氧麦角甾醇的5种溶剂系统
1.2.5过氧麦角甾醇DPPH自由基清除测定现有体外抗氧活性评测方法中,DPPH法稳定性好,灵敏度高且简便快捷[18],因此本文采用DPPH自由基清除法评价过氧麦角甾醇抗氧化活性。参照Marsdens Blois的文献[19],以无水乙醇为溶剂,将过氧麦角甾醇单体化合物配制成0.2、0.4、0.6、0.8、1 mg/mL的样品溶液。分别取2 mL样品溶液,加入2.0 mL 0.05 mg/mL的DPPH无水乙醇溶液。混匀后室温避光放置30 min,以无水乙醇为参比,分别测定其在517 nm处的吸光度值,抗坏血酸(维生素C)作为阳性对照,计算过氧麦角甾醇对DPPH自由基的清除能力,计算公式为DPPH自由基清除率(%)=(A空白-A样品)/A空白×100,式中A空白代表未加样品的DPPH溶液的吸光度值,A样品代表加入样品反应后的样品的DPPH溶液的吸光度值,实验平行进行3次,取平均值。
2 结果与分析
2.1HSCCC分离体系的筛选
样品成分的分配系数K值和螺旋管柱中固定相的保留值是分离系统筛选的两个关键因素。K值应该在0.5~2,固定相保留率需大于50%。文献[20]曾报道分离麦角甾醇使用含水体系正己烷-乙酸乙酯-甲醇-水(体积比为6∶1.7∶6∶0.3)体系获得满意效果,因过氧麦角甾醇在HPLC反相色谱上早于麦角甾醇出峰,极性大于麦角甾醇,因此推测使用含水体系应该可行。基于以上预实验和推断,笔者考察了表1中5种溶剂体系。
由上表可知,溶剂体系①分配系数太大,分离将非常耗时。溶剂体系②分配系数适宜,但保留率较低(45%),且分离时过氧麦角甾醇与其他杂质的分离度较低,该法虽与文献[21]报道一致,但却无法适用本研究所述样品,说明不同的样品中化合物种类不同,相同分离条件可能不适用。溶剂体系③分配系数合适,分离效果也不错,固定相保留率达到了63%,是个不错的候选体系。通过将溶剂体系③中的甲醇换为乙醇后,在实验中发现溶剂体系④和⑤均有较高的固定相保留率(≥75%),且随着体系中乙酸乙酯含量的减少,分配系数逐渐增大。对于溶剂体系⑤,HPLC测定分配系数为1.28,固定相保留率达到82%,且分离度较好,最终确定采用正己烷-乙酸乙酯-乙醇-水(体积比为3∶1∶2∶0.8)溶剂体系分离样品。实验中同时对比了HPLC和HPTLC测定的分配系数K值,发现两者相关性很好,说明在分配系数测试时,HPTLC可替代HPLC。
2.2过氧麦角甾醇的HSCCC的分离
根据2.1中筛选出的溶剂体系,按照1.2.4所述方法进行分离。将500 mg样品超声溶解于20 mL等体积上下相中,进样进行HSCCC分离,得到高速逆流色谱分离图2a,根据HPLC检测结果收集流份A(保留时间为134 min),旋干回收再次用旋干品重复该分离流程,得到高速逆流色谱分离图2b,截取流份B部分合并旋干,最终得到过氧麦角甾醇34 mg。

图2 HSCCC分离色谱图Fig.2 The separation chromatogram of HSCCC注:a为第一次分离,b为A流份回收后第二次分离。
2.3HSCCC分离成分的纯度检测及鉴定
参照1.2.2中HPLC法对制备得到的样品进行纯度分析,出峰时间与标准品一致,采用峰面积归一化法,计算分离得到的过氧麦角甾醇纯度为96.05%(图3)。并通过13C-NMR和1H-NMR检测得到数据如下:13C-NMR(CDCl3,125 MHz):δ135.5(CH,C-6),135.3(CH,C-22),132.3(CH,C-23),130.8(CH,C-7),82.3(C,COOC),79.5(C,COOC),66.4(CH,C-3),56.3(CH,C-17),51.6(CH,C-14),51.2(CH,C-9),44.7(C,C-13),42.7(CH,C-24),39.7(CH,C-20),39.3(CH2,C-12),36.9(C,C-10,and CH2,C-4),34.7(CH2,C-1),33.0(CH,C-25),30.1(CH2,C-2),28.6(CH2,C-16),23.3(CH2,C-15),20.8(CH3,C-21),20.6(CH2,C-11),19.9(CH3,C-26),19.6(CH3,C-27),18.1(CH3,C-19),17.5(CH3,C-28),12.8(CH3,C-18)。1H-NMR(CDCl3,600 MHz):δ0.72(3H,s,H-18),0.78(3H,d,J=6.5 Hz,H-26),0.82(3H,d,J=6.5 Hz,H-27),0.85(3H,s,H-19),0.87(3H,d,J=6.7 Hz,H-28),0.96(3H,d,J=6.7Hz,H-21),3.94(1H,m,H-3),5.12(1H,dd,J=8.1,15.1 Hz,H-22),5.17(1H,dd,J=7.7,15.1 Hz,H-23),6.22(1H,d,J=8.1 Hz,H-7),6.47(1H,d,J=8.3 Hz,H-6)。数据和文献[22]报道一致,确定该化合物为过氧麦角甾醇。

表2 过氧麦角甾醇,抗坏血酸的DPPH自由基抗氧化能力
注:±代表三次实验平均值范围。

图3 过氧麦角甾醇HPLC检测结果图Fig.3 The chromatogram of ergosterol peroxide
2.4过氧麦角甾醇DPPH自由基清除能力
由表2可知,相比抗坏血酸,过氧麦角甾醇的自由基清除能力不强,伴随着溶液浓度的增加,其对 DPPH 自由基的清除能力并未见明显提高,量效关系也不明显,这可能和它整体结构中羟基占比较少有关,因此,基本可判断该化合物DPPH自由基清除能力较弱。
3 结论与讨论
高速逆流色谱法已广泛用于各种天然产物的分离,其设备模块包括高速逆流色谱主机,分配系数K值测定用高效液相色谱两个主要设备。本文尝试了HPTLC+拍照+ImageJ比色软件比对计算分配系数的方案,发现其与HPLC测定数值非常相近,鉴于薄层色谱的展开剂、检测方法多样性,以及快捷和廉价性的特点,利用薄层扫描搭配HSCCC不失为一种重要的替代方案,只要规范操作细节,一定有较大的应用空间。
实验中还调查了转速,流动相流速和柱温对分离效果的影响,得出最优分离条件是 2 mL/min 流速,800 r/min 转速,柱温为 25 ℃。在正己烷-乙酸乙酯-乙醇-水(3∶1∶2∶0.8)四元溶剂体系系统上,通过两次操作可实现纵条纹炭角菌乙醇提物中过氧麦角甾醇的快速分离,方法相比柱色谱法简便且无样品吸附损失,效率更高,可以作为一种新的分离纯化方法,在真菌及其代谢产物的生物活性物质制备中推广应用。
由于真菌种类及生活环境分布广泛,其次生代谢产物非常多样,其中不乏价值巨大的化合物。且相对于植物,真菌因其可发酵大规模生产,实际开发应用价值可能更巨大。因此真菌发酵搭配HSCCC可能成为高价值次生代谢产物的重要工业化生产手段。伴随着HSCCC的大型化设备和配套的逐渐成熟,该方向可能成为天然产物生产的重要途径。
[1]贺新生. 四川盆地蕈菌图志[M]. 北京:科学出版社,2011:52-57.
[2]马橙,翁榕安,张平,等. 黑柄炭角菌的研究进展[J]. 菌物研究,2009,7(1):59-62.
[3]吴根福. 黑柄炭角菌产生的DPPH自由基捕捉成分[J]. 微生物学报,2001,41(3):363-366.
[4]龚庆芳,武守华,谭宁华,等. 黑柄炭角菌发酵菌丝中抗氧化及抗肿瘤活性的有效成分研究[J]. 食品科技,2008,33(12):28-31.
[5]龚庆芳,张玉梅,谭宁华,等. 黑柄炭角菌发酵菌丝体的化学成分研究[J]. 中国中药杂志,2008,33(11):1269-1272.
[6]麻兵继,阮元,刘吉开,等. 长柄炭角菌子实体化学成分研究[J]. 天然产物研究与开发,2008,20(1):63-65.
[7]杨小龙,刘吉开,罗都强,等. 黑柄炭角菌的化学成分[J]. 天然产物研究与开发,2011,23(5):846-849.
[8]王兴娜,黄午阳,刘吉开,等. 大炭角菌子实体化学成分的研究[J]. 中草药,2012,43(12):2327-2332.
[9]马贝贝,霍存录,贺新生,等. 纵条纹炭角菌子实体培养[J]. 食品与发酵科技,2013,49(2):44-47.
[10]冯望,吴颖,尤雅,等. 纵条纹炭角菌培养条件的优化[J]. 广东农业科学,2014(10):90-94.
[11]刘霞,高聪,钟雨婷,等. 纵条纹炭角菌菌丝体液体培养条件的优化[J]. 中药材,2014,37(8):1317-1321.
[12]Yasukawa K,Akihisa T,Kanno H,et al. Inhibitory effects of sterols isolated from Chlorella vulgaris on 12-O-tetradecanoylphorbol-13-acetate-induced inflammation and tumor promotion in mouse skin[J]. Biological and Pharmaceutical Bulletin,1996,19(4):573-576.
[13]Lindequist U,Lesnau A,Teuscher E,et al. Antiviral activity of ergosterol peroxide[J]. Pharmazie,1989,44(8):579-80.
[14]Nakanishi T,Murata H,Inatomi Y,et al. Screening of anti-HIV-1 activity of North American plants. Anti-HIV-1 activities of plant extracts,and active components of Lethalia vulpina(L.)Hue[J]. Journal of Natural Medicines,1998,52:521-26.
[15]Bok J W,Lermer L,Chilton J,et al. Antitumor sterols from the mycelia of Cordyceps sinensis[J]. Phytochemistry,1999,51(7):891-98.
[16]Ramos-Ligonio A,López-Monteon A,Trigos á,et al. Trypanocidal Activity of Ergosterol Peroxide from Pleurotus ostreatus[J]. Phytotherapy Research,2012,26(6):938-943.
[17]张萍,肖新月,黄玮,等. RP-HPLC-UV法测定5种发酵虫草制剂中麦角甾醇的含量[J]. 药物分析杂志,2010,31(2):258-260.
[18]Krystyna Pryzynska,Anna Pekal. Application of free radical diphenylpicrylhydrazyl(DPPH)to estimate the antioxidant capacity of food samples[J]. Analytical Methods,2013,5(17):4288-4295.
[19]Marsdens Blois. Antioxidant determinations by the use of a stable free radical[J]. Nature,1958,181:1199-1200.
[20]章能胜,王金彬,汪小艳,等. 高速逆流色谱法从蝙蝠蛾拟青霉中快速分离制备麦角甾醇纯品[J]. 色谱,2011,28(1):68-72.
[21]章能胜,王金彬,胡丰林,等. 玫烟色拟青霉中过氧麦角甾醇的高速逆流色谱法分离纯化及质谱分析[J]. 食品与发酵工业,2009(6):14-17.
[22]Andreas Schinkovitz,Aman Kaur,Ernst Urban,et al. Cytotoxic Constituents from Lobaria scrobiculata and a Comparison of Two Bioassays for Their Evaluation[J]. Journal of natural product,2014,77(4):1069-73.
Isolation and purification of ergosterol peroxide fromXylariaStriataby high-speed counter-current chromatography
HUANG Yi1,2,LEI Chuan-wen1,SONG Hang2,YANG Zhi-qin1,YUAN Xiao-hong1,HE Xin-sheng1
(1.School of Life Science and Engineering,Southwest University of Science and Technology,Mianyang 621010,China; 2.Department of Pharmaceutical and Biological Engineering,Sichuan University,Chengdu 610065,China)
Due to the various bio-activities,Ergosterol peroxide presents great application value. The column chromatography is the most commonly methods used in separation of this compound. However,sample loss caused by irreversible adsorption is very uneconomical and biggest challenges in industrial application. In present work,an effective and rapid high-speed counter-current chromatography(HSCCC)method for isolating and purifying ergosterol peroxide fromXylariaStriatahas been developed. After using HPTLC and HPLC to determinate the partition coefficient,the isolation efficiency of different solvent systems was observed. The result showed that the solvent system composed of n-hexane,ethyl acetate,ethanol and water(3∶1∶2∶0.8,v∶v∶v∶v)was the best,the lower phase was used as the mobile phase and performed at a flow rate of 2 mL/min,while the apparatus rotated at 800 r/min,and detected at 220 nm. The prepared ergosterol peroxide was identified by13C-NMR and1H-NMR. Its purity was 96.05% analyzed by high performance liquid chromatography. And the antioxidant potential of ergosterol peroxide was also investigated by the method of DPPH radical scavenging activity. Results revealed that ergosterol peroxide showed weaker DPPH radical scavenging activity(28.36%)at the concentration of 0.2 mg/mL compared with standard compound ascorbic acid(93.41%). The dose dependent was not observed also explained its weak DPPH radical scavenging activity. The established method was quite simple,fast,and suitable for the large-scale isolation and separation of ergosterol peroxide fromXylariaStriata.
Ergosterol peroxide;high-speed counter-current chromatography;XylariaStriata;antioxidant potential
2016-03-18
黄毅(1979-),男,博士,讲师,研究方向:真菌天然产物开发,E-mail:huangyi@swust.edu.cn。
国家自然科学基金(21272189);四川省苗子工程项目(2015RZ0015);西南科技大学创新基金(CX14-041);西南科技大学研究生创新基金(15ycx090)。
TS207.3
A
1002-0306(2016)17-0262-05
10.13386/j.issn1002-0306.2016.17.043
——过氧碳酸钠

