氮磷营养盐对大肠杆菌四环素耐药性的影响
陈秀萍,肖正润,林 晶,汪燕秋,张 洁,黄启发,俞道进
(福建农林大学 动物科学学院,福建 福州 350002)
氮磷营养盐对大肠杆菌四环素耐药性的影响
陈秀萍,肖正润,林晶,汪燕秋,张洁,黄启发,俞道进*
(福建农林大学 动物科学学院,福建 福州 350002)
根据临床和实验室标准协会(clinical and laboratory standards institute, CLSI)推荐的微量肉汤稀释法检测泥样中大肠杆菌对四环素的敏感性,并应用PCR法检测四环素耐药基因tetA,tetB,探讨氮磷营养盐对大肠杆菌四环素耐药性影响的可能机制。结果表明:添加不同剂量氮磷营养盐能够导致大肠杆菌对四环素产生耐药性,但大肠杆菌的耐药率与剂量间无明显相关性。37株高耐药率大肠杆菌tetA基因的阳性率为100%,66株低耐药率大肠杆菌tetA基因的阳性率为16.67%,而16株对药物敏感的大肠杆菌未检测到tetA基因;但供试大肠杆菌均未检测到tetB基因。这表明,氮磷营养盐诱导的大肠杆菌四环素耐药性与tetA基因有关。
微宇宙;大肠杆菌;四环素
水体富营养化是指由于过多的营养物质(主要是氮、磷)排入水中,从而引起各类水生生物异常繁殖和生长的现象[1],现已成为全世界需要共同面对的重大水环境问题。当环境发生改变时,细菌会通过各种变异来适应环境,而在这一过程中可能会导致细菌耐药性的产生。国内外许多学者利用微宇宙技术对兽药、化学物质等对生态环境的影响进行了研究:如Gorzerino等[2]通过建立24套小型水生微宇宙系统,探讨了辅助剂Agral 90对2种除草剂(敌草快和氟磺胺草醚)毒性的影响;俞道进等[3]通过模拟池塘生态系统,观察了土霉素残留对诱导底泥细菌耐药性的影响。
四环素类药物为广谱抗生素,主要用于抑制革兰氏阴性菌和革兰氏阳性菌,已经成功应用于医学临床[4]。四环素类药物主要通过阻止氨酰tRNA与核糖体结合位点(A)的结合来阻止菌体蛋白合成[5]。之前的研究显示,细菌对四环素的耐药性与tet基因有关。一般而言,细菌中四环素耐药性的迅速传播源于质粒、转座子和整合子上tet基因的定位[6]。
本试验以大肠杆菌作为研究对象,通过建立微宇宙,采用临床和实验室标准协会(clinical and laboratory standards institute, CLSI)推荐的微量肉汤稀释法检测细菌耐药性,研究氮磷营养盐对水环境中大肠杆菌四环素耐药性产生的影响;并采用PCR法检测四环素耐药基因tetA,tetB,探讨氮磷营养盐对大肠杆菌四环素耐药性影响的可能机制。
1 材料与方法
1.1试验材料
1.1.1微宇宙
用于建立微宇宙的底泥系福建省福州市森林公园采集的无抗生素污染土壤;所用水为装好适量的过滤水(单蒸水),并在阳光下暴晒1 d。使用容积18 L的白色透明储物箱建立微宇宙,并在外面搭建规格为3 m×3 m×2 m的帐篷,四周用白色透明的塑料膜围起来,顶端也用塑料膜覆盖。
1.1.2主要试剂
琼脂糖,购于上海鼎国生物技术有限公司;四环素,购于中国药品生物制品检验所;溴化乙啶,购于上海鼎国生物技术有限公司;PCR引物,由大连宝生物工程公司合成;DL Marker 2000与2×PCR Master均购于大连宝生物工程公司;5×TBE缓冲液,购于上海生工生物工程公司。
1.1.3培养基
MH(B)培养基(Mueller-Hinton Broth),购于北京奥博星生物技术有限责任公司。伊红美蓝琼脂(eosin-methylene blue agar,EMB),CM105;麦康凯琼脂(MacConkey agar),CM908;二者均购于北京陆桥技术有限责任公司。
1.2试验方法
1.2.1建立微宇宙及获取菌株样本
将高压灭菌后的泥土分别置于8个18 L的白色储物箱中,每个储物箱中的底泥厚度约为5 cm,再加入16 L单蒸水,最后加入适量大肠杆菌ATCC 25922标准菌株稀释液。在每个水位做好标记,适时补充单蒸水以保证微宇宙容积恒定。将8个储物箱放于塑料大棚内静置30 d左右,储物箱之间相距大约10 cm。
在微宇宙静置期间,测定微宇宙中总氮(TN)、总磷(TP)基底值。待系统稳定后,于水-底泥界面采样(即为第0 d),然后根据基底值加入已灭菌的氮(NH4NO3)、磷(NaH2PO4)营养液,并分别于第1,8,16,24,32,40,68,108天采样,然后进行细菌的分离、纯化,获得菌株样本。试验设置空白组和3个处理组,每组设2个重复。参考水体富营养化标准及宋玉芝等[7]、郑丙辉等[8]的研究设定微宇宙中TN,TP的终浓度,详见表1。
表1微宇宙中TN,TP的处理方案
Table 1Treatments of TN and TP in microcosm
1.2.2微量肉汤稀释法测定四环素的最小抑菌浓度(MIC)
首先,配置浓度为5 120 μg·mL-1的四环素母液,然后将其分装于2 mL的无菌离心管中,-20 ℃冰箱保存。使用时,先用0.22 μm的无菌过滤器过滤,再稀释10倍成工作液。
取E.coli纯培养菌液在摇床中振荡培养6 h后,取菌液在600 nm处用紫外分光光度计测定D值(MH肉汤作为参比),然后用已灭菌的MH肉汤将菌液稀释至(1~2)×108cfu·mL-1(D值为0.08~0.10)。接种时将前述菌液再稀释10倍。
利用96孔U型板,在其第1至12列,分别加入100 μL含有四环素的MH肉汤,其中的四环素浓度依次为256,128,64,32,16,8,4,2,1,0.5,0.25,0 μg·mL-1。用移液枪吸取5μL上述稀释好的菌液(浓度为107cfu·mL-1)加入到U型板中,盖好盖子。为保证试验结果,每块孔板的操作时间应尽量控制在15 min以内。将加样的U型板在37 ℃恒温培养箱中培养16~20 h,观察结果。首先,观察对照孔的细菌是否正常生长,以及质控菌株是否在质控范围,同时观察有无污染孔。然后从第11列开始依次观察浑浊的孔(浑浊说明有细菌生长),直到观察到清澈的孔(细菌不生长的孔)为止,则这个清澈的孔的抗生素浓度即为最小抑菌浓度(MIC值)。细菌对抗生素的耐受程度按照CLSI的标准来判定。
1.2.3基因检测
采用煮沸法提取大肠杆菌的基因组DNA[9],参照Schwaiger等[10]的方法合成引物,序列见表2。反应体系:上下游引物(20 μmol·L-1)各0.8 μL,2×PCR Master 10.0 μL,DNA模板2.0 μL,用双蒸水补足体系至20 μL。扩增程序见表3。以无菌双蒸水作为阴性对照,以实验室保存的标准菌株作为阳性对照。扩增好的产物进行琼脂糖凝胶电泳检测,利用全自动凝胶图像分析系统观察、记录结果。
表2PCR引物基因序列及预期产物片段
Table 2Multiple PCR primer sequences and expected product of gene segments

基因产物长度/bp引物序列ui-dA196uidA-F5'-CGATTCCGTTTCAGGGTT-3'uidA-R5'-TTTCTGATAGGACCGAGCAT-3'tetA888tetA-F5'-GTGAAACCCAACATACCCC-3'tetA-R5'-GAAGGCAAGCAGGATGTAG-3'tetB416tetB-F5'-CTCAGTATTCCAAGCCTTTG-3'tetB-R5'-CTAAGCACTTGTCTCCTGTT-3'
表3不同基因的扩增程序
Table 3Amplification conditions of different genes

扩增基因第一阶段 预变性 第二阶段第三阶段变性 → 退火 → 延伸循环次数延伸uidA94℃3min94℃1min→58℃30s→72℃1min3572℃7mintetA94℃5min94℃1min→56℃1min→72℃1min3572℃5mintetB94℃5min94℃30s→62℃30s→72℃90s3572℃5min
2 结果与分析
2.1添加不同剂量氮磷营养盐对大肠杆菌产生四环素耐药性的影响
从表4可以看出,向微宇宙中添加不同浓度的氮磷营养盐后,分离到的大肠杆菌对四环素产生耐药性。其中,加入低剂量氮磷营养盐后1 d,就可从微宇宙中分离得到耐药菌株(占比6.25%);8~24 d期间,微宇宙中耐药的大肠杆菌占比逐渐升高(从6.25%上升至72.7%);至32 d又略有下降;40~108 d内耐药菌占比均为100%。加入中剂量氮磷营养盐后,第8天才可从微宇宙中分离得到耐药菌株(占比26.7%);第16天微宇宙中耐药菌占比达71.4%;至第24天下降至33.3%;32~40 d期间,微宇宙中耐药菌占比回升至100%;但当时间延长至68 d时,未能从微宇宙中分离得到大肠杆菌,因此无法进行药敏试验;一直到第108天,才再次分离到大肠杆菌,耐药菌占比为66.7%。加入高剂量氮磷营养盐后16 d才可从微宇宙中分离得到耐药菌株(占比56.2%);16~32 d期间,微宇宙中耐药的大肠杆菌占比逐渐下降;至40 d又突然上升至100%,且一直持续到108 d。不加入氮磷营养盐的空白组,试验全程均未分离得到耐药大肠杆菌,仅获得部分中介菌株。
2.2基因检测结果
以提取的细菌DNA为模板,使用uidA基因的引物进行PCR反应,部分检测结果如图1所示。结果表明,扩增获得的条带长度符合预期,阳性率达98.05%(402/410),说明微宇宙中分离到的细菌大部分均为大肠杆菌。
表4添加氮磷营养盐后不同时间微宇宙中分离得到的耐药大肠杆菌及中介菌的比例(%)
Table 4Proportions of TE resistant and intermediateE.colistrains at different time after nitrogen and phosphorous addition
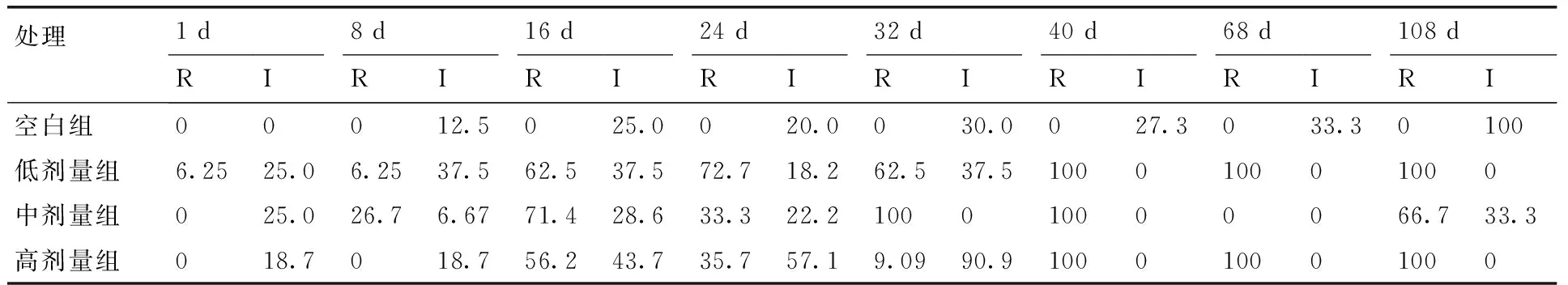
处理1d8d16d24d32d40d68d108dRIRIRIRIRIRIRIRI空白组00012.5025.0020.0030.0027.3033.30100低剂量组6.2525.06.2537.562.537.572.718.262.537.5100010001000中剂量组025.026.76.6771.428.633.322.2100010000066.733.3高剂量组018.7018.756.243.735.757.19.0990.9100010001000
注:I表示敏感与耐药的中介菌株在全部分离菌中的比例;R表示耐药菌株在全部分离菌中的比例。
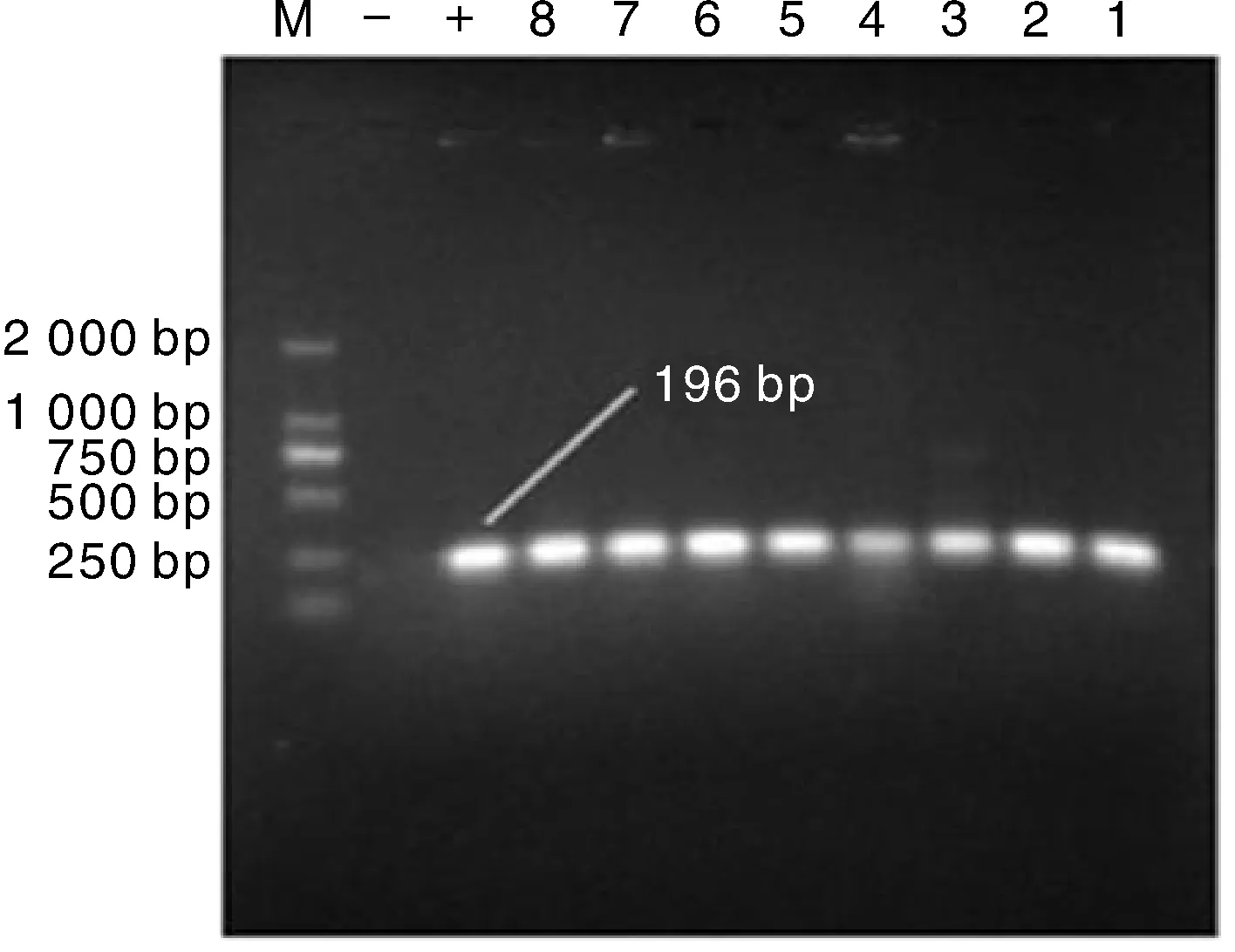
M表示DNA分子量标准; +表示阳性对照, 系实验室保存菌株; -表示阴性对照(双蒸水); 1—8为不同样本。 下同。图1 部分样品uidA基因的PCR检测结果Fig.1 The PCR amplification results of uidA gene
对102株耐四环素大肠杆菌的tetA基因和tetB基因进行检测。结果表明,选取的37株高耐药菌tetA基因的检测阳性率为100%,66株较低耐药性大肠杆菌中tetA的检测阳性率为16.67%,而16株对四环素敏感的大肠杆菌中未检测到tetA基因。部分检测结果如图2所示。此外,无论是对照菌株还是在本试验中分离得到的四环素耐药菌,均未检测到tetB基因。这表明添加氮磷营养盐后,大肠杆菌对四环素耐药性的产生可能与tetA基因有关,但与tetB基因无关。
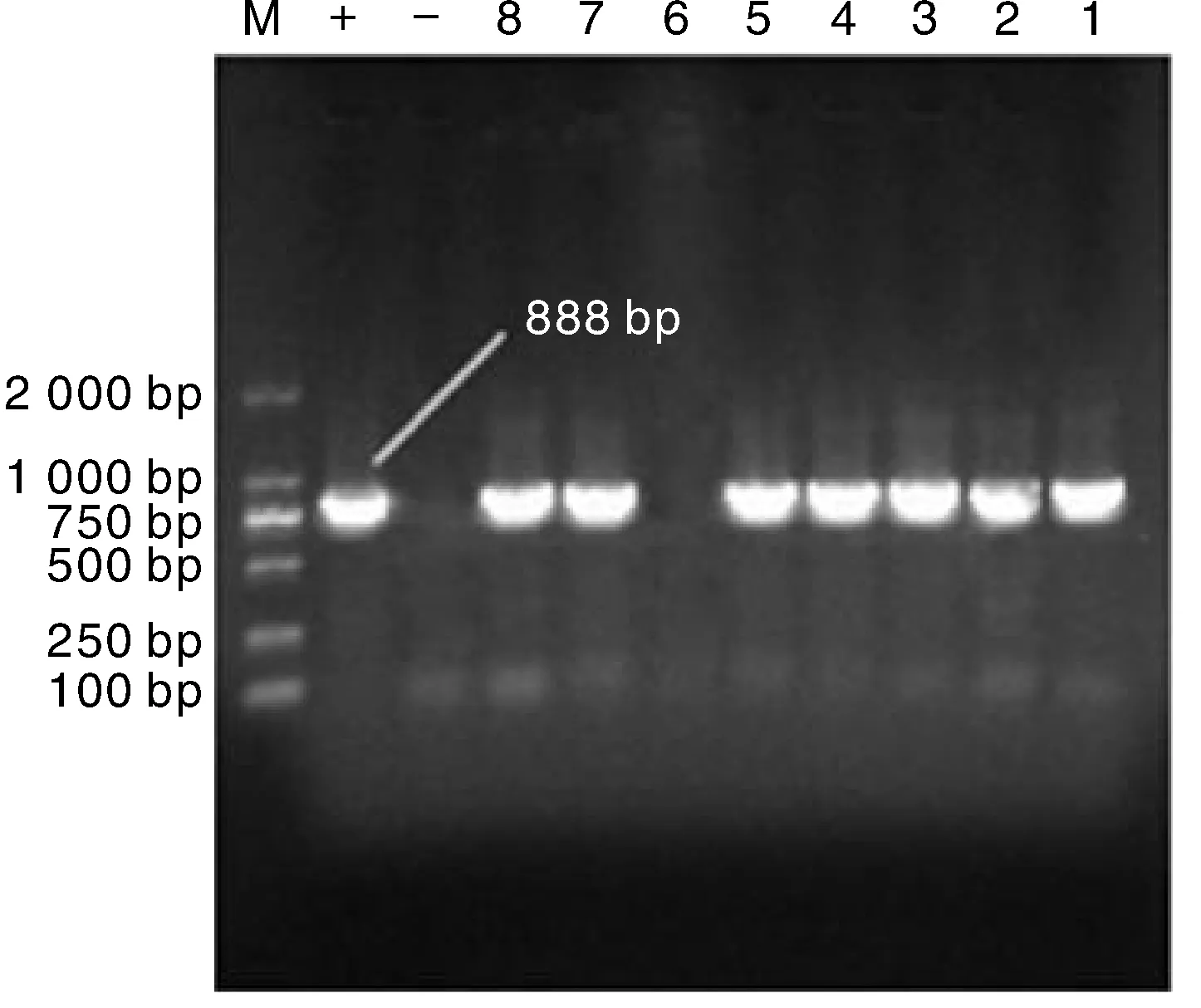
图2 四环素耐药基因tetA的PCR检测结果Fig.2 PCR detection result of tetracycline resistance gene tetA in isolated strains
3 结论与讨论
本研究表明,不同剂量的氮磷营养盐均能诱导大肠杆菌对四环素产生耐药性,其影响程度与添加剂量无明显相关性,但耐药性出现的时间与剂量表现出一定的负相关性。张扬等[11]证明,tetA或tetA+tetB是导致细菌对四环素类药物产生耐药性的主要机制。但在本研究中,各处理条件下分离得到的大肠杆菌中均未检测到tetB基因,但耐药菌中可检测到tetA基因,且该基因的检测阳性率与分离菌群的耐药性水平表现出一定的正相关性,表明tetA基因可能参与了氮磷营养盐诱导的大肠杆菌四环素耐药性的产生过程。tetA和tetB基因检测结果的差异性可能与其来源有关。早期研究表明,tetA主要是在动物源性的菌株中被发现,而tetB主要是在从人类中分离到的菌株中检测出[10]。
在本试验中,微宇宙中空白组0—108 d均未检测出tetA基因,但加入氮磷营养盐后,部分耐药菌中检测到了tetA基因。这表明环境因素的改变可能会诱发细菌基因组的改变,导致耐药基因的产生。Thevenon等[12]在对部分日内瓦湖沉积物的研究中发现了大肠杆菌和肠球菌对5种抗生素的耐药性,并且从1970年开始,随着湖泊富营养化程度的加深,大肠杆菌和肠球菌对5种抗生素的多重耐药性增加,大肠杆菌的耐药率从0.12%增加到4.6%,肠球菌的耐药率从0.016%增加至11.6%。此外,还可以从所有泥沙样本(包括不被污水处理厂排放的污水所影响的样本)中扩增出aadA耐药基因。Alvero[13]从两个不同程度富营养化的湖泊水中分离出87份异养性细菌,其中,有71%的细菌对抗生素具有耐药性,44%的细菌具有多重耐药性。值得注意的是,在前述试验中,分离出高耐药水平菌株的湖水并没有直接被污水所污染。所以,由营养因素诱导产生的细菌耐药性及其耐药机制值得进一步探讨。
[1]王保栋. 长江口及邻近海域富营养化状况及其生态效应[D]. 青岛: 中国海洋大学, 2009.
[2]GORZERINO C, QUEMENEUR A, HILLENWECK A, et al. Effects of diquat and fomesafen applied alone and in combination with a nonylphenol polyethoxylate adjuvant onLemnaminorin aquatic indoor microcosms[J].Ecotoxicology&EnvironmentalSafety, 2009, 72(3): 802-810.
[3]俞道进, 曾振灵, 陈杖榴. 土霉素残留对模型池塘生态系统代谢的影响[J]. 应用与环境生物学报, 2006, 12(4): 511-513.
[4]DE RUYCK H, DE RIDDER H. Determination of tetracycline antibiotics in cow’s milk by liquid chromatography/tandem mass spectrometry[J].RapidCommunicationsinMassSpectrometry, 2007, 21(9): 1511-1520.
[5]冯新, 韩文瑜, 雷连成. 细菌对四环素类抗生素的耐药机制研究进展[J]. 中国兽药杂志, 2004, 38(2): 38-42.
[6]BRYAN A, SHAPIR N, SADOWSKY M J. Frequency and distribution of tetracycline resistance genes in genetically diverse, nonselected, and nonclinicalEscherichiacolistrains isolated from diverse human and animal sources[J].Applied&EnvironmentalMicrobiology, 2004, 70(4): 2503-2507.
[7]宋玉芝, 杨美玖, 秦伯强. 苦草对富营养化水体中氮磷营养盐的生理响应[J]. 环境科学, 2011, 32(9):2569-2575.
[8]郑丙辉, 许秋瑾, 朱延忠. 湖泊营养盐控制标准制订方法的初步研究[J]. 环境科学, 2009, 30(9):2497-2501.
[9]李州. 圈养野生动物大肠杆菌耐药性流行病学研究[D]. 福州: 福建农林大学, 2012.
[10]SCHWAIGER K, HÖLZEL C, BAUER J. Resistance gene patterns of tetracycline resistantEscherichiacoliof human and porcine origin[J].VeterinaryMicrobiology, 2010, 142(3/4): 329-336.
[11]张扬, 陈丽鹏, 吴华, 等. 鸡源大肠杆菌四环素耐药基因检测[J]. 江西农业学报, 2014, 26(1): 94-96.
[12]THEVENON F, ADATTE T, WILDI W, et al. Antibiotic resistant bacteria/genes dissemination in lacustrine sediments highly increased following cultural eutrophication of Lake Geneva (Switzerland)[J]. Chemosphere, 2012, 86(5): 468-476.
[13]ALVERO C C. Antibiotic resistance of heterotrophic bacterial flora of two lakes[J].Systematic&AppliedMicrobiology, 1987 (9): 169-172.
(责任编辑高峻)
Effect of nitrogen and phosphorous on tetracycline resistance of Escherichia coli
CHEN Xiu-ping, XIAO Zheng-run, LIN Jing, WANG Yan-qiu, ZHANG Jie, HUANG Qi-fa, YU Dao-jin*
(CollegeofAnimalScience,FujianAgricultureandForestryUniversity,Fuzhou350002,China)
In the present study, sensitivity ofEscherichiacolistrains to tetracycline (TE) was detected by broth micro-dilution method, andtetA,tetBgenes ofE.colistrains were detected by PCR methods to explore the possible mechanisms. It was shown that addition of different concentrations of nitrogen and phosphorous induced resistance ofE.colito TE. But, there was no significant correction between TE resistance ofE.coliand nitrogen or phosphorus dose. For 37 strains with high TE resistance, the detection rate oftetAgene was 100%; for 66 strains with lower TE resistance, the detection rate oftetAgene was 16.67%; and notetAgene was detected in the strains sensitive to TE. Interestingly, notetBgene was detected in either TE resistant or sensitiveE.colistrains, which indicated thattetAgene, other thantetBgene, might be involved in the nitrogen and phosphorus induced TE resistance ofE.coli.
microcosm;Escherichiacoli; tetracycline
10.3969/j.issn.1004-1524.2016.02.11
2015-01-09
国家自然科学基金项目(31272606)
陈秀萍(1989—),女,福建永安人,在读硕士研究生,研究方向为兽医药理学及兽药新制剂。E-mail:1120643004@fafu.edu.cn
,俞道进,E-mail:yudaojin@yeah.net
S852.61;X52
A
1004-1524(2016)02-0247-05
陈秀萍,肖正润,林晶,等. 氮磷营养盐对大肠杆菌四环素耐药性的影响[J].浙江农业学报,2016,28(2): 247-251.

