天府肉鸭发育过程中胸腺Bcl-2,Bax基因及蛋白的表达
刘春雨,朱盼盼,方 静,蒋 敏,尹 恒
(四川农业大学 动物医学院,四川 雅安 625014)
天府肉鸭发育过程中胸腺Bcl-2,Bax基因及蛋白的表达
刘春雨,朱盼盼,方 静,蒋 敏,尹 恒
(四川农业大学 动物医学院,四川 雅安 625014)
为探讨胸腺淋巴细胞凋亡的调控机制,将65只天府肉鸭分为22,24,26 d胚龄3个组和胚后0(新生雏),3,5,8,14,17,20,26,29,32周龄10个组,采用免疫组织化学和原位杂交方法研究天府肉鸭胚胎及胚后发育期胸腺中Bcl-2和BaxmRNA及其蛋白的表达情况。结果表明,Bcl-2和BaxmRNA及蛋白免疫阳性反应见于胸腺淋巴细胞及胸腺上皮细胞。胸腺小叶皮质和髓质淋巴细胞BCL-2蛋白阳性率在22 d胚龄~17周龄恒定,20~32周龄呈下降趋势;淋巴细胞BAX蛋白阳性率在22~26 d胚龄恒定,0~8周龄上升,8~17周龄恒定,20~32周龄呈上升趋势;淋巴细胞BCL-2/BAX值在22~26 d胚龄恒定;0~8周龄下降,8~17周龄恒定,20~32周龄下降。胸腺皮质和髓质淋巴细胞Bcl-2 mRNA和BaxmRNA 阳性率分别与其蛋白阳性率变化规律一致。各组皮质淋巴细胞Bcl-2 mRNA 与蛋白阳性率以及BCL-2/BAX值均显著低于髓质;各组皮质淋巴细胞BaxmRNA和蛋白阳性率均明显高于髓质。推测BCL-2和BAX蛋白及其基因是天府肉鸭胸腺胚胎及胚后发育期淋巴细胞凋亡的重要调节物。
鸭;胸腺;Bcl-2;Bax;免疫组化;原位杂交
胸腺是禽类的中枢免疫器官,是培育T淋巴细胞的场所。在胸腺发育过程中,凋亡机制参与淋巴细胞选择的全过程。胸腺中淋巴细胞凋亡同一般细胞一样,受多种基因调控,其中Bcl-2(B-cell lymphoma-2,B淋巴细胞瘤-2基因)和Bax基因家族发挥着重要的作用[1-3]。
BCL-2具有抗细胞凋亡的作用,而BAX可促进细胞凋亡。前人用多种方法探讨了Bcl-2和Bax基因及其相关蛋白在高等动物胸腺中的自然表达[4-7],但在禽类报道中较少,且集中在鸡胸腺发育的某一或某些特定时期,如张书霞等[8]用Northern blot 分子杂交技术研究了成年鸡和胚胎鸡胸腺中Bcl-2基因表达与细胞凋亡的关系;随后又用流式细胞法测定了鸡胸腺中BCL-2蛋白的表达及细胞凋亡率[9]。李奎等[10]应用免疫组织化学方法研究了BCL-2,BAX凋亡蛋白在鸡胸腺胚后发育期中的表达。而天府肉鸭胸腺发育过程中BCL-2与BAX蛋白及基因的自然表达尚未见报道。
作者前期工作显示淋巴细胞凋亡在天府肉鸭胸腺胚胎及胚后发育过程中普遍存在,且具有明显增龄变化特性[11]。在此基础上本研究应用免疫组化方法及原位杂交技术对天府肉鸭胸腺胚胎及胚后发育过程中BCL-2和BAX蛋白及其基因表达进行定性和定量的动态观察,以揭示两种分子的表达时序、相互作用关系,旨在更深入地认识胸腺细胞凋亡的调控机制。
1 材料与方法
1.1 试验动物
选用四川农业大学种鸭场同批孵化和饲养的天府肉鸭,按发育年龄分组,胚胎期分为22,24,26 d胚龄3个组;胚后期分为0(新生雏),3,5,8,14,17,20,26,29,32周龄10个组。每组试验动物数为5 羽(胚胎期不分性别,胚后期均为雄鸭)。
1.2 光镜标本制作
分别采取各组鸭的胸腺组织,4%多聚甲醛固定,常规石蜡包埋,5 μm连续切片。
1.3 主要试剂
兔抗BCL-2和BAX多克隆抗体、SABC免疫组化试剂盒、DAB显色试剂盒、Bcl-2和BaxmRNA原位杂交试剂盒均购自武汉博士德生物工程有限公司。
1.4 BCL-2和BAX免疫组化染色
BCL-2和BAX免疫组化染色方法按试剂盒说明书进行,具体操作步骤见参考文献[11](一抗的稀释浓度为1∶100),用PBS代替一抗作为阴性对照。BCL-2和BAX阳性反应物呈棕黄色。
1.5 原位杂交检测Bcl-2和Bax mRNABcl-2和BaxmRNA原位杂交染色方法按试剂盒说明书进行,其主要步骤如下:石蜡切片常规脱蜡至水,30% H2O21份加纯甲醇50份混合,室温30 min以灭活内源性酶;滴加3%柠檬酸新鲜稀释的胃蛋白酶,37 ℃或室温消化5~120 s;后固定于4%多聚甲醛/0.1 mol·L-1PBS(pH 7.2~7.6),含有1/1 000 DEPC,室温10 min;滴加预杂交液,38~42 ℃ 24 h;滴加杂交液,恒温38~42 ℃ 24 h;滴加封闭液37 ℃ 30 min;滴加生物素化鼠抗地高辛37 ℃ 60 min 或室温120 min;滴加SABC 37 ℃ 20 min 或室温30 min;滴加生物素化过氧化物酶37 ℃ 20 min 或室温30 min;DAB显色;苏木素轻度复染,常规脱水,透明,中性树胶封固,光镜观察。以上各步骤均用原位杂交用PBS洗涤。阴性对照采用两种方法,方法一用RNA酶预处理;方法二用不含Bcl-2或Bax寡核苷酸探针杂交液孵育,其余步骤同上。Bcl-2或BaxmRNA阳性反应物定位于细胞质,呈棕黄色。
1.6 定量分析和统计学处理
每个胸腺标本间隔200 μm取一张切片,共取3张切片,每张切片随机选取胸腺小叶各10个进行阳性细胞计数(用江苏捷达801形态分析软件)。淋巴细胞BCL-2或BAX阳性率=单位面积内BCL-2或BAX阳性淋巴细胞总数/单位面积内淋巴细胞总数×100%。单位面积为0.001 mm2,相当于1 000倍下的视野范围。 实验数据均用平均值±标准差表示,采用单因素方差分析中的LSD或Dunnett T3法对组间进行多重比较。数据处理均用SPSS 11.5软件,P<0.05表示差异显著。
2 结果与分析
2.1 BCL-2和BAX蛋白免疫组织化学
实验片中,BCL-2和BAX蛋白免疫阳性反应呈棕黄色颗粒,阳性物质定位于胞质和胞膜(图1-a—e);在阴性对照片中,均为单一蓝色苏木素染色(图1-f)。
各组中均可见胸腺小叶皮质和髓质淋巴细胞呈BCL-2和BAX阳性反应(图1-a—e)。表1显示,胸腺小叶皮质和髓质淋巴细胞BCL-2阳性率在22 d胚龄~17周龄无明显变化(P>0.05),20周龄显著下降(P<0.05),随后呈下降趋势,32周龄达最低;各组皮质淋巴细胞BCL-2阳性率均显著低于髓质(P<0.05)。皮质和髓质淋巴细胞BAX阳性率在22~26 d胚龄无明显变化(P>0.05),0~8周龄逐渐上升(P<0.05),8~17周龄恒定(P>0.05),20周龄显著升高(P<0.05),以后呈上升趋势,32周龄达其峰值;各组皮质淋巴细胞BAX阳性率均明显高于髓质(P<0.05)。皮质和髓质淋巴细胞BCL-2/BAX比值在22~26 d胚龄恒定(P>0.05),0~8周龄下降(P<0.05),8~17周龄恒定(P>0.05),20~32周龄呈下降趋势; 各组皮质淋巴细胞BCL-2/BAX值均明显低于髓质(P<0.05)(详情见表1)。此外,在5~32周龄各组中,部分皮质和髓质胸腺上皮细胞呈BCL-2阳性反应(图1-b);弥散胸腺小体的上皮细胞呈BCL-2和BAX阳性反应。
2.2 Bcl-2和Bax mRNA原位杂交
实验片中,Bcl-2和BaxmRNA原位杂交免疫阳性反应呈棕黄色颗粒,阳性物质多定位于胞质和胞膜,少量定位于核膜和核质(图2-a—e);在阴性对照片中,均为单一蓝色苏木素染色(图2-f)。
各组中均可见胸腺淋巴细胞呈Bcl-2和BaxmRNA阳性反应(图2-a—e)。表2显示胸腺皮质和髓质淋巴细胞Bcl-2 mRNA阳性率在22 d胚龄~17周龄无明显变化(P>0.05);20周龄显著下降(P<0.05),随后呈下降趋势,32周龄达最低;各组皮质淋巴细胞Bcl-2 mRNA阳性率均明显小于髓质(P<0.05)。表2还显示皮质和髓质淋巴细胞BaxmRNA阳性率在22~26 d胚龄恒定(P>0.05),0~8周龄上升(P<0.05),8~17周龄恒定(P>0.05),20~32周龄呈上升趋势。各组皮质淋巴细胞BaxmRNA 阳性率均明显高于髓质(P<0.05)。此外,弥散胸腺小体中部分胸腺上皮细胞和淋巴细胞呈Bcl-2和BaxmRNA阳性反应(图2-e)。
表1 胸腺淋巴细胞BCL-2,BAX蛋白阳性率及BCL-2/BAX值
Table 1 The positive ratios of BCL-2 and BAX proteins and the BCL-2/BAX values in lymphocytes of thymus
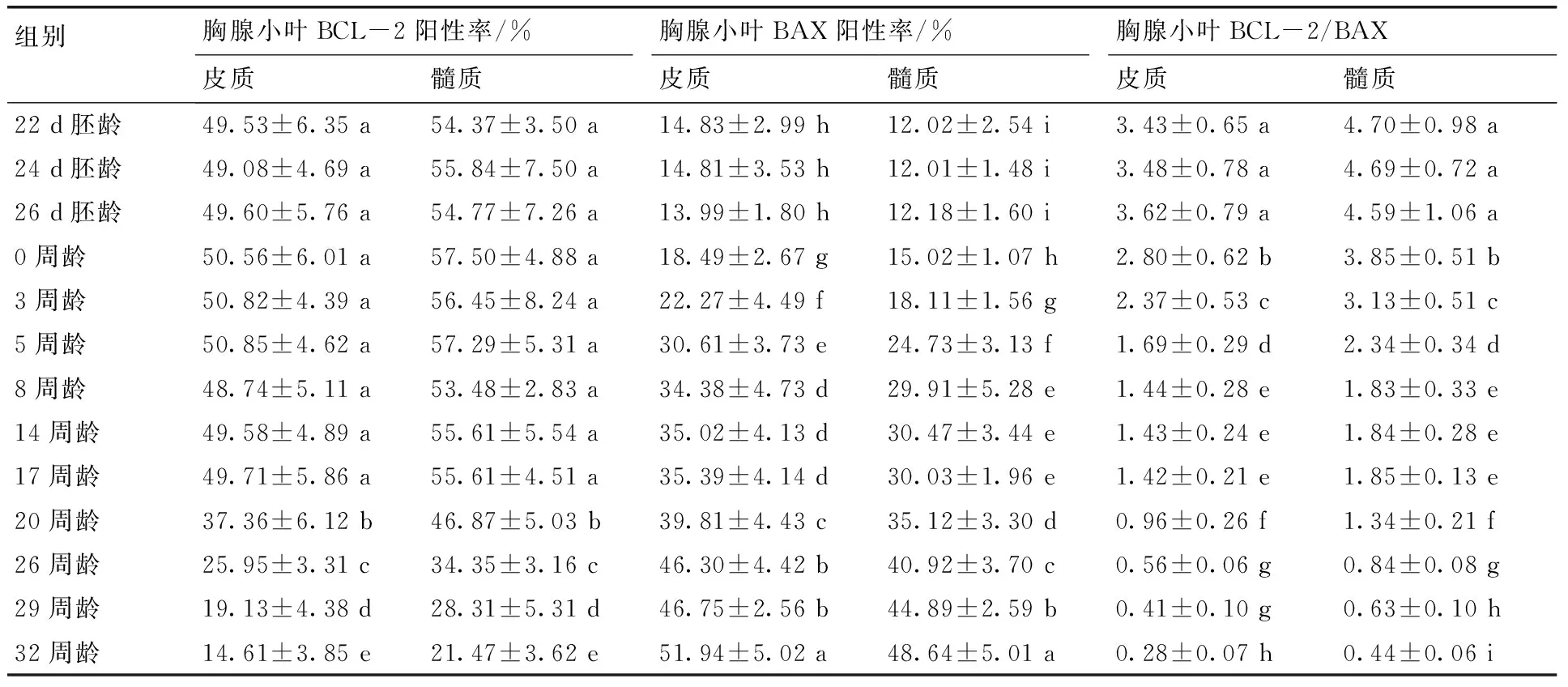
组别胸腺小叶BCL-2阳性率/%胸腺小叶BAX阳性率/%胸腺小叶BCL-2/BAX皮质髓质皮质髓质皮质髓质22d胚龄49.53±6.35a54.37±3.50a14.83±2.99h12.02±2.54i3.43±0.65a4.70±0.98a24d胚龄49.08±4.69a55.84±7.50a14.81±3.53h12.01±1.48i3.48±0.78a4.69±0.72a26d胚龄49.60±5.76a54.77±7.26a13.99±1.80h12.18±1.60i3.62±0.79a4.59±1.06a0周龄50.56±6.01a57.50±4.88a18.49±2.67g15.02±1.07h2.80±0.62b3.85±0.51b3周龄50.82±4.39a56.45±8.24a22.27±4.49f18.11±1.56g2.37±0.53c3.13±0.51c5周龄50.85±4.62a57.29±5.31a30.61±3.73e24.73±3.13f1.69±0.29d2.34±0.34d8周龄48.74±5.11a53.48±2.83a34.38±4.73d29.91±5.28e1.44±0.28e1.83±0.33e14周龄49.58±4.89a55.61±5.54a35.02±4.13d30.47±3.44e1.43±0.24e1.84±0.28e17周龄49.71±5.86a55.61±4.51a35.39±4.14d30.03±1.96e1.42±0.21e1.85±0.13e20周龄37.36±6.12b46.87±5.03b39.81±4.43c35.12±3.30d0.96±0.26f1.34±0.21f26周龄25.95±3.31c34.35±3.16c46.30±4.42b40.92±3.70c0.56±0.06g0.84±0.08g29周龄19.13±4.38d28.31±5.31d46.75±2.56b44.89±2.59b0.41±0.10g0.63±0.10h32周龄14.61±3.85e21.47±3.62e51.94±5.02a48.64±5.01a0.28±0.07h0.44±0.06i
注:同列不同小写字母标注示差异显著(P<0.05),相同小写字母标注示差异不显著(P>0.05)。下同。
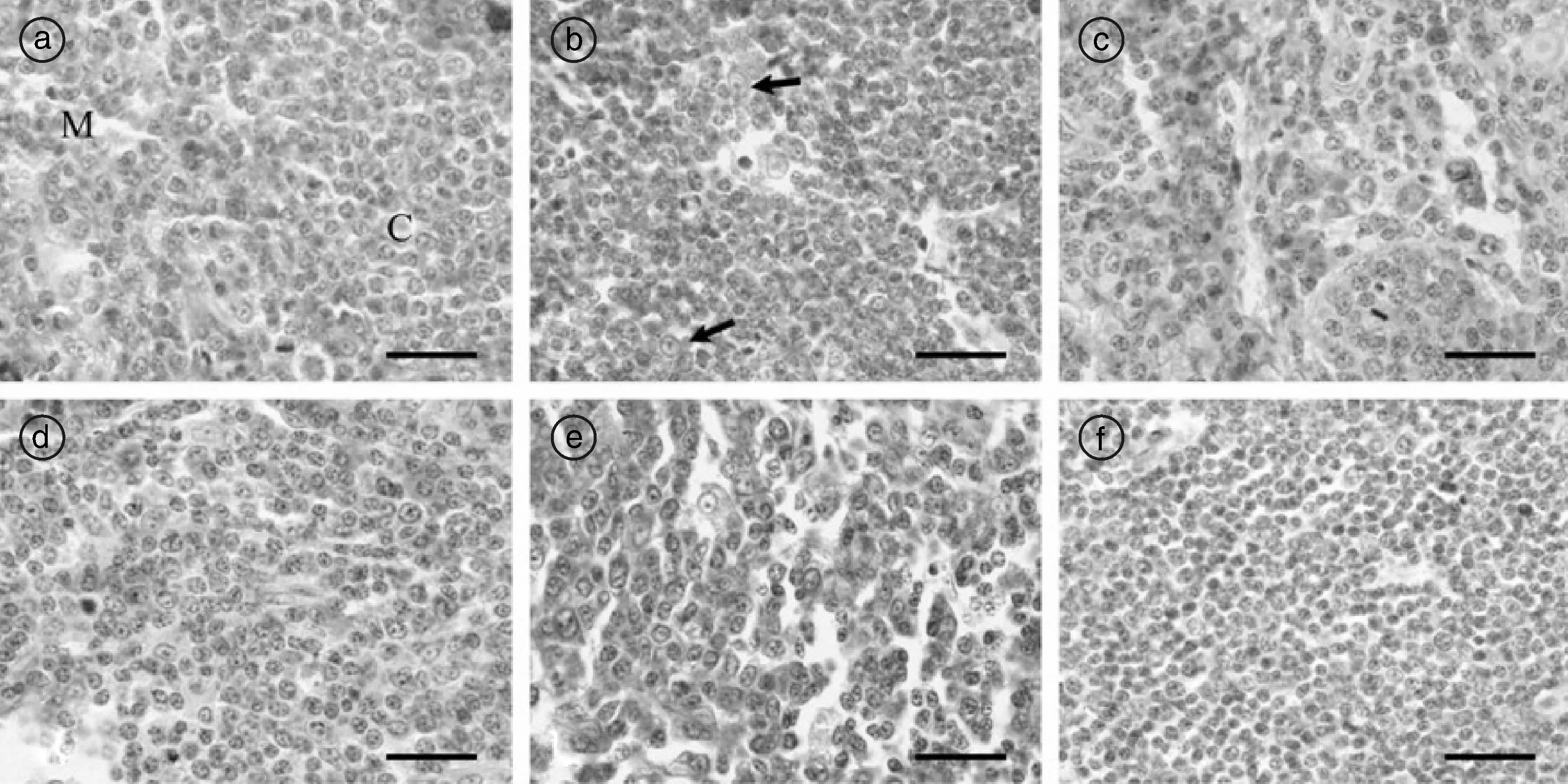
a: 26 d胚龄胸腺小叶皮质和髓质淋巴细胞BCL-2蛋白阳性反应; b: 胚后20周龄皮质淋巴细胞和上皮细胞(箭头)BCL-2蛋白阳性反应; c: 胚后29周龄髓质淋巴细胞BCL-2蛋白阳性反应; d: 22 d胚龄皮质淋巴细胞BAX蛋白阳性反应; e: 胚后32周龄皮质淋巴细胞BAX蛋白阳性反应; f: 胚后3周龄胸腺BAX蛋白阴性对照。 C: 皮质; M: 髓质; 标尺=20 μm。图1 胸腺BCL-2、BAX蛋白免疫组织化学染色Fig.1 The immunohistochemistry for BCL-2 and BAX protein in thymus
3 讨论
胸腺是培育T淋巴细胞的重要场所,其中95%的T淋巴细胞通过凋亡而死亡[1]。凋亡对胸腺T淋巴细胞的发育、分化和成熟以及保持其功能稳定性均发挥着重要作用。方静等[11]前期研究结果显示,天府肉鸭胸腺胚后发育可分为继续发育期(0~8周龄)、成熟持续期(8~17周龄)和退化期(20~32周龄);胸腺小叶皮质和髓质淋巴细胞凋亡率在22~26 d胚龄恒定;0~8周龄上升,8~17周龄恒定,20~32周龄上升。
表2 胸腺淋巴细胞Bcl-2和BaxmRNA阳性率
Table 2 The positive ratios ofBcl-2 andBaxmRNA in lymphocytes of thymus
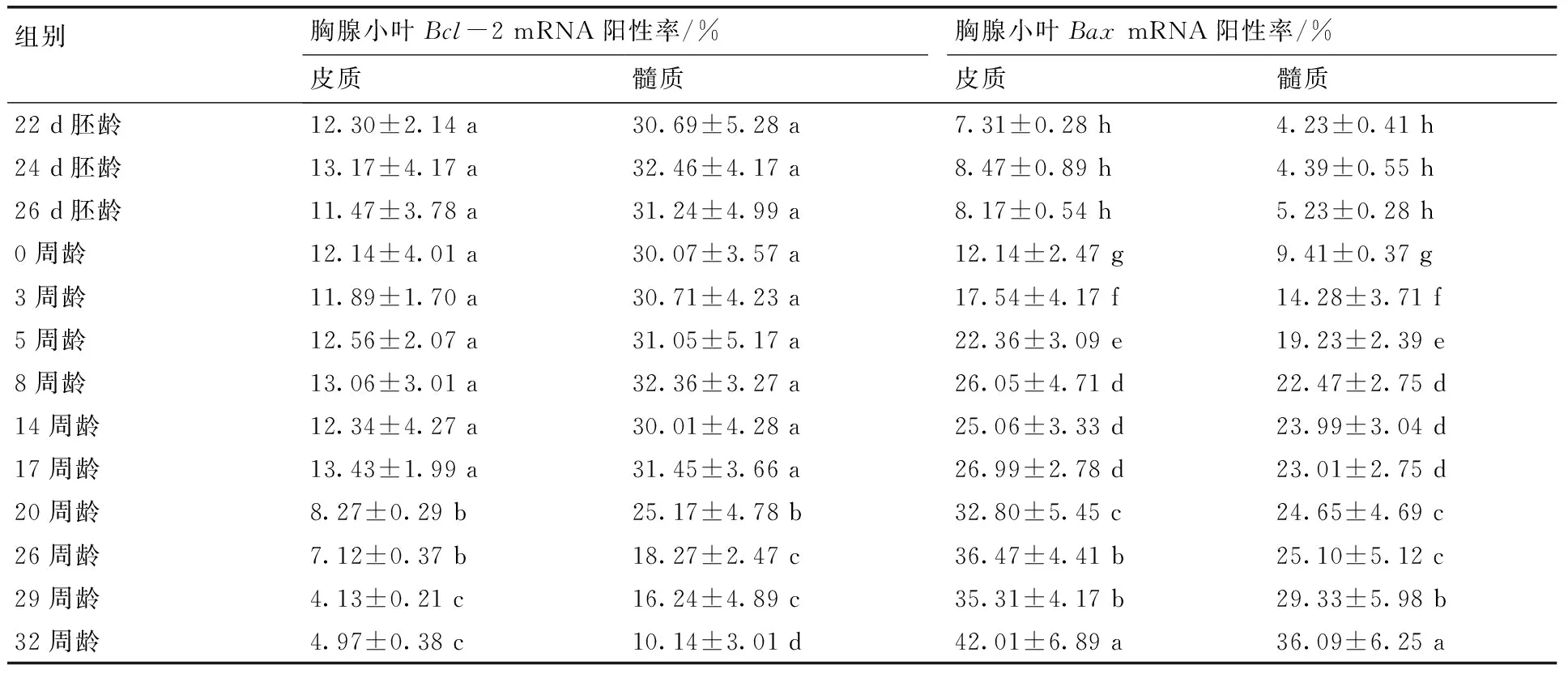
组别胸腺小叶Bcl-2mRNA阳性率/%胸腺小叶BaxmRNA阳性率/%皮质髓质皮质髓质22d胚龄12.30±2.14a30.69±5.28a7.31±0.28h4.23±0.41h24d胚龄13.17±4.17a32.46±4.17a8.47±0.89h4.39±0.55h26d胚龄11.47±3.78a31.24±4.99a8.17±0.54h5.23±0.28h0周龄12.14±4.01a30.07±3.57a12.14±2.47g9.41±0.37g3周龄11.89±1.70a30.71±4.23a17.54±4.17f14.28±3.71f5周龄12.56±2.07a31.05±5.17a22.36±3.09e19.23±2.39e8周龄13.06±3.01a32.36±3.27a26.05±4.71d22.47±2.75d14周龄12.34±4.27a30.01±4.28a25.06±3.33d23.99±3.04d17周龄13.43±1.99a31.45±3.66a26.99±2.78d23.01±2.75d20周龄8.27±0.29b25.17±4.78b32.80±5.45c24.65±4.69c26周龄7.12±0.37b18.27±2.47c36.47±4.41b25.10±5.12c29周龄4.13±0.21c16.24±4.89c35.31±4.17b29.33±5.98b32周龄4.97±0.38c10.14±3.01d42.01±6.89a36.09±6.25a

a: 胚后3周龄皮质和髓质淋巴细胞Bcl-2 mRNA阳性反应; b: 胚后29周龄皮质和髓质淋巴细胞Bcl-2 mRNA阳性反应; c: 22 d胚龄皮质和髓质淋巴细胞Bax mRNA阳性反应; d: 胚后32周龄髓质淋巴细胞Bax mRNA阳性反应; e: 胚后29周龄弥散胸腺小体(*)中上皮细胞(粗箭头)和淋巴细胞(细箭头)Bax mRNA阳性反应; f: 胚后3周龄胸腺Bax mRNA阴性对照。 C: 皮质; M: 髓质;标尺=20 μm。图2 胸腺Bcl-2,Bax mRNA原位杂交染色Fig.2 In situ hybridization techniques for Bcl-2 and Bax mRNA in thymus
BCL-2是BCL-2家族蛋白成员中的主要抗凋亡分子[12-14]。本研究结果显示,在胸腺胚胎及胚后发育过程中BCL-2蛋白表达于皮质和髓质淋巴细胞,其阳性率在22 d胚龄~17周龄恒定,20~32周龄呈下降趋势。比较鸭胸腺淋巴细胞BCL-2蛋白阳性率与其凋亡率[11]的关系,发现二者在22 d胚龄~17周龄无明显对应关系,在20~32周龄呈反向关系,说明BCL-2蛋白主要在退化期对胸腺淋巴细胞凋亡发挥抑制作用。Veis等[5]报道15.5~16.5 d胚龄小鼠胸腺中有60%~70%的淋巴细胞表达BCL-2,而发育到17.5 d胚龄时,表达BCL-2的淋巴细胞数降至20%~30%,说明在胚胎发育期,BCL-2蛋白在胸腺中表达呈现阶段性变化;李奎等[10]研究发现BCL-2蛋白在胚后不同发育阶段固始鸡胸腺内的表达没有阶段性差异,这与本文观察到BCL-2蛋白在鸭胸腺淋巴细胞中的表达规律不同。本研究中,各组胸腺皮质淋巴细胞BCL-2阳性率均明显小于髓质,说明BCL-2蛋白优势定位于髓质,这与小鼠、人、鸡中的研究结果相似[5,7,10]。
BAX蛋白可促进细胞凋亡[12-14]。本研究结果显示,BAX蛋白表达于胸腺小叶皮质和髓质淋巴细胞,且阳性率在22~26 d胚龄及8~17周龄恒定,而在0~8周龄和17~32周龄呈上升趋势。比较鸭胸腺淋巴细胞BAX阳性率与其凋亡率[11]的关系,发现二者的变化趋势基本一致,提示BAX在胸腺胚胎及胚后发育过程中对其淋巴细胞凋亡具有明显的促进作用。李奎等[10]研究显示,BAX在固始鸡胸腺淋巴细胞内有表达,主要分布于胸腺小叶髓质,其次是皮质与髓质交界处;BAX蛋白在胸腺不同发育阶段,其表达量不同,1~8周龄与12~20周龄相比有差异,后者比前者维持较高的表达量。本研究观察到天府肉鸭胸腺中BAX在胸腺皮质中的表达量高于髓质。由此可见BAX蛋白在天府肉鸭胸腺内的表达部位以及胚后表达规律与固始鸡均不相同。
BCL-2和BAX是BCL-2家族中功能相反的两个重要成员,分别有抑制和促进凋亡的作用。Oltvai等[12]认为,BCL-2和BAX比值是决定细胞生死存亡的关键机制之一,比值升高,表现抗凋亡作用;反之,则促进凋亡。本研究结果显示,胸腺皮质和髓质淋巴细胞BCL-2/BAX值在22~26 d胚龄恒定,0~8周龄下降,8~17周龄恒定,20~32周龄下降,将这一结果与胸腺淋巴细胞凋亡率[11]进行比较,可见BCL-2/BAX值在22~26 d胚龄以及8~17周龄当凋亡率趋于恒定时也维持恒定,其余各组则基本与凋亡率呈反向关系。说明总体上胸腺淋巴细胞凋亡的发生与否与BCL-2/BAX的比值有关。前期研究结果显示,胸腺淋巴细胞凋亡率在0~8周龄和20~32周龄呈上升态势[11]。本试验观察到0~8周龄,BCL-2阳性率变化不大,但BAX阳性率则逐渐升高,提示在此期间,淋巴细胞凋亡逐渐活跃,可能主要受BAX的上调,BCL-2/BAX值的减小实现的;胚后20~32周龄,BCL-2阳性率呈显著下降趋势,而BAX阳性率呈明显上升态势,说明在胸腺退化期,淋巴细胞凋亡明显增强,不仅受BAX的上调,而且还受BCL-2的下调,BCL-2/BAX值减小,促进了淋巴细胞的凋亡。
本文结果表明在胚胎及胚后发育过程中胸腺淋巴细胞Bcl-2 mRNA阳性率与其蛋白阳性率的变化规律基本一致,且各组胸腺皮质淋巴细胞Bcl-2 mRNA及其蛋白阳性率均明显小于髓质,说明二者的组织分布一致,均优势定位于髓质,以上结果提示该基因在天府肉鸭胸腺中的表达调控发生在转录水平。关于Bcl-2基因在胸腺中的调控机制报道不一。Chleg-Deschamps等[6]报道人胸腺组织内均有BCL-2蛋白和Bcl-2 mRNA阳性反应,但二者定位彼此分离,前者主要分布于髓质,后者则相对密集于皮质,说明人胸腺Bcl-2基因表达存在转录后调控。而陈协群等[7]研究显示,Bcl-2 mRNA及其蛋白均优势定位于人胎儿胸腺髓质区,仅少数BCL-2蛋白阳性细胞和Bcl-2 mRNA弱阳性细胞散在分布于皮质,因而Bcl-2基因在人胸腺中的表达调控发生在转录水平。由于Chleg-Deschamps等采用“有意义”或正链Bcl-2寡核苷酸探针作为阴性对照时,胸腺皮质仍出现明确且较强的“阳性”杂交信号[6],因此陈协群等[7]对Chleg-Deschamps等设计的BCL-2反义寡核苷酸探针是否具有可靠的特异性及敏感性提出疑问。我们的结果和结论与陈协群等相似,而与Chleg-Deschamps等的不同,与Chleg-Deschamps等的不同是否也与陈协群等提出的疑问有关,尚需进一步探讨。此外,Yutaka等[15]报道Bcl-2 mRNA在胚胎和成年鸡胸腺中均有表达,其中在胚胎鸡中的表达较成年鸡高;张书霞等[8]研究显示,鸡胚及成年鸡胸腺中均有Bcl-2 mRNA的高效表达。本研究结果显示,鸭胸腺中均有Bcl-2 mRNA的表达,其中在胚胎期中的表达高于胚后20~32周龄,这一结果与Yutaka等[15]和张书霞等[8]的报道具有相似之处。
本试验中,胸腺皮质和髓质淋巴细胞BaxmRNA阳性率与其蛋白阳性率的变化规律基本一致,且各组皮质淋巴细胞BaxmRNA及其蛋白阳性率均明显高于髓质,说明二者的组织分布一致,均优势定位于凋亡活跃的皮质区T淋巴细胞,而髓质区长命T淋巴细胞的阳性反应相对较少,据上述结果推测胸腺中Bax基因表达涉及转录水平调控。
综上所述,在天府肉鸭胸腺发育过程中,其淋巴细胞可表达BCL-2、BAX蛋白及其Bcl-2和BaxmRNA,它们是免疫细胞亚型选择的重要调节物,直接调控胸腺淋巴细胞的凋亡,调节和控制胸腺的生长、发育和退化。
[1] LAURA P H. Histologic and molecular assessment of human thymus[J].AnnalsofDiagnosticPathology, 2004, 8(1):50-60.
[2] ZHANG N, HRATIG H D, ZHAGALOV I, et al. The role of apoptosis in the development and function of T lymphocytes[J].CellResearch, 2005, 15(10):749-769.
[3] MOORE N C, ANDERSON G, WILLIAMS G T, et al. Developmental regulation of bc1-2 expression in the thymus[J].Immunology, 1994, 81(1):115-119.
[4] 周瑞祥,黄云梅,刘卉.胸腺细胞凋亡的死亡信号表达[J].解剖学杂志,2006,29(2):170-173.
[5] VEIS D J, SENTMAN C L, BACH E A, et al. Expression of the Bcl-2 protein in murine and human thymocytes and in peripheral T lymphocytes[J].JournalofImmunology, 1993, 151(5):2546-2554.
[6] CHLEG-DESCHAMPS C M, LEBRUN D P, HUIE P, et al. Topographical dissociation of bcl-2 messenger RNA and protein in human lymphoid tissues[J].Blood, 1993, 81(2):293-298.
[7] 陈协群,黄高升,王文亮. 人胎儿胸腺内Bcl-2基因表达与分布[J]. 中国组织化学与细胞化学杂志,1996,5(3):270-272.
[8] 张书霞,陈万芳,于勇,等.Bcl-2基因在成年和胚胎鸡免疫器官中的表达及其与细胞凋亡的关系[J].南京农业大学学报,1999,22(4):65-68.
[9] 张书霞,鲍恩东.鸡免疫器官中半胱天冬酶-3、Bcl-2的表达与细胞凋亡的关系[J].畜牧兽医学报,2002,33(6):619-622.
[10] 李奎,李明,康相涛,等. 固始鸡免疫器官内细胞凋亡相关蛋白Bax和Bcl-2的动态表达[J].畜牧兽医学报,2008,39(7):967-973.
[11] 方静, 崔恒敏, 陈正礼, 等. 天府肉鸭胸腺淋巴细胞增殖与凋亡的增龄变化[J].畜牧兽医学报,2014,45(2):305-312.
[12] OLTVAIZ N, MILLIMAN C I, KORSMEYER S J, et al. Bcl-2 heterodimerizes in vivo with a conserved homology, bax, that acclerates programmed cell death[J].Cell, 1993, 74 (4):609-619.
[13] OSAMU T, JILL F, HEIKYUNG S, et al. Essential role of BAX, BAK in B cell homeostasis and prevention of autoimmune disease[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 2005, 102 (32):11272-11277.
[14] ROSET R, ORTET L, GIL G, et al. Role of Bcl-2 family members on apoptosis:what we have learned from knock-out mice[J].FrontiersinBioscience-landmark, 2007, 12 (20):4722-4730.
[15] YUTAKA E, DONALD L. Isolation and characterization of the chickenBcl-2 gene:expression in a variety of tissues including lymphoid and neuronal organs in adult and embryo[J].JournalofImmunology, 1993, 151 (5):2546-2554.
(责任编辑 卢福庄)
Expression of mRNA and proteins of Bcl-2 and Bax during the development in duck thymus
LIU Chun-yu*, ZHU Pan-pan*, FANG Jing**, JIANG Min, YIN Heng
(CollegeofVeterinaryMedicine,SichuanAgriculturalUniversity,Ya’an625014,China)
In order to study the expression ofBcl-2 andBaxmRNA and their proteins during the embryonic and post embryonic development of Tianfu duck thymus, 65 Tianfu ducks were divided into 3 groups as follows: 22, 24 and 26 days at embryonic stage, and 0 (neonatal stage), 3, 5, 8, 14, 17, 20, 26, 29 and 32 weeks after hatching. Immunohistochemisty andinsituhybridization techniques were used in this study. The results showed thatBcl-2 andBaxmRNA and their proteins were distributed in the thymic lymphocytes and epithelial cells. The BCL-2 positive ratios of lymphocytes in the thymic cortex and medulla were not changed from 22 days at embryonic stage to 17 weeks after hatching, but were decreased from 20 to 32 weeks after hatching. The BAX positive ratios of lymphocytes in the thymic cortex and medulla were kept unchanged from 20 to 26 days at embryonic stage and from 8 to 17 weeks after hatching, but were increased from 0 to 8 weeks and from 20 to 32 weeks after hatching. The BCL-2/BAX values of lymphocytes in the thymic cortex and medulla were not changed from 22 to 26 days at embryonic stage and from 8 to 17 weeks after hatching, but were decreased from 0 to 8 weeks and from 20 to 32 weeks after hatching. The change patterns ofBcl-2 mRNA andBaxmRNA positive ratios of lymphocytes in the thymic cortex and medulla were similar to their protein positive ratios, respectively. In each group, the BCL-2 protein,Bcl-2 mRNA positive ratios and BCL-2/BAX value of lymphocytes in the follicle cortex were significantly lower than those in the medulla, while the BAX protein andBaxmRNA positive ratios of lymphocytes in the follicle cortex were significantly higher than those in the medulla, respectively. This study indicated thatBcl-2,Baxgenes and their proteins are important modulators for the lymphocyte apoptosis of Tianfu duck thymus.
duck;thymus;Bcl-2;Bax;immunohistochemisty;insituhybridization
http://www.zjnyxb.cn
10.3969/j.issn.1004-1524.2016.01.03
2015-06-09
教育部长江学者和创新团队发展计划(0848)
刘春雨(1993—),女,河南新乡人,硕士研究生,研究方向为动物解剖与组织胚胎学,E-mail:liuchunyucyl@163.com ;朱盼盼(1994—),女,河南南阳人,本科生,E-mail:suyitianya123@163.com
**通信作者,方静,E-mail:fang jing4109@163.com
S834.89;S852
A
1004-1524(2016)01-0015-07
浙江农业学报ActaAgriculturaeZhejiangensis, 2016,28(1):15-21
刘春雨,朱盼盼,方静,等. 天府肉鸭发育过程中胸腺Bcl-2,Bax基因及蛋白的表达[J].浙江农业学报,2016,28(1):15-21.
*刘春雨,朱盼盼对本论文具有同等贡献,为共同第一作者。

