河南汉族人群HLA超型的分析研究
刘悦越, 杜加亮, 刘 艳, 宣 博, 范行良, 于晴川, 高加梅, 国 泰
(中国食品药品检定研究院,北京 100050; *通讯作者,E-mail:guotai@nifdc.org.cn)
河南汉族人群HLA超型的分析研究
刘悦越, 杜加亮, 刘 艳, 宣 博, 范行良, 于晴川, 高加梅, 国 泰
(中国食品药品检定研究院,北京 100050;*通讯作者,E-mail:guotai@nifdc.org.cn)
目的 分析河南汉族人群HLA基因多态性和超型分布。 方法 采用测序法对111名志愿者的血样进行HLA-A、-B、-C、-DRB1和-DQB1五个座位的基因分型,分别根据5个研究组的HLA超型分型标准进行HLAⅠ类和Ⅱ类超型的分析统计。 结果 总共检测出130个HLA等位基因,其中HLA-A座位为21个等位基因,-B座位为41个,-C座位为24个,-DRB1座位为27个,-DQB1座位为17个。依据不同的分型方法,共得到86个超型,其中HLAⅠ类51种,Ⅱ类35种。按照5个研究组的分型标准,HLAⅠ类的优势超型型别基本相似,其中HLA-A2和-B7的分布差异无统计学意义(P>0.05)。但对于HLAⅡ类分子,超型名称分类标准在不同的研究组均不同。 结论 获得河南汉族人群的超型分布特征,HLAⅠ类分子的优势超型为HLA-A3、-A2、-B7、-B44和-B62,但HLAⅡ类分子的超型分类标准尚不统一,有待进一步研究。
人类白细胞抗原; 超型; 基因多态性; 表位疫苗
人类白细胞抗原(human leukocyte antigen,HLA)是人体调节免疫应答的关键分子,丰富的群体多态性是HLA的一个重要特点[1]。它包括224个基因座位,其中128个为功能基因,96个为假基因。截止至2016年3月,国际免疫遗传学信息系统数据库IMGT/HLA中记录的HLA Ⅰ类等位基因为10 730个,HLA Ⅱ类等位基因为3 743个[2]。而且随着研究的不断进行,其种类持续增长。大多数多态性位于肽结合区,理论上每一种等位基因识别一种抗原表位。然而,研究表明很多HLA分子可以结合相似的一类肽,根据HLA的肽结合位点的相似基序可以将一些HLA分子归类为一种超型[1,3],这种分类在一定程度上简化了HLA多态复杂性。
目前对于HLA超型的分类尚无统一的标准和方法。本文采用序列分析技术(sequence-based typing,SBT)对111名河南汉族健康人血样进行HLA-A、-B、-C、-DRB1、-DQB1位点等位基因分型,通过综述相关文献的超型分类标准对样本等位基因进行超型归类,以探讨在我国河南省HLA基因多态性和超型的分布特征,为研究HLA超型与移植免疫、病原体感染的相关性,特别是疫苗设计与免疫效果的机制研究提供免疫学基础支持资料。
1 材料及方法
1.1 样本来源
样本为本实验室留存的来自河南汉族人群的111份疫苗免疫原性研究剩余样本,置于-80 ℃保存。征得受试者或其监护人同意后,进行HLA分型检测。
1.2 主要试剂与仪器
DNA提取试剂盒(QIAamp DNA Blood Mini Kit,凯杰公司),HLA-A,-B,-C,-DRB1和-DQB1分型试剂盒(SBT法,深圳华大基因),PCR产物纯化试剂盒(ExoSAP-IT,美国USB公司),BigDye®Terminator v3.1循环测序试剂盒(美国ABI公司),基因扩增仪(Verti96,美国ABI公司),基因测序仪(3730XL,美国ABI公司)
1.3 DNA提取
按照QIAamp DNA Blood Mini Kit说明书操作步骤进行DNA提取,100 μl洗脱液洗脱,于-30 ℃保存备用。
1.4 HLA分型
分别采用深圳华大基因的BGI HLA-A,-B,-C,-DRB1和-DQB1分型试剂盒对HLA五个位点进行PCR扩增,使用PCR产物纯化试剂盒对PCR产物进行纯化,按照BigDye®Terminator v3.1循环测序试剂盒说明书步骤对纯化后的产物进行测序反应和纯化,置于ABI 3730XL基因测序仪进行测序,测序结果导入Soap typing 1.01软件,在IMGT/HLA数据库3.10中进行比对分型。
1.5 确定超型分类依据
在Pubmed数据库中检索关键词为“supertype”和“HLA”的所有HLA超型分型相关文献,剔除不符合条件的文章,如研究不是基于高分辨的HLA等位基因分型结果,或仅仅局限于有限的几个等位基因型别进行超型分型。根据各文献研究结果将各型别的等位基因归于相应的超型。
1.6 统计学处理
使用Arlequin3.5.1.3软件分别对人群的5个位点基因分布进行Hardy-Weinber平衡检验,P>0.05为期望值和观察值差异无统计学意义。统计分析使用SPSS 19.0软件,计算人群HLA等位基因和超型的频数。对于频率较高的优势超型,采用卡方检验统计根据不同研究组的分类标准该超型的分布差异,P<0.05代表差异有统计学意义。
2 结果
2.1 各位点HLA等位基因频率
在111份样本中,总共检测出130个HLA等位基因,其中HLA-A座位为21个等位基因,-B座位为41个,-C座位为24个,-DRB1座位为27个,DQB1座位为17个,呈现较高的基因多态性。A、B、C、DRBl和DQB1各座位频率排名前4位的等位基因分别是A*11:01,A*02:01,A*24:02,A*30:01,B*13:02,B*52:01,B*40:01,B*13:01,C*07:02,C*03:04,C*06:02,C*01:02,DRB1*15:01,DRB1*09:01,DRB1*07:01,DRB1*11:01,DQB1*03:01,DQB1*03:03,DQB1*06:01,DQB1*06:02。除了HLA-B座位外,其他座位的前4个等位基因累计频率均超过50%,表明在本研究人群中,HLA等位基因的分布相对比较集中。通过最大似然估计法对人群的HLA-A、-B、-C、-DRB1和-DQB1五个位点基因分布进行Hardy-Weinber平衡检验,均无统计学差异(P>0.05),说明所选样本具有群体代表性。
2.2 超型分类
根据检索结果,共有5个实验室[4-8]的分类标准用于HLA Ⅰ类的超型分型,5个[5,9-12]用于HLA Ⅱ类的超型分型。结合本研究的HLA分型结果,共得到86个超型,其中HLA Ⅰ类51种,Ⅱ类35种。
2.3 超型分布
根据不同研究组的超型分类方法,各HLA超型所包括的HLA等位基因型别不完全一致,所占频数和频率也不完全相同,HLAⅠ类分子超型见表1。总体分布以HLA-A3、A2和B7、B44、B62为主,所占比重较大。根据不同的分类标准,A2(P=0.297)和B7(P=0.208)分布频率差异无统计学意义,但A3、B44和B62的分布差异有统计学意义(P=0.000)。
HLAⅡ类分子超型见表2。根据不同的Ⅱ类超型分类方法,超型的名称表示方法及其分布频率均不同。
3 讨论
在人类机体的免疫系统中,T淋巴细胞识别抗原递呈细胞表面的HLA Ⅰ类或Ⅱ类分子结合肽,是启动适应性免疫反应的第一步。形成HLA-抗原肽-TCR复合物,才能启动免疫应答[13]。从疫苗的[n]是指按照参考文献n的分类标准对HLA各等位基因进行超型分型;其他是指文献中未涉及,而本调查人群中检出的等位基因,均归为其他角度来说,需要含有模拟感染性病原体或肿瘤的抗原,且能够与HLAⅠ类或Ⅱ类分子结合,才能有效激活免疫反应。但是对于表位肽疫苗,由于HLA基因的多态性导致HLA的肽结合能力差异,使得特定的肽段仅能与有限的HLA特异性结合,因此该疫苗仅能用于有限的人群,而缺乏广谱性。为了减低HLA基因多态性的这种复杂性,使表位肽疫苗的使用成为可能,不同的HLA分子根据其具有相同或相似的肽结合特异性而被定义为同一HLA超型,从而简化了疫苗抗原肽的选择,使之能够与大多数HLA分子结合[14]。
表1 河南汉族人群HLA Ⅰ类超型分布频率
Table 1 The frequencies of HLA class Ⅰ supertypes in Henan Han population
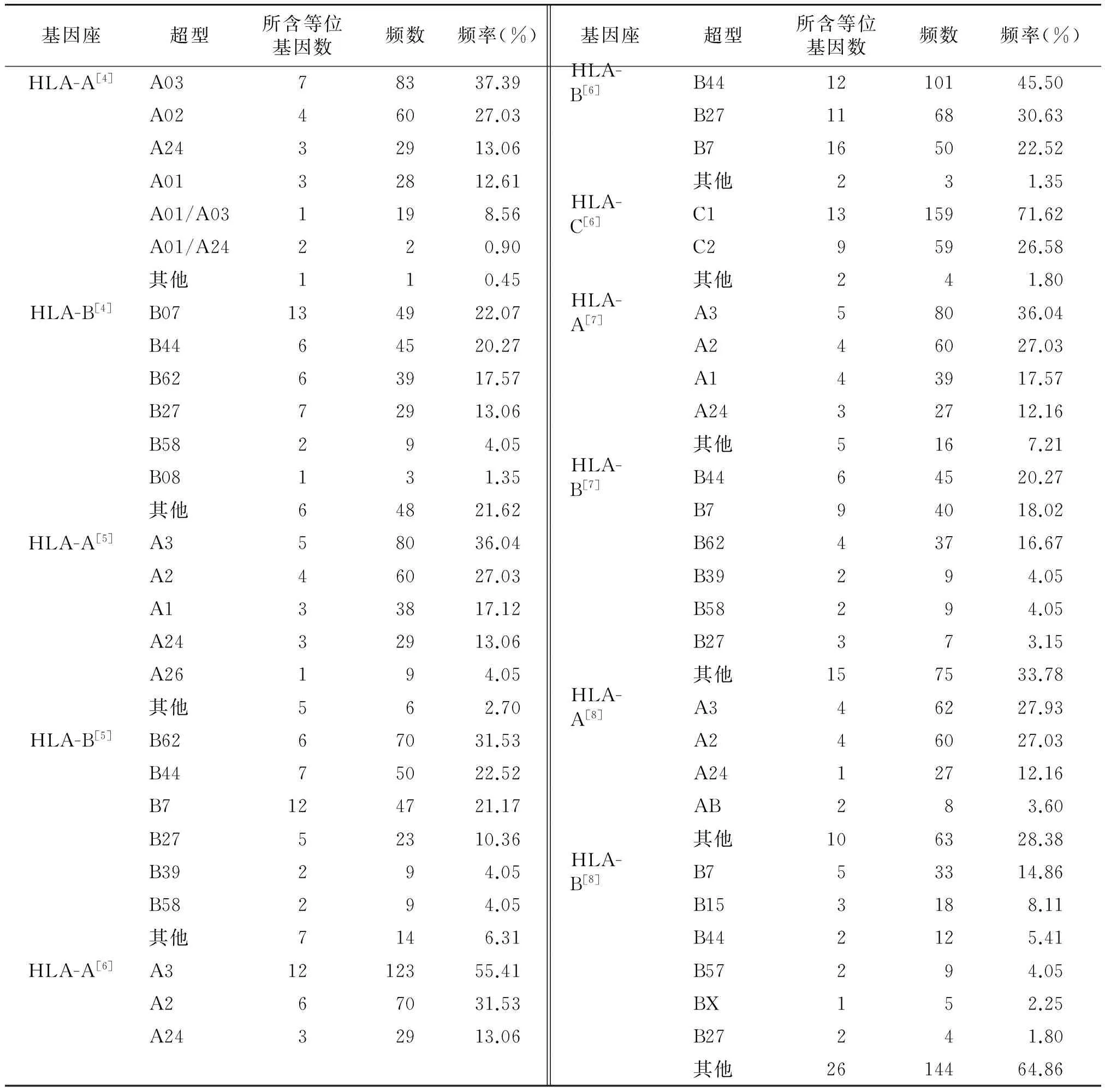
基因座超型所含等位基因数频数频率(%)基因座超型所含等位基因数频数频率(%)HLA-A[4]A0378337.39HLA-B[6]B441210145.50A0246027.03B27116830.63A2432913.06B7165022.52A0132812.61其他231.35A01/A031198.56HLA-C[6]C11315971.62A01/A24220.90C295926.58其他110.45其他241.80HLA-B[4]B07134922.07HLA-A[7]A358036.04B4464520.27A246027.03B6263917.57A143917.57B2772913.06A2432712.16B58294.05其他5167.21B08131.35HLA-B[7]B4464520.27其他64821.62B794018.02HLA-A[5]A358036.04B6243716.67A246027.03B39294.05A133817.12B58294.05A2432913.06B27373.15A26194.05其他157533.78其他562.70HLA-A[8]A346227.93HLA-B[5]B6267031.53A246027.03B4475022.52A2412712.16B7124721.17AB283.60B2752310.36其他106328.38B39294.05HLA-B[8]B753314.86B58294.05B153188.11其他7146.31B442125.41HLA-A[6]A31212355.41B57294.05A267031.53BX152.25A2432913.06B27241.80其他2614464.86
肽亲和力是影响T细胞识别和结合病原体的重要因素,测定和判断哪些型别的HLA分子具有相似的肽亲和力,有不同的方法。学者们基于不同的方法,提出几种不同的分类系统来定义HLA超型的类型。目前研究HLA超型的难点是其分类尚没有一个公认的标准来定义哪些等位基因构成特定的超型。不同的研究组可能采用不同的实验和计算标准[n]是指按照参考文献n的分类标准对HLA各等位基因进行超型分型;其他是指文献中未涉及,而本调查人群中检出的等位基因,均归为其他来确定HLA分子-肽亲和力,从而对等位基因进行超型分类。例如,Sidney等[4]采用基序扫描的方式根据结合基序的重叠关系定义HLA分子超型;而根据HLA分子中多肽结合槽的氨基酸突变规律,Doytchinova等[6]利用分级成簇和主要成分分析技术对HLAⅠ类分子的结构以及结合位点残基突变特点进行计算得到超型;Hertz和Yanover[7]则利用距离矩阵对HLAⅠ类分子的超型进行划分。因此,本研究中我们使用多个研究组的不同超型定义标准,来对研究数据进行超型分类。这种方法能够为HLA超型的分布特点提供新的信息,同时避免因局限于某种方法而忽略了应有的结果。
表2 河南汉族人群HLA Ⅱ类超型分布频率
Table 2 The frequencies of HLA class Ⅱ supertypes in Henan Han population
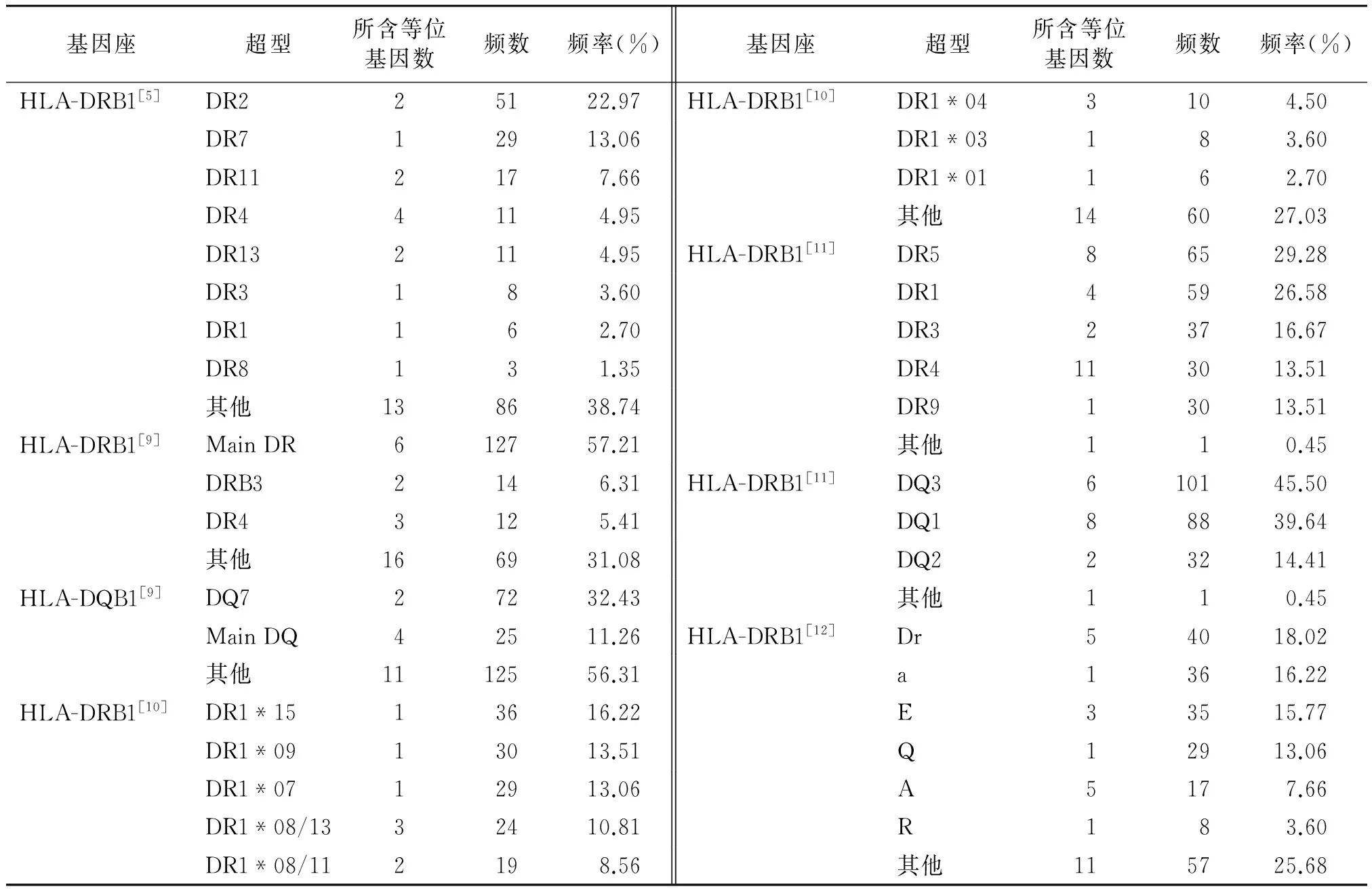
基因座超型所含等位基因数频数频率(%)基因座超型所含等位基因数频数频率(%)HLA-DRB1[5]DR225122.97HLA-DRB1[10]DR1*043104.50DR712913.06DR1*03183.60DR112177.66DR1*01162.70DR44114.95其他146027.03DR132114.95HLA-DRB1[11]DR586529.28DR3183.60DR145926.58DR1162.70DR323716.67DR8131.35DR4113013.51其他138638.74DR913013.51HLA-DRB1[9]MainDR612757.21其他110.45DRB32146.31HLA-DRB1[11]DQ3610145.50DR43125.41DQ188839.64其他166931.08DQ223214.41HLA-DQB1[9]DQ727232.43其他110.45MainDQ42511.26HLA-DRB1[12]Dr54018.02其他1112556.31a13616.22HLA-DRB1[10]DR1*1513616.22E33515.77DR1*0913013.51Q12913.06DR1*0712913.06A5177.66DR1*08/1332410.81R183.60DR1*08/112198.56其他115725.68
在本研究中,根据不同研究组的分类标准,HLA各位点的超型组成有所不同。但有些位点的优势超型型别基本一致,如HLA-A位点,根据不同研究组的标准,频率最高的超型均是A3(27.93%-55.41%),其次为A2(27.03%-31.53%)。对于HLA-B位点,由于不同的判定标准,各超型所包含的等位基因不同,优势超型也不同,如根据Sidney等[4]、Reche等[8]两个研究组的标准,频率最高的B位点超型是B07,按照Doytchinova等[6]、Hertz等[5]两个研究组的标准,频率最高的是B44超型,而按照Lund等[5]的分类方法,优势超型则是B62。其中B07的分布频率差异无统计学意义(P=0.208),但B44和B62的分布差异有统计学意义(P<0.05)。而对于HLA Ⅱ类分子,其分类研究不如Ⅰ类分子成熟,在不同的研究组,各超型名称和分类标准差异明显,尚有待进一步研究和规范。
中国人群的HLA呈现出明显的基因多态性和空间异质性。本研究首次综合不同的HLA超型分类标准分析河南地区志愿者HLAⅠ类和Ⅱ类超型分布规律及特点,是在HLA超型水平上对以往统计研究结果的补充与深入,从新的角度为研究疾病与HLA分子相关性分析的提供一定的数据支持,为今后有针对性地设计感染性病原体或肿瘤相关抗原HLA超型限制性表位疫苗的设计提供方向。
[1] Vejbaesya S,Thongpradit R,Kalayanarooj S,etal.HLA class Ⅰ supertype associations with clinical outcome of secondary dengue virus infections in ethnic Thais[J].J Infect Dis,2015,212(6):939-947.[2] The IPD-IMGT/HLA database.HLA allele statistics[EB/OL].[2016-05-01].http://www.ebi.ac.uk/ipd/imgt/hla/stats.html.
[3] Dos Santos Francisco R,Buhler S,Nunes JM,etal.HLA supertype variation across populations:new insights into the role of natural selection in the evolution of HLA-A and HLA-B polymorphisms[J].Immunogenetics,2015,67(11-12):651-663.
[4] Sidney J,Peters B,Frahm N,etal.HLA class Ⅰ supertypes:a revised and updated classification[J].BMC Immunol, 2008, 9:1.
[5] Lund O,Nielsen M,Kesmir C,etal.Definition of supertypes for HLA molecules using clustering of specificity matrices[J].Immunogenetics,2004,55(12):797-810.
[6] Doytchinova IA,Guan P,Flower DR.Identifying human MHC supertypes using bioinformatic methods[J].J Immunol,2004,172(7):4314-4323.
[7] Hertz T,Yanover C.Identifying HLA supertypes by learning distance functions[J].Bioinformatics,2007,23(2):e148-155.
[8] Reche PA,Reinherz EL.Definition of MHC supertypes through clustering of MHC peptide-binding repertoires[J].Methods Mol Biol,2007,409:163-173.
[9] Greenbaum J,Sidney J,Chung J,etal.Functional classification of class Ⅱ human leukocyte antigen(HLA) molecules reveals seven different supertypes and a surprising degree of repertoire sharing across supertypes[J].Immunogenetics,2011,63(6):325-335.
[10] Nielsen M,Lundegaard C,Blicher T,etal.Quantitative predictions of peptide binding to any HLA-DR molecule of known sequence:NetMHCIIpan[J].PLoS Comput Biol,2008,4(7):e1000107.
[11] Doytchinova IA,Flower DR.In silico identification of supertypes for class Ⅱ MHCs[J].J Immunol,2005,174(11):7085-7095.
[12] Ou D,Mitchell LA,Tingle AJ.A new categorization of HLA DR alleles on a functional basis[J].Hum Immunol,1998,59(10):665-676.
[13] Garcia-Guerrero E,Perez-Simon JA,Sanchez-Abarca LI,etal.The dynamics of the human leukocyte antigen head domain modulates its recognition by the T-cell receptor[J].PLoS One,2016,11(4):e0154219.
[14] Wang S,Bai Z,Han J,etal.Improving the prediction of HLA class Ⅰ-binding peptides using a supertype-based method[J].J Immunol Methods,2014,405:109-120.
Study of HLA supertype in Henan Han population
LIU Yueyue, DU Jialiang, LIU Yan, XUAN Bo, FAN Xingliang, YU Qingchuan, GAO Jiamei, GUO Tai*(NationalInstitutesforFoodandDrugControl,Beijing100050,China;*Correspondingauthor,E-mail:guotai@nifdc.org.cn)
ObjectiveTo analyze the polymorphism of HLA gene and its supertype distribution in Henan Han population.MethodsBlood samples of 111 volunteers were genetyped by sequence-based typing(SBT) method for the HLA-A, -B, -C, -DRB1 and DQB1 loci. The HLA class Ⅰ and class Ⅱ supertypes were studied according to the standard defined by 5 different laboratories, respectively.ResultsA total of 130 HLA alleles were observed, including 21 HLA-A alleles, 41 HLA-B alleles, 24 HLA-C alleles, 27 HLA-DRB1 alleles and 17 HLA-DQB1 alleles. A total of 86 HLA supertypes were observed based on classification systems in 5 different laboratories, including 51 HLA class Ⅰ and 35 HLA class Ⅱ supertypes. The dominant supertypes of HLA class Ⅰ were basically similar. There was no significant difference in the frequencies of HLA-A2 and-B7 according to different classification system(P>0.05). However, the name and classification criteria were different for HLA class Ⅱ molecules according to different research groups.ConclusionThe distribution characteristics of the HLA supertype of Henan Han population are obtained. The dominant supertypes of HLA class Ⅰ are HLA-A3, -A2, -B7, -B44 and -B62. But the classification criteria of HLA class Ⅱ molecules are not uniform and need to be further studied.
human leukocyte antigen(HLA); supertype; gene polymorphism; peptide-based vaccines
国家科技重大专项课题资助项目(2012ZX10004702,2014ZX09304-316)
刘悦越,女,1983-04生,硕士,助理研究员,E-mail:yyliu@nifdc.org.cn
2016-07-01
Q394
A
1007-6611(2016)09-0822-05
10.13753/j.issn.1007-6611.2016.09.009

