mt-P53及Mcm7、Aurora-A在结直肠癌组织中的表达及其意义
马玮玮,张晨丽, 张 煦
(兰州大学基础医学院病理学研究所,兰州 730000;*通讯作者,E-mail:zhangxu64@163.com)
mt-P53及Mcm7、Aurora-A在结直肠癌组织中的表达及其意义
马玮玮,张晨丽, 张 煦
(兰州大学基础医学院病理学研究所,兰州 730000;*通讯作者,E-mail:zhangxu64@163.com)
目的 探讨mt-P53、Mcm7及Aurora-A在结直肠癌组织中表达的意义及其相互关系。 方法 采用免疫组织化学法(SP法)检测60例结直肠癌、30例结直肠腺瘤和10例正常结直肠组织中mt-P53、Mcm7及Aurora-A的表达情况。 结果 ①mt-P53、Mcm7及Aurora-A在结直肠癌、结直肠腺瘤、正常结直肠组织中的表达均有差异性(P<0.05)。②mt-P53、Mcm7及Aurora-A在结直肠癌中的表达与性别、年龄及肿瘤大小无关(P>0.05),但都与浸润程度有关(P<0.05)。Mcm7与肿瘤的分化程度、淋巴结转移和Dukes分期关系密切(P<0.05),<5年生存期病例的Mcm7阳性率高于≥5年生存期病例,但差异无统计学意义(P>0.05);mt-P53与淋巴结转移和Dukes分期关系密切(P<0.05)。<5年生存期病例的Aurora-A和mt-P53表达阳性率高于≥5年生存期病例(P<0.05)。③mt-P53分别与Mcm7、Aurora-A表达存在显著正相关(r=0.284,P<0.05;r=0.547,P<0.01)。 结论 P53的突变与Mcm7和Aurora-A蛋白的过表达在结直肠癌的发生、侵袭和转移中可能发挥着重要作用。综合分析mt-P53 及其结合蛋白Mcm7、Aurora-A蛋白的表达对结直肠癌的诊断和预后判断具有重要价值。
结直肠肿瘤; P53; 微小染色体维持蛋白7; Aurora-A激酶; 免疫组织化学
结直肠癌是消化系统常见恶性肿瘤之一,2008年全世界约有120万结直肠癌新发病例,其死亡率约占全部恶性肿瘤的8%[1]。近年我国的结直肠癌发病和死亡均呈上升趋势。2006-2009年结直肠癌连续位居我国恶性肿瘤发病第3位和死亡第5位[2]。目前普遍认为结直肠细胞癌变是一个多基因参与、多步骤发展的极为复杂的过程。虽然国内外已有较多的临床及实验研究对此进行探讨,但是其发病机制仍不明确。P53参与细胞内多种通路的调控,包括细胞周期阻滞、DNA损伤修复、衰老、分化、凋亡等[3],是细胞内一种主要的肿瘤抑制因子。P53的缺失和突变(mt-P53)在结直肠癌发病机制中起重要作用。另外,有关研究表明,P53结合蛋白微小染色体维持蛋白7(minichromosome maintenance protein 7,Mcm7)[4]及中心体相关激酶Aurora-A[5]也与多种消化道恶性肿瘤的发生发展关系密切。但Mcm7、Aurora-A及mt-P53蛋白在结直肠癌中的表达及其相关性还未见报道。我们采用免疫组化的方法检测Mcm7、Aurora-A及mt-P53蛋白在人结直肠癌组织中的表达,并探讨三者在结直肠癌发生、发展中的作用。
1 资料与方法
1.1 一般资料
随机抽取河西学院附属张掖人民医院病理科2009-01~2011-12经手术切除并经病理证实的结直肠癌标本60例。患者年龄在35-78岁,中位年龄62岁;其中男性34例,女性26例。根据2010年WHO消化系统肿瘤分类标准进行病理分级:高分化腺癌10例,中分化腺癌36例,低分化腺癌14例。浸润深度:肌层14例,浆膜层46例;淋巴结转移:未转移35例,转移25例;对60例结肠癌患者进行随访,5年内死亡24例,5年以上存活36例。另选取癌旁正常肠黏膜10例,腺瘤30例。所有标本均经 10%福尔马林固定,石蜡包埋后4 μm 连续切片。
1.2 主要试剂
兔抗人Mcm7抗体、兔抗人Aurora-A抗体购自英国Abcam公司,鼠抗人P53单克隆抗体、DAB显色试剂、PBS缓冲液、柠檬酸盐抗原修复缓冲液均购自福州迈新公司。
1.3 检测方法
采用免疫组化SP法,染色步骤按说明书提示,抗体Mcm7工作液浓度为1∶200,Aurora-A工作液浓度为1∶250,P53为即用型,三者都需要抗原修复,DAB显色,苏木精复染。以PBS代替一抗作为阴性对照,已知阳性片作为阳性对照。
1.4 结果判定
Mcm7、Aurora-A及mt-P53阳性染色为黄色、棕黄色或棕褐色颗粒,Mcm7及P53蛋白阳性信号位于细胞核,Aurora-A则定位于细胞质。采用二级计分法,染色强度分类:0分为无色;1分为黄色;2分为棕黄色;3分为棕褐色(深浅与背景色相对比)。阳性细胞计数:在400倍镜下选定10个视野观察,每个视野计数100个肿瘤细胞,共计1 000个细胞,计算阳性细胞所占百分比。阳性细胞百分比=阳性细胞数/所计数细胞总数×100%。1分为阳性细胞≤10%;2分为11%-50%;3分为51%-75%;4分为>76%。两者记分相乘后0-3分为阴性;>3分为阳性。
1.5 统计学方法
统计学软件采用SPSS 21.0软件包,计数资料采用χ2检验,相关分析采用Spearman等级相关分析,P<0.05为差异有统计学意义。采用Kaplan-Meier法分析mt-P53及Mcm7、Aurora-A表达与生存期的关系。
2 结果
2.1 Mcm7、Aurora-A及mt-P53蛋白在不同组织中的表达
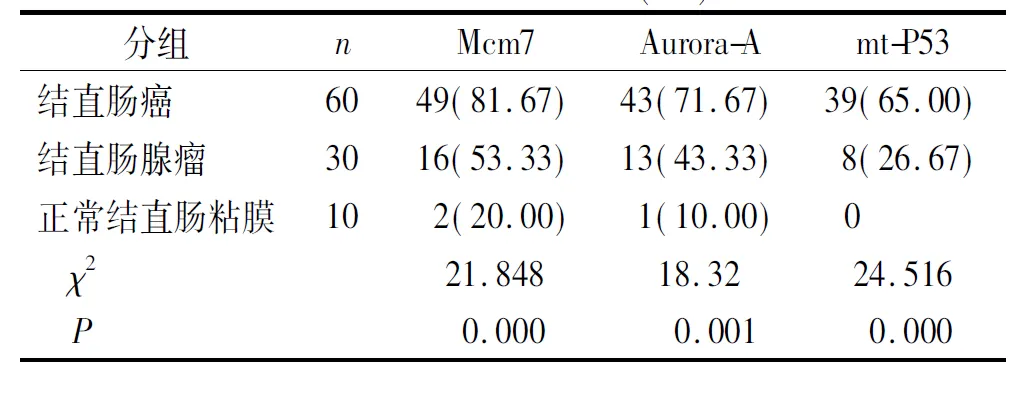
Mcm7、Aurora-A及mt-P53在正常结直肠黏膜组织、结直肠腺瘤及结直肠癌中的表达率依次增高,三组间差异均具有统计学意义(P<0. 05,见表1)。病理免疫组化结果见图1。
表1 Mcm7、Aurora-A和mt-P53在结直肠癌、腺瘤及正常组织中的阳性表达率
Table 1 The positive expression rateof Mcm7,Aurora-A and mt-P53 in colorectal carcinoma,adenoma and normal mucosa
例(%)
cases(%)
2.2 Mcm7、Aurora-A和mt-P53的表达与结直肠癌临床病理特征的关系
经统计显示,在结直肠癌组织中,Mcm7、Aurora-A和mt-P53的表达与性别、年龄及肿瘤大小无关(P>0.05),但都与浸润程度有关(P<0.05),Mcm7与肿瘤的分化程度、淋巴结转移和Dukes分期有关(P<0.05),mt-P53与淋巴结转移和Dukes分期关系密切(P<0.05),与肿瘤的分化程度无关(P>0.05),而Aurora-A与肿瘤的分化程度、淋巴结转移和Dukes分期无关(P>0.05)。<5年生存期病例的Aurora-A和mt-P53表达阳性率高于≥5年生存期病例,差异有统计学意义(P<0.05)。Mcm7在结直肠癌中的表达<5年生存期病例的阳性率高于≥5年生存期病例,但差异无统计学意义(P>0.05,见表2)。
2.3 Mcm7、Aurora-A和mt-P53在结直肠癌中的表达关系
将60例结直肠腺癌组织Mcm7、Aurora-A和mt-P53的表达结果相互对照,经Spearman等级相关分析显示,mt-P53和Mcm7、Aurora-A在结直肠癌组织中的表达存在显著正相关,且具有统计学意义(r=0.279,P<0.05;r=0.547,P<0.01;见表3);但Mcm7和Aurora-A在结直肠癌组织的表达相关性不明显,且无统计学意义(r=-0.057,P>0.05)。
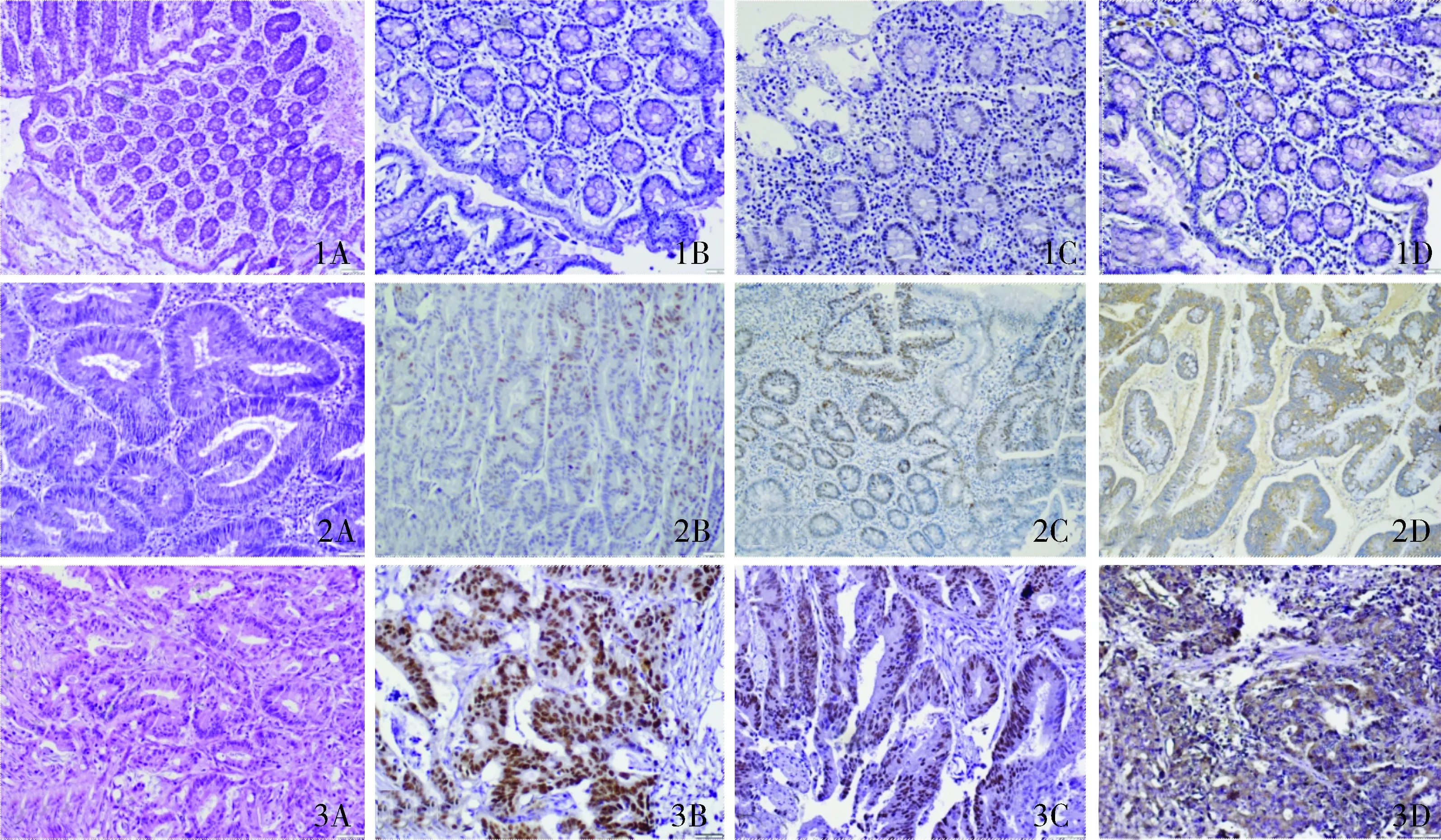
第一行正常结直肠黏膜组织,第二行结直肠腺瘤组织,第三行结直肠腺癌组织;A为HE染色,B为mt-P53表达,C为Mcm7表达,D为Aurora-A表达图1 mt-P53、Mcm7及Aurora-A在正常结直肠黏膜组织、结直肠腺瘤及结直肠癌中的表达 (×400)Figure 1 The expression of mt-P53, Mcm7 and Aurora-A in normal colorectal tissue, colorectal adenoma and colorectal carcinoma tissue (×400)
表2 Mcm7、Aurora-A和mt-P53表达与结直肠癌临床病理特征之间的关系例(%)
Table 2 Relationship between expression of Mcm7,Aurora-A and mt-P53 and clinicopathological characteristics in colorectal carcinoma cases(%)
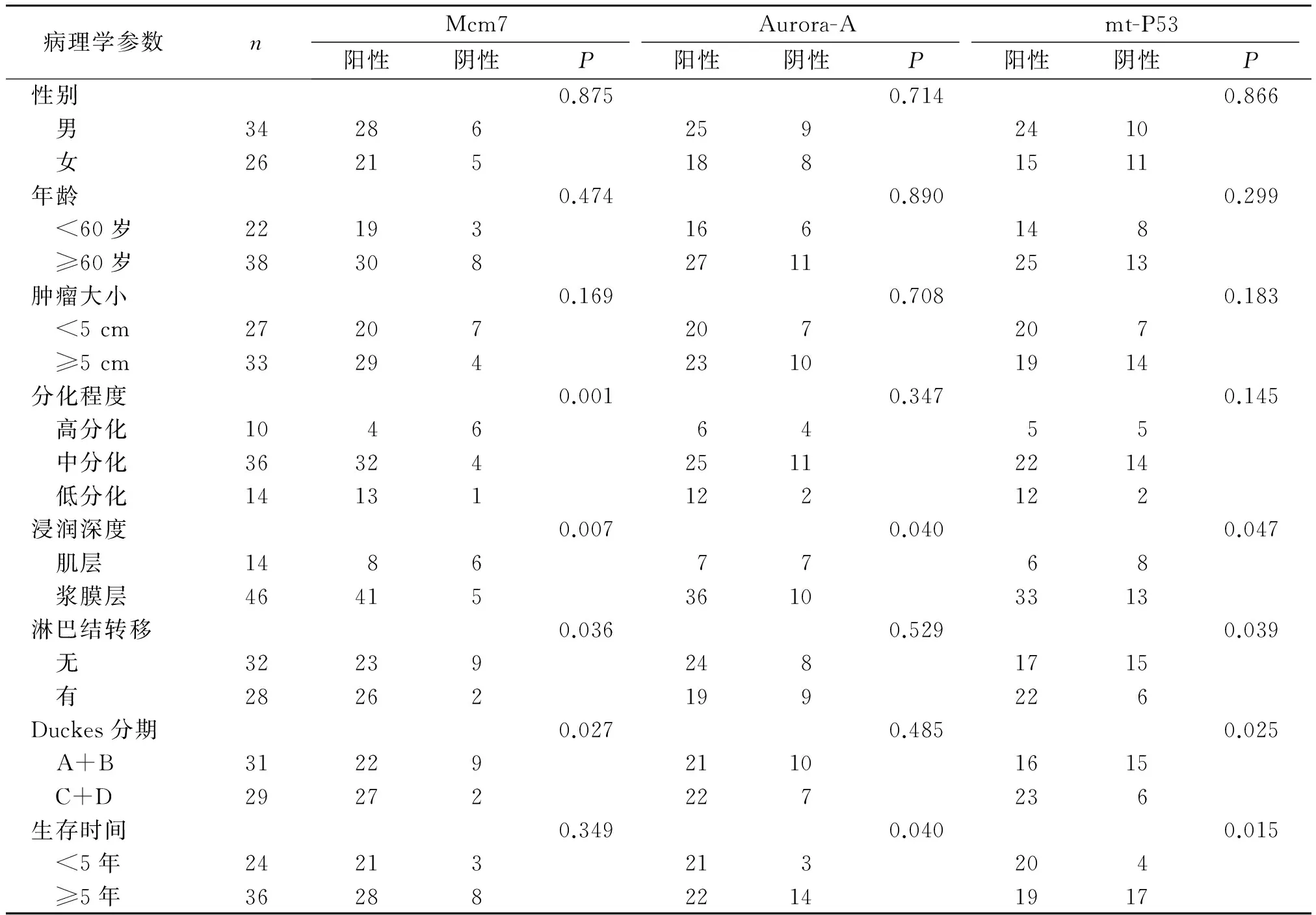
病理学参数nMcm7Aurora-Amt-P53阳性阴性P阳性阴性P阳性阴性P性别0.8750.7140.866 男342862592410 女262151881511年龄0.4740.8900.299 <60岁22193166148 ≥60岁3830827112513肿瘤大小0.1690.7080.183 <5cm27207207207 ≥5cm3329423101914分化程度0.0010.3470.145 高分化10466455 中分化3632425112214 低分化14131122122浸润深度0.0070.0400.047 肌层14867768 浆膜层4641536103313淋巴结转移0.0360.5290.039 无322392481715 有28262199226Duckes分期0.0270.4850.025 A+B3122921101615 C+D29272227236生存时间0.3490.0400.015 <5年24213213204 ≥5年3628822141917
表3 Mcm7、Aurora-A与mt-P53在结直肠癌组织中表达的关系
Table 3 Correlation between the expression of Mcm7, Aurora-A and mt-P53 in colorectal cancer
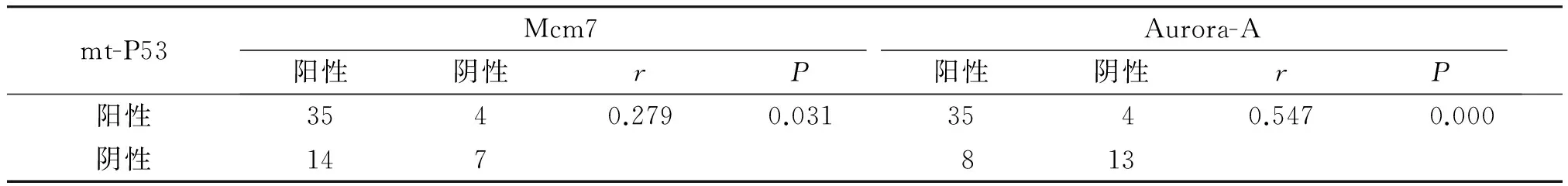
mt-P53Mcm7Aurora-A阳性阴性rP阳性阴性rP阳性3540.2790.0313540.5470.000阴性147813
2.4 Mcm7、Aurora-A和mt-P53表达与结直肠癌预后的关系
预后分析显示,60例结直肠癌组织中Mcm7阳性表达49例、阴性表达11例,<5年生存期病例的阳性率高于≥5年生存期病例,但差异无统计学意义(P>0.05)。Aurora-A阳性表达43例、阴性表达17例,mt-P53阳性表达39例、阴性表达21例,<5年生存期病例的Aurora-A和mt-P53表达阳性率高于≥5年生存期病例,其阳性和阴性患者间术后5年生存期差异均有统计学意义(P<0.05,见图2)。

图2 mt-P53、Mcm7和Aurora-A的表达与结直肠癌术后生存曲线Figure 2 The mt-P53,Mcm7 and Aurora-A expression and postoperative survival curves of colorectal cancer patients
3 讨论
肿瘤是一种基因病,当细胞的原癌基因激活及抑癌基因失活,导致细胞生长调控和分化功能紊乱,继而发展成肿瘤。P53蛋白是经典的抑癌基因,被认为是细胞生长的“监控器”,负责监视基因组完整性、抑制细胞周期、促进肿瘤细胞凋亡等,实现抑制肿瘤的作用。然而,P53亦是容易出现突变的基因。在恶性肿瘤中,约半数以上存在P53基因的突变。突变型的P53(mt-P53)不仅丧失野生型P53(wt-P53)的正常功能,而且拮抗wt-P53对细胞基因的监视作用,使得正常细胞向癌细胞发生转变。不仅如此,部分mt-P53反而获得了癌基因的功能,促进细胞增殖失控,增加染色体错配和畸变的几率,提高了细胞癌变风险[6-7]。与wt-P53相比,mt-P53蛋白由于构象改变,半衰期明显延长,在细胞核内堆积,故可用免疫组织化学方法检测其表达水平。本实验结果显示,mt-P53蛋白在正常结直肠黏膜、结直肠腺瘤、结直肠腺癌中的阳性表达率呈逐渐升高的趋势(P<0.05),提示P53的基因突变在结直肠癌的发生发展过程中可能具有一定的作用,或可作为从癌前病变发展为癌的检测指标。另外,mt-P53在结直肠癌细胞的表达与淋巴结转移和Dukes分期也均有相关性,而且mt-P53蛋白的阳性表达率随着肿瘤浸润深度的增加而增高,在<5年与≥5年生存期病例中的表达差异相比差异有统计学意义,说明mt-P53在大肠癌的侵袭和转移过程中也可能起着重要作用,其蛋白的过表达提示大肠癌的预后较差。P53的突变在结直肠腺瘤向癌的转化过程中可能起了促进作用,同时还可能促进癌细胞的转移。
微小染色体维持蛋白(minichromosome maintenance protein,MCM)是近年来发现的一组反应细胞增殖的蛋白标志物,是一类高度保守的蛋白家族,在DNA复制许可(DNA replication license)和控制细胞周期从G1期到S期过程中起着必不可少的作用。到目前为止,已报道发现的有Mcm 2-9等8个蛋白家族成员。Mcm7作为Mcm蛋白家族成员之一,在维持MCM复合体的螺旋酶的活性及控制DNA复制的起始中起了关键作用,同时与转录、细胞增殖和肿瘤的发生与发展密切相关。本实验检测了Mcm7蛋白在正常结直肠黏膜组织、结直肠腺瘤及结直肠癌中的表达情况,发现Mcm7在结直肠癌中的表达明显高于腺瘤组及正常组织组,并且依次降低(P<0.05),差异具有统计学意义。进一步分析发现Mcm7的阳性表达率越高,癌组织分化越差、癌细胞浸润深度越深、5年生存率越低;并且存在淋巴结转移的组织,阳性表达率也较高。证实了Mcm7蛋白与细胞增殖密切相关,其表达与细胞增殖程度呈正相关,与组织分化程度呈负相关。另外还有许多研究表明,在多种人类恶性肿瘤细胞中如结直肠癌[8]、肺癌[9]、前列腺癌[10]、霍奇金淋巴瘤[11]、乳腺癌[12]、子宫内膜癌[13]都存在着Mcm7过表达或扩增现象,提示Mcm7在肿瘤的发生发展过程中起了重要作用,是肿瘤发生的早期事件之一,是反映细胞增殖的可靠标志物,检测Mcm7的表达对判断肿瘤的恶性程度、疗效评估、术后复发具有重要意义。
Aurora蛋白激酶家族是一种丝氨酸/苏氨酸蛋白激酶,在细胞的有丝分裂期发挥着重要作用,目前分为3种即Aurora-A、Aurora-B、Aurora-C。Aurora-A位于细胞的中心体上,有丝分裂时Aurora-A和纺锤体两极相连并且参与中心体重组[14]。当Aurora-A过表达会破坏细胞周期多个检测点功能,导致纺锤体组织异常及胞质分离异常,最终形成非整倍体细胞,与肿瘤发生过程密切相关[15]。本研究实验结果显示,结直肠癌的Aurora-A表达明显高于结直肠腺瘤以及正常的结直肠组织,具有显著性差异(P<0.05),且浸润深度越深,Aurora-A的阳性表达率越高,提示Aurora-A表达的升高在结直肠癌的侵袭潜能中起重要作用。目前还在膀胱癌[16]、胃癌[17]、食道癌[18]、乳腺癌[19]等研究中也发现Aurora-A过度表达,并且Aurora-A的过表达与肿瘤的侵袭存在很大程度的相关性。另外,<5年生存期病例的Aurora-A和mt-P53表达阳性率高于≥5年生存期病例,差异有统计学意义(P<0.05)。因此监测结直肠癌中Aurora-A的表达可作为临床评价结直肠癌发展及预后的参考指标。
对于P53和Mcm7在结直肠癌演变过程中的相互关系,有文献报道[4,20],Mcm7是一个新发现的P53作用蛋白,过表达的Mcm7能够结合P53,将P53束缚在细胞质中,P53无法进入细胞核从事基因转录,从而间接地使P53失活。再者,P53是在DNA受损时通过激活下游基因从而发挥抑制肿瘤的作用,而Mcm7能够抑制内源的P53蛋白对其下游靶基因(如P21、PUMA)的转录活性,从而促进癌细胞的增殖。在某些肿瘤中,Mcm7还可调节P53的蛋白水平,降低P53蛋白的稳定性,促进肿瘤细胞的生长。因此,Mcm7通过妨碍抑癌因子P53功能的发挥,在DNA损伤时参与调控P53介导的相关功能,在细胞癌变过程中起协同促进的重要作用。本实验中,Mcm7与mt-P53共同在结直肠癌中的高表达,表明其在结直肠癌的发生发展中具有协同作用,增强结直肠癌细胞的侵袭性及转移特性。
P53与Aurora-A蛋白之间存在相互调节。P53通过Aurora-A N末端的Aurora-box直接与Aurora-A结合,反馈性地抑制Aurora-A的激活酶活性及其中心体扩增;另一方面,Aurora-A高度活化能磷酸化P53的Ser315位点,通过泛素化途径降解P53,同时也能磷酸化P53的Ser215位点,减低P53的转录活性,从而下调P53的抑癌功能[6,7]。本实验结果中,Aurora-A与mt-P53在结直肠癌中的表达显著正相关(P<0.01),并且随着肿瘤细胞浸润程度的加深,二者的表达都有所增强,表明在结直肠癌中,Aurora-A可能是P53的一个调控基因,Aurora-A的高表达可能使wt-P53变为mt-P53,导致mt-P53蛋白在结直肠癌组织中的表达异常增高。而失活或突变的P53,失去了正常情况下对Aurora-A蛋白的抑制作用,造成了Aurora-A的高表达,而Aurora-A的高表达更进一步促进了P53功能的丧失。过表达或过度激活Aurora-A打破了细胞内的Aurora-A-P53平衡,造成细胞恶性增殖。然而,该两项指标在结直肠癌患者中也有个别表达不一致,提示Aurora-A和P53在结直肠癌进展中并非绝对必需的,说明Aurora-A和mt-P53有相关性但又可能都是独立的致癌因子。
研究发现,在结直肠癌中,Mcm7可与P53结合,降低P53的活性,促进癌细胞的增殖,Aurora-A可通过泛素化途径降解P53,并且有可能使wt-P53变为mt-P53,导致mt-P53蛋白在结直肠癌组织中的表达异常增高,而P53的失活或突变,又使Aurora-A失去抑制,造成Aurora-A的高表达,从而引起细胞的异常分离,形成肿瘤。本实验结果显示结直肠癌组织中Mcm7蛋白和Aurora-A蛋白的表达无明显相关,二者可能通过不同的作用机制参与结直肠癌的发生和发展。P53能抑制Aurora-A,自身又可被Mcm7结合降解,说明P53基因是联系Mcm7与Aurora-A基因之间的关键基因,三者通过复杂的信号通路联系在一起,存在相互联系、相互制约的关系。综上所述,单一检测结直肠癌的癌基因不能全面反映其生物学特性,且易造成假阳性率,联合癌基因检测可以兼顾敏感性和特异性,既提高了灵敏度,又减少了假阳性率。
[1] Ferlay J,Shin HR,Bray F,etal.GLOBOCAN 2008,cancer incidence and mortality worldwide:IARC cancerbaseNo.10[M].Lyon:International Agency for Research on Cancer,2010.
[2] 王宁,孙婷婷,郑荣寿,等.中国2009年结直肠癌发病和死亡资料分析[J].中国肿瘤,2013,22(7):515-520.
[3] Hofseth LJ,Hussain SP,Harris CC.p53:25 years after its discovery[J].Trends Pharmacol Sci,2004,25(4):177-181.
[4] Wei Q,Li J,Liu T,etal.Phosphorylation of minichromosomemaintenance protein 7(MCM7) by cyclin/cyclin-dependent kinase affects its function in cell cycle regulation[J].J Biol Chem,2013,288(27):19715-19725.
[5] Warnock LJ,Raines SA,Milner J.Aurora A mediates cross-talk between N-and C-terminal post-translational modifications of p53[J].Cancer Biol Ther,2011,12(12):1059-1068.
[6] Christiane DF,Corinna H,Claudia M,etal.Occurrence of multipolar mitoses and association with Aurora-A/-B kinases and P53 mutations in aneuploid esophageal carcinoma cells[J].BMC Cell Biol,2011,12:13-28.
[7] Hsueh KW,Fu SL,Chang CB,etal.A novel Aurora-A-mediated phosphorylation of P53 inhibits its interaction with MDM2[J].Biochim Biophys Acta,2013,1834(2):508-515.
[8] Ishibashi Y,Kinugasa T,Akagi Y,etal.Minichromosome maintenance protein 7 is a risk factor for recurrence in patients with Dukes Colorectal cancer[J].Anticancer Res,2014,34(8):4569-4575.
[9] Toyokawa G,Masuda K,Daigo Y,etal.Minichromosome maintenance protein 7 is a potential therapeutic target in human cancer and a novel prognostic marker of non-small cell lung cancer[J].Mol Cancer,2011,10:65-76.
[10] Tolonen TT,Tammela TL,Kujala PM,etal.Histopathologicalvariables and biomarkers enhancer of zeste homologue 2,Ki-67 and minichromosome maintenance protein 7 as prognosticators in primarily endocrine-treated prostate cancer[J].BJU Int,2011,108(9):1430-1438.
[11] Marnerides A,Vassilakopoulos TP,Boltetsou E,etal.Immunohistochemical expression and prognostic significance of CCND3,MCM2 and MCM7 in Hodgkin lymhoma[J].Anticancer Res,2011,31(10):3585-3594.
[12] Huang TH,Huo L,Wang YN,etal.Epidermal growth factor receptor potentiates MCM7-mediated DNA replication through tyrosine phosphorylation of Lyn kinase in human cancers[J].Cancer Cell,2013,23(6):796-810.
[13] Li SS,XueWC,KhooUS,etal.Replicative MCM7 protein as a proliferation marker in endometrial carcinoma:a tissue microarray and clinicopathological analysis[J].Histopathology,2005,46(3):307-313.
[14] Wang S,Midgley CA,Sca⊇rou F,etal.Discovery of N-phenyl-4-(thiazol-5-yl)pyrimidin-2-amine aurora kinase inhibitors[J].J Med Chem,2010,53(11):4367-4378.
[15] Saeki T,Ouchi M,Ouchi T.Physiological and oncogenic Aurora-A pathway[J].Int J Biol Sci,2009,5(7):758-762.
[16] de Martino M,Shariat SF,HofbauerSL,etal.Aurora A Kinase as a diagnostic urinary marker for urothelial bladder cancer[J].World J Urol,2015,33(1):105-110.
[17] Honma K,Nakanishi R,Nakanoko T,etal.Contribution of Aurora-A and-B expression to DNA aneuploidy in gastric cancers[J].Surg Today,2014,44(3):454-461.
[18] Tamotsu K,Okumura H, UchikadoY,etal.Correlation of Aurora-A expression with the effect of chemoradiation therapy on esophageal squamous cell carcinoma[J].BMC Cancer,2015,15:323-330.
[19] Tentler JJ,Ionkina AA,Tan AC,etal.p53 Family members regulate phenotypic response to aurora kinase A inhibition in triple-negative breast cancer[J].Mol Cancer Ther,2015,14(5):1117-1129.
[20] Li Z,Hou J,Sun L,etal.NMI mediates transcription-independent ARF regulation in response to cellular stresses[J].Mol Biol Cell,2012,23(23):4635-4646.
Expression of mt-P53 and Mcm7,Aurora-A and their significance in colorectal carcinoma
MA Weiwei,ZHANG Chenli,ZHANG Xu*
(InstituteofPathology,SchoolofBasicMedicine,LanzhouUniversity,Lanzhou730000,China;*Correspondingauthor,E-mail:zhangxu64@163.com)
ObjectiveTo investigate the expression and its significance of mt-P53,Mcm7 and Aurora-A in colorectal carcinoma and their correlation.MethodsThe expression of mt-P53,Mcm7 and Aurora-A was detected by immunohistochemical SP methods in 60 cases of colorectal carcinoma tissues,30 cases of colorectal adenoma and 10 cases of normal colorectal tissues.Results①Ectopic expression of mt-P53,Mcm7 and Aurora-A was significantly different in normal colorectal mucosa, colorectal adenomas and colorectal carcinoma(P<0.05).②The expression of mt-P53,MCM7 and Aurora-A genes in colorectal carcinoma tissues was associated with the depth(P<0.05),but not correlated with the age, gender and size of tumors(P>0.05).The expression of Mcm7 was associated with the differential degree, Dukes stages and lymph node metastasis(P<0.05).Mcm7 expression in patients with survival of less than 5 years was higher than in patients with survival of more than 5 years,but there was no significant difference(P>0.05).The expression of mt-P53 was associated with the Dukes stages and lymph node metastasis(P<0.05). Mt-P53 and Aurora-A expression in patients with survival of less than 5 years was higher than in patients with survival of more than 5 years(P<0.05). ③The expression of Mcm7 and Aurora-A gene was significantly related to the expression of mt-P53(r=0.284,P<0.05;r=0.547,P<0.01).ConclusionThe mutation of P53 and the overexpression of Mcm7 and Aurora-A may play an important role in tumorigenesis, tumor invasion and metastasis of colorectal cancer. Thus, the co-detection of mt-P53 and its interacting protein Mcm7,Aurora-A should have important value in the diagnosis and prognosis of colorectal cancer.
colorectal cancer; P53; Mcm7; Aurora-A; immunohistochemistry
马玮玮,女,1984-01生,本科,讲师, E-mail:183214528@163.com
2016-05-11
R735.37
A
1007-6611(2016)09-0841-06
10.13753/j.issn.1007-6611.2016.09.014

