亚砷酸钠对酵母细胞抗氧化酶活性和脂质过氧化的影响
吴丽华,陈燕飞,陈鹏,仪慧兰
1.太原师范学院生物系,太原030031
2.山西大学生命科学学院,太原030006
亚砷酸钠对酵母细胞抗氧化酶活性和脂质过氧化的影响
吴丽华1,陈燕飞1,陈鹏1,仪慧兰2,*
1.太原师范学院生物系,太原030031
2.山西大学生命科学学院,太原030006
以模式生物酿酒酵母为材料,研究亚砷酸钠对细胞生长、抗氧化酶活性、丙二醛(MDA)含量及胞内活性氧(ROS)水平的影响。结果显示,加入亚砷酸钠(终浓度0.1~0.6 mmol·L-1)后,培养液在600 nm处的光密度值(OD600值)低于对照组,并呈浓度依赖性降低。经亚砷酸钠处理12 h后,酵母细胞中过氧化物酶(POD)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和总抗氧化能力(T-AOC)活性均增高,但胞内ROS水平和MDA含量与对照组无显著差异。砷处理24 h后,POD在0.2 mmol·L-1砷处理组中活性最高,而CAT、SOD和T-AOC活性呈浓度依赖性增高;胞内ROS水平和MDA含量在高浓度砷组(0.4和0.6 mmol·L-1)显著增高。结果表明,亚砷酸钠可抑制酵母细胞生长,改变细胞内抗氧化酶活性,较高浓度时可引起细胞氧化损伤。
亚砷酸钠;酵母菌;抗氧化物酶;丙二醛;ROS
吴丽华,陈燕飞,陈鹏,等.亚砷酸钠对酵母细胞抗氧化酶活性和脂质过氧化的影响[J].生态毒理学报,2016,11(3):302-307
Wu L H,Chen Y F,Chen P,et al.Sodium arsenite exposure affects the levels of antioxidant enzymes and lipid peroxidation inSaccharomyces cerevisiae [J].Asian Journal of Ecotoxicology,2016,11(3):302-307(in Chinese)
砷是环境中常见的、具有毒性作用的类金属元素,其分布范围及浓度除了受地质条件、地球化学条件、水文地质条件等多种环境因素的影响外,由于砷还广泛应用于工、农、医药等行业及含砷废水、废渣的不合理排放,从而导致部分地区环境中砷含量超标,严重威胁着生态系统和人类的身体健康[1]。氧化应激机制是目前被广泛认可的砷毒性机制之一,砷化物进入植物或动物体后,机体内抗氧化物酶活性升高,以维持胞内氧化还原平衡,从而达到解毒作用[2-3];当体内累积砷浓度过高,细胞内超氧阴离子(O2·-)、羟基自由基(·OH)和过氧化氢(H2O2)等活性氧自由基大量产生而无法被及时清除时,则会影响机体生理功能,抑制细胞生长,诱导细胞死亡[4-5]。
酵母细胞是目前公认的研究真核生物细胞学机制的模式生物,且具有生长周期短、易培养等特点。本课题组已有研究证明,亚砷酸钠可通过诱导胞内活性氧(reactive oxygen species,ROS)升高而诱导酵母细胞死亡[6],但砷对酵母细胞氧化损伤机理还不清楚。因此,本实验通过分析亚砷酸钠对酵母细胞生理生化指标的影响,研究砷化物的氧化损伤效应,进一步探讨砷化物的毒性作用机制。
1 材料与方法(Materials and methods)
1.1 实验材料
酿酒酵母购于中国科学院微生物研究所菌种保藏中心。酵母细胞接种于YPD液体培养中,28℃,180 r·min-1振荡培养至对数期后用于毒性实验。
1.2 药物处理及生长曲线测定
取对数期细胞至含有不同浓度亚砷酸钠(0、0.1、0.2、0.4和0.6 mmol·L-1)的液体培养基中,使各处理组培养液在600 nm处的初始光密度值(OD600)相等且小于0.1,28℃,180 r·min-1振荡培养,每隔2 h以培养基为对照测定培养液OD600,绘制生长曲线;培养24 h后检测抗氧化物酶活性、MDA含量及ROS水平,每个处理设置3个重复。
1.3 抗氧化酶的测定
1.3.1 细胞酶液的提取[7]
将酵母细胞悬浮于预冷的细胞裂解液中,加入一定体积的酸性玻璃珠,高速震荡10 min(每震荡2 min冰浴1 min)后,冰浴15 min。11 500 r·min-1低温离心10 min,取上清液即为酶提取液。
1.3.2 抗氧化酶活性和MDA含量测定
过氧化物酶(POD)活力测定用POD测定试剂盒;超氧化物歧化酶(SOD)活力测定用T-SOD测定试剂盒;过氧化氢酶(CAT)活力测定用CAT测定试剂盒;总抗氧化能力(T-AOC)测定用T-AOC测定试剂盒;丙二醛(MDA)含量参照[8]方法测定。
1.4 胞内ROS水平测定
收集酵母细胞,洗涤并悬浮于终浓度为5 μmol ·L-1的二氯荧光黄双乙酸酯(DCFH-DA)中,30℃避光孵育30 min后,流式细胞仪检测细胞荧光水平。
1.5 统计分析
计算每组3个重复实验的平均值和标准误(Mean±SD),采用SPSS 18.0和Duncan方法对实验结果进行F检验并多重比较,分析各处理组之间的差异显著性(检验标准为P<0.05)。
2 结果(Results)
2.1 亚砷酸钠对酵母细胞生长的影响

图1 亚砷酸钠对酵母细胞生长的影响
由图1可知,在初始OD600相同的情况下培养24 h后,各处理组培养液OD600均明显低于对照组,且随着处理浓度的增加而逐渐降低。在0.6 mmol· L-1处理组中酵母细胞几乎完全停止生长。结果说明,亚砷酸钠可抑制酵母细胞生长和分裂,并具有一定的浓度依赖性。
2.2 亚砷酸钠对酵母细胞抗氧化酶活性的影响
酵母细胞抗氧化酶活性如图2所示。与对照组相比,酵母细胞经亚砷酸钠胁迫12 h后,抗氧化酶活性随浓度增高而逐渐升高,高浓度处理组(0.4和0.6 mmol·L-1)中酶活性均显著高于对照组,其中POD活性在0.2 mmol·L-1处理组中与对照组间已具显著差异,说明酵母POD对亚砷酸钠胁迫相对敏感。
酵母细胞经亚砷酸钠胁迫24 h后,CAT活性随处理浓度升高而增强,在0.4和0.6 mmol·L-1处理组中明显增加,均与对照组具有显著差异;SOD活性在处理浓度范围内与砷浓度显著正相关(r=0.99),说明SOD活性在一定程度上能反映环境中砷污染程度;POD活性则呈现先升高后降低的趋势,0.2 mmol·L-1处理组中,POD活性达到最高,高浓度组中,POD活性下降,可能与亚砷酸钠胁迫后酵母胞内的氧自由基浓度有关,低浓度时可激活机体抗氧化防御系统[9],而浓度过高时,对酵母细胞造成严重伤害,抗氧化物酶系统受到破坏,POD活性下降;TAOC活性在0.1 mmol·L-1处理组中略低于对照组,但无显著差异;在0.2~0.6 mmol·L-1处理组中其活性显著高于对照组。结果表明,亚砷酸钠胁迫后,酵母细胞中抗氧化物酶在逆境生理中发挥了重要作用。
2.3 亚砷酸钠对酵母细胞ROS水平的影响
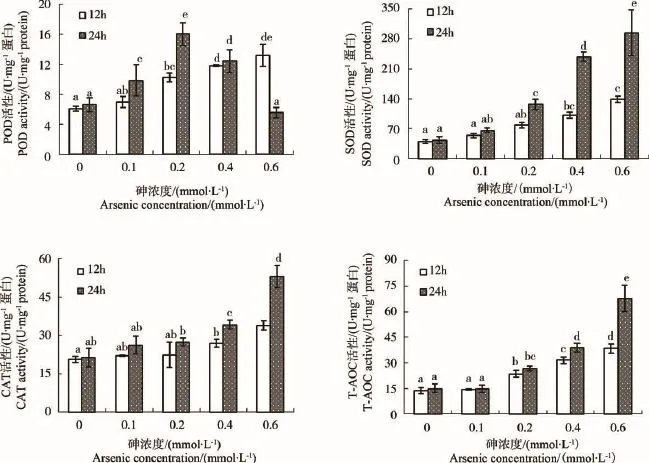
图2 亚砷酸钠对酵母细胞抗氧化酶活性的影响
本实验采用流式细胞术检测酵母细胞ROS水平,发现酵母细胞经不同浓度亚砷酸钠胁迫后,胞内ROS水平随处理浓度的升高和处理时间延长而逐渐增加,并具有一定的浓度效应和时间效应(图3)。经亚砷酸钠胁迫12 h后,各处理组胞内ROS水平与对照组之间均无显著差异;经0.2~0.6 mmol·L-1亚砷酸钠胁迫24 h后,酵母胞内ROS水平显著高于对照组,这可能是因为砷浓度较低或作用时间较短时,机体内抗氧化物酶可有效降低由砷胁迫产生的氧自由基;当砷浓度升高或作用时间较长时,机体内抗氧化物防御系统与过多的氧自由基失去动态平衡,导致ROS水平显著增高。
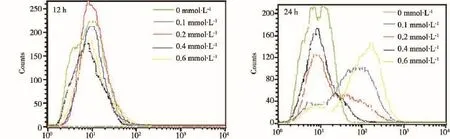
图3 亚砷酸钠对酵母细胞ROS水平的影响

图4 亚砷酸钠对酵母细胞MDA含量的影响
2.4 亚砷酸钠对酵母细胞MDA含量的影响
从图4可看出,酵母细胞经亚砷酸钠胁迫后MDA含量随砷浓度的升高和时间延长而逐渐增加。酵母细胞经亚砷酸钠胁迫12 h或经低浓度(0.1和0.2 mmol·L-1)亚砷酸钠胁迫24 h后,各处理组中MDA含量均与对照组无显著差异;经高浓度(0.4和0.6 mmol·L-1)亚砷酸钠处理24 h后,MDA含量显著升高,与对照组相比分别增加了107.07%和386.17%。研究结果说明,低浓度砷或短时间的砷胁迫不会对酵母细胞造成严重的氧化损伤;随着砷浓度升高,活性氧增多,导致细胞脂质过氧化程度加剧,MDA含量升高,引起酵母细胞氧化损伤。
3 讨论(Discussion)
众所周知,砷是一种广泛存在于自然界中的环境诱变剂,对植物、动物和微生物均可产生毒害作用[6,10-11]。Wu等[12]研究发现,砷化物可抑制骨髓瘤细胞生长。本实验以模式生物酿酒酵母为材料研究砷化物的毒性作用,发现亚砷酸钠可抑制酵母细胞生长,并随着砷浓度的提高抑制作用增强,说明亚砷酸钠对酵母细胞具有一定的毒性作用。
大量研究表明,氧化应激机制是砷毒性作用机制之一,那么砷对酵母细胞的毒性作用是否与氧化应激有关?正常情况下,当机体受到外源物质胁迫时,即可诱导细胞抗氧化物酶表达以清除胁迫产生的过量ROS,从而使细胞内ROS等自由基的产生与清除处于动态平衡状态;当体内ROS等氧自由基增加过多或抗氧化系统能力下降时,机体则会发生氧化应激反应,胞内ROS水平升高,从而引起细胞发生氧化损伤[13]。SOD、POD和CAT是生物体内抗氧化酶系中最重要的酶类,其活性可在一定程度上反映细胞的抗氧化能力;ROS是氧在细胞内不能被完全还原而生成的产物的总称,包括·、·OH及H2O2等,其水平能反应细胞内氧化系统情况;MDA含量是反映细胞膜脂损伤的重要指标,可间接反映细胞发生氧化损伤的情况,常用来评价环境污染物的潜在毒性[14]。因此,我们进一步检测了酵母抗氧化酶活性、胞内ROS水平及MDA含量。
本研究结果显示,酵母细胞经亚砷酸钠胁迫12 h后,抗氧化酶活性随着处理浓度的升高而逐渐增强,胞内ROS水平和MDA含量与对照组相比均无显著差异。这说明较短时间的砷胁迫可激活抗氧化物酶活性以清除酵母体内过量的氧自由基,抑制胞内ROS水平升高,此时亚砷酸钠并不会对酵母造成氧化胁迫,这是酵母对逆境环境的适应性反应。酵母细胞经亚砷酸钠处理24 h后,SOD活性随处理浓度升高而增强,说明SOD在整个实验中将超氧阴离子催化生成H2O2的能力逐渐增强。CAT和POD可将H2O2转变为氧气和水,从而消除H2O2对细胞造成的毒性作用。在本研究中,酵母细胞经亚砷酸钠胁迫24 h后,CAT活性随处理浓度升高而增强;在高浓度处理组中,POD活性呈下降趋势,胞内ROS水平显著高于对照组水平。这有可能是因为低浓度砷即可快速激活抗氧化酶活性以清除酵母细胞内氧自由基,而砷浓度较高时,POD活性下降,细胞清除H2O2的能力减弱;虽然CAT和SOD活性持续增加,但胞内产生的氧自由基超过了抗氧化酶的清除能力,自身氧化还原系统平衡遭到破坏,使胞内ROS水平升高。
总之,在亚砷酸钠胁迫下,酵母细胞内SOD、POD和CAT活性发生改变,ROS水平升高,MDA含量增加,表明砷胁迫引起酵母细胞内活性氧的产生和清除失衡,细胞发生氧化损伤,最终引起酵母细胞的生理代谢紊乱,细胞生长受到抑制。
研究结果表明,0.1~0.6 mmol·L-1的亚砷酸钠能够诱导酵母细胞内ROS水平升高,抗氧化酶活性增强,从而提高酵母细胞对逆境的适应能力,但胞内ROS水平超过一定阈值无法被及时清除时,就会导致膜脂过氧化水平加剧,MDA含量升高,从而对酵母细胞造成氧化损伤。
(References):
[1] Garelick H,Jones H,Dybowska A,et al.Arsenic pollution sources[J].Reviews of Environmental Contamination and Toxicology,2008,197:17-60
[2] Malik J A,Goel S,Kaur N,et al.Selenium antagonises the toxic effects of arsenic on mungbean(Phaseolus aureusRoxb.)plants by restricting its uptake and enhancing the antioxidative and detoxification mechanisms[J].Environmental and Experimental Botany,2012,77:242-248
[3] Sharma I.Arsenic induced oxidative stress in plants[J]. Biologia,2012,67(3):447-453
[4] 薛美昭,仪慧兰.活性氧介导砷诱导的蚕豆保卫细胞死亡[J].生态毒理学报,2013,8(2):257-261
Xue M Z,Yi H L.Involvement of ROS in arsenic-induced guard cell death in detached epidermis ofVicia fabaleaves[J].Asian Journal of Ecotoxicology,2013,8(2): 257-261(in Chinese)
[5] Wu L H,Yi H L,Yi M.Assessment of arsenic toxicity usingAllium/Viciaroot tip micronucleus assays[J].Journal of Hazardous Materials,2010,176(1/3):952-956
[6] Wu L H,Yi H L,Zhang H F.Reactive oxygen species and Ca2+are involved in sodium arsenite-induced cell killing in yeast cells[J].FEMS Microbiology Letter,2013, 343:57-63
[7] 刘向勇.酿酒酵母Bdf1p转录因子在高盐胁迫反应中调控机制的研究[D].济南:山东大学,2008:84-85
Liu X Y.Regulation of the Bdf1p transcription factor in the salt stress response ofSaccharomyces cerevisiae[D]. Jinan:Shandong University,2008:84-85
[8] 潘军航.酿酒酵母耐铝机制中可能包含抗氧化作用[D].杭州:浙江大学,2005:17
Pan J H.The involvement of antioxidant inSaccharomyces cerevisiaealuminum tolerance[D].Hangzhou:Zhejiang University,2005:17
[9] 于庆云,王悠,徐彦,等.镉和铅对菲律宾蛤仔脂质过氧化及抗氧化酶活性的影响[J].生态毒理学报,2013, 8(4):504-512
Yu Q Y,Wang Y,Xu Y,et al.Effects of cadmium and lead on the lipid peroxidation and levels of antioxidant enzymes inRuditapes philippinarum[J].Asian Jounal of Ecotoxicology,2013,8(4):504-512(in Chinese)
[10] Wang Q,Xiong D,Zhao P,et al.Effect of applying an arsenic-resistant and plant growth-promoting rhizobacterium to enhance soil arsenic phytoremediation byPopulus deltoidsLH05-17[J].Journal of Applied Microbiology, 2011,111:1065-1074
[11] Ivanov V N,Gengyun W,Hei T K.Sodium arsenite exposure inhibits AKT and Stat3 activation,suppresses self-renewal and induces apoptotic death of embryonic stem cells[J].Apoptosis,2013,18(2):188-200
[12] Wu X,Shi J,Wu Y,et al.Arsenic trioxide-mediated growth inhibition of myeloma cells is associated with an extrinsic or intrinsic signaling pathway through activation of TRAIL or TRAIL receptor 2[J].Cancer Biology and Therapy,2010,10:1201-1214
[13] Li L J,Liu X M,Guo Y P,et al.Activity of the enzymes of the antioxidative system in cadmium-treated oxyachinensis(Orthoptera acridoidae)[J].Environmental Toxicology and Pharmacology,2005,20:412-416
[14] 龙奕,刘珊珊,王萌,等.纳米Al2O3和Cd联合暴露对铜锈环棱螺体内Cd的生物积累和抗氧化酶活性的影响[J].生态毒理学报,2015,10(2):216-223
Long Y,Liu S S,Wang M,et al.Effect of Cd and Al2O3-NPs co-exposure on bioaccumulation of Cd and antioxidase enzyme activities inBellamya aeroginosa[J].Asian Journal of Ecotoxicology,2015,10(2):216-223(in Chinese)
[15] Yannic M,Robert B.Repression of gene express by oxidative stress[J].Biochemical Journal,1999,342:481-496
[16] Du L,Yu Y,Chen J,et al.Arsenic induces caspase-and mitochondria-mediated apoptosis inSaccharomyces cerevisiae[J].FEMS Yeast Research,2007,7:860-865
[17] Li B,Li X,Zhu B,et al.Sodium arsenite induced reactive oxygen species generation,nuclear factor(erythroid-2 related)factor 2 activation,heme oxygenase-1 expression, and glutathione elevation in Chang human hepatocytes[J]. Environmental Toxicology,2013,28:401-410
[18] Wolff S P,Dean R T.Fragmentation of proteins by free radicals and its effect on their susceptibility to enzymic hydrolysis[J].Biochemical Journal,1986,234:399-403
[19] Stadtman E R.Protein oxidation and aging[J].Science, 1992,257:1220-1224
[20] Gasch A P,Spellman P T,Kao C M,et al.Genomic expression programs in the response of yeast cells to environmental changes[J].Molecular Biology of the Cell, 2000,11:4241-4257◆
Sodium Arsenite Exposure Affects the Levels of Antioxidant Enzymes and Lipid Peroxidation in Saccharomyces cerevisiae
Wu Lihua1,Chen Yanfei1,Chen Peng1,Yi Huilan2,*
1.Department of Biology,Taiyuan Normal University,Taiyuan 030031,China
2.School of Life Science,Shanxi University,Taiyuan 030006,China
5 November 2015 accepted 29 January 2016
Arsenic is a high toxic metalloid widely distributed in the environment.However,the underlying mechanisms of arsenic toxicity are not yet well understood.Saccharomyces cerevisiaeas a model organism was selected as the materials to investigate the toxic mechanism of sodium arsenite(As).The results showed that cell culture density(OD600)of yeast cells was lower in all As-treatment groups(in the concentration range of 0.1-0.6 mmol· L-1)than in the control group.The values of OD600decreased in a concentration-dependent manner.The activities of antioxidant enzymes such as superoxide dismutase(SOD),peroxidase(POD),catalase(CAT)and total antioxidant capacity(T-AOC)increased with increasing arsenic concentrations after yeast cells were exposed to sodium arsenite for 12 h,but no significant difference in intracellular reactive oxygen species(ROS)level or malondialdehyde(MDA)content was found between the control and As-treatment group.After 24 h of exposure,the activitiesof CAT,POD,SOD and T-AOC increased also in a concentration-dependent manner,however POD reached its peak in 0.2 mmol·L-1As-treatment group.And both intracellular ROS levels and MDA contents significantly increased in yeast cells after they were exposed to 0.4 mmol·L-1or 0.6 mmol·L-1sodium arsenite.These results suggested that sodium arsenite can induce cell growth inhibition,alter the activities of antioxidant defense system,and result in oxidative damage in yeast cells.
sodium arsenite;yeast;antioxidant enzymes;malondialdehyde;ROS
2015-11-05 录用日期:2016-01-29
1673-5897(2016)3-302-06
X171.5
A
10.7524/AJE.1673-5897.20151105001
简介:仪慧兰(1963—),女,博士,教授,博士生导师,主要研究方向为环境生物学与逆境生理学,已发表研究论文90余篇,获国家发明专利授权2项。
国家自然科学基金青年基金(21307087);山西省高等学校大学生创新创业项目(2015363)
吴丽华(1981—),女,博士,副教授,研究方向为环境毒理学,E-mail:wlh1981622_510@163.com
*通讯作者(Corresponding author),E-mail:yihl@sxu.edu.cn

