小麦根系菲与磷吸收及转运的相互作用
杨青青,陆守昆,王红菊,李金凤,沈羽,占新华
南京农业大学资源与环境科学学院,南京210095
小麦根系菲与磷吸收及转运的相互作用
杨青青,陆守昆,王红菊,李金凤,沈羽,占新华*
南京农业大学资源与环境科学学院,南京210095
作物根系对多环芳烃(PAHs)与磷吸收及转运之间的相互作用研究对农产品的安全生产和PAHs污染环境植物修复的强化具有重要意义。为此,本文以菲为PAHs的代表,采用水培试验研究了不同磷、菲水平下小麦根系菲、磷吸收及其转运的效果,旨在揭示植物根系吸收PAHs与磷素的相互作用。结果表明,在0~1 200 μmol·L-1磷浓度范围内,小麦根系、茎叶菲含量在低磷浓度(10 μmol·L-1)时最高,分别为36.87 mg·kg-1和2.07 mg·kg-1;磷含量总体呈现随磷处理浓度的升高而增大的趋势;成对数据t-检验显示无论加菲与否,根系、茎叶磷含量无显著性差异(P>0.05)。磷可促进菲从根部向地上部转运,而菲对磷转运没有显著性影响。在低磷浓度下(10 μmol·L-1),随着菲浓度的升高,小麦根系、茎叶菲含量呈现显著升高趋势(P<0.05)。磷、菲共存处理介质pH升高幅度大于单一处理。
多环芳烃;菲;磷素;小麦;根系吸收;转运
杨青青,陆守昆,王红菊,等.小麦根系菲与磷吸收及转运的相互作用[J].生态毒理学报,2016,11(3):219-225
Yang Q Q,Lu S K,Wang H J,et al.Interaction of uptake and acropetal translocation between phenanthrene and phosphate in wheat roots[J].Asian Journal of Ecotoxicology,2016,11(3):219-225(in Chinese)
多环芳烃(PAHs)是一类具有强烈致癌、致畸、致突变作用的持久性有机污染物[1],它们广泛存在于自然环境中,已经对生态环境造成了一定程度的影响[2]。环境中的PAHs主要赋存于土壤中[3-4],并能够通过食物链进行迁移、转化和积累,对人类的食品安全和健康造成了严重的威胁[5-6]。研究植物根系PAHs的吸收及其转运机制对农产品的安全意义重大。
磷是植物生长所必需的营养元素之一[7],它不仅是细胞质、细胞核和核苷酸的重要组成成分,而且对碳水化合物的代谢和运输、氮代谢和脂肪的代谢起着重要作用[8]。由于植物对磷的需求量比较大,而土壤中的磷一般是以难溶性磷酸盐的形式存在,只有少量磷能被植物吸收,因此生产实践中需要施用磷肥来满足植物生长所需的磷量。磷肥也是农业生产中施用量和施用频率均较高的三大类肥料(氮肥、磷肥和钾肥)之一。研究指出,植物根土、细胞间、组织间磷的运输是与H+和Na+共运的需能过程[9],其中以与H+共运为主[10],H+-ATPase水解ATP形成质子驱动力为磷的转运提供动力[11]。
植物根系PAHs的主动吸收是以氢质子共运方式进行[12-13];且植物根系PAHs和钾元素吸收之间存在耦合作用[12];氮素形态会影响植物根系对PAHs的吸收和转运[14]。然而关于植物根系PAHs和磷吸收与转运之间的相互关系鲜有报道,植物磷与PAHs吸收及转运的相互作用机制更是未明。为此,本文研究不同磷、PAHs浓度下,植物根系吸收和迁移PAHs的效应及PAHs对植物根系吸收和转运磷的影响,拟揭示作物根系PAHs与磷吸收及转运中的相互作用,为通过农艺施肥措施保障农产品安全和强化PAHs污染环境植物修复的效果提供科学依据。
1 材料与方法(Materials and methods)
1.1 供试材料
供试小麦(Triticum aestivumL.)为南农9918,是江苏地区的主要栽培品种,购于江苏省农业科学院种子站。
1.2 试验设计
1.2.1 幼苗的培养
选取一定量饱满一致的小麦种子用去离子水浮选去除瘪粒,然后用3%H2O2溶液消毒5 min。清水漂洗干净,将洗净后的种子置于底部铺有用去离子水润湿的吸水纸的搪瓷托盘中,在25℃、无光照的恒温培养箱中进行催芽。种子出芽后转移至装有蛭石的花盆中,并放入25℃人工气候箱(白天光照16 h,温度25℃;夜晚8 h,温度20℃,光照强度为400 μmol·(s·m2)-1,相对空气湿度为75%)内培养7 d。
1.2.2 水培试验
选择长势比较一致的小麦幼苗移入水培箱内进行曝气培养,先后在1/2浓度和全浓度的Hoagland营养液(pH 5.50)中各培养3 d,再换成超纯水饥饿处理1 d。然后在缺磷Hoagland营养液(即营养液中的磷被Cl-取代,pH 5.50)中加入不同浓度磷素和菲,处理4 h。
磷和菲处理如下。(1)磷梯度:①对照组,营养液中菲浓度为0(A0)。磷素浓度设置5个水平,具体为0(缺磷)、10(低磷)、300(正常)和600、1 200 μmol·L-1(高磷)NaH2PO4,并分别用P0、P1、P2、P3、P4表示。②实验组,营养液中菲浓度为1 mg·L-1(用A1表示)。磷素浓度设置同对照组,分别用P0、P1、P2、P3、P4表示。(2)菲梯度:营养液中磷浓度为10 μmol ·L-1(在低磷浓度下小麦根系对菲的吸收量达到最高),菲浓度设置6个水平,分别为0、0.2、0.4、0.6、0.8、1.0 mg·L-1,并用A0、A0.2、A0.4、A0.6、A0.8、A1.0表示。每个处理组合重复3次。营养液中菲用甲醇溶解后加入,且对照组和实验组中均含有等量的甲醇(控制甲醇体积浓度小于0.1%,在此浓度范围内甲醇对植物生长无影响)[15]。处理结束后,加菲组的植株样品用超纯水充分洗净,根系在甲醇中浸泡30 s后,再用超纯水冲洗干净,吸干表面水分备用。
1.3 测定方法
1.3.1 植物体内菲的测定
称取1 g左右(鲜重)小麦根或茎叶,剪碎混匀,装入离心试管中,加入10 mL丙酮/二氯甲烷为1:1 (体积比)的混合溶液,超声萃取30 min,萃取过程重复3次。将萃取液过无水硫酸钠硅胶柱收集至50 mL锥形瓶中,然后用10 mL正己烷/二氯甲烷为1:1 (体积比)的混合溶液淋洗,合并收集液与洗脱液在40℃下用真空旋转蒸发器蒸干。蒸干后,用2 mL色谱甲醇溶解,过0.22 μm滤膜后用HPLC分析。该方法菲的回收率为90.67%。
HPLC分析条件:利用美国Thermo公司生产的UltiMate 3000 HPLC进行分析测试,泵的型号为LPG-3400 SDN,紫外检测器型号为VWD-3100,色谱柱是Thermo公司生产的4.6 mm×150 mm C18柱,柱温30℃,流动相为甲醇/水(80/20,V/V),流速为1.0mL·min-1,进样量为10 μL,菲的紫外检测波长为254 nm,菲的最低检出限为48.5 pg。
1.3.2 植物体内总磷的测定
分别采集小麦根系和茎叶,105℃下杀青30 min,70℃烘箱中烘至恒重,磨碎,混匀,进行植株总磷量测定。取0.1000~0.2000 g左右干样,浓H2SO4-H2O2混合消煮,钒钼黄比色法于700 nm波长处比色测定[17]。
1.4 数据统计分析
采用Origin 8.0和SPSS 21.0软件对试验结果进行数据处理、作图及差异性和显著性分析。
2 结果与讨论(Results and discussion)
2.1 不同磷浓度下磷菲吸收和转运的相互作用
2.1.1 小麦菲含量
小麦根系和茎叶菲含量如图1所示。在溶液中菲浓度为1.0 mg·L-1条件下,处理4 h后,根系、茎叶菲含量均随着磷浓度的增加呈现先上升后下降的趋势;小麦根系菲含量的变化范围为25.57~36.87 mg· kg-1,茎叶菲含量变化范围为1.75~2.07 mg·kg-1。在磷浓度为0~10 μmol·L-1时,小麦根系、茎叶菲含量呈现升高的趋势,并在磷浓度为10 μmol·L-1时,菲含量达到最高,根系为36.87 mg·kg-1,茎叶为2.07 mg·kg-1;在磷浓度为10~1 200 μmol·L-1时,随磷浓度的升高,小麦根系与茎叶菲含量逐渐下降,且在磷浓度为300~1 200 μmol·L-1时,根系与茎叶菲含量差异均不显著(P>0.05)。
5个磷浓度的处理中,小麦根系-茎叶菲迁移系数(小麦茎叶菲量/小麦根系菲量)分别为:0.051± 0.001 d、0.056±0.001 c、0.070±0.001 b、0.074±0.003 a、0.074±0.000 a。差异显著性分析表明在磷浓度为600~1 200 μmol·L-1时,菲迁移系数间的差异不明显(P>0.05),而其他处理间均存在显著性差异(P< 0.05)。在0~600 μmol·L-1范围内,菲迁移系数随着磷浓度的升高而逐渐升高,说明在此浓度范围内磷酸盐能够促进菲从小麦根系向地上部转运。
从动力学角度来说,植物对磷的吸收是以低浓度下的高亲和力和高浓度下的低亲和力机制来实现的[17]。低亲和系统是高等植物在正常生长状态下吸收磷的主要转运系统,而高亲和力转运系统在正常供磷情况下会被抑制,只有在缺磷状态下才会表达,是低磷浓度下植物细胞吸收磷的主要转运系统[18]。在磷胁迫的情况下,植物会通过改变根系形态、增加酸性磷酸酶的分泌等方式活化难溶性磷,从而提高植物对磷的吸收能力。磷浓度达到正常水平或者较高水平时,磷主要是以扩散作用和主动吸收进入植物体内,其主动吸收过程一般认为是以质膜ATP酶建立的质子驱动力为动力,借助于质子化的磷酸根载体实现[19]。小麦吸收无机磷酸盐会增加脂肪酸里的双键指数以及根部质膜的流动性,质膜的流动性会影响到根部的水力传导,在磷缺乏的情况下可能会导致根部的水力传导性能降低[20]。该性能降低可能会使得较少的菲从根部运输到茎叶部,从而更多的菲积累在小麦的根系,上述小麦根系-茎叶菲迁移系数也清楚地表明了这一点。随着磷浓度的升高,菲的吸收逐渐受到抑制,这可能与磷的主动吸收过程(即以H+/H2PO4-进入植物体内)有关,由于两者都是与氢质子共运方式进入植物体内,二者存在H+的竞争。
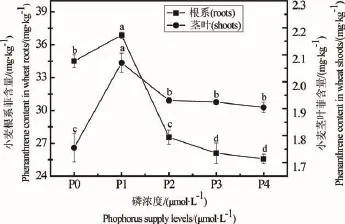
图1 不同磷浓度处理小麦根系和茎叶菲含量
2.1.2 小麦磷含量
不同磷浓度下,菲浓度为1.0 mg·L-1,处理4 h后,菲对小麦根系、茎叶磷含量的影响如图2所示。无论加菲与否,随着磷浓度的升高,小麦根系磷含量逐渐升高。无菲处理根系全磷含量范围为0.86%~0.97%,有菲处理磷含量变化范围为0.87%~0.96%。成对数据t-检验结果表明,菲对小麦根系磷含量无显著影响(P>0.05)。
无菲处理和有菲处理小麦茎叶磷含量范围分别为1.07%~1.24%和1.01%~1.20%。无论加菲与否,随着磷浓度的升高,小麦茎叶磷含量呈现上升趋势,但有无菲处理间茎叶磷含量差异不明显(成对数据t-检验,P>0.05)。
2.1.3 介质pH
质子与阴、阳离子之间的相互作用对植物矿质营养元素的吸收有重要意义。因此,植物吸收矿质元素时介质pH的变化受到了广泛的关注[21]。本研究表明,小麦根系对菲的吸收导致营养液pH发生了明显的变化(P<0.05)(表1)。在外加磷素的条件下,随着磷素浓度的增加,有菲处理小麦的ΔpH(小麦根系吸收菲4 h后营养液pH值减初始营养液pH值)呈现先升高后下降的趋势,并在磷浓度为10 μmol·L-1时达到最大值0.31(表1),与根系菲吸收的趋势相一致。无菲处理小麦ΔpH随着磷素浓度的升高,逐渐升高,其变化范围为0.02~0.10(表1)。无论加菲与否,处理4 h以后pH显著高于处理前的pH(5.50),并且同一磷素条件下,加菲处理的ΔpH显著高于无菲处理的ΔpH(P<0.05)。
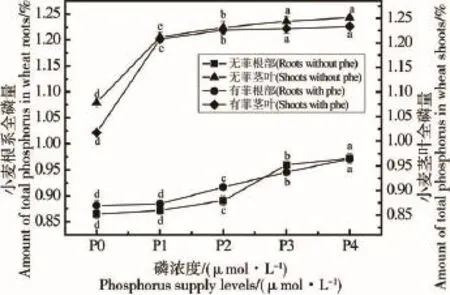
图2 在菲存在下不同磷浓度处理小麦根系和茎叶全磷含量
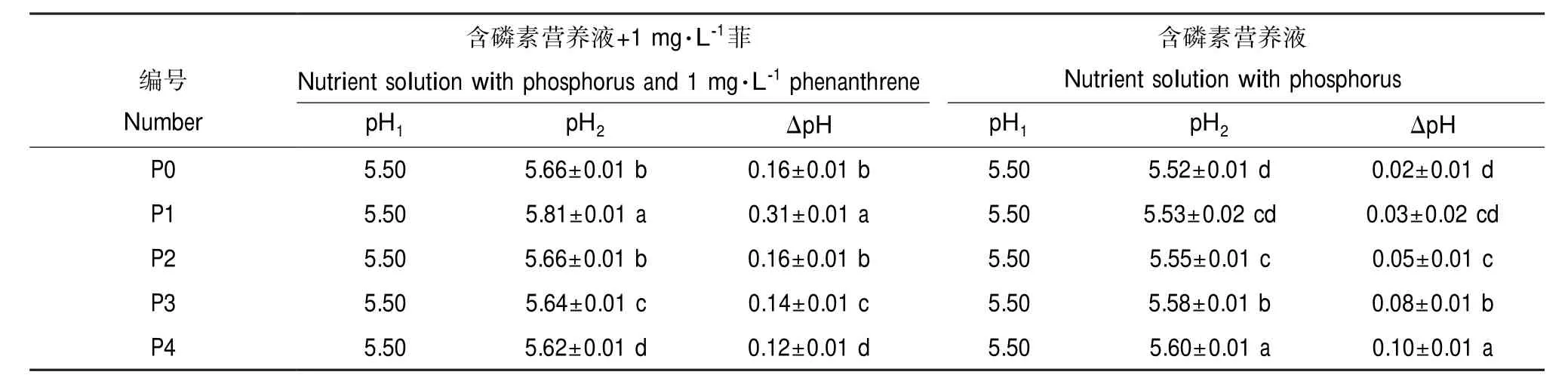
表1 不同磷素浓度下小麦根系吸收菲前后营养液pH值Table 1 pH values of hydroponic solution initially and after 4 h of phenanthrene uptake by wheat roots supplied with different phosphorus levels
植物根系对磷酸盐的吸收主要是以H+/H2共运输方式进行[22]。因此,无菲组营养液pH的升高,是由于H+/H2的共运作用造成的。课题组前期研究表明,植物根系对PAHs的吸收是需要载体协助和耗能的主动吸收过程[23],该过程是以H+/菲共运的方式进入植物体内的[12],所以菲的吸收也会引起营养液pH的上升。因此,在磷酸盐和菲共存的条件下,营养液pH升高幅度高于无菲处理。随着磷浓度的升高,小麦根系菲含量逐渐下降(表1),进入小麦根系的H+也随之减少,从而导致介质pH上升幅度变小。
2.2 不同菲浓度下磷菲吸收和转运的相互作用
2.2.1 小麦菲含量
由于在低磷浓度P1(10 μmol·L-1)时,菲的吸收量最大(图1),因此菲对小麦磷含量影响的试验均在低磷浓度(10 μmol·L-1)下进行。
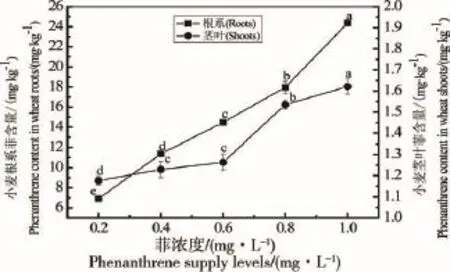
图3 不同菲浓度处理下小麦根系、茎叶菲含量
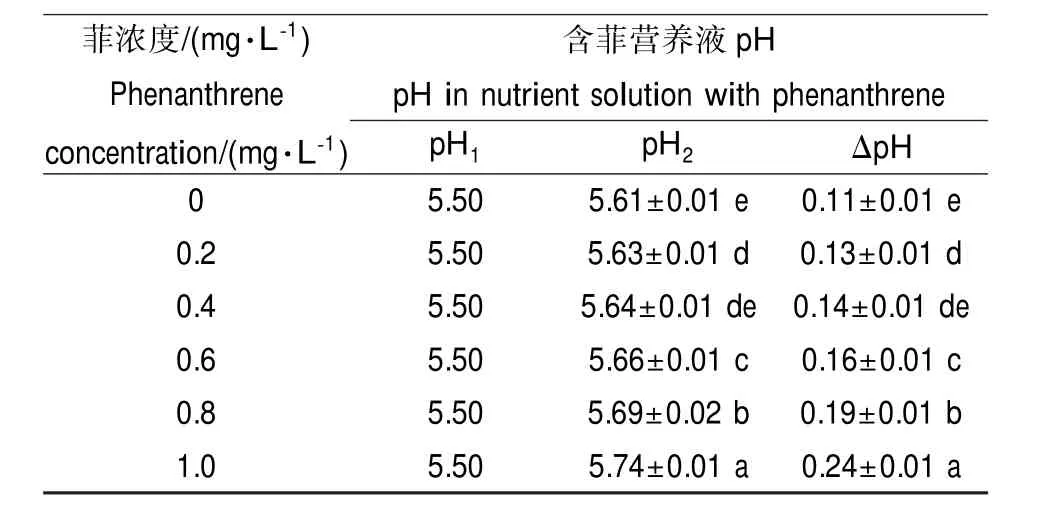
表2 不同菲浓度下小麦根系菲吸收前后营养液pH值Table 2 pH values of hydroponic solution initially and after 4 h of phenanthrene uptake by wheat roots at 10 μmol·L-1NaH2PO4
不同菲浓度对小麦根系、茎叶菲含量的影响如图3所示。不同处理小麦根系、茎叶菲含量各异,并且都随菲浓度的增加而呈现上升的趋势。在营养液中菲浓度分别为0.2和1.0 mg·L-1时,小麦根系菲含量分别为6.91和24.36 mg·kg-1,后者是前者的3.53倍,而茎叶菲含量分别为1.17和1.62 mg·kg-1,后者是前者的1.38倍。各处理间根系菲含量差异显著(P<0.05),茎叶菲含量除0.4和0.6 mg·L-1处理间差异不显著(P>0.05)外,其余处理都存在显著性差异(P<0.05)。
不同菲浓度处理下,小麦根系-茎叶菲迁移系数(茎叶菲量/根系菲量)分别为0.170±0.004 a、0.108± 0.001 b、0.087±0.003 c、0.086±0.002 c、0.067±0.002 d。在营养液中菲浓度为0.6和0.8 mg·L-1时差异性不明显(P>0.05),其余处理间存在显著性差异(P< 0.05)。迁移系数的变化规律总体表现为随着菲浓度的升高而降低。
2.2.2 小麦磷含量
菲对小麦根系、茎叶磷含量的影响如图4所示。小麦根系磷含量变化范围为0.63%~0.68%,总体来看,小麦根系磷含量随着菲浓度的增加呈现增加的趋势,但是增加比较缓慢,且各处理的差异不显著(P >0.05)。小麦茎叶磷含量变化范围为0.97%~1.01%,其变化趋势和根系变化趋势一致,也是随着菲浓度的升高呈现缓慢增加,但是处理间无显著性差异(P>0.05)。
小麦根系、茎叶磷含量随菲浓度的增加差异不明显,即低磷浓度下,菲对小麦根系、茎叶磷含量影响不显著。这与图2的结果相吻合。
2.2.3 不同菲浓度处理介质pH的变化
同一磷浓度,不同菲浓度处理下,小麦根系吸收菲前后营养液pH变化如表2所示。小麦根系菲吸收可引起营养液pH发生显著变化(P<0.05)。同一磷浓度,随着菲浓度的升高,营养液ΔpH呈现显著升高的趋势,ΔpH的变化范围为0.11~0.24。
因为植物根系对磷酸盐和菲的吸收都是以与氢质子共运的方式进行,所以这些物质进入植物体内,必然会引起介质pH升高。随着营养液中菲浓度的升高,植物吸收菲的量也增大,进入植物体内的氢质子也会增多,进而导致介质pH增高,所以ΔpH呈现逐渐上升的趋势。
综上所述:(1)低磷或缺磷可促进小麦根系对菲的吸收和富集;当磷浓度达到正常供应水平后,磷浓度的升高则抑制了小麦根系的菲吸收;菲对小麦根系磷的吸收无明显影响。(2)磷可促进菲从小麦根部向地上部转运,而菲对磷的吸收转运没有显著影响。(3)磷、菲的吸收均可导致介质pH升高,但磷/菲共存介质pH升高幅度更大。
(References):
[1] Maila M P,Gloete T E.Germination ofLepidium sativum as a method to evaluate polycyclic aromatic hydrocarbons (PAHs)removal from contaminated soil[J].International Biodeterioration and Biodegradation,2002,50(2):107-113
[2] 赵云英,马永安.天然环境中多环芳烃的迁移转化及其对生态环境的影响[J].海洋环境科学,1998,17(2): 68-72
Zhao Y Y,Ma Y A.Transport process and ecological impact of polycyclic aromatic hydrocarbons in the natural environment[J].Marine Environmental Science,1998,17 (2):68-72(in Chinese)
[3] 朱满党,都江雪,乐乐,等.植物根系质外体溶液的提取方法研究:以多环芳烃为例[J].环境科学,2015,36 (2):700-705
Zhu M D,Du J X,Yue L,et al.Extraction of plant root apoplast solution:A case study with polycyclic aromatic hydrocarbons[J].Environmental Science,2015,36(2): 700-705(in Chinese)
[4] Zhan X H,Liang X,Xu G H,et al.Influence of plant root morphology and tissue composition on phenanthrene uptake:Stepwise multiple linear regression analysis[J].Environmental Pollution,2013,179:294-300
[5] Wenzl T,Simon R,Kleiner J,et al.Analytical methods for polycyclic aromatic hydrocarbon(PAHs)in food and the environment needed for new food legislation in the European Union[J].Trends in Analytical Chemistry, 2006,25(7):716-725
[6] 杨静,占新华,周立祥.小麦根系吸收菲的动力学机制探究[J].南京农业大学学报,2009,32(4):100-105
Yang J,Zhan X H,Zhou L X.Kinetic characteristics of phenanthrene uptake by wheat roots under hydroponic condition[J].Journal of Nanjing Agricultural University, 2009,32(4):100-105(in Chinese)
[7] Richardon A E,Hocking P J,Simpson R J,et al.Plant mechanism to optimise access to soil phosphorus[J]. Crop&Pasture Science,2009,60(2):124-143
[8] 王晋,强继业,杨林楠,等.玉米吸收磷素营养的代谢及分布[J].西南农业大学学报,2002,24(2):159-161
Wang J,Qiang J Y,Yang L N,et al.Metabolism and distribution of P in maize plants[J].Journal of Southwest Agricultural University,2002,24(2):159-161(in Chinese)
[9] Karthikeyan A S,Varadarajan D K,Mukatira U T,et al. Regulated expression ofArabidopsisphosphate transporters[J].Plant Physiology,2002,130(1):221-233
[10] Wang Y,Ribot C,Rezzonico E,et al.Structure and expression profile of theArabidopsisPHO1 gene family indicates a broad role in inorganic phosphate homeostasis [J].Plant Physiology,2004,135(1):400-411
[11] Chen Y F,Wang Y,Wu W H.Membrane transporter for nitrogen,phosphate and potassium uptake in plants[J]. Journal of Interagrative Plant Biology,2008,50(7):835-848
[12] Zhan X H,Liang X,Jiang T H,et al.Interaction of phenanthrene and potassium uptake by wheat roots:A mechanistic model[J].BMC Plant Biology,2013,13:168
[13] Zhan X H,Yi X,Yue L,et al.Cytoplasmic pH-stat during phenanthrene uptake by wheat roots:A mechanistic consideration[J].Environmental Science&Technology, 2015,49(10):6037-6044
[14] Zhan X H,Yuan J H,Yue L,et al.Response of uptake and translocation of phenanthrene to nitrogen form in lettuce and wheat seedlings[J].Environmental Science and Pollution Research,2015,22(8):6280-6287
[15] Chapin F S,Moilanen L,Kielland K.Preferential use of organic nitrogen for growth by a non-mycorrhizal artical sedge[J].Nature,1993,361:150-153
[16] 鲍士旦.土壤农化分析[M].第3版.北京:中国农业出版社,2000:268-270
Bao S D.Analysis for Soil and Agricultural Chemistry [M].The third edition.Beijing:China Agriculture Press, 2000:268-270(in Chinese)
[17] Fageria N K.Kinetics of phosphate absorption by intact rice plants[J].Australian Journal of Agriculture,1974,25 (3):395-400
[18] 王庆仁,李继云,李振声.植物高效利用土壤难溶态磷研究动态及展望[J].植物营养与肥料学报,1998,4(2): 107-116
Wang Q R,Li J Y,Li Z S.Dynamics and prospect on studies of high acquisition of soil unavailable phosphorus by plants[J].Plant Nutrition and Fertilizer Science,1998, 4(2):107-116(in Chinese)
[19] 史瑞和.植物营养原理[M].南京:江苏科学技术出版社,1989:285-286Shi R H.Theory of Plant Nutrition[M].Nanjing:Jiangsu Science and Technology Press,1989:285-286
[20] Carvajal M,Cooke D T,Clarkson D T.Plasma membrane fluidity and hydraulic conductance in wheat roots:Interaction between root temperature and nitrate or phosphate deprivation[J].Plant,Cell&Environment,1996,19(9): 1110-1114
[21] Bowen J E.Kinetics of active uptake of boron,zinc,copper and manganese in barley and sugarcane[J].Journal of Plant Nutrition,1981,3(1-4):215-223
[22] Sakano K.Proton/phosphate stoichiometry in uptake of inorganic phosphate by cultured cells ofCatharanthus roseus(L.)[J].Plant Physiology,1990,93(2):479-483
[23] Zhan X H,Zhang X B,Yin X M,et al.H+/phenanthrene symporter and aquaglyceroporin are implicated in phenanthrene uptake by wheat(Triticum aestivumL.)roots[J]. Journal of Environmental Quality,2012,41(1):100-196◆
Interaction of Uptake and Acropetal Translocation between Phenanthrene and Phosphate in Wheat Roots
Yang Qingqing,Lu Shoukun,Wang Hongju,Li Jinfeng,Shen Yu,Zhan Xinhua*
College of Resources and Environmental Sciences,Nanjing Agricultural University,Nanjing 210095,China
22 September 2015 accepted 27 November 2015
It is important to investigate the interactions of polycyclic aromatic hydrocarbons(PAHs)and phosphorus during their uptake and translocation in crop roots for the safe production of food crops and the enhancement in phytoremediation of PAH-contaminated soil and water.In this paper,the hydroponic experiments were employed for the uptake and transfer of phenanthrene and phosphate in wheat roots at different phosphorus and phenanthrene concentrations.Phenanthrene contents in wheat roots and shoots peak with 36.87 mg·kg-1and 2.07 mg·kg-1respectively at 10 μmol·L-1phosphorus.Phosphorus content is raised in both roots and shoots with an increase of phosphorus in the range of 0-1 200 μmol·L-1.According to the pairedt-test,there are no significant differences(P> 0.05)in phosphorus contents of wheat roots or shoots between the treatments with and without phenanthrene.Phosphorus can escalate the translocation of phenanthrene from wheat roots to shoots,but phenanthrene has no significant effects on phosphorus acropetal translocation.Nutrient solution pH in the presence of phenanthrene and phos-phorus increases more than that in the presence of either phenanthrene or phosphorus.
polycyclic aromatic hydrocarbons;phenanthrene;phosphate;wheat;root uptake;translocation
2015-09-22 录用日期:2015-11-27
1673-5897(2016)3-219-07
X171.5
A
10.7524/AJE.1673-5897.20150922002
简介:占新华(1972—),男,博士,教授,博士生导师,主要研究方向为污染生物学与污染场地修复。
国家自然科学基金项目(31370521);中央高校基本科研业务费专项(KYZ201145)
杨青青(1990-),女,硕士研究生,研究方向为污染控制化学,E-mail:2013103060@njau.edu.cn;
*通讯作者(Corresponding author),E-mail:xhzhan@njau.edu.cn

